LITERATURA Kala P Organick chemie zkladn st Kala








- Slides: 18

LITERATURA Kalač, P. : Organická chemie – základní část. Kalač P. : Organická chemie – přírodní a kontaminující látky. Pacák, J. : Stručné základy organické chemie. Fikr, J. : Názvosloví organické chemie

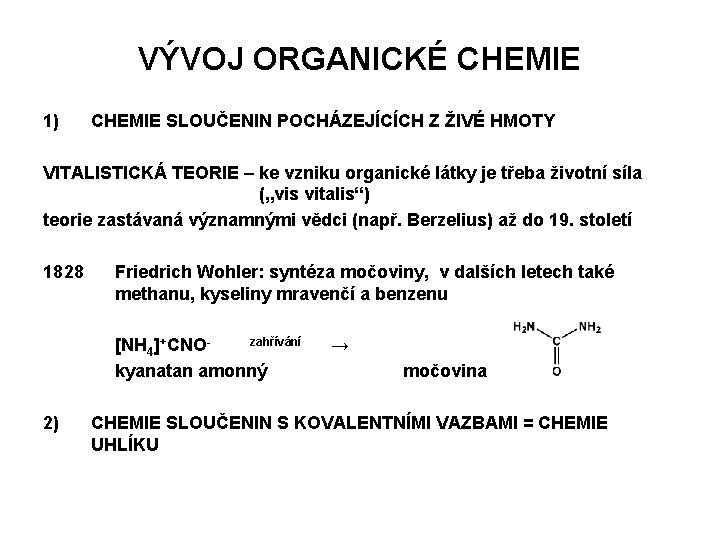
VÝVOJ ORGANICKÉ CHEMIE 1) CHEMIE SLOUČENIN POCHÁZEJÍCÍCH Z ŽIVÉ HMOTY VITALISTICKÁ TEORIE – ke vzniku organické látky je třeba životní síla („vis vitalis“) teorie zastávaná významnými vědci (např. Berzelius) až do 19. století 1828 Friedrich Wohler: syntéza močoviny, v dalších letech také methanu, kyseliny mravenčí a benzenu [NH 4]+CNO- zahřívání → kyanatan amonný 2) močovina CHEMIE SLOUČENIN S KOVALENTNÍMI VAZBAMI = CHEMIE UHLÍKU

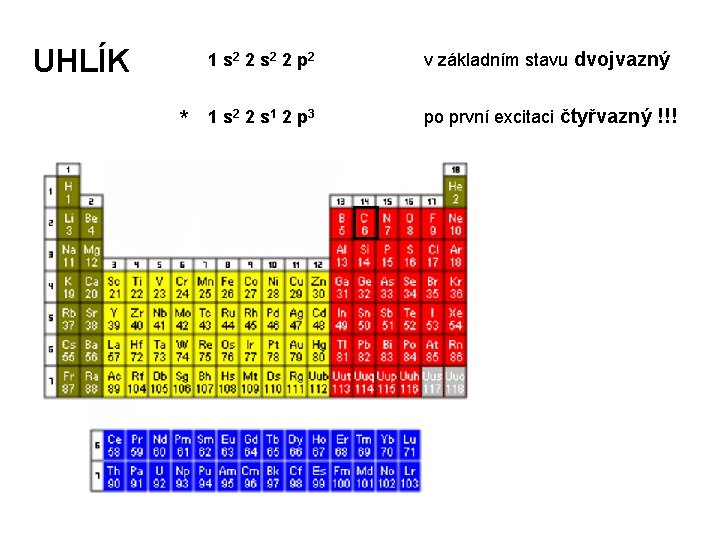
UHLÍK * 1 s 2 2 p 2 v základním stavu dvojvazný 1 s 2 2 s 1 2 p 3 po první excitaci čtyřvazný !!! UHLÍK

VÝCHODISKA 1) UHLÍK JE ČTYŘVAZNÝ 2) VŠECHNY VAZBY JSOU ROVNOCENNÉ 3) TYPY VAZEB: JEDNODUCHÉ DVOJNÉ TROJNÉ 4) EXISTUJE VOLNÁ OTÁČIVOST KOLEM JEDNODUCHÉ VAZBY

SYSTÉM ORGANICKÝCH SLOUČENIN UHLOVODÍKY R – H, Ar – H HALOGENDERIVÁTY R – X AMINY R – NH 3 THIOLY R – SH FENOLY Ar – OH ALKOHOLY R – OH ETHERY R – O – R KETONY R – C – R ║ O ALDEHYDY R – C ═ O │ H KYSELINY R – C ═ O │ OH

NÁZVOSLOVÍ 1) TRIVIÁLNÍ: nejstarší, název sloučeniny nesouvisí s její strukturou a většinou vychází z vlastností látek nebo jejich zdroje, … chlorofyl (řec. chloros – zelený) glycin (řec. glýkis - sladký) 2) RADIKÁLOVÉ: název se skládá z označení tzv. radikálu (uhlovodíkového zbytku) a z označení tzv. funkční skupiny methylalkohol, diethylether, . . 3) SUBSTITUČNÍ: všechny organické sloučeniny jsou považovány za deriváty příslušného uhlovodíku, ze kterého vznikly výměnou (substitucí) jednoho či více atomů vodíku za jiný atom nebo skupinu atomů kyselina 2 – hydroxypropanová 2 – methylbutan - 1 - ol

TYPY VZORCŮ V ORGANICKÉ CHEMII SUMÁRNÍ (MOLEKULOVÉ) UDÁVÁ PŘESNÝ CELKOVÝ POČET VŠECH ATOMŮ V MOLEKULE CH 4 C 6 H 6 C 5 H 12 STRUKTURNÍ (KONSTITUČNÍ) UDÁVÁ DRUH ATOMŮ, JEJICH POŘADÍ A DRUH VAZBY MEZI NIMI CH 3 - CH 2 - CH 3 - CH 2 - CH 3 │ CH 3 RACIONÁLNÍ ZJEDNODUŠENÝ STRUKTURNÍ VZOREC CH 3 - (CH 2)3 -CH 3 KONFIGURAČNÍ ZNÁZORŇUJE PROSTOROVÉ ORIENTACE JEDNOTLIVÝCH VAZEB V MOLEKULE

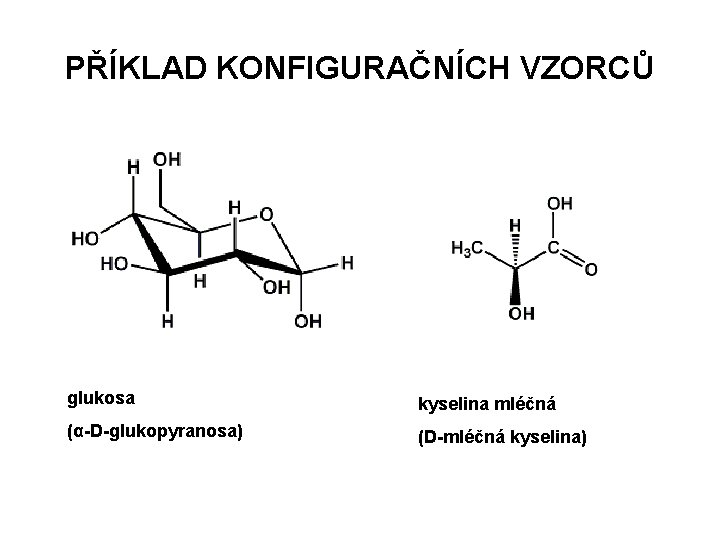
PŘÍKLAD KONFIGURAČNÍCH VZORCŮ glukosa kyselina mléčná (α-D-glukopyranosa) (D-mléčná kyselina)

IZOMERIE IZOMERY MAJÍ STEJNÝ SUMÁRNÍ VZOREC, ALE ODLIŠNÝ VZOREC STRUKTURNÍ. DRUHY IZOMERIE KONSTITUČNÍ: izomery se liší pořadím atomů a vazeb v molekule ŘETĚZOVÁ stavba uhlíkového řetězce POLOHOVÁ poloha substituentu SKUPINOVÁ různá funkční skupina TAUTOMERIE různá poloha dvojné vazby a H KONFIGURAČNÍ: izomery mají stejnou konstituci, ale různé prostorové uspořádání GEOMETRICKÁ (CIS-TRANS) dvojná vazba OPTICKÁ opticky aktivní (asymetrický) atom

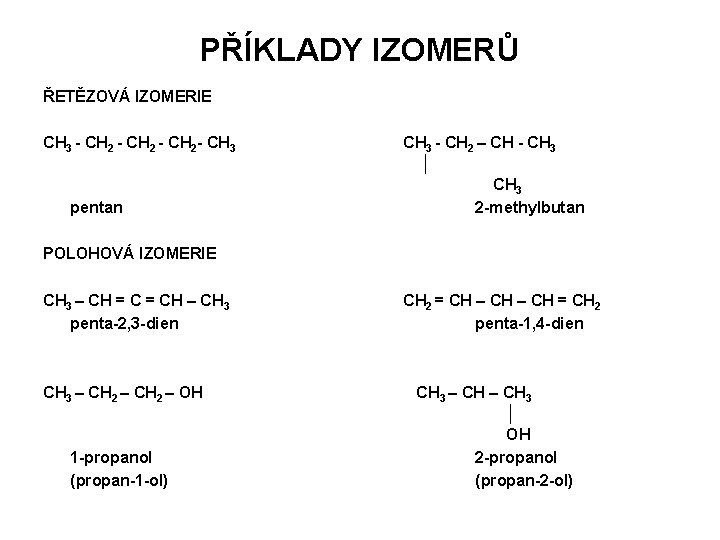
PŘÍKLADY IZOMERŮ ŘETĚZOVÁ IZOMERIE CH 3 - CH 2 - CH 3 pentan CH 3 - CH 2 – CH - CH 3 │ CH 3 2 -methylbutan POLOHOVÁ IZOMERIE CH 3 – CH = CH – CH 3 penta-2, 3 -dien CH 2 = CH – CH = CH 2 penta-1, 4 -dien CH 3 – CH 2 – OH CH 3 – CH 3 │ OH 2 -propanol (propan-2 -ol) 1 -propanol (propan-1 -ol)

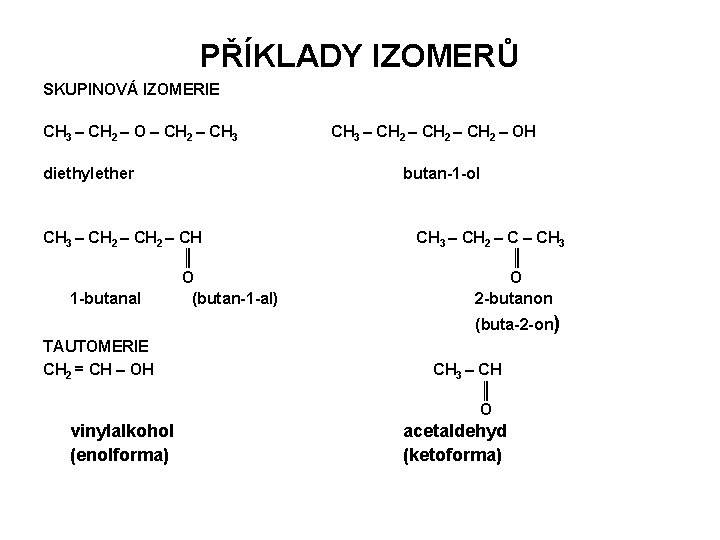
PŘÍKLADY IZOMERŮ SKUPINOVÁ IZOMERIE CH 3 – CH 2 – O – CH 2 – CH 3 – CH 2 – OH diethylether butan-1 -ol CH 3 – CH 2 – CH ║ O 1 -butanal (butan-1 -al) CH 3 – CH 2 – CH 3 ║ O 2 -butanon (buta-2 -on) TAUTOMERIE CH 2 = CH – OH CH 3 – CH ║ O vinylalkohol (enolforma) acetaldehyd (ketoforma)

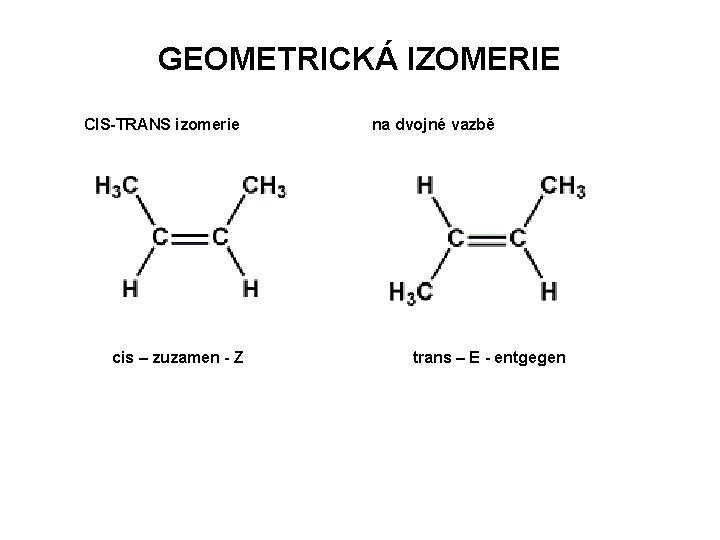
GEOMETRICKÁ IZOMERIE CIS-TRANS izomerie cis – zuzamen - Z na dvojné vazbě trans – E - entgegen

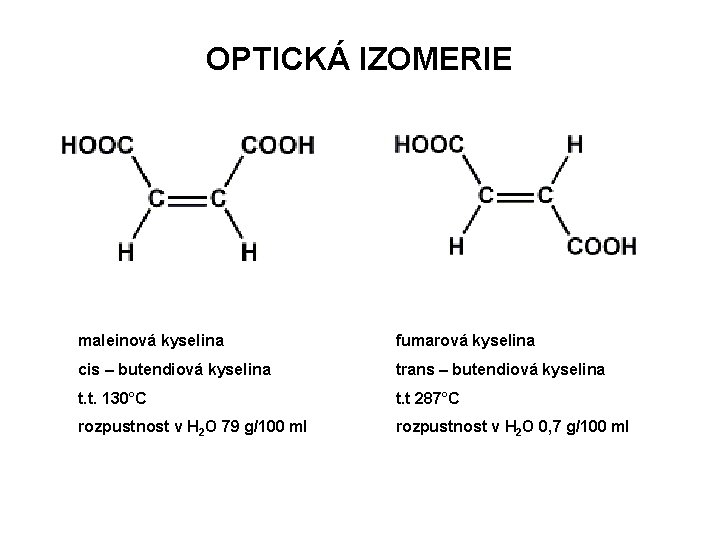
OPTICKÁ IZOMERIE maleinová kyselina fumarová kyselina cis – butendiová kyselina trans – butendiová kyselina t. t. 130°C t. t 287°C rozpustnost v H 2 O 79 g/100 ml rozpustnost v H 2 O 0, 7 g/100 ml

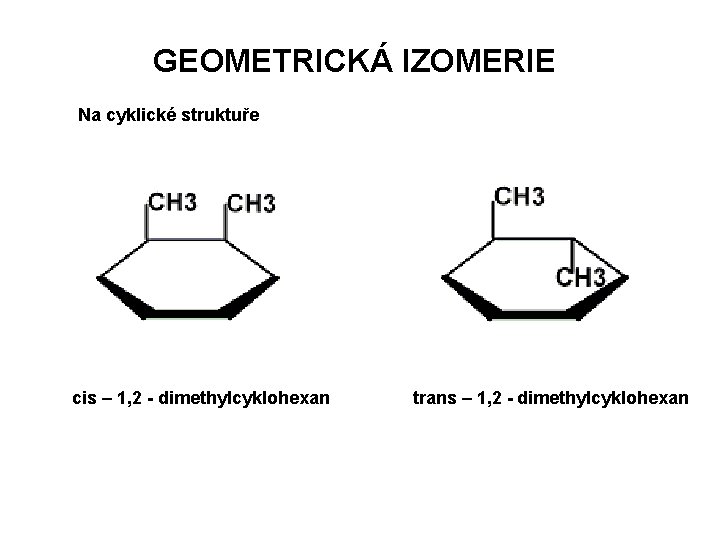
GEOMETRICKÁ IZOMERIE Na cyklické struktuře cis – 1, 2 - dimethylcyklohexan trans – 1, 2 - dimethylcyklohexan

DŮSLEDKY GEOMETRICKÉ IZOMERIE Cis- a trans- izomery se liší fyzikálními i chemickými vlastnostmi. Mají často odlišné i biologické účinky. Karotenoidy: nenasycené uhlovodíky, patří mezi izoprenoidy plná biologická účinnost pouze s trans-uspořádáním na všech dvojných vazbách (all-trans) účinnost klesá s izomerizací (vlivem UV-světla) Mastné kyseliny: polynenasycené mají cis-uspořádání Přírodní polymery: mají zásadně odlišné fyzikální vlastnosti Kaučuk: cis- izomer, je pružný Gutaperča: trans-izomer, je křehká

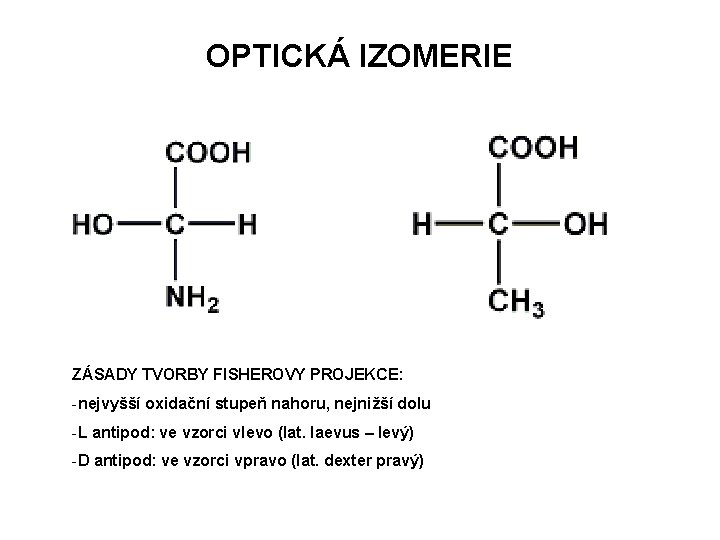
OPTICKÁ IZOMERIE ZÁSADY TVORBY FISHEROVY PROJEKCE: -nejvyšší oxidační stupeň nahoru, nejnižší dolu -L antipod: ve vzorci vlevo (lat. laevus – levý) -D antipod: ve vzorci vpravo (lat. dexter pravý)

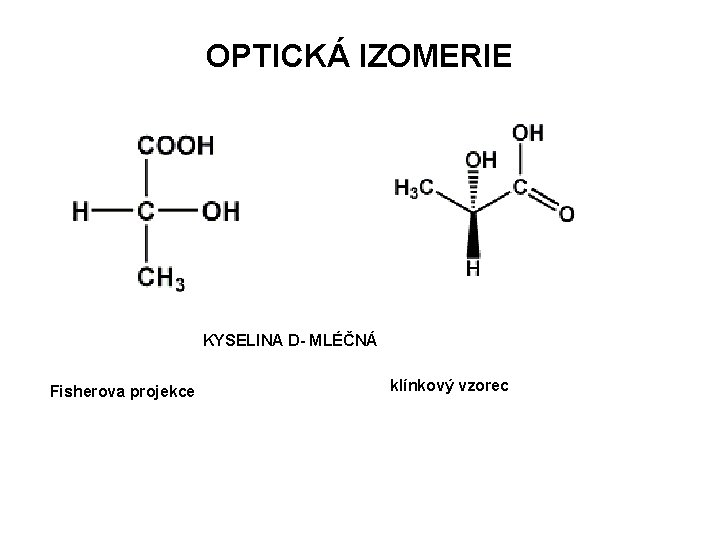
OPTICKÁ IZOMERIE KYSELINA D- MLÉČNÁ Fisherova projekce klínkový vzorec

DŮSLEDKY OPTICKÉ IZOMERIE Analytická chemie : roztoky opticky aktivních sloučenin stáčejí rovinu polarizovaného světla – polarimetrie, velikost úhlu otočení je úměrná koncentraci látky v roztoku (+) stáčí po směru hodinových ručiček (-) stáčí proti směru hodinových ručiček Není souvislost mezi typem optického antipodu (L, D) a smyslem stáčení světla, vztah je nahodilý! Biologické důsledky optické aktivity: pouze jeden antipod je biologicky aktivní – L – aminokyseliny, D – sacharidy Racemická směs (racemát) – směs stejných látkových množství obou antipodů, je opticky neaktivní (nestáčí rovinu polarizovaného světla)
 Kala persalinan
Kala persalinan Kala 1 sampai kala 4
Kala 1 sampai kala 4 Grondtoestand elektronenconfiguratie
Grondtoestand elektronenconfiguratie Dobrý sluha ale zlý pán chemie
Dobrý sluha ale zlý pán chemie Donau chemie pischelsdorf
Donau chemie pischelsdorf Schilling chemie
Schilling chemie Impuls chemie 4
Impuls chemie 4 Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Danke für eure aufmerksamkeit chemie
Danke für eure aufmerksamkeit chemie Chemie für mediziner
Chemie für mediziner Gefahrensymbole chemie zum ausdrucken
Gefahrensymbole chemie zum ausdrucken Chemie
Chemie Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Nico rutten
Nico rutten Poloacetal
Poloacetal Krasové jevy chemie
Krasové jevy chemie Areny chemie
Areny chemie Hochofen aufbau
Hochofen aufbau Naturfasern chemie
Naturfasern chemie