Nepechodn prvky 16 skupiny Kyslk VI A skupina
















- Slides: 28

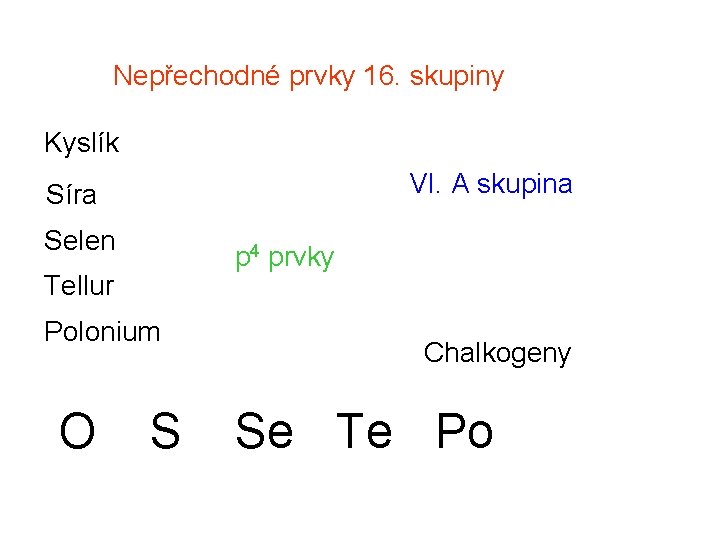
Nepřechodné prvky 16. skupiny Kyslík VI. A skupina Síra Selen p 4 prvky Tellur Polonium O S Chalkogeny Se Te Po


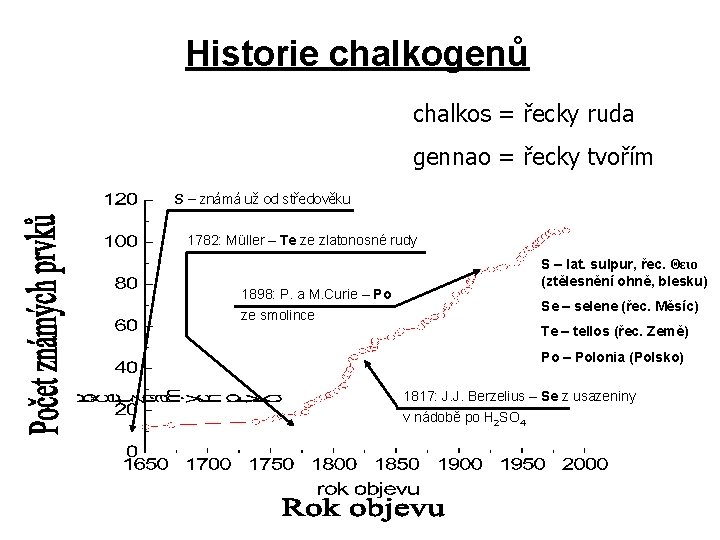
Historie chalkogenů chalkos = řecky ruda gennao = řecky tvořím S – známá už od středověku 1782: Müller – Te ze zlatonosné rudy S – lat. sulpur, řec. Θειο (ztělesnění ohně, blesku) 1898: P. a M. Curie – Po Se – selene (řec. Měsíc) ze smolince Te – tellos (řec. Země) Po – Polonia (Polsko) 1817: J. J. Berzelius – Se z usazeniny v nádobě po H 2 SO 4

Charakteristika 16. skupiny Se stoupajícím protonovým číslem: stoupá: ■ molární hmotnost (g / mol) ■ hustota ■ kovový charakter ■ bod tání a bod varu ■ reaktivita k O 2 klesá: ■ kyselý charakter oxidů konfigurace valenčních elektronů: ns 2 np 4 skupenství prvků (při 30°C): kyslík - plynné síra - tellur - pevné selen - polonium

kyslík, síra = nekovy selen, tellur = polokovy polonium = radioaktivní kov většina chalkogenů jsou prvky alotropní např. síra - kosočtverečná - jednoklonná selen - červený - šedý

Kyslík Oxygenium O

Historie • za objevitele kyslíku jsou považováni C. W. Scheele a J. Priestley

Kyslík objevili téměř současně 1771 - 1774 při žíhání kyslíkatých sloučenin Na. NO 3, Mn. O 2, Hg. O 15. století - Leonardo da Vinci pozoroval, že vzduch má několik složek, z nichž jedna podporuje hoření. 1777 - A. L. Lavoasier: vytvořil název oxygenium (domníval se, že kyslík je nezbytnou složkou kyselin) 1781 - H. Cavendish: zjistil, že voda je sloučenina kyslíku a vodíku české pojmenování prvku: J. S. Presl

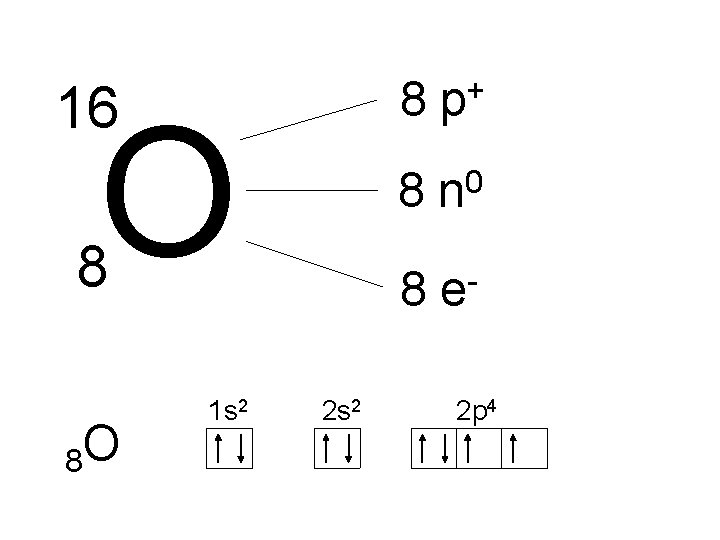
8 16 O 8 n 0 8 8 O 1 s 2 + p 8 2 s 2 e 2 p 4

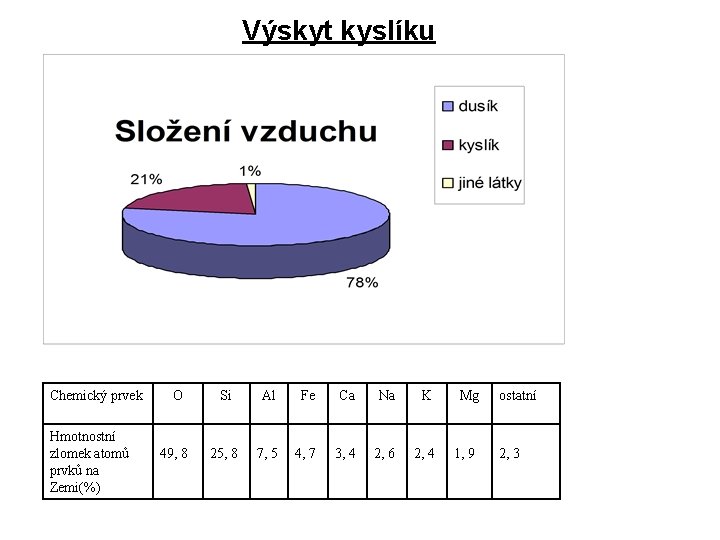
Výskyt kyslíku Chemický prvek Hmotnostní zlomek atomů prvků na Zemi(%) O Si Al Fe Ca Na K 49, 8 25, 8 7, 5 4, 7 3, 4 2, 6 2, 4 Mg 1, 9 ostatní 2, 3

Kyslík: nejrozšířenější prvek v zemské kůře (49%) v atmosféře 23% hmotnosti, 21% objemu hydrosféra 89% hmotnosti litosféra (nerosty a horniny) makrobiogenní prvek vzniká asimilací zelených rostlin (fotosyntéza) Přírodní kyslík je směsí tří izotopů: 16 8 O (99, 76%) 17 8 O (0, 04%) 18 8 O (0, 20%)

Vazebné možnosti kyslíku: - elektronová konfigurace a vysoká hodnota elektronegativity(X 0= 3, 5) ovlivňují vazebné možnosti kyslíku ve sloučeninách, oxidační číslo -II (v peroxidech –I) a) anion: O 2 b) dvě kovalentní vazby: -O- (H 2 O) O= (CO 2) c) dativní vazba: H 3 O+ - zvláštním případem je vazba v molekule dikyslíku ( O=O )

Fyzikální vlastnosti: ■ elementární kyslík ve dvou formách: dikyslík O 2 a trikyslík (ozon) O 3 ■ bezbarvý plyn ■ těžší než vzduch ■ při teplotě -183°C kondenzuje na modrou kapalinu Ozon O 3 ■ namodralý plyn ■ ostrého zápachu ■ jedovatý Teplota tání °C Teplota varu °C O 2 O 3 -219 -193 -183 -112

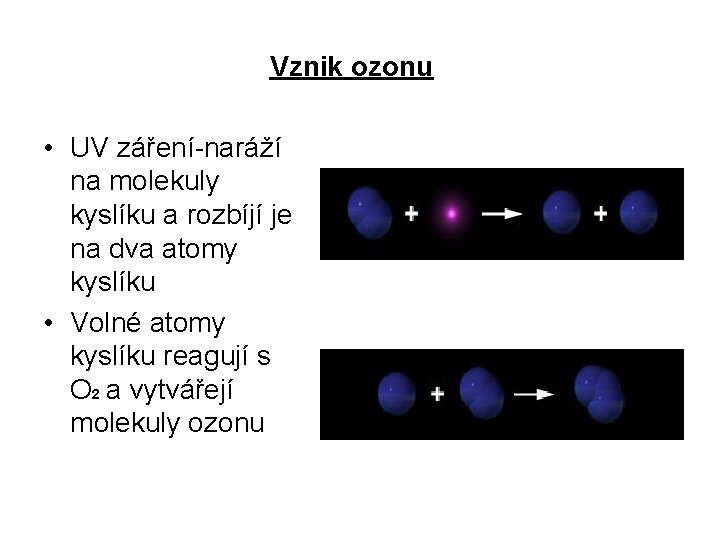
Vznik ozonu • UV záření-naráží na molekuly kyslíku a rozbíjí je na dva atomy kyslíku • Volné atomy kyslíku reagují s O 2 a vytvářejí molekuly ozonu

Výskyt ozonu • Nachází se v 10 -50 km nad zemí • Nejvíce zkoncentrován ve stratosféře (23 -24 km)

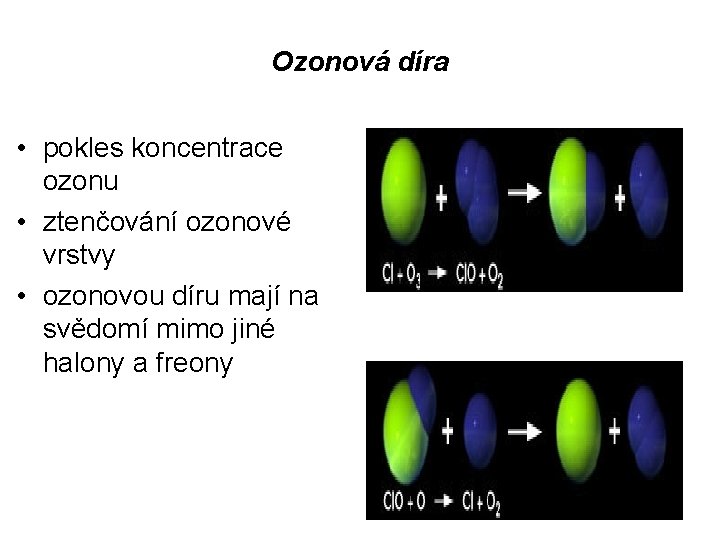
Ozonová díra • pokles koncentrace ozonu • ztenčování ozonové vrstvy • ozonovou díru mají na svědomí mimo jiné halony a freony

Chemické vlastnosti kyslíku: O 2 ■ velmi reaktivní ■ reaguje téměř se všemi prvky (výjimkou jsou halogeny, vzácné plyny a některé přechodné kovy) ■ hoření (prudká oxidace za vývoje tepla a světla) O 3 ■ vzniká v horních vrstvách atmosféry účinkem kosmického záření na dikyslík O 2 + O → O 3 ■ reaguje prudčeji než dikyslík O 3 + 2 KI + H 2 O → I 2 + 2 KOH + O 2

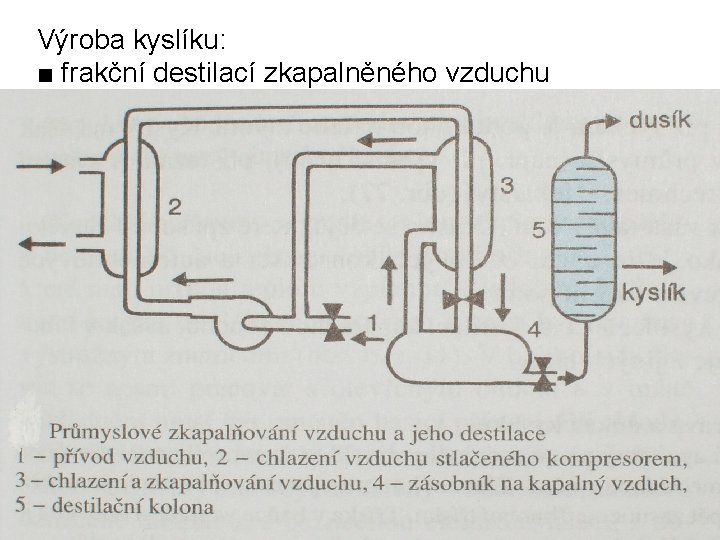
Výroba kyslíku: ■ frakční destilací zkapalněného vzduchu

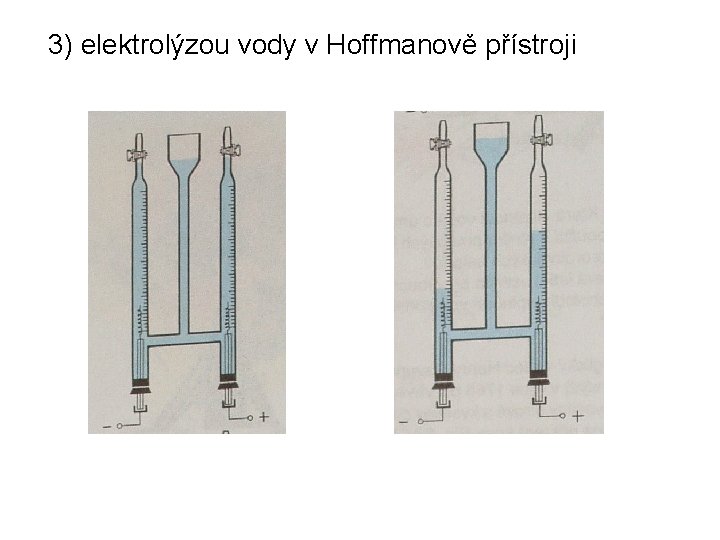
elektrolýzou vody: katoda: 4 H 3 O+ + 4 e- → 4 H 2 O + 2 H 2 anoda: 4 OH- → 2 H 2 O + O 2 + 4 e-

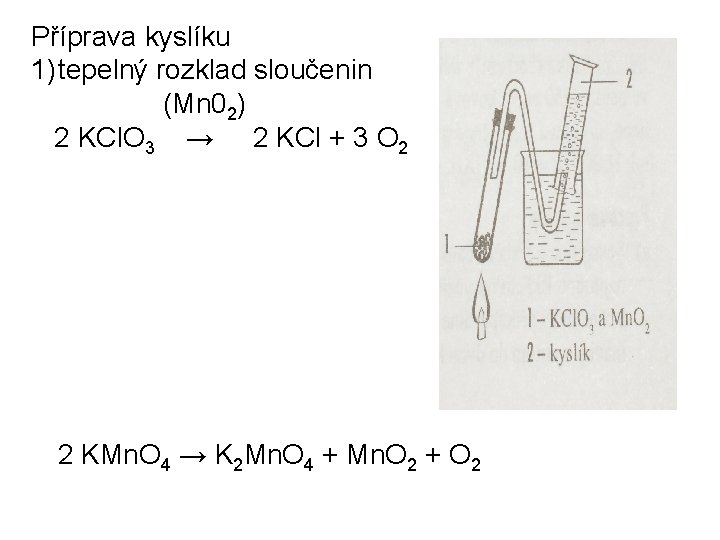
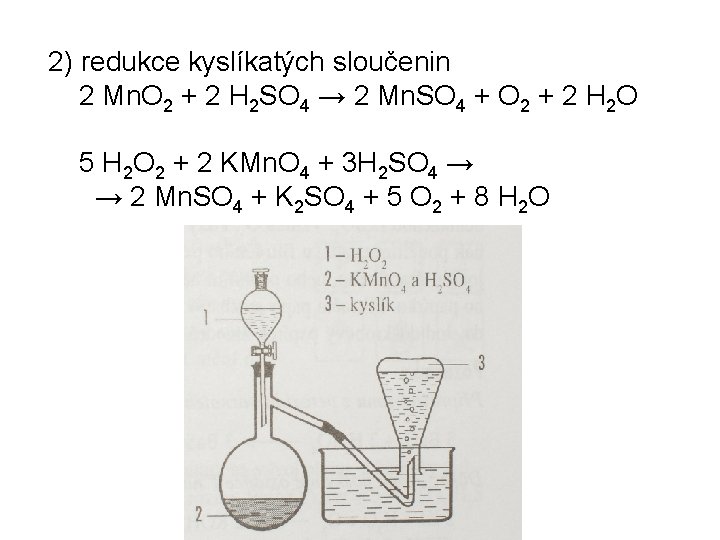
Příprava kyslíku 1) tepelný rozklad sloučenin (Mn 02) 2 KCl. O 3 → 2 KCl + 3 O 2 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2

2) redukce kyslíkatých sloučenin 2 Mn. O 2 + 2 H 2 SO 4 → 2 Mn. SO 4 + O 2 + 2 H 2 O 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 → → 2 Mn. SO 4 + K 2 SO 4 + 5 O 2 + 8 H 2 O

3) elektrolýzou vody v Hoffmanově přístroji

Použití kyslíku: O 2 sváření a řezání kovů kyslíkové přístroje ve zdravotnictví, letectví, hornictví, kosmonautice k pohonu raket (kapalný kyslík) k urychlení chemických procesů (výroba oceli) O 3 dezinfekce H 2 O a vzduchu bělení textilních vláken

Binární sloučeniny kyslíku: - oxidy, - peroxid vodíku, - peroxidy kovů Oxidy: OIIrozdělení: a) podle struktury molekulové oxidy (mezi jednotlivými molekulami existují většinou jen slabé van der Waalsovy interakce) -oxidy nekovů např. CO, CO 2, NO 2, SO 2 kovalentní krystaly (atomy tvoří trojrozměrné mřížky, pevné látky, velmi tvrdé např. Si. O 2, Al 2 O 3, Fe 2 O 3 iontové krystaly (pevné látky, v pevném stavu elektricky nevodivé, v tavenině vedou elektrický proud např. Na 2 O, Ba. O

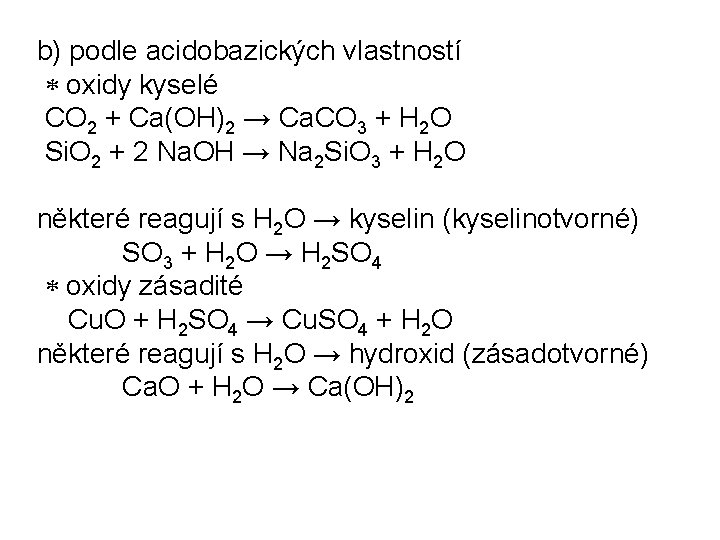
b) podle acidobazických vlastností oxidy kyselé CO 2 + Ca(OH)2 → Ca. CO 3 + H 2 O Si. O 2 + 2 Na. OH → Na 2 Si. O 3 + H 2 O některé reagují s H 2 O → kyselin (kyselinotvorné) SO 3 + H 2 O → H 2 SO 4 oxidy zásadité Cu. O + H 2 SO 4 → Cu. SO 4 + H 2 O některé reagují s H 2 O → hydroxid (zásadotvorné) Ca. O + H 2 O → Ca(OH)2

oxidy amfoterní reagují s kyselinami i se zásadami vzniká sůl a voda Al 2 O 3 + 6 H 2 O → 2 Al. Cl 3 + 3 H 2 O Al 2 O 3 + 2 Na. OH + 3 H 2 O → 2 Na[Al(OH)4] Zn. O + 2 HCl → Zn. Cl 2 + H 2 O Zn. O + 2 Na. OH + H 2 O → Na 2[Zn(OH)4] oxidy netečné nereagují s vodou, kyselinami ani zásádami např. CO, N 2 O, Cl. O 2

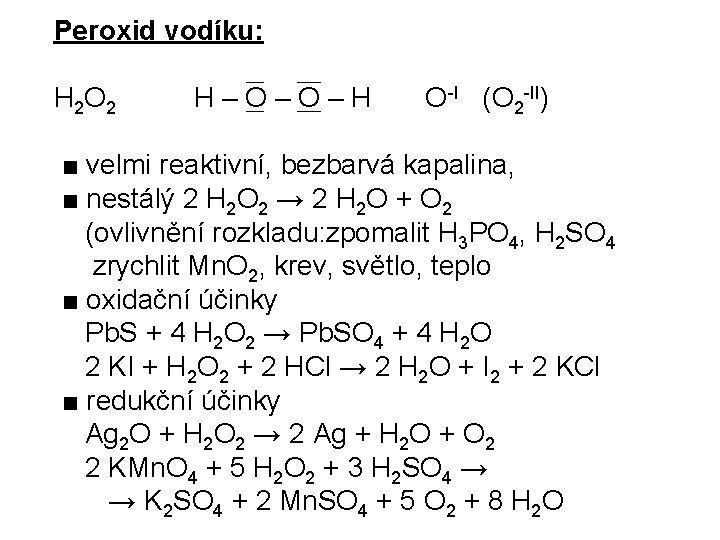
Peroxid vodíku: H 2 O 2 H–O–O–H O-I (O 2 -II) ■ velmi reaktivní, bezbarvá kapalina, ■ nestálý 2 H 2 O 2 → 2 H 2 O + O 2 (ovlivnění rozkladu: zpomalit H 3 PO 4, H 2 SO 4 zrychlit Mn. O 2, krev, světlo, teplo ■ oxidační účinky Pb. S + 4 H 2 O 2 → Pb. SO 4 + 4 H 2 O 2 KI + H 2 O 2 + 2 HCl → 2 H 2 O + I 2 + 2 KCl ■ redukční účinky Ag 2 O + H 2 O 2 → 2 Ag + H 2 O + O 2 2 KMn. O 4 + 5 H 2 O 2 + 3 H 2 SO 4 → → K 2 SO 4 + 2 Mn. SO 4 + 5 O 2 + 8 H 2 O

Laboratorní příprava: Ba. O 2 + H 2 SO 4 → Ba. SO 4 + H 2 O 2 Použití: bělící a dezinfekční prostředek 3% roztok v lékařství kadeřnictví
 Prvky 18. skupiny
Prvky 18. skupiny Halogeny charakteristika
Halogeny charakteristika Prvky 13. skupiny
Prvky 13. skupiny Prvky 17 skupiny
Prvky 17 skupiny Vi a skupina
Vi a skupina Iii.a skupina
Iii.a skupina Prvky 16 skupiny
Prvky 16 skupiny Piesen literarny druh
Piesen literarny druh Kyslk
Kyslk Kyslk
Kyslk Zs nade hejnej
Zs nade hejnej Kyslk
Kyslk Kyslk
Kyslk čím dýchají vzdušnicovci
čím dýchají vzdušnicovci Krevni skupiny
Krevni skupiny Krvne skupiny tabulka
Krvne skupiny tabulka Nuklida stabil
Nuklida stabil Socialne skupiny delenie
Socialne skupiny delenie Stejnokřídlí se dělí na dvě skupiny
Stejnokřídlí se dělí na dvě skupiny Sociální skupiny
Sociální skupiny Zabv
Zabv Karel dinda
Karel dinda Skupiny řas
Skupiny řas Chondrogenní osifikace
Chondrogenní osifikace Krevni skupiny
Krevni skupiny Pseudocholinesteráza
Pseudocholinesteráza Krevní skupiny dědičnost
Krevní skupiny dědičnost Konformita ve skupině
Konformita ve skupině Krevní skupiny
Krevní skupiny


















































