Periodiska systemet Grupp 1 Alkalimetallerna Har 1 valenselektron
























- Slides: 43

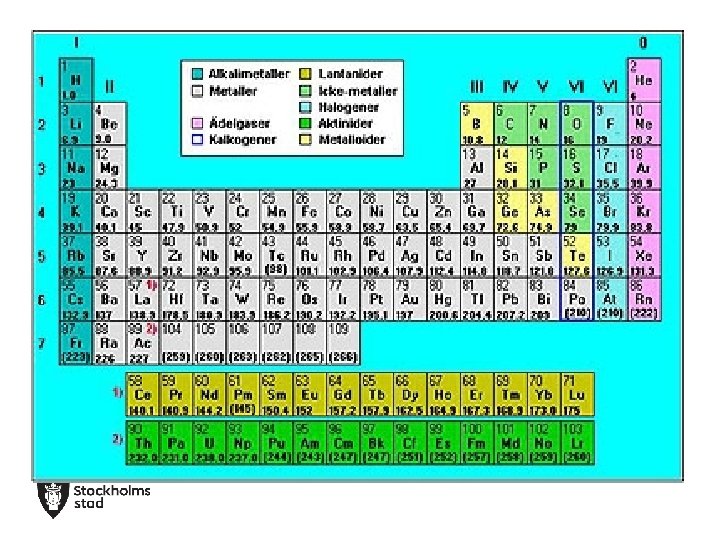
Periodiska systemet • Grupp 1 Alkalimetallerna. Har 1 valenselektron. Reagerar häftigt med vatten. T. ex. natrium och väte. • Grupp 2 Alkaliska jordartsmetaller. Har 2 valenselektroner. Reagerar häftigt med syror. T. ex. kalcium och magnesium. • Grupp 7(17) Halogenerna. De har 7 valenselektroner. Reagerar mycket lätt med andra ämnen och bildar ofta salter. Har en stickande lukt. Har färg i gasform. T. ex. Fluor och klor. • Grupp 8 (18) Ädelgaserna. Har fullt yttre skal. Reagerar ogärna. T. ex. helium och neon.

Atomnummer • • I periodiska systemet En karta över alla kända grundämnen Alla atomer har ett atomnummer Atomnumret talar om hur många protoner det finns i atomkärnan

Masstal • Antalet neutroner och protoner sammanlagt. Det ökar med stigande atomnummer eftersom ju större atom desto fler neutroner finns det i kärnan.

Grupper De lodräta raderna i periodiska systemet anger antalet valenselektroner

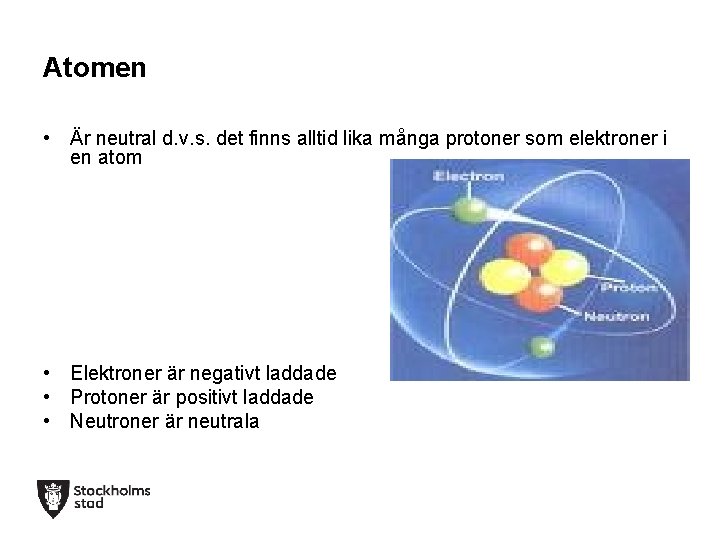
Atomen • Är neutral d. v. s. det finns alltid lika många protoner som elektroner i en atom • Elektroner är negativt laddade • Protoner är positivt laddade • Neutroner är neutrala

Period De vågräta raderna talar om antalet skal , K, L, M, N, O, PQ

Atom • I mitten av atomen finns en atomkärna. • Atomkärnan består av protoner (positivt laddade) och neutroner (ingen laddning, neutral). • Runt om kärnan kretsar elektroner (negativt laddade) • Det finns lika många protoner (positiva laddningar) som elektroner (negativa laddningar) i en atom. • Laddningarna tar alltså ut varandra och gör så att atomen i sin helhet är elektriskt neutral.

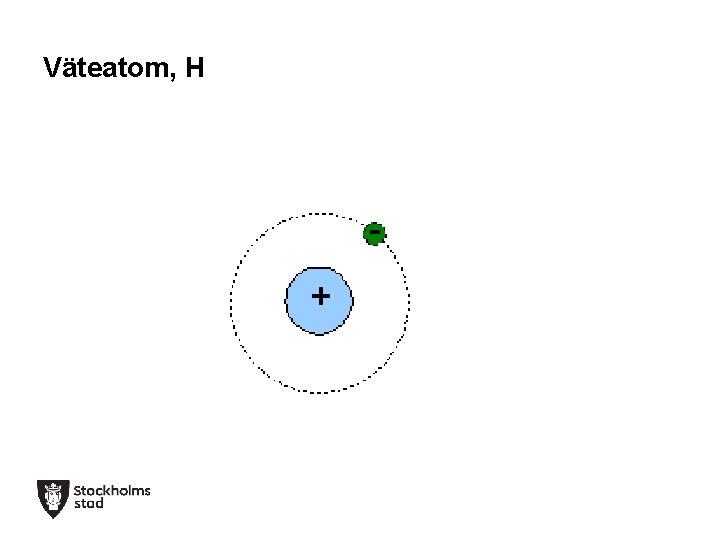
Väteatom, H +

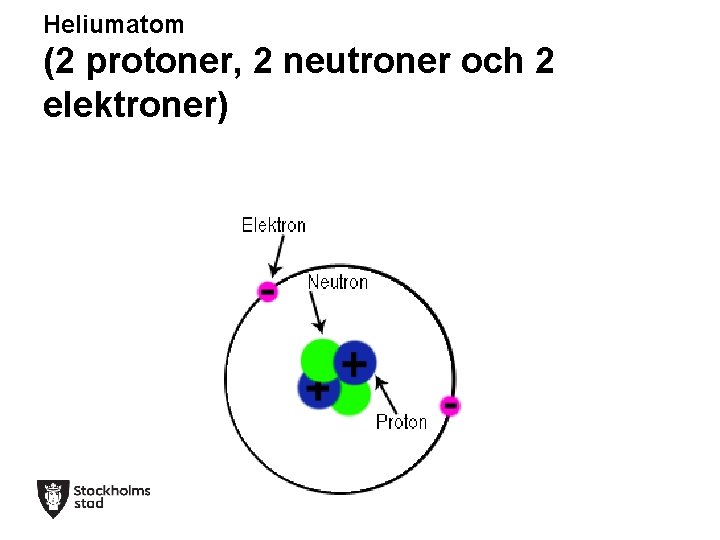
Heliumatom (2 protoner, 2 neutroner och 2 elektroner)

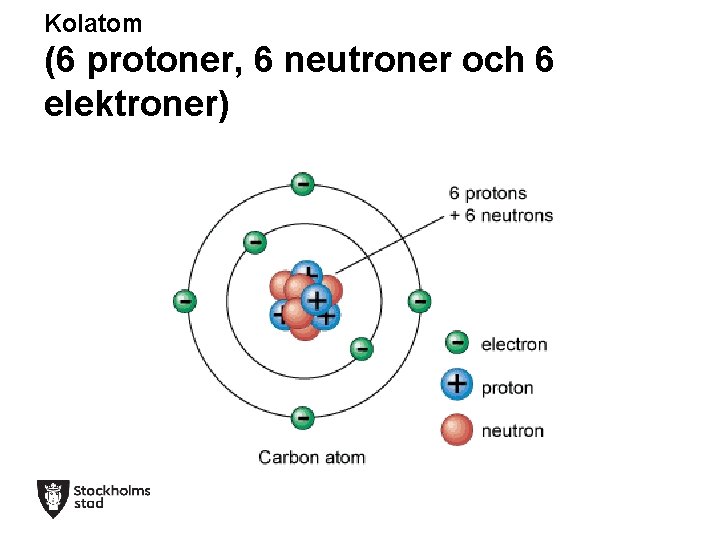
Kolatom (6 protoner, 6 neutroner och 6 elektroner)

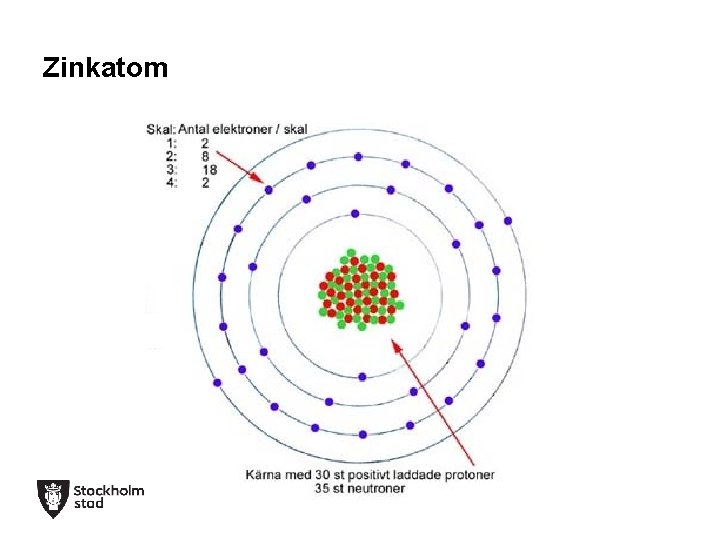
Zinkatom

molekyler • Två eller flera atomer som sitter ihop • Vanliga molekyler: H 2 O, CO 2 O 2, N 2 • Siffran talar om hur många av atomslaget som sitter i hop

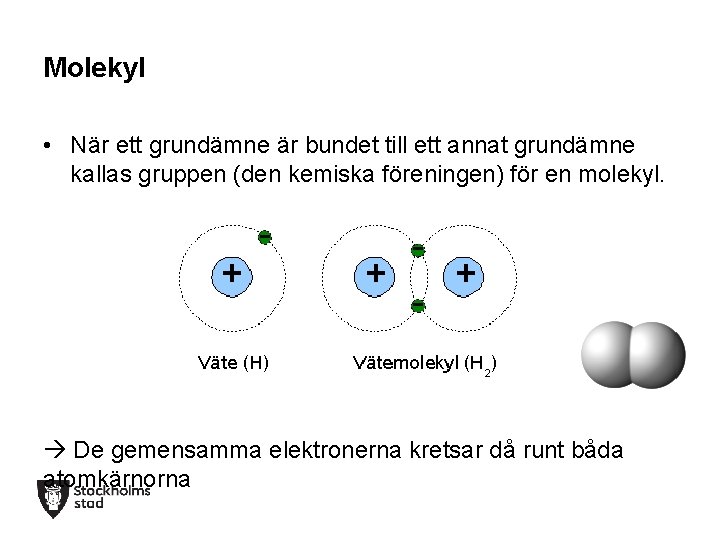
Molekyl • När ett grundämne är bundet till ett annat grundämne kallas gruppen (den kemiska föreningen) för en molekyl. + - + De gemensamma elektronerna kretsar då runt båda atomkärnorna

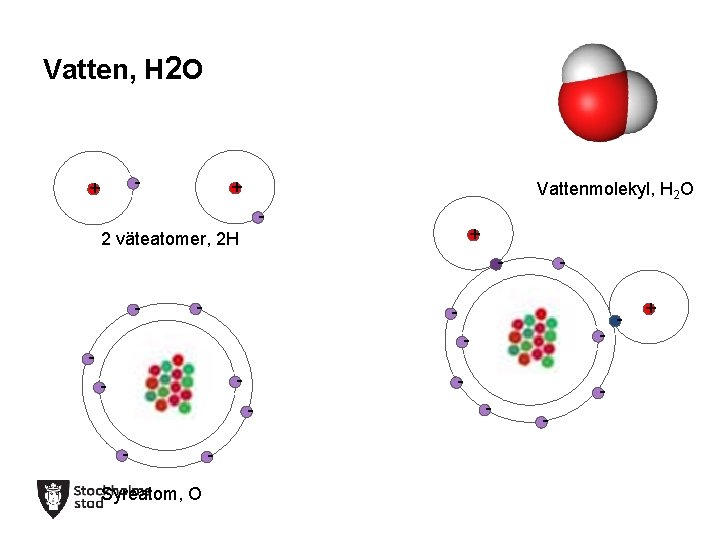
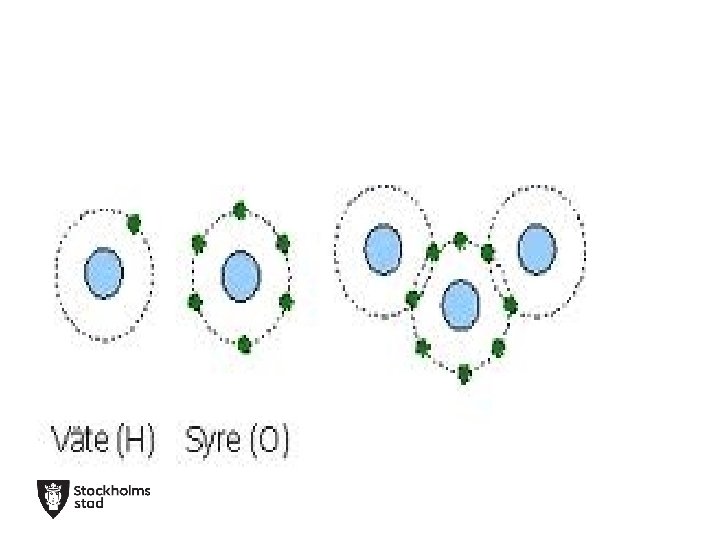
Vatten, H 2 O Syre (O) Väte (H)

Vatten, H 2 O + - -- + - 2 väteatomer, 2 H -- -- ---- Syreatom, O -- Vattenmolekyl, H 2 O + - ---- -- -- + -

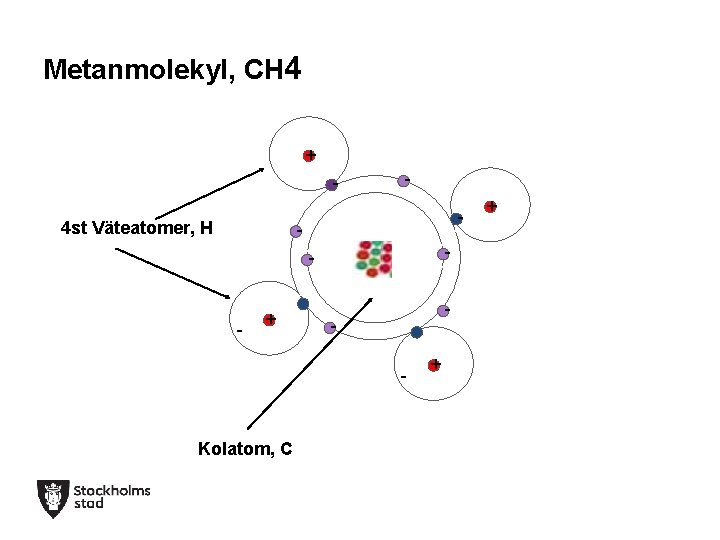
Metanmolekyl, CH 4 + - 4 st Väteatomer, H - -- --+ - -- -- Kolatom, C -+ - -- + -

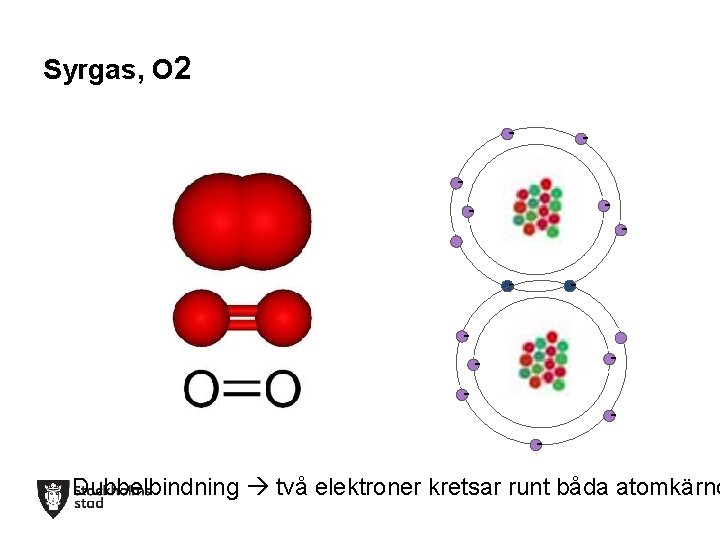
Syrgas, O 2 -- -- ----- -- Dubbelbindning två elektroner kretsar runt båda atomkärno

Kemiska beteckningar för molekyler • Varje atom betecknas med sitt kemiska tecken • Antal atomer betecknas efter atomens kemiska tecknet – CO 2 (koldioxid) – CH 4 (metan) • Antal molekyler betecknas innan molekyl beteckningen – 2 CO 2 – 3 CH 4

VAD ÄR DET FÖR SKILLNAD PÅ 2 O OCH O 2? • 2 O betyder att det finns två syreatomer. • O 2 betyder att syreatomerna sitter ihop i en kemisk förening, molekyl.

VAD ÄR DET FÖR SKILLNAD PÅ 2 O OCH O 2? • 2 O betyder att det finns två syreatomer. • O 2 betyder att syreatomerna sitter ihop i en kemisk förening, molekyl.

Kemisk reaktion • Nya ämnen bildas genom att molekylerna sätts ihop eller tas isär. • Atomerna försvinner aldrig! Lika många atomer finns innan och efter reaktionen. • En kemisk reaktion kan beskrivas med en reaktionsformel Ämne + Ämne Nytt Ämne

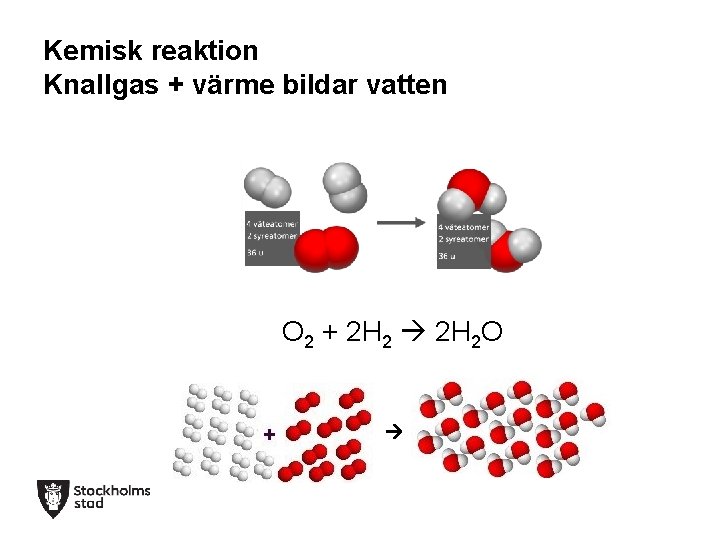
Kemisk reaktion Knallgas + värme bildar vatten O 2 + 2 H 2 O

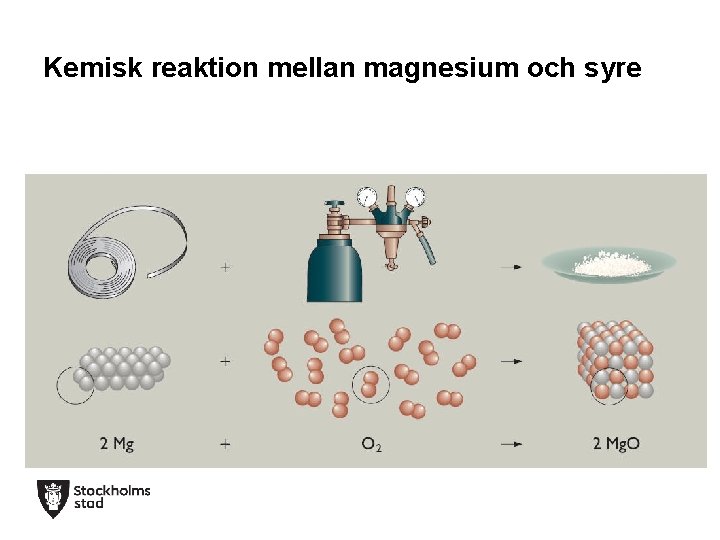
Kemisk reaktion mellan magnesium och syre

Kemisk reaktion mellan järn och svavel REAKTIONSFORMEL När man skriver en reaktionsformel använder man ämnenas kemiska tecken. Fe + S Fe. S

OBS! • Det ska alltid finna lika många atomer av varje grundämne på båda sidor om pilen! • En järnatom + en svavelatom en järnsulfidmolekyl • Fe. S Fe + S

Reaktionsformel steg för steg Om vi vill skriva reaktionsformeln för järn (Fe) och svavel (S) går vi tillväga på följande sätt: • Steg 1: Fe + S – Skriv de ämnen du har från början (Fe och S) – Sätt ett plustecken mellan ämnena. • Steg 2: Fe + S – Rita en pil efter ämnena • Steg 3: Fe + S Fe. S – Till höger om pilen skriver du det eller de ämnen som bildats.

Reaktionsformler • Reaktionsformeln för när magnesium brinner i syre: • 2 Mg + O 2 2 Mg. O • Varför ser formeln ut så?

Svaret kommer här. . • 2 Mg + O 2 2 Mg. O • Syre förkommer i luft som en gas, syrgas, vilket betyder att syret är bundet till ett annat syre. • Syrgas består av syremolekyler och ska därför skrivas O 2. • Vid reaktionen delar syremolekylen upp sig till två syreatomer

Fortsättning. . 2 Mg + O 2 2 Mg. O • Syreatomerna förenar sig sedan med varsin magnesiumatom. • Nytt ämne som har bildats kallas magnesiumoxid (Mg. O).

• 2 Mg + O 2 2 Mg. O • Eftersom syret har två stycken syreatomer som sitter ihop i en molekyl på vänster sida om pilen så måste det finnas med två syreatomer även på höger sida om pilen. • För att det ska vara jämvikt och reaktionen kunna äga rum måste det finnas lika många magnesiumatomer som syreatomer, eftersom att det är syret och magnesiumet som reagerar. • Därför sätter man dit en 2: a framför Mg.

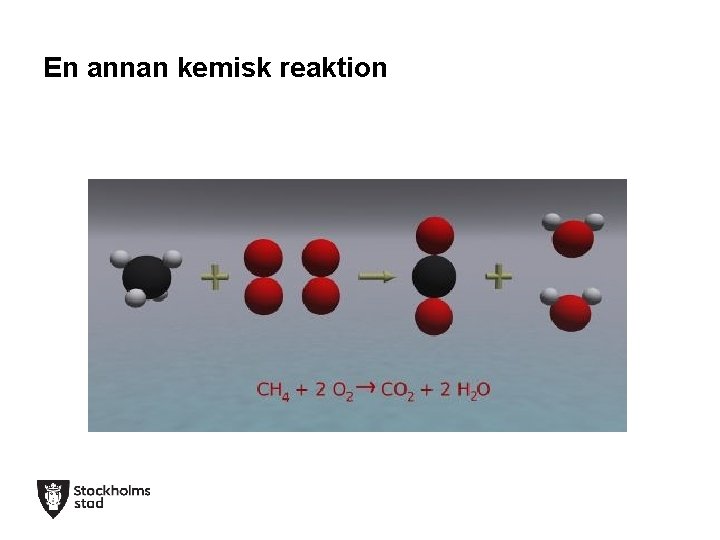
En annan kemisk reaktion

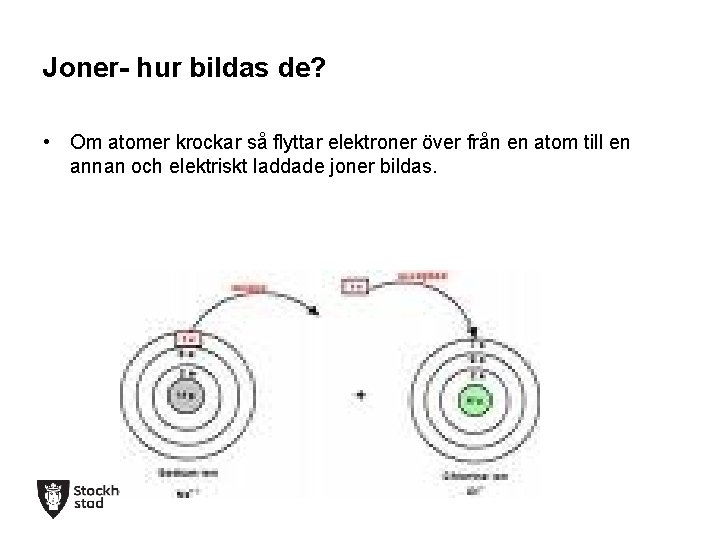
Joner- hur bildas de? • Om atomer krockar så flyttar elektroner över från en atom till en annan och elektriskt laddade joner bildas.

Vad är Joner • Joner är partiklar med en elektrisk laddning. • Skapas genom att en atom antingen tar upp eller avger elektroner (e-). • En positiv jon bildas genom att en atom avger en eller flera elektroner. • En negativ jon bildas genom att en atom tar upp en eller flera elektroner. • Exempel på joner är: – Li+ Litiumjon – laddning 1+ – Mg 2+ Magnesiumjon – laddning 2+ – Cl. Kloridjon – laddning 1– O 2 Oxidjon – laddning 2 -

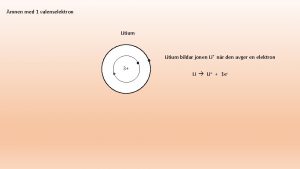
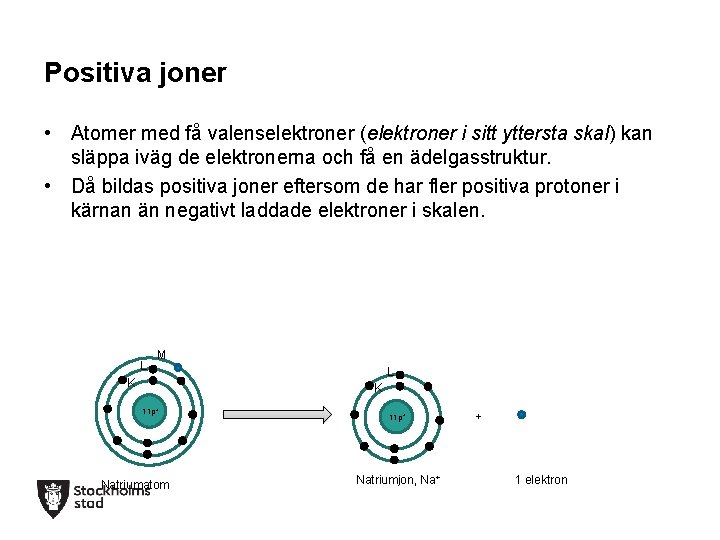
Positiva joner • Atomer med få valenselektroner (elektroner i sitt yttersta skal) kan släppa iväg de elektronerna och få en ädelgasstruktur. • Då bildas positiva joner eftersom de har fler positiva protoner i kärnan än negativt laddade elektroner i skalen. L M K L K 11 p+ Natriumatom 11 p+ Natriumjon, Na+ + 1 elektron

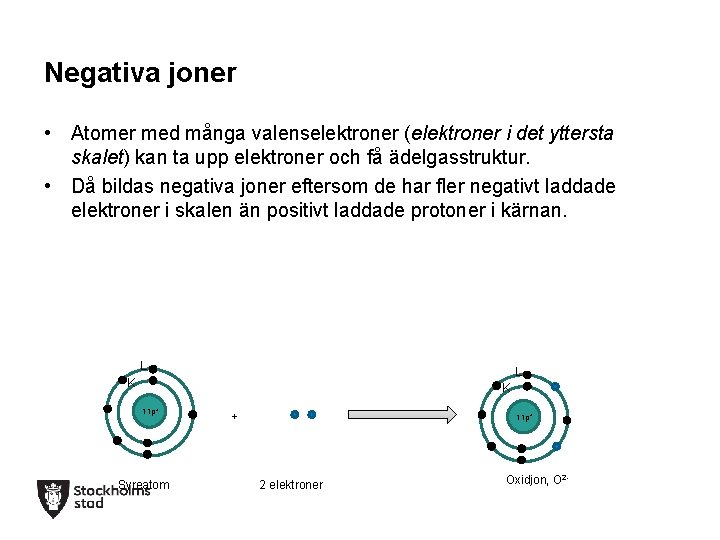
Negativa joner • Atomer med många valenselektroner (elektroner i det yttersta skalet) kan ta upp elektroner och få ädelgasstruktur. • Då bildas negativa joner eftersom de har fler negativt laddade elektroner i skalen än positivt laddade protoner i kärnan. L L K K 11 p+ Syreatom + 11 p+ 2 elektroner Oxidjon, O 2 -

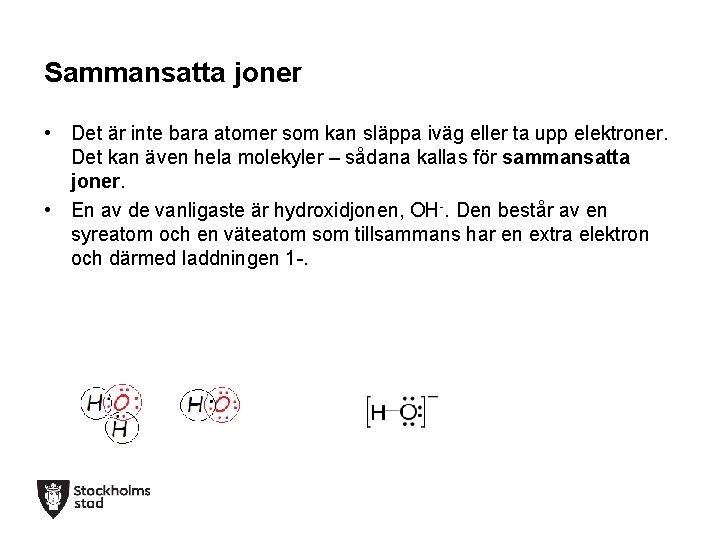
Sammansatta joner • Det är inte bara atomer som kan släppa iväg eller ta upp elektroner. Det kan även hela molekyler – sådana kallas för sammansatta joner. • En av de vanligaste är hydroxidjonen, OH-. Den består av en syreatom och en väteatom som tillsammans har en extra elektron och därmed laddningen 1 -.

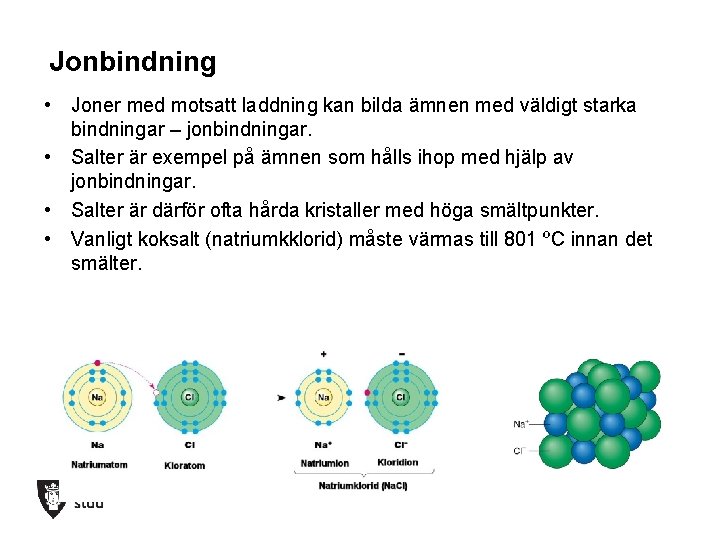
Jonbindning • Joner med motsatt laddning kan bilda ämnen med väldigt starka bindningar – jonbindningar. • Salter är exempel på ämnen som hålls ihop med hjälp av jonbindningar. • Salter är därför ofta hårda kristaller med höga smältpunkter. • Vanligt koksalt (natriumkklorid) måste värmas till 801 ºC innan det smälter.



Vanliga joner i salter… Vanliga positiva joner i salter • • Natriumjon, Na+ Kaliumjon, K+ Kalciumjon, Ca 2+ Järnjon, Fe 2+eller Fe 3+ Vanliga negativa joner i salter • • Kloridjon, Cl. Nitratjon, NO 3 Sulfatjon, SO 42 Karbonatjon, CO 32 -



 Vad är grupp i periodiska systemet
Vad är grupp i periodiska systemet Periodiska systemet perioder
Periodiska systemet perioder Periodiska systemet grupper och perioder
Periodiska systemet grupper och perioder Fr periodiska systemet
Fr periodiska systemet Tidsord
Tidsord Hjärnans delar
Hjärnans delar Supanova fettförbränning
Supanova fettförbränning Systemet karlskoga
Systemet karlskoga Ia systemet
Ia systemet Policy i plural
Policy i plural Verb svenska
Verb svenska Orsak konsekvens analys
Orsak konsekvens analys Ifkv moodle
Ifkv moodle Myron kettaheitja
Myron kettaheitja Vad är primärgrupp
Vad är primärgrupp Deindividualisering
Deindividualisering Moreland och levines modell
Moreland och levines modell Olika roller i en grupp
Olika roller i en grupp Har model
Har model Vi har kun en sol tekst
Vi har kun en sol tekst Vilka uppgifter har skelettet
Vilka uppgifter har skelettet Dim sum 101
Dim sum 101 Hur många diagonaler kan man dra i en sexhörning
Hur många diagonaler kan man dra i en sexhörning Don quijote 1605
Don quijote 1605 Hvem har regnskapsplikt
Hvem har regnskapsplikt Vi vil gi dig ære
Vi vil gi dig ære Nukte ke har phir se
Nukte ke har phir se Sannsynlighet til prosent
Sannsynlighet til prosent Je skulle vøri fire år i romjul
Je skulle vøri fire år i romjul Gik alle konger frem på rad
Gik alle konger frem på rad Blodtransport
Blodtransport Det har regnet på mit vindue
Det har regnet på mit vindue Bobur lirikasi haqida malumot
Bobur lirikasi haqida malumot Vad är skillnaden mellan atomer och joner
Vad är skillnaden mellan atomer och joner O'quvchilar shaxsini har tomonlama kamol toptirish
O'quvchilar shaxsini har tomonlama kamol toptirish Kon volym formel
Kon volym formel Tarbiya jarayonining o'ziga xos xususiyatlari
Tarbiya jarayonining o'ziga xos xususiyatlari Medusa systrar
Medusa systrar Cinco har
Cinco har Gik alle konger frem på rad
Gik alle konger frem på rad Te har
Te har Predikatsfyllnad
Predikatsfyllnad Hinduismen guder brahma
Hinduismen guder brahma Trene med mensen
Trene med mensen