Atomer joner och det periodiska systemet Allt i









- Slides: 19

Atomer, joner och det periodiska systemet

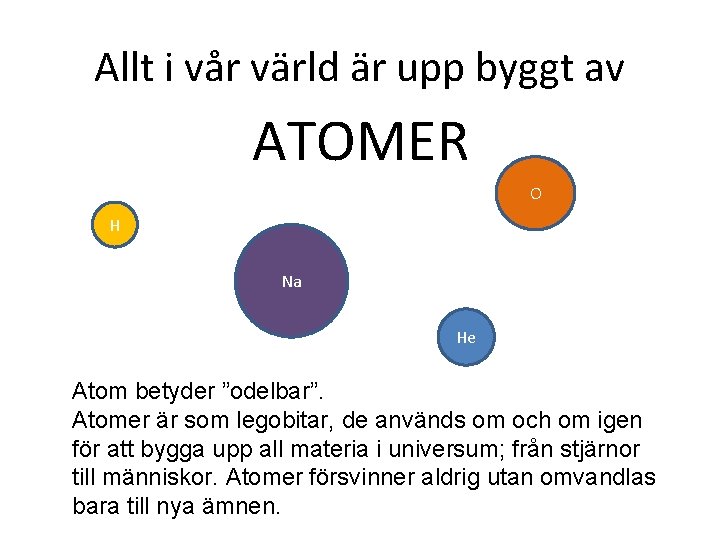
Allt i vår värld är upp byggt av ATOMER O H Na He Atom betyder ”odelbar”. Atomer är som legobitar, de används om och om igen för att bygga upp all materia i universum; från stjärnor till människor. Atomer försvinner aldrig utan omvandlas bara till nya ämnen.

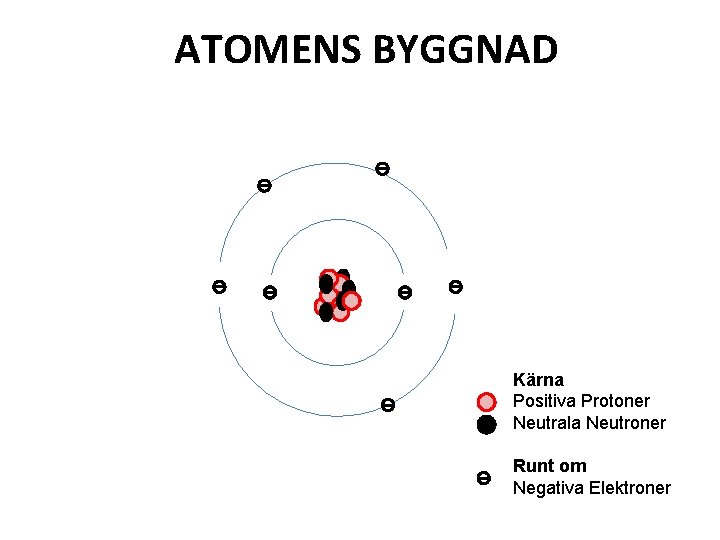
ATOMENS BYGGNAD Kärna Positiva Protoner Neutrala Neutroner Runt om Negativa Elektroner

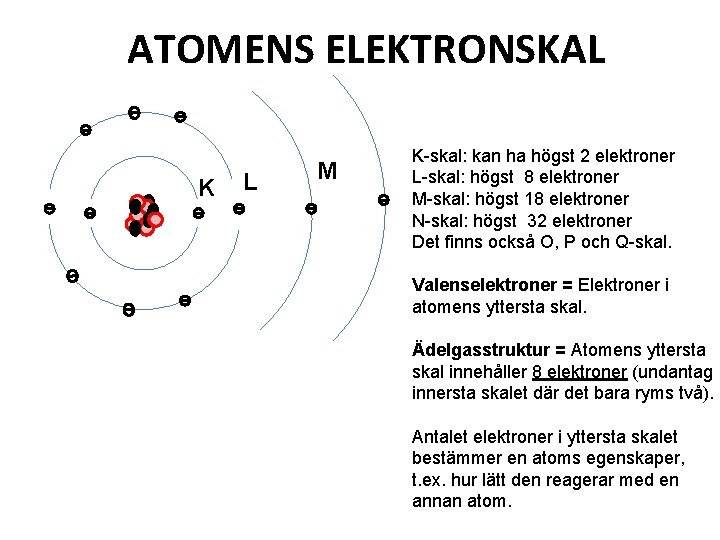
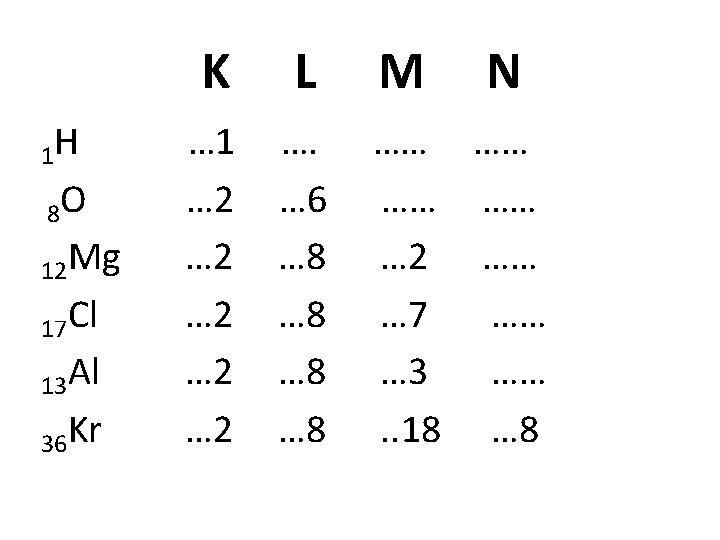
ATOMENS ELEKTRONSKAL K L M K-skal: kan ha högst 2 elektroner L-skal: högst 8 elektroner M-skal: högst 18 elektroner N-skal: högst 32 elektroner Det finns också O, P och Q-skal. Valenselektroner = Elektroner i atomens yttersta skal. Ädelgasstruktur = Atomens yttersta skal innehåller 8 elektroner (undantag innersta skalet där det bara ryms två). Antalet elektroner i yttersta skalet bestämmer en atoms egenskaper, t. ex. hur lätt den reagerar med en annan atom.


PERIODISKA SYSTEMET En tabell med alla grundämnen indelade efter egenskaper.

Atomnummer och atommassa • Atomnummer = antalet protoner = antalet elektroner ex. Litium (Li) har atomnummer 3: Antalet protoner = 3, antalet elektroner = 3 • Atommassa (vikten) = antalet protoner + antalet neutroner ex. Litium (Li) har atommassan 7: Antalet protoner = 3, antalet neutroner = 4 (3 + 4 = 7)

Vad är atomnummer och atommassa för kol (C)? Svar: Atomnummer = 6 och atommassa = 12

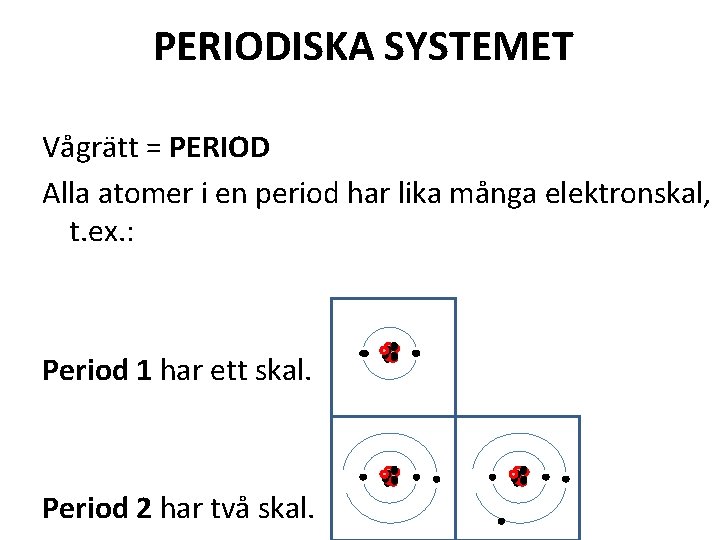
PERIODISKA SYSTEMET Vågrätt = PERIOD Alla atomer i en period har lika många elektronskal, t. ex. : Period 1 har ett skal. Period 2 har två skal.

PERIODISKA SYSTEMET Lodrätt = GRUPPER Alla atomer i en grupp har lika många elektroner i yttersta skalet (valenselektroner), t. ex. : Grupp 17: • • Grupp 1 har en valenselektron Grupp 2 har två valenselektroner Grupp 17 har sju valenselektroner Grupp 18 har åtta valenselektroner Grundämnen i samma grupp har liknande egenskaper.

Vilka egenskaper kännetecknar grundämnen i grupp 1? Grupp 1 Väte, litium, natrium, kalium, rubidium, cesium, francium Egenskaper • Alla atomer i gruppen har 1 valenselektron. • Vill gärna lämna ifrån sig sin valenselektron för att få 8 elektroner i yttersta skalet (2 för små atomer). • Reagerar därför lätt med andra grundämnen. Ex. Litium och Natrium

Vilka egenskaper kännetecknar grundämnen i grupp 17? Grupp 17 Fluor, klor, brom, jod, astat Egenskaper • Alla atomer i gruppen har 7 valenselektroner. • Vill gärna ta upp en elektron för att få 8 elektroner i sitt yttersta skal. • Reagerar därför lätt med andra grundämnen. • Ex. Fluor - Bra för tänderna Klor - Bleker och är bakteriedödande

Vilka egenskaper kännetecknar grundämnen i grupp 18? Grupp 18 Helium, neon, argon, krypton, xenon, radon Egenskaper • Har 8 elektroner (2 för helium) i sitt yttersta skal och vill inte ha fler/färre elektroner. • Är därför mycket stabila och reagerar inte med andra grundämnen. Ex. • Helium (i ballonger) • Neon (i färgade lysrör) • Argon (i glödlampor så glödtråden ej ska brinna av)

ATOMER BLIR TILL JONER Atomer vill gärna få ”ädelgasstruktur”, dvs få 8 elektroner (2 för små atomer) i det yttre skalet. För att uppnå detta måste de antingen avge eller ta upp elektroner. Då omvandlas atomerna till positivt eller negativt laddade joner. • När grundämnen i grupp 1 lämnar ifrån sig sin valenselektron omvandlas de till positiva joner. Den positiva laddningen markeras med ett plus uppe till höger, t. ex. natriumjon: Na+ • När grundämnen i grupp 17 tar upp en extra valenselektron omvandlas de till negativa joner. Den negativa laddningen markeras med ett minus uppe till höger, t. ex. kloridjon: Cl-

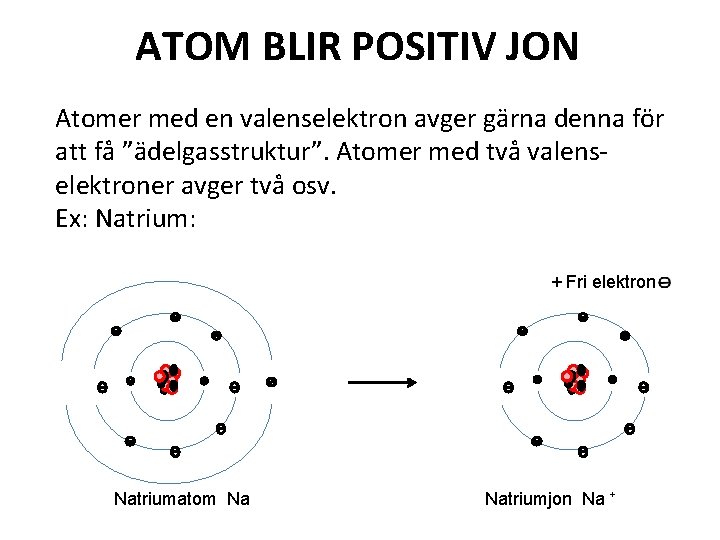
ATOM BLIR POSITIV JON Atomer med en valenselektron avger gärna denna för att få ”ädelgasstruktur”. Atomer med två valenselektroner avger två osv. Ex: Natrium: + Fri elektron Natriumatom Na Natriumjon Na +

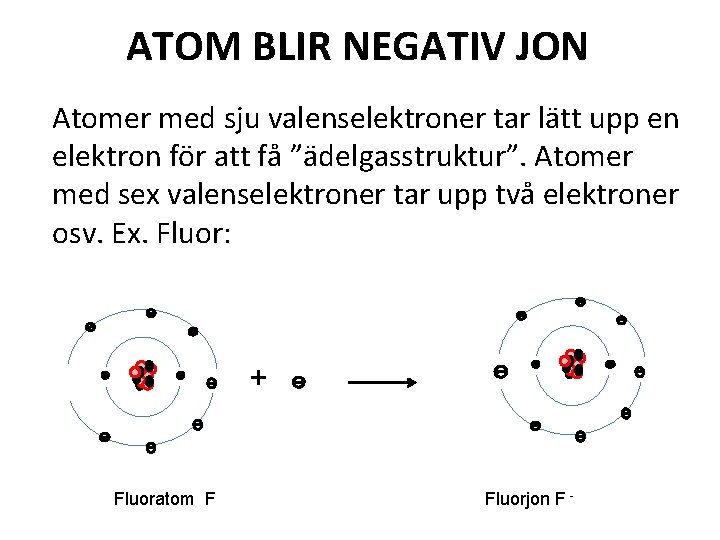
ATOM BLIR NEGATIV JON Atomer med sju valenselektroner tar lätt upp en elektron för att få ”ädelgasstruktur”. Atomer med sex valenselektroner tar upp två elektroner osv. Ex. Fluor: + Fluoratom F Fluorjon F -

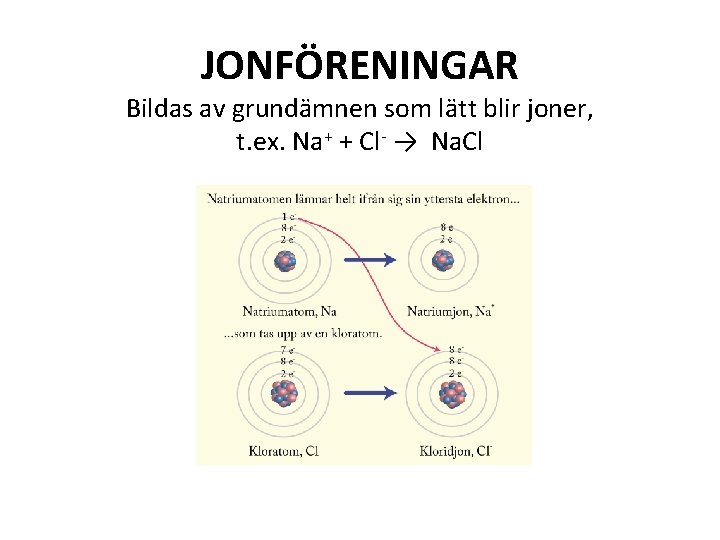
JONFÖRENINGAR Bildas av grundämnen som lätt blir joner, t. ex. Na+ + Cl- → Na. Cl

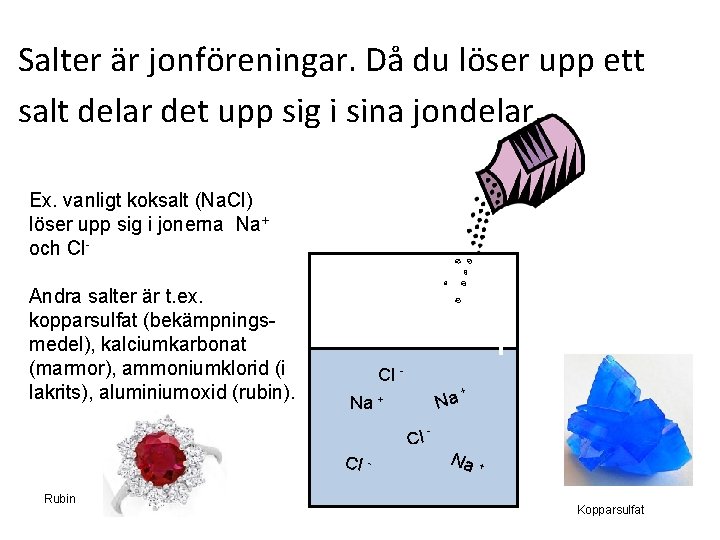
Salter är jonföreningar. Då du löser upp ett salt delar det upp sig i sina jondelar. Ex. vanligt koksalt (Na. Cl) löser upp sig i jonerna Na+ och Cl. Andra salter är t. ex. kopparsulfat (bekämpningsmedel), kalciumkarbonat (marmor), ammoniumklorid (i lakrits), aluminiumoxid (rubin). Cl Na Na + Cl Cl Rubin - + - Na + Kopparsulfat

OXIDATION OCH REDUKTION (överkurs) Oxidation: Sker när en atom avger elektroner, t. ex. Na Na+ (Natriumatomen avger en elektron) Reduktion: Sker när en atom tar upp elektroner, t. ex. Cl Cl- (Kloratomen tar upp en elektron) När salt bildas sker alltid en oxidation av det ena ämnet och en reduktion av det andra = redoxreaktion. T. ex. när koksalt bildas: Na oxideras och Cl reduceras
 Hur har kungsvatten fått sitt namn
Hur har kungsvatten fått sitt namn Periodiska systemet grupper och perioder
Periodiska systemet grupper och perioder Grupp 1 periodiska systemet
Grupp 1 periodiska systemet Periodiska systemet grupper
Periodiska systemet grupper Landskapsgrundämne
Landskapsgrundämne Atomer och molekyler
Atomer och molekyler Ungefär hur många atomslag finns det
Ungefär hur många atomslag finns det Hvor i det periodiske system står atomer med 5 skaller?
Hvor i det periodiske system står atomer med 5 skaller? De fem pelarna islam
De fem pelarna islam Joner 1 on 1
Joner 1 on 1 Dubbel socialisation exempel
Dubbel socialisation exempel Innefattar allt levande
Innefattar allt levande Mig pronomen
Mig pronomen Tjock och smal liten och stor
Tjock och smal liten och stor Jämförelse hinduism och buddhism
Jämförelse hinduism och buddhism Det beskrivende og det komplekse kulturbegreb
Det beskrivende og det komplekse kulturbegreb Systemet karlskoga
Systemet karlskoga Iasystemet
Iasystemet Biologiska perspektivet
Biologiska perspektivet Andningsreglering
Andningsreglering