KEMISKA FRENINGAR MOLEKYLFRENINGAR eller JONFRENINGAR PERIODISKA SYSTEMET Grupp











- Slides: 15

KEMISKA FÖRENINGAR MOLEKYLFÖRENINGAR eller JONFÖRENINGAR

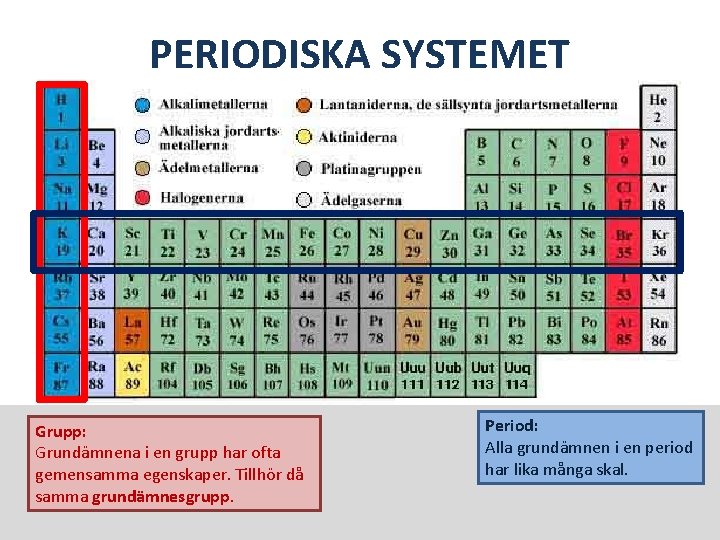
PERIODISKA SYSTEMET Grupp: Grundämnena i en grupp har ofta gemensamma egenskaper. Tillhör då samma grundämnesgrupp. Period: Alla grundämnen i en period har lika många skal.

K: max 2 e. L: max 8 e. M: max 8 e- om det ligger ytterst ATOMENS UPPBYGGNAD - - - M L - - K - + ++ + + + +++ + + - 18 Ar - - - Argon Om det finns skal utanför kan man dock få plats med 18 elektroner i M-skalet. - - Atomnummer: Visar antalet protoner och elektroner

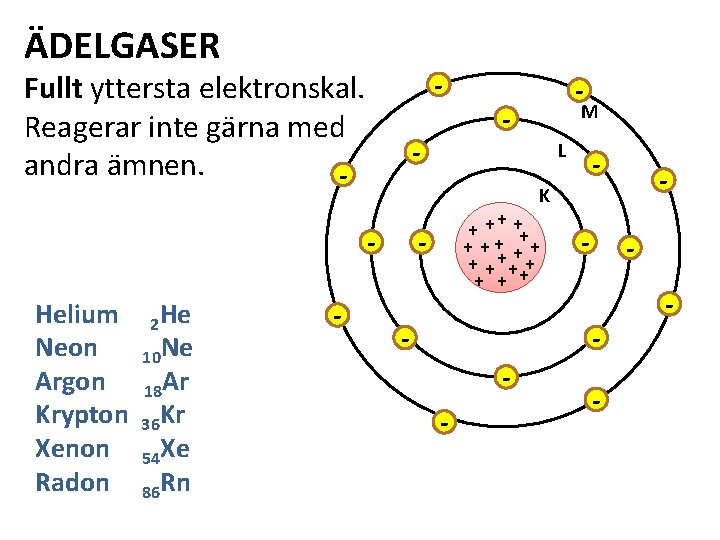
ÄDELGASER - Fullt yttersta elektronskal. Reagerar inte gärna med andra ämnen. - - 2 He 10 Ne 18 Ar 36 Kr 54 Xe 86 Rn - M L - - K Helium Neon Argon Krypton Xenon Radon - + ++ + + + +++ + + - - -

VALENSELEKTRONER • De elektroner som finns i atomens yttersta skal kallas valenselektroner. Obs! Ämnen med fullt yttersta skal (ädelgaser) har inga valenselektroner • Ämnen med få valenselektroner bildar ädelgasstruktur genom att avge sina valenselektroner • Ämnen med många valenselektroner bildar ädelgasstruktur genom att ta upp så många elektroner att de får ädelgasstruktur

HUR KEMISKA FÖRENINGAR BILDAS • Vid kemiska reaktioner strävar ämnena efter att uppnå ädelgasstruktur (fullt yttersta elektronskal) • Detta kan ske på flera sätt: – Molekylförening Atomerna binds samman genom att dela på valenselektroner. – Jonförening Atomerna lämnar ifrån sig eller tar upp elektroner och blir joner. Jonerna hålls sedan ihop av elektriska krafter.

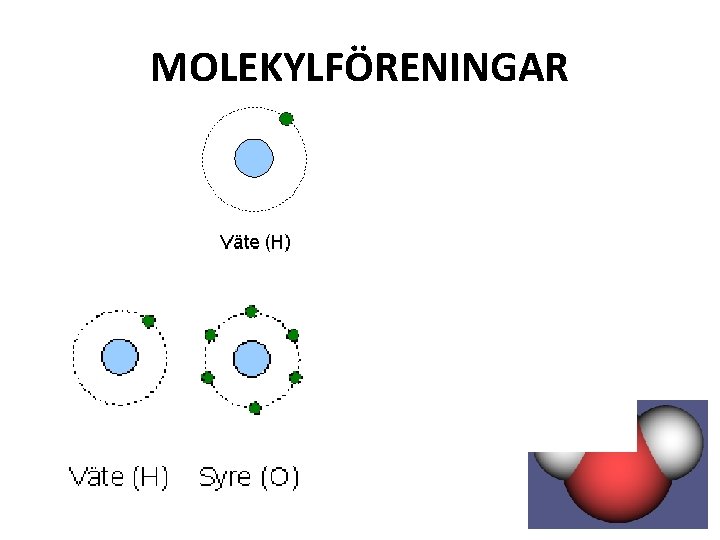
MOLEKYLFÖRENINGAR I molekylföreningar binds atomerna samman genom att dela på elektroner. Det kallas elektronparbindning eller kovalent bindning.

MOLEKYLFÖRENINGAR

JONFÖRENINGAR • Många kemiska föreningar bildas genom att atomerna omvandlas till joner • Jonerna har olika laddningar (+ eller ). • Jonföreningar byggs upp av positiva och negativa joner som hålls samman av elektriska krafter

PERIODISKA SYSTEMET Grupp 1: ALKALIMETALLERNA Har en enda elektron i det yttersta skalet. Reagerar lätt med andra ämnen (lämnar ifrån sig elektronen i yttersta skalet). Alla grundämnen i gruppen är metaller utom väte.

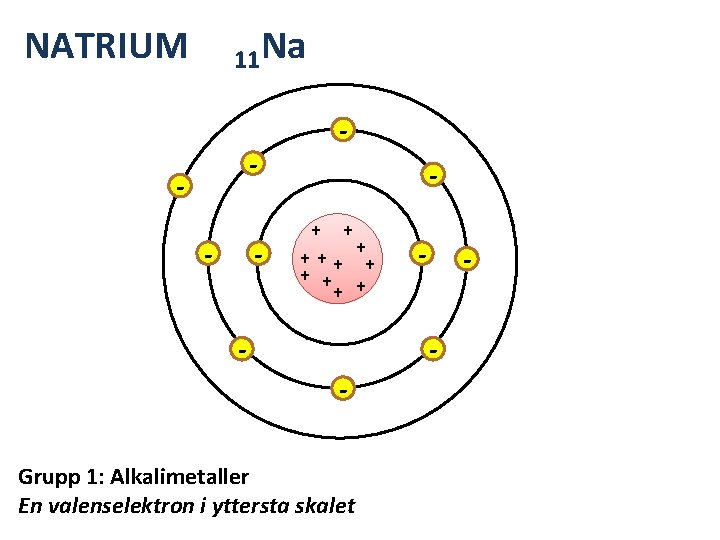
NATRIUM 11 Na - - - + +++ + + - - - Grupp 1: Alkalimetaller En valenselektron i yttersta skalet

PERIODISKA SYSTEMET Grupp 17: HALOGENERNA Har en ledig elektronplats i yttersta skalet. Bildar gärna kemiska föreningar med andra ämnen (tar då till sig en elektron).

KLOR 17 Cl - - + ++ + + +++ + + - - - - Grupp 17: Halogener Har sju elektroner i yttersta skalet - en ”ledig” elektronplats i yttersta skalet

NATRIUM - - +++ + + ++ + - 11 Na - KLOR - - - Natriumjon Na+ Har lämnat ifrån sig en elektron. Har nu en extra plusladdning. - - ++ + + ++ ++ + + - - 17 Cl - - - Kloridjon Cl- Har tagit upp en elektron. Har nu en extra minusladdning.

Natriumkloridkristall • Jonerna har olika elektriska laddningar Natriumjonen: positivt laddad (lämnat ifrån sig en elektron) Kloridjonen: negativt laddad (tagit upp en elektron) • Olika laddningar dras till varandra → de ordnar sig i ett kristallmönster Natriumjon, Na+ Kloridjon, Cl
 Grupp i periodiska systemet
Grupp i periodiska systemet Elektronskal max antal
Elektronskal max antal Periodiska systemet ptable
Periodiska systemet ptable Fr periodiska systemet
Fr periodiska systemet Boyles lag
Boyles lag Kvävemolekyler med kemiska tecken
Kvävemolekyler med kemiska tecken Systemet karlskoga
Systemet karlskoga Ia-systemet
Ia-systemet Mamillarkroppen
Mamillarkroppen Supanova fettförbränning
Supanova fettförbränning Gdq dmca
Gdq dmca Pseudogrupp
Pseudogrupp Gruppsamarbete
Gruppsamarbete Exempel på informella roller
Exempel på informella roller Substantiv plural
Substantiv plural Individ grupp samhälle
Individ grupp samhälle