ORGANSKA KEMIJA se ukvarja s preuevanjem spojin ki




















- Slides: 26

ORGANSKA KEMIJA se ukvarja s preučevanjem spojin, ki vsebujejo ogljik. Organske spojine so kemijska osnova vsemu, kar je živega. Kaj vse sodi med organske spojine? proteini ogljikovi hidrati (sladkorji) encimi hormoni nafta, zemeljski plin premog mnogo umetnih snovi (npr. barvila, plastika, tekstilna vlakna)

Vsebina predavanj 1. 2. 3. 4. 5. 6. 7. 8. 9. Organske spojine in vezi Alkani in cikloalkani Alkeni, alkini in aromatske spojine Alkoholi, fenoli, etri in halidi Aldehidi in ketoni Karboksilne kisline in estri Amini in amidi Ogljikovi hidrati Lipidi

Kakšna je razlika med organskimi in anorganskimi spojinami? V preteklosti ločevanje po izvoru: organske spojine – izvor v živih organizmih anorganske spojine – mineralne snovi Leta 1828 sintetizirajo ureo (NH 2)2 CO iz anorganskih reagentov NH 4 Cl in Ag. CNO (srebrov cianat) Novejša definicija: Ø Ø Organska kemija je veda, ki preučuje ogljikovodike in njihove derivate (več kot 80 % vseh spojin, število se hitro veča). Anorganska kemija pa je veda, ki preučuje vse ostale spojine. Nekatere spojine vsebujejo ogljik, pa jih uvrščamo med anorganske spojine: CO, CO 2, Na 2 CO 3. Pri teh ogljik ni vezan na vodik.

Primerjava lastnosti organskih in anorganskih spojin Organske spojine Anorganske spojine Prevladujejo kovalentne vezi. Mnogo spojin ima ionske vezi. Spojine so plini, tekočine in trdne snovi z nizkimi T tališča ( 360 C) Večinoma netopne v vodi. Veliko topnih v vodi. Večinoma topni v organskih topilih (npr. Skoraj popolnoma netopni v organskih benzen, bencin, CCl 4) topilih. V raztopinah ne prevajajo električnega toka. Vodne raztopine prevajajo električni tok. Večinoma gorijo. Zelo redke gorijo. Reakcije so večinoma počasne. Reakcije so večinoma zelo hitre. Organske spojine lahko izoliramo iz narave (iz živih organizmov) ali jih sintetiziramo v laboratoriju. Večino naravnih organskih spojin lahko sintetiziramo tudi v laboratoriju (ni razlik v lastnostih, primer vitamin C). Mnogo spojin sintetiziranih samo v laboratoriju (npr. acetilen, CCl 4, DDT, TNT, mnogi pesticidi, mnoga moderna zdravila).

Kemijske vezi Zakaj tvori ogljik 5 -krat toliko spojin kot vsi drugi elementi skupaj? Ogljiki se med seboj lahko povezujejo na več načinov dolge verige C atomov, ciklične strukture C atomov, kombinacija obeh Razlog: elektronska konfiguracija – IV. skupina periodnega sistema vsebuje 4 zunanje elektrone potrebuje 4 elektrone, da zapolni zunanjo lupino lahko tvori 4 kovalentne vezi (delitev skupnega elektronskega para)

Na kakšen način lahko ogljik tvori 4 vezi? Povezuje se s štirimi atomi 4 enojne vezi. Povezuje se s tremi atomi 2 enojni vezi in 1 dvojna vez Povezuje se z dvema atomoma 2 dvojni vezi ali 1 trojna vez in 1 enojna vez *

Ogljikovodiki in njihovi derivati Ogljikovodiki so spojine, ki vsebujejo samo ogljikove in vodikove atome: nasičeni (C atomi se povezujejo samo z enojnimi vezmi) nenasičeni (vsebujejo eno ali več dvojnih in/ali trojnih vezi med C atomi) Derivati ogljikovodikov pa poleg ogljikovih in vodikovih atomov vsebujejo enega ali več dodatnih elementov (npr. O, N, S, P, F, Cl, Br).

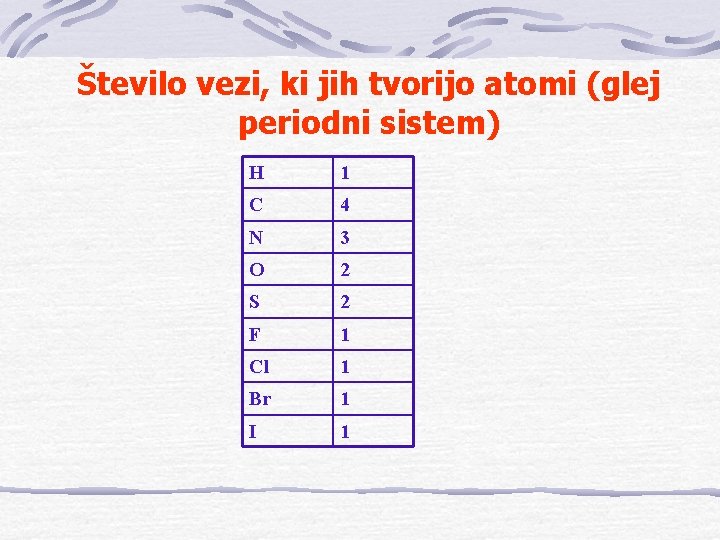
Število vezi, ki jih tvorijo atomi (glej periodni sistem) H 1 C 4 N 3 O 2 S 2 F 1 Cl 1 Br 1 I 1

Ogljikovodiki So spojine, ki vsebujejo samo ogljik in vodik, kljub temu pa poznamo več tisoč takšnih spojin. Ogljikovodike razdelimo na: Alkane (imajo samo enojne vezi) Alkene (imajo dvojne vezi) Alkine (imajo trojne vezi) Aromatske ogljikovodike (imajo benzenske obroče)

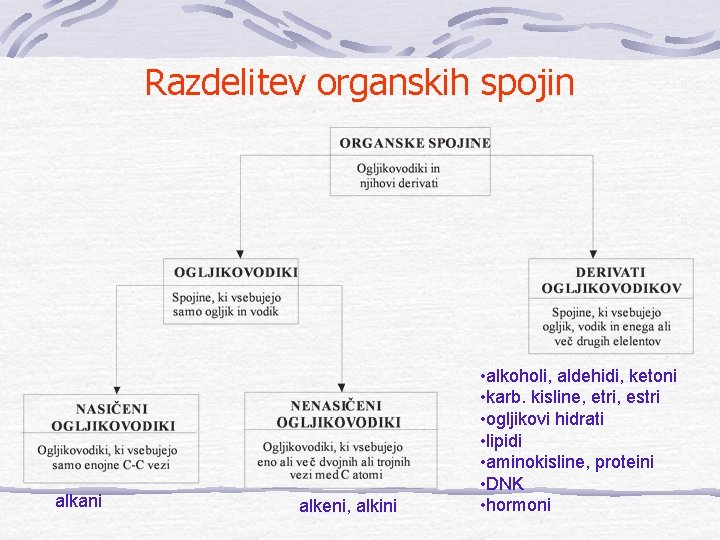
Razdelitev organskih spojin alkani alkeni, alkini • alkoholi, aldehidi, ketoni • karb. kisline, etri, estri • ogljikovi hidrati • lipidi • aminokisline, proteini • DNK • hormoni

Alkani so nasičeni ogljikovodiki, ki imajo aciklično razporeditev ogljikovih atomov. (razlika med cikličnimi in acikličnimi) To pomeni, da alkani vsebujejo samo enoje C -C vezi (nasičene) in ne vsebujejo obročev (aciklični). Molekulska formula alkanov: Cn. H 2 n+2 n-število C atomov Primeri: C 4 H 10, C 5 H 12, C 8 H 18

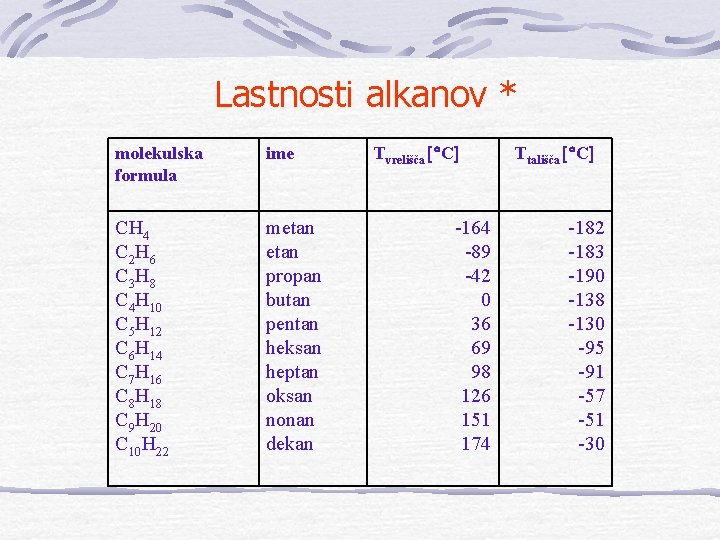
Lastnosti alkanov * molekulska formula ime CH 4 C 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 metan propan butan pentan heksan heptan oksan nonan dekan Tvrelišča C -164 -89 -42 0 36 69 98 126 151 174 Ttališča C -182 -183 -190 -138 -130 -95 -91 -57 -51 -30

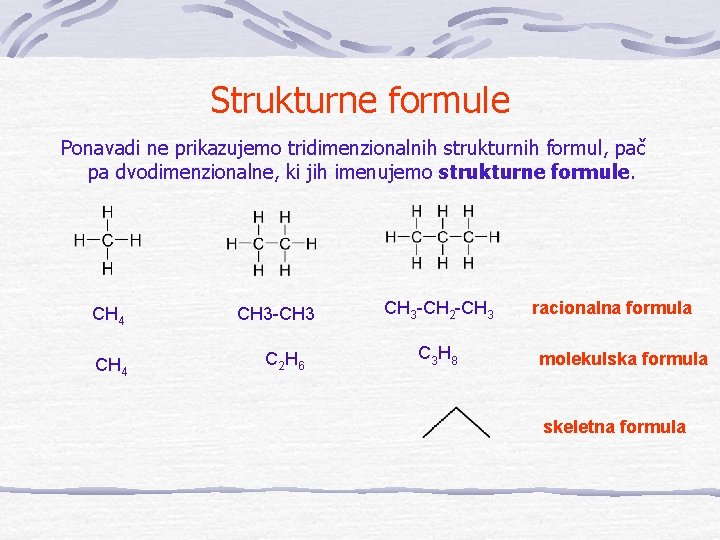
Strukturne formule Ponavadi ne prikazujemo tridimenzionalnih strukturnih formul, pač pa dvodimenzionalne, ki jih imenujemo strukturne formule. CH 4 CH 3 -CH 3 C 2 H 6 CH 3 -CH 2 -CH 3 C 3 H 8 racionalna formula molekulska formula skeletna formula

Strukturni izomeri Pri alkanih, ki imajo več kot 4 C atome, se molekule z enako molekulsko formulo pojavljajo v več kot eni obliki. Molekule z enako molekulsko formulo in različnimi strukturnimi formulami, imenujemo strukturni izomeri. butan izobutan C 4 H 10 molekulska formula Prva struktura predstavlja nerazvejano molekulo butana, druga pa predstavlja razvejano obliko molekule butana (izobutan).

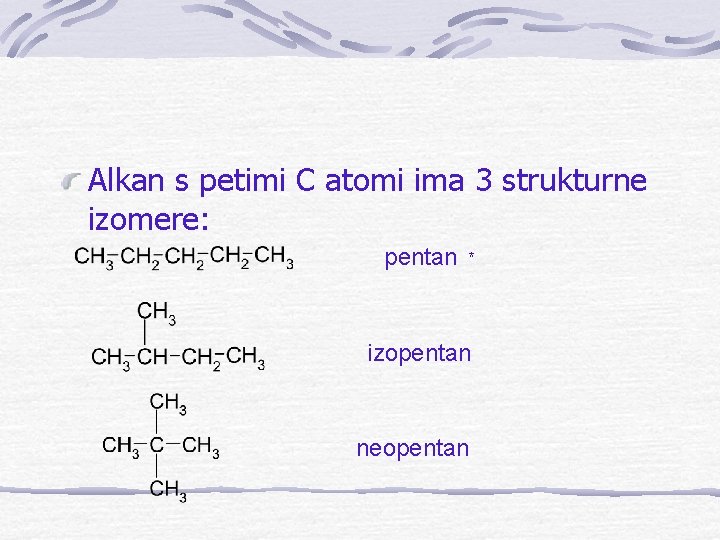
Alkan s petimi C atomi ima 3 strukturne izomere: pentan * izopentan neopentan

Glede na strukturo se razlikujejo tudi lastnosti molekul. alkan butan izobutan pentan izopentan neopentan Tvrelišča gostota -0, 5 C -11, 6 C 0, 579 g/m. L 0, 549 g/m. L 36, 1 C 27, 8 C 9, 5 C 0, 626 g/m. L 0, 620 g/m. L 0, 614 g/m. L

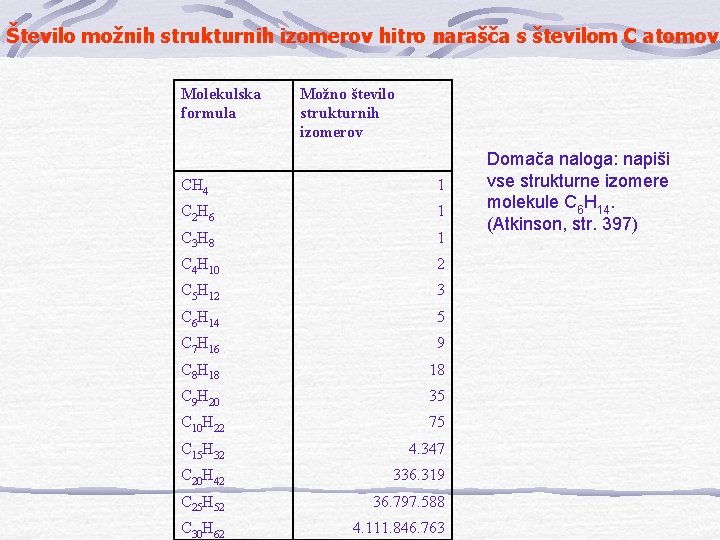
Število možnih strukturnih izomerov hitro narašča s številom C atomov Molekulska formula Možno število strukturnih izomerov CH 4 1 C 2 H 6 1 C 3 H 8 1 C 4 H 10 2 C 5 H 12 3 C 6 H 14 5 C 7 H 16 9 C 8 H 18 18 C 9 H 20 35 C 10 H 22 75 C 15 H 32 4. 347 C 20 H 42 336. 319 C 25 H 52 36. 797. 588 C 30 H 62 4. 111. 846. 763 Domača naloga: napiši vse strukturne izomere molekule C 6 H 14. (Atkinson, str. 397)

Definiramo izraze Primarni C atom: se veže z enim ali nobenim C atomom (metan, etan) Sekundarni C atom: se veže s dvema C atomoma (propan) Terciarni C atom: se veže s tremi C atomi (izobutan) Kvartarni C atom: se veže s štirimi C atomi (neopentan) Normalni alkani: vsebujejo samo primarne in sekundarne C atome Razvejani alkani: tudi terciarne in kvartarne

IUPAC-ova nomenklatura alkanov International Union of Pure and Applied Chemistry (IUPAC) Imena, ki jih predpisuje IUPAC, so sistematična, kar pomeni, da eno ime opisuje točno določeno spojino in obratno. Uporabljamo tudi trivialna imena za spojine, ki jih pogosto srečamo v vsakdanjem življenju (ocetna kislina, mravljična kislina. . . ).

Molekulska formula Ime CH 4 C 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 metan propan butan pentan heksan heptan oksan nonan dekan

Definicija alkilne skupine (radikali, substituenti): alkilno skupino dobimo, če odstranimo en vodik (primer CH 4, metan; CH 3 -, metilna skupina) alkilne skupine niso samostojne molekule formula ime CH 3 C 2 H 5 C 3 H 7 C 4 H 9 C 5 H 11 C 6 H 13 - metil propil butil pentil heksil

Osnovna pravila za poimenovanje: 1. Poišči najdaljšo verigo ogljikovih atomov in jo poimenuj glede na število C atomov 2. Oštevilči C atome s tiste strani, da ima C-atom, na katerega je vezana alkilna skupina(radikal, substituent), najnižje možno število. 3. Če je prisotna samo ena alkilna skupina, jo poimenujemo in povemo njeno pozicijo (2 -metilpentan, 2 -metilheksan). 4. Če je na osnovno verigo vezanih več enakih alkilnih skupin, napišemo njihove pozicije, njihovo število pa označimo s preponami di-, tri-, tetra-, penta- (2, 4 dimetilpentan, 3, 3 -dimetilpentan) 5. Kadar sta na osnovno verigo vezani dve alkilni slupini, vsako posebej oštevilčimo in ju poimenujemo po abecednem vrstnem redu (3 -etil-2 -metil-pentan, 3 -etil-4, 5 -dipropiloktan) 6. Primer 12. 2

Cikloalkani so nasičeni ogljikovodiki, katerih C atomi so razporejeni v obroču. Najmanjši cikloalkan je ciklopropan, potem ciklobutan, ciklopentan, cikloheksan, . . . ciklopropan ciklobutan Kakšne so molekulske formule? ciklopentan cikloheksan

IUPAC-ova nomenklatura cikloalkanov Poimenovanje je podobno kot pri necikličnih alkanih, le da dodamo predpono ciklo-. Ostala pravila pa so: Če ima obroč samo en substituent (alkilno skupino), potem ni potrebno označiti lokacije (metilciklobutan) Če ima obroč dva substituenta, jih oštevilčimo po abecednem vrstnem redu. (1 -etil-2 -metilciklopentan)

Izomerizacija cikloalkanov Strukturne izomere so možne pri cikloalkanih, ki imajo 4 ali več C atomov. Npr. Obstaja 5 strukturnih izomerov z molekulsko formulo C 5 H 10. Ciklopentan, metilciklobutan, 1, 2 -dimetilciklopropan, 1, 1 dimetilciklopropan, etilciklopropan Pri cikloalkanih z vezanima dvema ali več substituenti obstaja geometrijska izomerija (cis-trans izomerija). V tem primeru sta tako molekulska kot strukturna formula enaki, drugačna pa je razporeditev v prostoru, ker ni mogoča rotacija okrog C-C vezi (tako kot pri necikličnih alkanih). Na ta način dobimo spodnjo in zgornjo stran molekule. 1, 2 -dimetilciklopentan (cis-1, 2 -dimetilciklopentan; trans-1, 2 dimetilciklopentan) molekuli sta stereoizomeri

Stereoizomeri imata enako molekulsko in strukturno formulo ter drugačno tridimenzionalno strukturo. cis izomera je izomera cikloalkanov, kjer sta oba substituenta na isti strani ogljikovega obroča trans izomera je izomera cikloalkanov, kjer sta oba substituenta na različnih straneh ogljikovega obroča Prehajanje iz ene oblike v drugo je možno samo v primeru, ko se obroč odpre. Obe izomeri imata različne lastnosti (Tvrelišča).
 Kisikove funkcionalne skupine
Kisikove funkcionalne skupine Funkcionalne skupine kisikovih spojin
Funkcionalne skupine kisikovih spojin Boja svinjske masti
Boja svinjske masti Organska jedinjenja sa kiseonikom
Organska jedinjenja sa kiseonikom Prometeidi
Prometeidi Homologni niz alkohola
Homologni niz alkohola Kvaternerni amonijum jon
Kvaternerni amonijum jon Kemija 8 kisline baze in soli
Kemija 8 kisline baze in soli Hvala na pažnji kemija
Hvala na pažnji kemija Sapuni kemija
Sapuni kemija Vigreuxova kolona
Vigreuxova kolona Kiseline baze soli
Kiseline baze soli Kvantna kemija
Kvantna kemija Dobivanje etanola
Dobivanje etanola Eterska skupina
Eterska skupina Kemija atomi 7 razred
Kemija atomi 7 razred Kemija 8 ioni
Kemija 8 ioni Portal nikola tesla biologija
Portal nikola tesla biologija Ogljikovi hidrati kemija
Ogljikovi hidrati kemija čavao u slanoj vodi
čavao u slanoj vodi Kemija danes 2 učbenik rešitve organske kisikove spojine
Kemija danes 2 učbenik rešitve organske kisikove spojine Hvala na pažnji kemija
Hvala na pažnji kemija Hvala na pažnji hemija
Hvala na pažnji hemija Vrelišče alkoholov
Vrelišče alkoholov Edutorij kemija 2
Edutorij kemija 2 Pokus sa modrom galicom
Pokus sa modrom galicom Maščobe kemija 9
Maščobe kemija 9