Dobivanje i svojstva etera Nastavni predmet Organska kemija

Dobivanje i svojstva etera Nastavni predmet: Organska kemija Ekološki tehničar-3. razred Trajanje: 2 sata Autor: Zorica Majić, prof.

Dragi učenici i drage učenice, kako bismo vam olakšali učenje za vas smo pripremili materijale za samostalni rad. U ovoj prezentaciji su sadržaji koji se odnose na nastavni predmet: Organska kemija Također prezentacija sadrži i zadatke za vježbu. Na kraju prezentacije nalaze se pitanja za ponavljanje gradiva. Vaši nastavnici će vam također pružati podršku u učenju na daljinu. Želimo vam sretno i ugodno učenje.

Dobivanje i svojstva etera
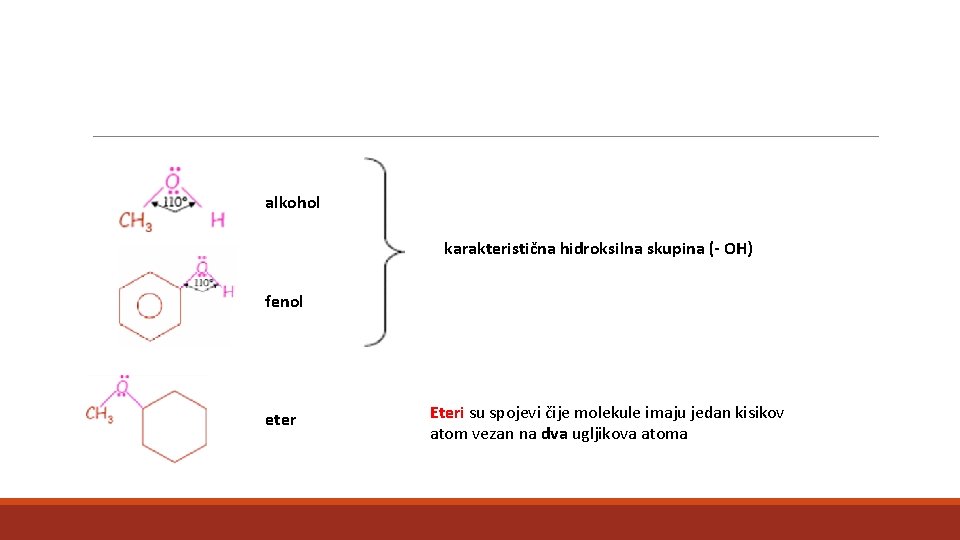
alkohol karakteristična hidroksilna skupina (- OH) fenol eter Eteri su spojevi čije molekule imaju jedan kisikov atom vezan na dva ugljikova atoma
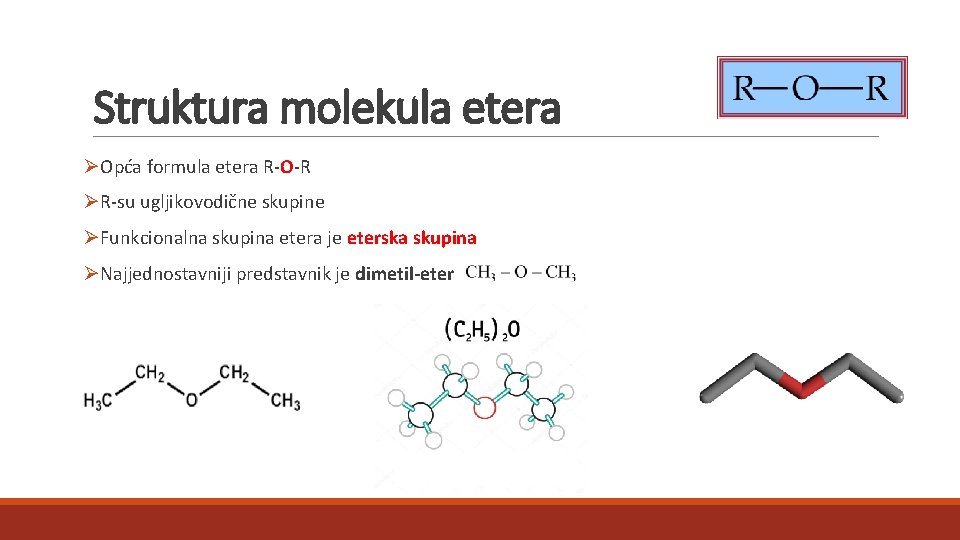
Struktura molekula etera ØOpća formula etera R-O-R ØR-su ugljikovodične skupine ØFunkcionalna skupina etera je eterska skupina ØNajjednostavniji predstavnik je dimetil-eter

Nomenklatura etera TRIVIJALNA IMENA ØAbecednim redoslijedom navedu se alkilne skupine i doda riječ „eter” SUSTAVNA IMENA Ø po IUPAC nomenklaturi nazivu manjeg radikala dodaje se riječ OKSI a zatim naziv većeg radikala koji nosi puni naziv alkana od koga je nastao npr. - razlikujemo SIMETRIČNE i ASIMETRIČNE etere dimetil eter met. OKSImetan
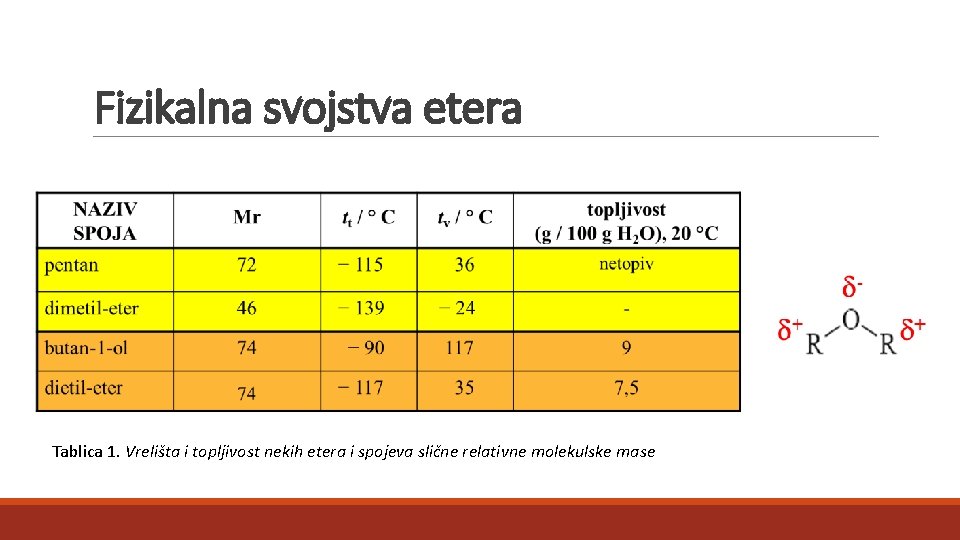
Fizikalna svojstva etera Tablica 1. Vrelišta i topljivost nekih etera i spojeva slične relativne molekulske mase
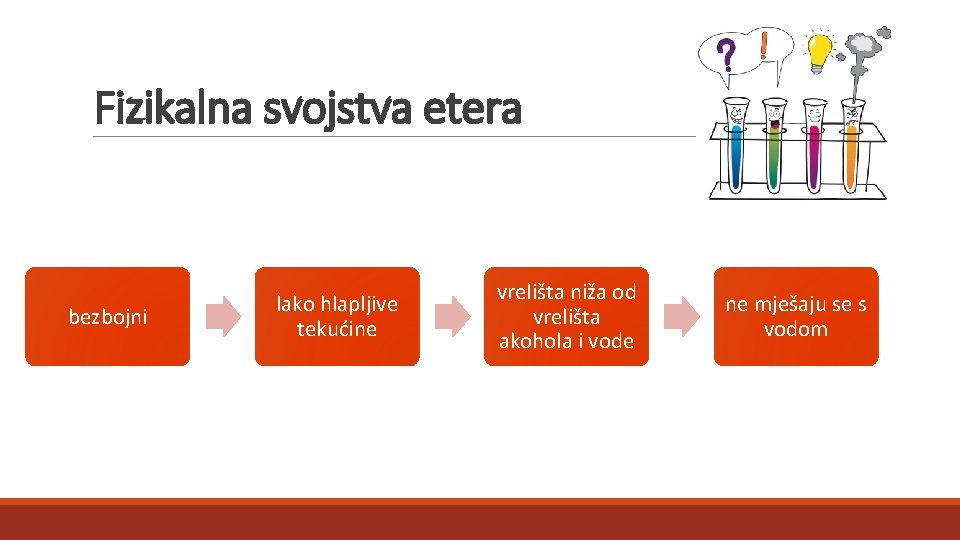
Fizikalna svojstva etera bezbojni lako hlapljive tekućine vrelišta niža od vrelišta akohola i vode ne mješaju se s vodom

Dobivanje SIMETRIČNI 1. Iz alkohola uz sumpornu kiselinu ( npr. zagrijavanjem etanola i konc. H 2 SO 4 do 140 0 C nastaje dietil-eter) 2 CH 3 CH 2 OH H 2 SO 4 CH 3 CH 2 O CH 2 CH 3 + H 20 ASIMETRIČNI 2. Reakcijom halogenalkana s alkoksidima (npr. reakcija 1 -jodpropana i natrijeva metoksida nastaje metil-propil-eter) CH 3 CH 2 I + CH 3 ONa+ CH 3 CH 2 O CH 3 + Na. I

Kemijska svojstva etera Økemijski dosta inertni Øne reagiraju s natrijem i kalijem ni s njihovim hidroksidima Øreagiraju s jakim halogenovodičnim kiselinama ( HBr i HI) Jednadžba reakcije etera s bromovodičnom kiselinom: CH 3 CH 2 O CH 2 CH 3 + HBr dietil-eter CH 3 CH 2 OH + CH 3 CH 2 Br etanol brometan

Uporaba i farmakološko djelovanje Pokus : Eter kao otapalo Pribor i kemikalije: epruveta s čepom , stalak za epruvete, jod (I 2) , dietileter ((C 2 H 5)2 O) Izvođenje pokusa: • 1. U epruvetu se ulije oko 5 ml vode u kojoj je uz snažno mućkanje otopljeno nekoliko kristalića joda. • 2. Toj se otopini doda jednak volumen etera (dietil-eter) i ponovno promućka
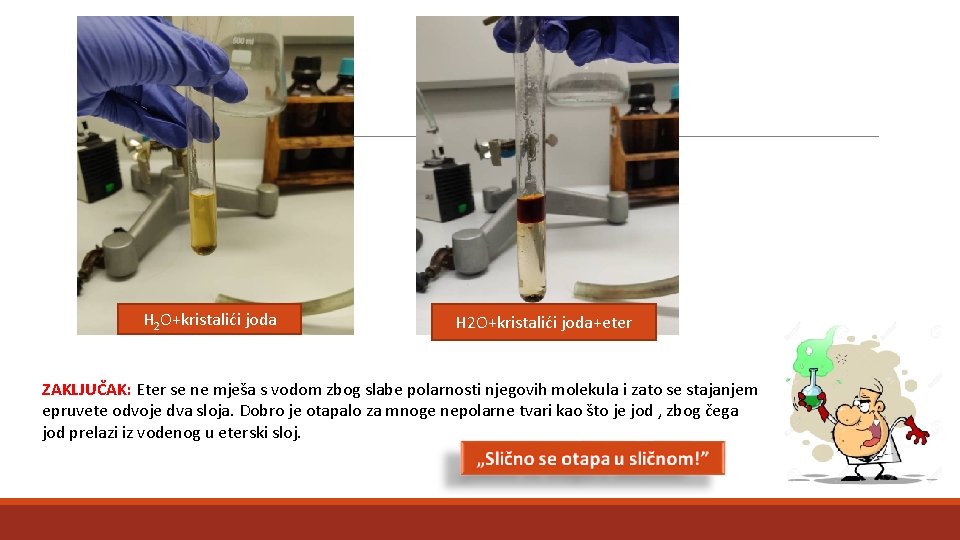
H 2 O+kristalići joda+eter ZAKLJUČAK: Eter se ne mješa s vodom zbog slabe polarnosti njegovih molekula i zato se stajanjem epruvete odvoje dva sloja. Dobro je otapalo za mnoge nepolarne tvari kao što je jod , zbog čega jod prelazi iz vodenog u eterski sloj.

Uporaba i farmakološko djelovanje Nekadašnja poznata primjena dietil-etera je u kirurgiji (medicini), gdje je služio kao sredstvo za inhalacijsku anesteziju (narkozu), ali danas je zbog neugodnih popratnih pojava vrlo ograničena (neke slabije razvijene zemlje ga i dalje koriste) i rabi se sve manje jer su ga potisnuli bolji i učinkovitiji opći anestetici (time i složeniji i skuplji). Popratne pojave dietil etera su bile mučnine i druge razne nuspojave, a osoba nakon anestezije eterom izgledala je pijano i drogirano. Razlog istiskivanja s tržišta i zamjenom drugim anesteticima, je i opasnost od požara i eksplozije. Pošto je dobro otapalo raznih organskih spojeva, upotrebljava se u farmaceutskoj i kemijskoj industriji (u laboratorijima kao otapalo za ekstrakciju) jer je hlapljiv i lako se uklanja iz reakcijske smjese. U smjesi sa suhim ledom postiže se temperatura od -80°C, pa se upotrebljava i za hlađenje.

PONAVLJANJE 1. Što su eteri! 2. Navedite opću formulu etera? 3. Kako dijelimo etere ? 4. Nabrojite bar 3 fizikalna svojstva etera? 5. Kako dobivamo simetrične a kako asimetrične etere? 6. Nabrojite koja su kemijska svojstva etera? 7. Koja je uporaba etera? !
- Slides: 14