I TUMORI DEL TESTICOLO CORSO INTEGRATO DI ONCOLOGIA





















































- Slides: 82

I TUMORI DEL TESTICOLO CORSO INTEGRATO DI ONCOLOGIA CLINICA Teodoro Sava Oncologia Medica O. C. M. Verona Teodoro. sava@ospedaleuniverona. it Verona 10/12/2014

COSA DOVETE RICORDARE PER ESPERIENZA PER ESAME n n n I PARTE STADIAZIONE PROGNOSI MARCATORI OPZIONI TERAPEUTICHE n n n MULTIDISCIPLINARIETA’ EXTRAGONADICI EFFETTI COLLATERALI TARDIVI RUOLO IMAGING Allegato lavoro

Approccio Multidisciplinare Medico di medicina generale Urologo Patologo Radiologo Biochimico Clinico Radioterapista Oncologo Psicologo Andrologo

Epidemiologia n n n L’incidenza di questa neoplasia varia da 1. 5 a 9 nuovi casi su 100000 abitanti per anno In Italia costituisce l’ 1 -2% di tutti i tumori primitivi In Italia sono descritti 500 -600 nuovi casi all’anno Rappresenta la più comune neoplasia maligna nei maschi fra i 15 ed i 35 anni E’ la prima causa di morte per tumore nella fascia d’età compresa fra i 15 e 35 anni

Eziologia n n n Dal 7% al 10% dei pazienti ha avuto una storia di criptorchidismo Traumi od atrofia del testicolo Differente incidenza fra diversi gruppi etnici e regioni geografiche (bassa incidenza nella razza nera) Incidenza maggiore nelle classi socio-economiche medio-alte Influenza genetica Somministrazione di estrogeni alla gravida

Classificazione n Neoplasie primitive Neoplasie a cellule germinali (90%) n n n Seminoma (classico, spermatocitico, anaplastico) 60 -65% Carcinoma embrionario 19% Teratoma (maturo, immaturo) 7% Coriocarcinoma 0. 4% Yolk Sac Tumor Neoplasie a cellule non germinali n n n Neoplasie a cellule gonadiche stromali specializzate (a cellule di Leydig) Gonadoblastoma Miscellanea

Classificazione Neoplasie secondarie n Neoplasie reticoloendoteliali n Metastasi Neoplasie paratesticolari n Adenomatoide n Cistoadenoma dell’epididimo n Neoplasie mesenchimali

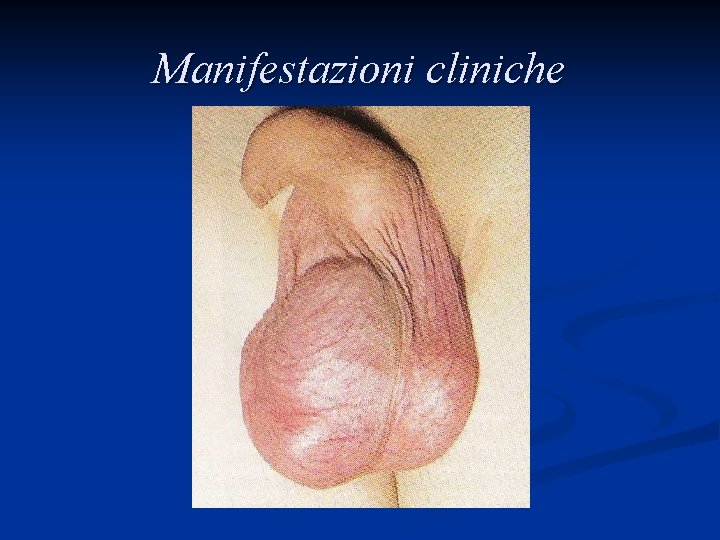
Manifestazioni cliniche Comparsa di nodulo duro ed indolente n 30 -40% dei pazienti presentano dolore sordo al basso addome, in regione anale o scrotale n 10% dei pazienti presenta una sintomatologia dolorosa acuta n 10% dei pazienti si presenta con segni e sintomi legati alla presenza di metastasi (tosse, dispnea, anoressia, nausea, vomito, dolore lombare…) n

Manifestazioni cliniche

Massa scrotale n Anamnesi Età n Epoca di comparsa n Velocità di crescita n Precedente anamnestico di criptorchidismo, torsione del funicolo spermatico, chirurgia inguino -scrotale, trauma n Sintomi urinari associati n Iperpiressia n

Massa scrotale n Esame obiettivo Dolorabilità n Delimitabilità rispetto al didimo ed epididimo n Consistenza della tumefazione n Transilluminabilità n Segni di flogosi scrotale n Dolorabilità della prostata all’esplorazione rettale n Linfoadenopatia inguinale, laterocervicale n

Diagnosi differenziale delle masse scrotali Orchiepididimite: tumefazione dolente spesso associata a febbre, sintomi urinari disurici, leucocituria n Idrocele: tumefazione transilluminabile dello scroto n Trauma: storia anamnestica di trauma n Ernia inguinale: tumefazione riducibile alla manovra di taxis n

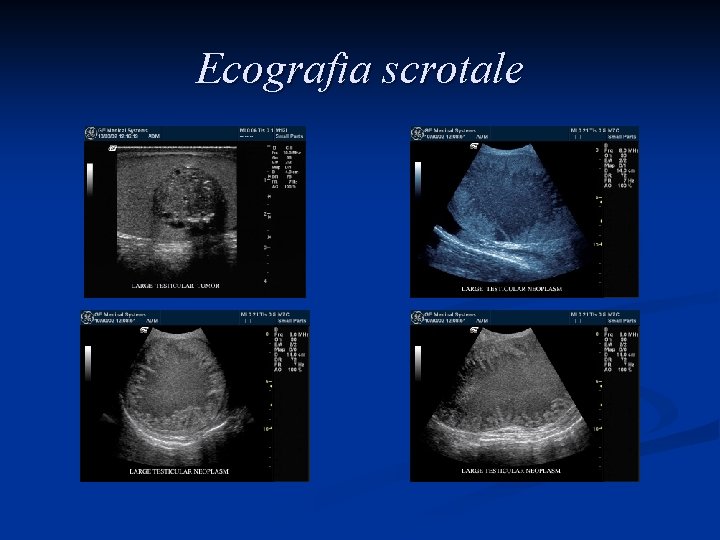
Ecografia scrotale

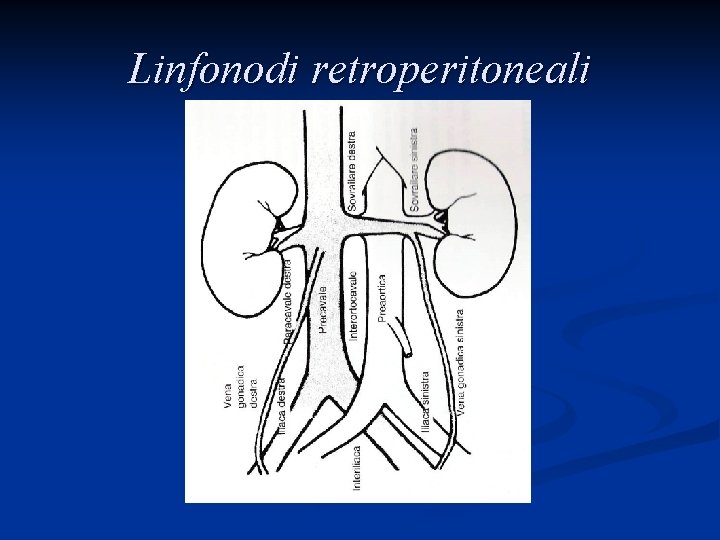
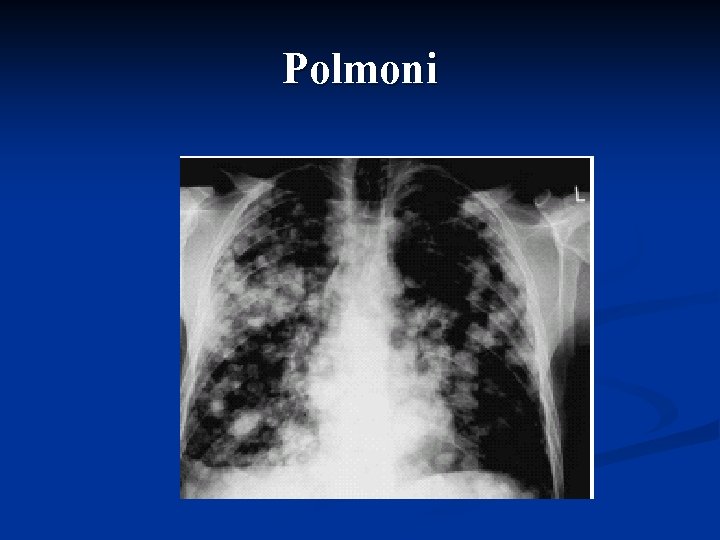
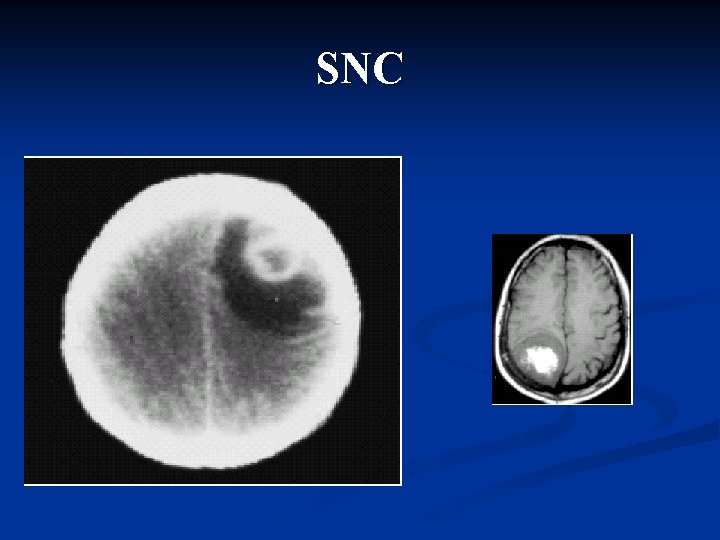
Storia naturale della neoplasia La maggior parte delle neoplasie del testicolo metastatizza inizialmente attraverso i vasi linfatici ai linfonodi regionali (retroperitoneali) e solo in un secondo tempo, attraverso il circolo sanguigno, agli organi viscerali (polmone, fegato, visceri addominali, cervello ed ossa)

Linfonodi retroperitoneali

MARCATORI TUMORALI n n n Sostanze che, dimostrabili nei fluidi biologici, costituiscono un segnale della presenza e dello sviluppo di una neoplasia. Alti valori di sensibilità e specificità nelle neoplasie germinali del testicolo. -fetoproteina (AFP), gonadotropina corionica umana (HCG) e latticodeidrogenasi (LDH). Utilità in ambito diagnostico, stadiativo, prognostico, monitoraggio delle terapie e follow-up. Utile dosaggio pre-orchifunoclectomia e dopo (curva).

-FETOPROTEINA Proteina plasmatica fondamentale nello sviluppo fetale ed embrionale (prealbumina) n Emivita: 5 giorni n Patologie “benigne”: epatiti, cirrosi n Neoplasie: carcinoma epatocellulare, germinali del testicolo, ovaio o extragonadiche n

GONADOTROPINA CORIONICA UMANA n n n Glicoproteina prodotta dal trofoblasto placentare (gravidanza) Costituita da due catene: e ; è comune a LH, FSH, TSH; (COO 2) è peculiare Emivita: 48 ore Fisiologicamente: gravidanza Neoplasie: n n Malattie trofoblastiche Neoplasie germinali (testicolo, ovaio, extragonadiche)

GONADOTROPINA CORIONICA UMANA Marcatore tessuto-specifico>diagnostico n Valore prognostico n Valore stadiativo n Criterio di risposta ai trattamenti n Monitoraggio follow-up n Emivita 24 -48 ore

TERAPIA ADIUVANTE NELLE NEOPLASIE DEL TESTICOLO MARCATORI Anche se imaging -, ma: NO n Markers in rialzo ADIUVANTE n Markers elevati o in calo MA PEB X 3 ma non in emivita. .

Marcatori tumorali n Alfa-feto proteina n n Subunità beta della gonadotropina corionica n n n Emivita compresa fra 5 e 7 giorni Può esser prodotta dal carcinoma embrionario, dal teratocarcinoma, dallo Yolk Sac Tumor a dalle forme miste Non è prodotta dal coriocarcinoma e dal seminoma puro Emivita compresa fra le 24 e 36 ore Può esser prodotta dal coriocarcinoma, dal carcinoma embrionario e dal seminoma puro Lattico deidrogenasi (si correla alla presenza di metastasi)

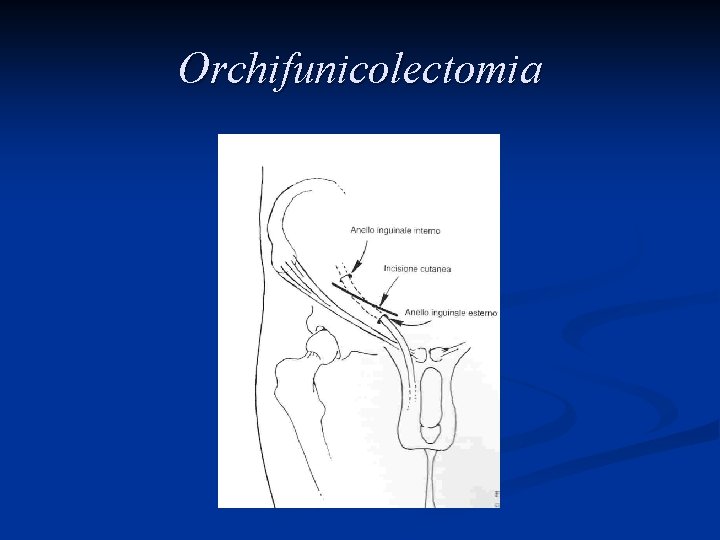
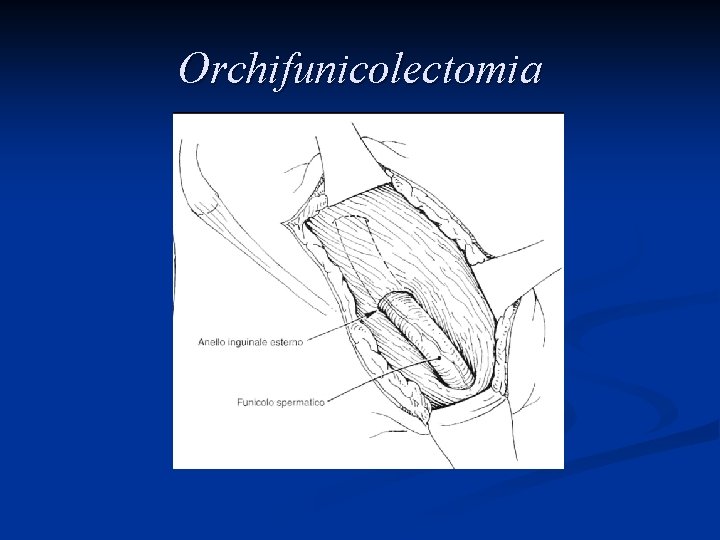
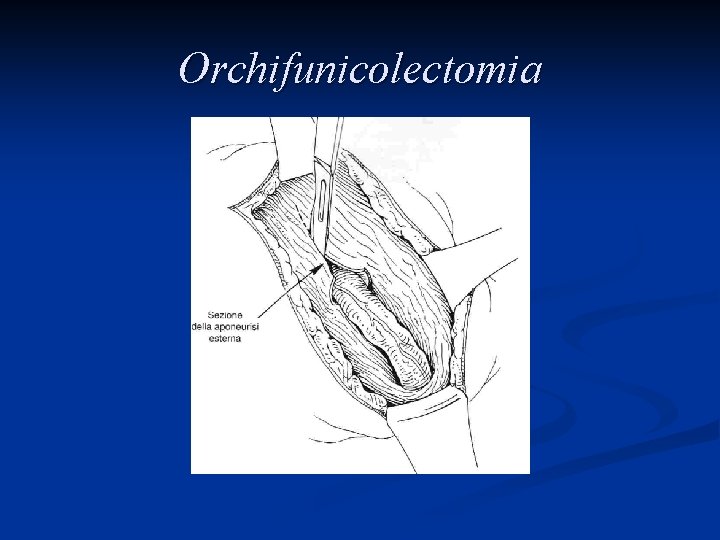
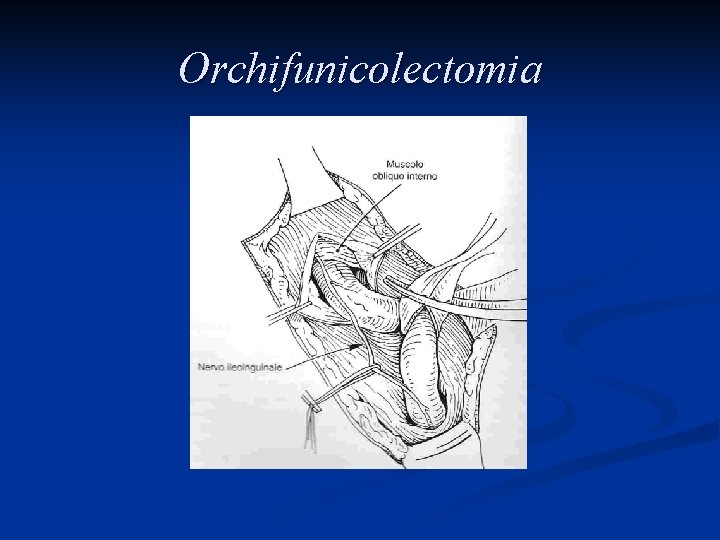
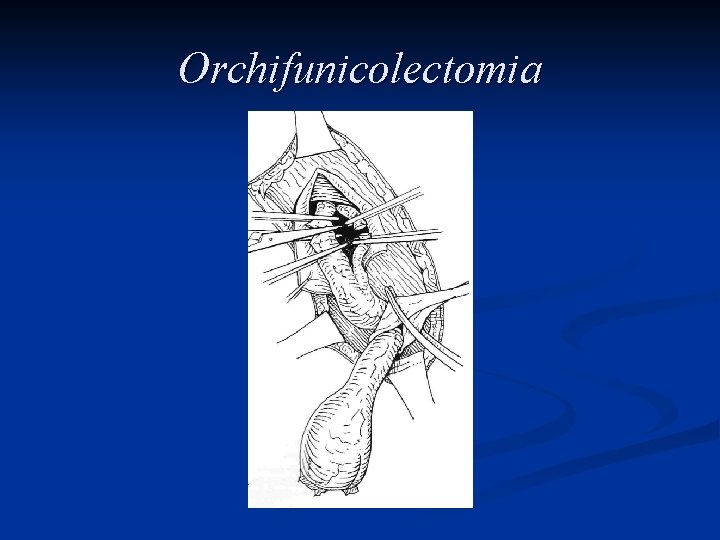
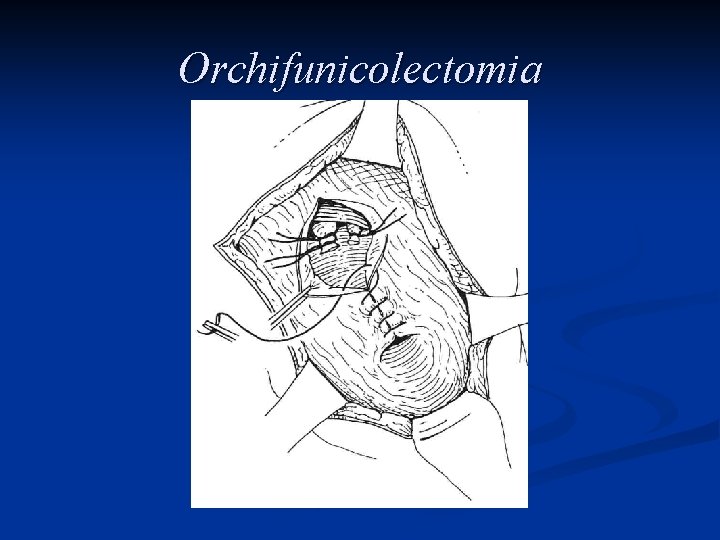
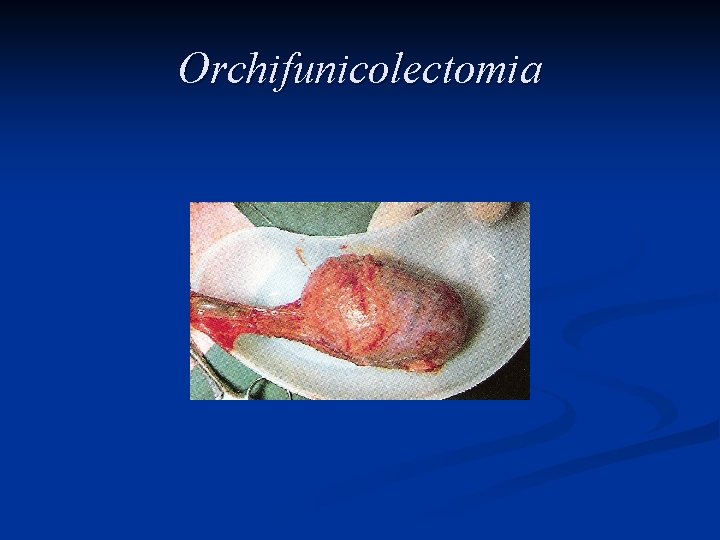
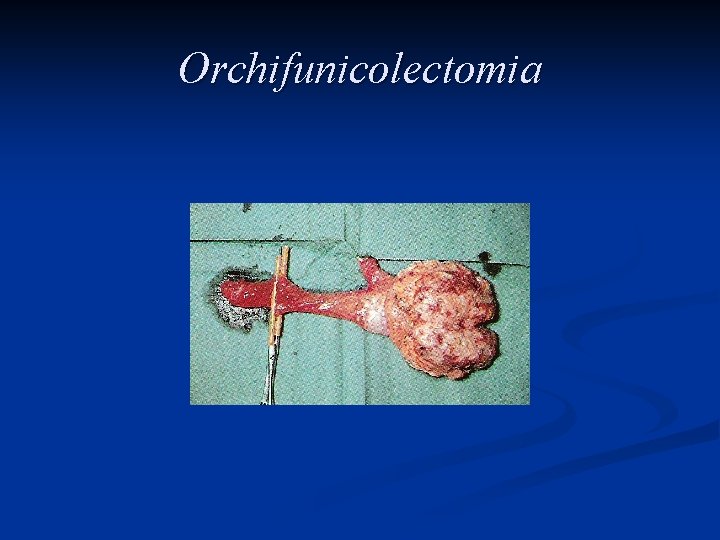
Trattamento L’asportazione del testicolo e del funicolo spermatico attraverso un accesso chirurgico inguinale, l’orchifunicolectomia, è la procedura definitiva sia per la diagnosi che per il trattamento locale della neoplasia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia

Orchifunicolectomia TGST Teratoma TGNST TCR

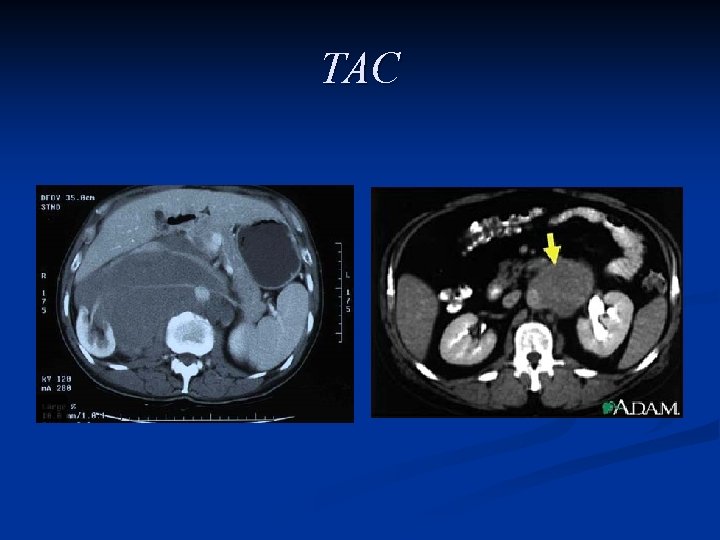
Stadiazione Dopo l’orchifunicolectomia le tecniche di stadiazione includono: l’esame fisico del paziente, la determinazione dei livelli sierici dei marcatori tumorali, la TAC dell’addome, della pelvi e del torace

TNM n T (tumore primitivo) n n n n Tx: tumore primitivo non valutabile T 0: assenza di neoplasia Tis: tumore intratubulare T 1: tumore limitato al testicolo compresa la rete testis T 2: tumore che invade oltre la tonaca albuginea o dentro l’epididimo, invasione vascolare e/o linfatica T 3: tumore che invade il funicolo spermatico T 4: tumore che invade lo scroto

TNM n N (linfonodi regionali) n n n Nx: linfonodi non valutabili N 0: assenza di metastasi linfonodali N 1: metastasi in un solo linfonodo inferiore ai 2 cm N 2: metastasi in un solo linfonodo fra i 2 e 5 cm o più metastasi nessuna maggiore di 5 cm N 3: metastasi in un linfonodo maggiore di 5 cm M (metastasi a distanza) n n n Mx: metastasi non valutabili M 0: assenza di metastasi M 1: presenza di metastasi - 1 a linfonodale/i non regionali - 1 b in altre sedi

Royal Marsden Hospital Classification n I (nessuna evidenza di metastasi) n n IM: marcatori tumorali aumentati II (metastasi linfonodali retroperitoneali) IIA: meno di 2 cm n IIB: fra 2 e 5 cm n IIC: più di 5 cm n III (metastasi linfonodali sovradiaframmatiche) n IV (metastasi extralinfatiche) n

TAC

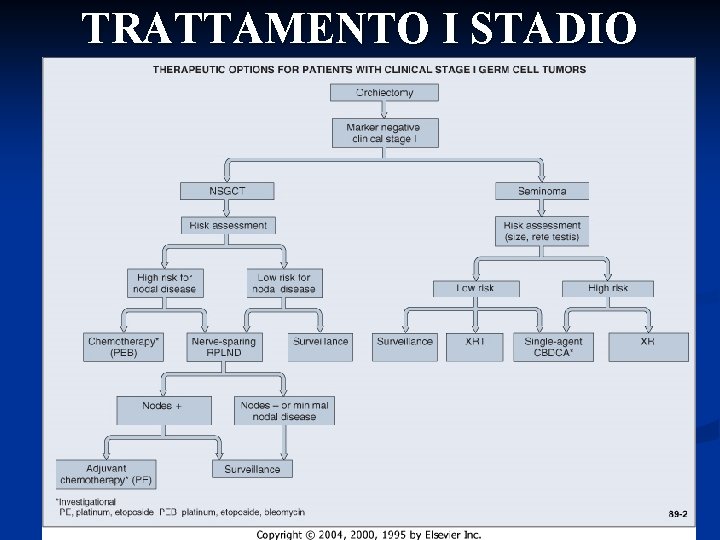
Il trattamento appropriato, dopo l’orchifunicolectomia, delle neoplasie a cellule germinale del testicolo in I stadio clinico è ancora oggetto di discussione

TRATTAMENTO I STADIO

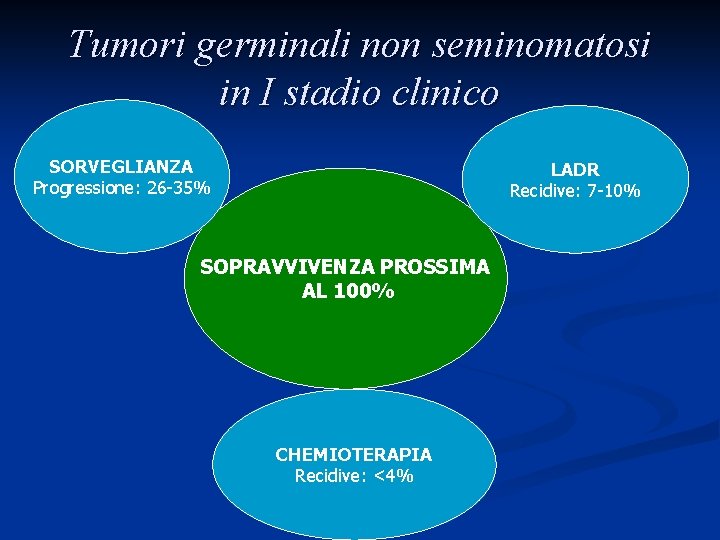
Tumori germinali non seminomatosi in I stadio clinico SORVEGLIANZA Progressione: 26 -35% LADR Recidive: 7 -10% SOPRAVVIVENZA PROSSIMA AL 100% CHEMIOTERAPIA Recidive: <4%

Tumori germinali non seminomatosi in I stadio clinico Fattori prognostici indicativi di una possibile recidiva o progressione di malattia n n n n n Invasione vascolare e/o linfatica Presenza di carcinoma embrionario Assenza di elementi di Yolk Sac Tumor Stadio patologico locale Età, dimensione della neoplasia, valori preoperatori dei marcatori tumorali KI-67 Indici di proliferazione cellulare (MIB-1) Analisi citometrica del DNA Espressione di p-53, bcl-2, serin-proteasi Catepsina D, Ecaderina

Tumori germinali non seminomatosi in I stadio clinico Fattori prognostici indicativi di una possibile recidiva o progressione di malattia: l’invasione vascolare e/o linfatica Autore Recidive % Peckham 80 Wishnow 45. 5 Jacobsen 36 Gels 52 Pizzocaro 50

Tumori germinali non seminomatosi in I stadio clinico Fattori prognostici indicativi di una possibile recidiva o progressione di malattia: la presenza di carcinoma embrionario Autore Recidive % Peckham 43 Wishnow 55 Sogani 46 Gels 30 Pizzocaro 42. 5

Tumori germinali non seminomatosi in I stadio clinico Sorveglianza (Wait and see) n Circa il 70% dei pazienti è curato dalla sola orchifunicolectomia n Progressione di malattia in circa il 26 -35% dei pazienti n Attenta selezione del paziente n Stress legato ai continui controlli a cui il paziente deve sottoporsi

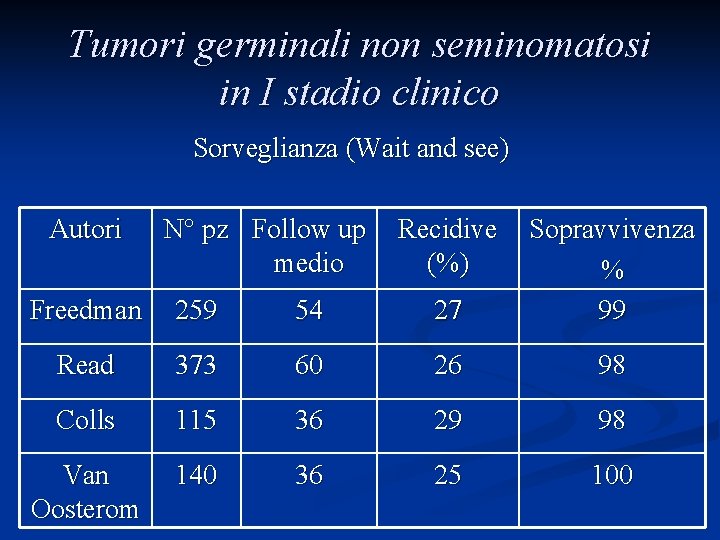
Tumori germinali non seminomatosi in I stadio clinico Sorveglianza (Wait and see) Autori N° pz Follow up medio Recidive (%) Freedman 259 54 27 Sopravvivenza % 99 Read 373 60 26 98 Colls 115 36 29 98 Van Oosterom 140 36 25 100

Tumori germinali non seminomatosi in I stadio clinico Linfoadenectomia retroperitoneale (LADR) n Accurata stadiazione linfonodale della malattia n Asportazione di micrometastasi nel 15 -40% dei pazienti n Overtreatment in circa il 60 -70% dei pazienti n Complicanze chirurgiche a breve e lungo termine

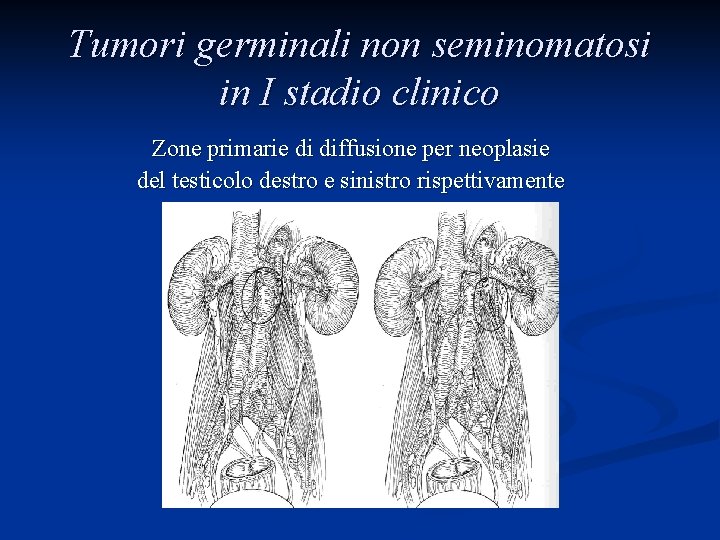
Tumori germinali non seminomatosi in I stadio clinico Zone primarie di diffusione per neoplasie del testicolo destro e sinistro rispettivamente

Tumori germinali non seminomatosi in I stadio clinico Linfoadenectomia retroperitoneale (LADR) monolaterale Schema chirurgico

Tumori germinali non seminomatosi in I stadio clinico Linfoadenectomia retroperitoneale (LADR) monolaterale Note di tecnica chirurgica

Tumori germinali non seminomatosi in I stadio clinico Linfoadenectomia retroperitoneale (LADR) Autore N° pz Donohue 378 Mc Leod 459 Stadio Recidive Sopravvivenza patologico % % 70% p. I 12 99 30% p. II 57% p. I 10 98 43% p. II

Tumori germinali non seminomatosi in I stadio clinico Chemioterapia (Short course) n Pazienti ad alto rischio di progressione o recidiva n Bassa incidenza di recidive (meno del 4%) n Morbidità a breve, medio e lungo termine

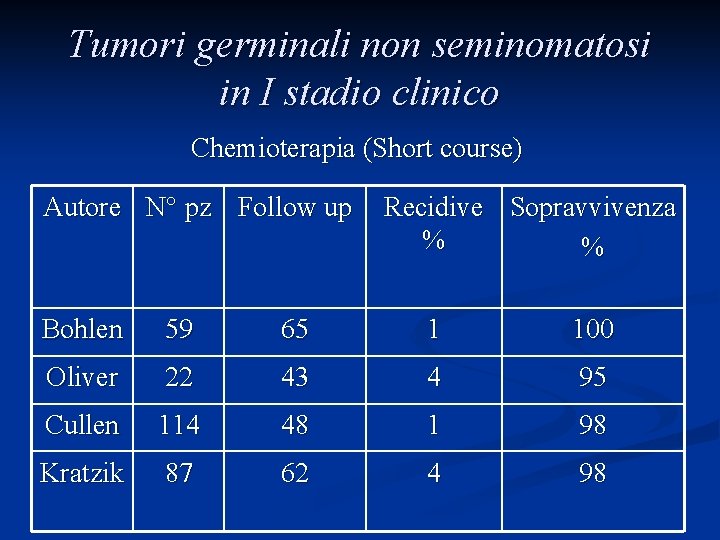
Tumori germinali non seminomatosi in I stadio clinico Chemioterapia (Short course) Autore N° pz Follow up Recidive Sopravvivenza % % Bohlen 59 65 1 100 Oliver 22 43 4 95 Cullen 114 48 1 98 Kratzik 87 62 4 98

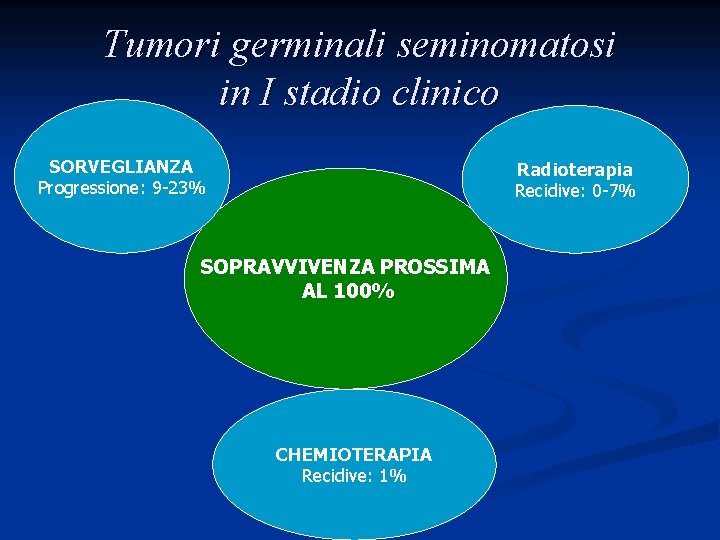
Tumori germinali seminomatosi in I stadio clinico SORVEGLIANZA Progressione: 9 -23% Radioterapia Recidive: 0 -7% SOPRAVVIVENZA PROSSIMA AL 100% CHEMIOTERAPIA Recidive: 1%

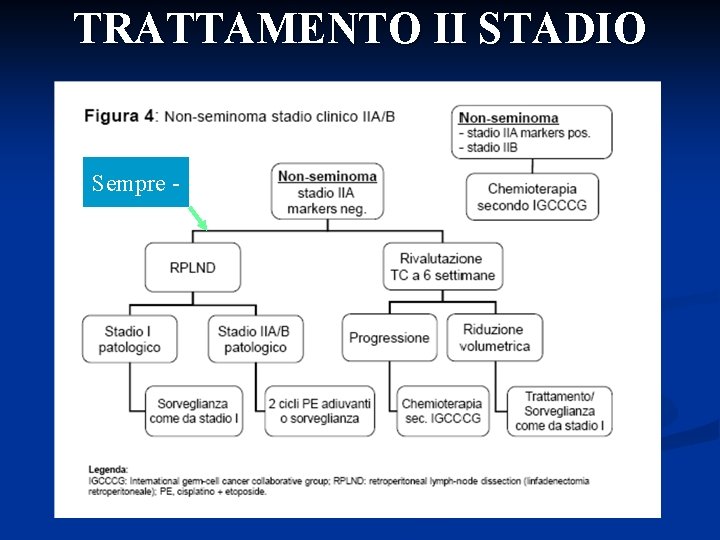
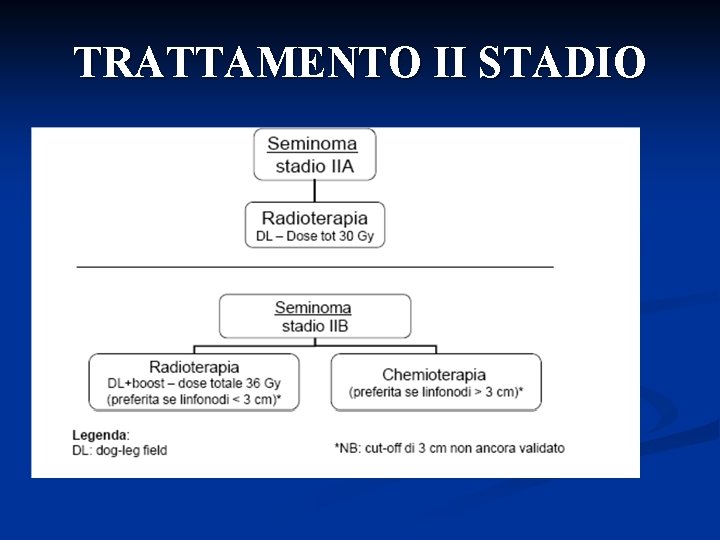
Tumori germinali non seminomatosi in stadio clinico IIA-IIB Il trattamento dei pazienti in stadio clinico II con malattia linfonodale inferiore ai 5 cm è tutt’ora controverso. Approssimativamente un terzo di questi pazienti saranno sottoposti ad un trattamento combinato chemioterapico e chirurgico.

TRATTAMENTO II STADIO Sempre -

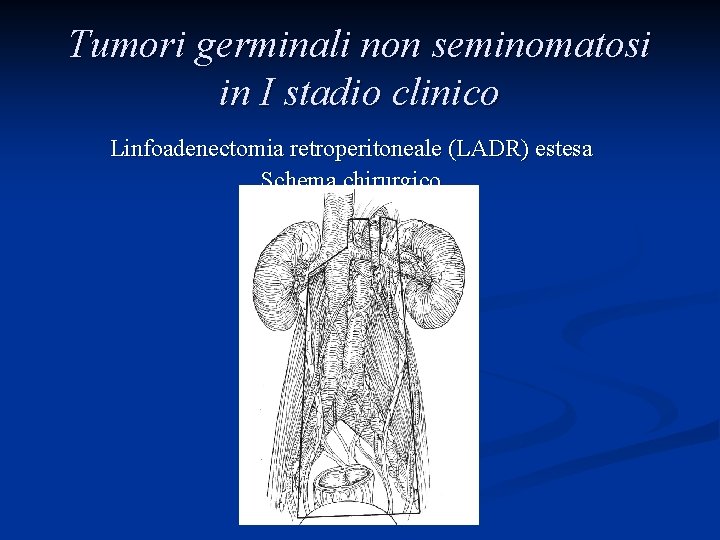
Tumori germinali non seminomatosi in I stadio clinico Linfoadenectomia retroperitoneale (LADR) estesa Schema chirurgico

TRATTAMENTO II STADIO

Trattamento Il trattamento della malattia avanzata (>IIb): n Orchifunicolectomia n Chemioterapia n Eventuale trattamento del residuo postchemioterapia: # chirurgia se non seminoma # radioterapia se seminoma e residuo captante alla PET

Linfoadenopatia retroperitoneale

Retroperitoneo

Polmoni

SNC

GRUPPO A BUONA PROGNOSI Non-seminoma Tutte le caratteristiche: – primitivo testicolare/retroperitoneo – metastasi viscerali solo polmonari 56% dei casi – AFP < 1000 ng/ml – - h. CG < 5000 ml. U/L (1000 ng/ml) 5 ys OS 92% – LDH < 1. 5 x v. n. Seminoma Tutte le caratteristiche: – primitivo in qualunque sede – metastasi viscerali solo polmonari 90% dei casi – AFP normale – qualsiasi - h. CG – qualsiasi LDH 5 ys OS 86%

GRUPPO A PROGNOSI INTERMEDIA Non-seminoma Tutte le caratteristiche: – primitivo testicolare/retroperitoneo – metastasi viscerali solo polmonari 28% dei casi – AFP > 1000 e < 10000 ng/ml – - h. CG > 5000 e < 50000 ml. U/L 5 ys OS 80% oppure – LDH > 1. 5 e < 10 x v. n. Seminoma Almeno una delle seguenti caratteristiche: – primitivo in qualunque sede – metastasi viscerali solo polmonari 10% dei casi – AFP normale – qualsiasi - h. CG – qualsiasi LDH 5 ys OS 72%

GRUPPO A CATTIVA PROGNOSI Non-seminoma Almeno una delle seguenti caratteristiche: – primitivo mediastinico – metastasi viscerali non polmonari 16% dei casi – AFP > 10000 ng/ml – - h. CG > 50000 ml. U/L (>10000 ng/ml) – LDH > 10 x v. n. Seminoma Nessun paziente in questo gruppo 5 ys OS 48%

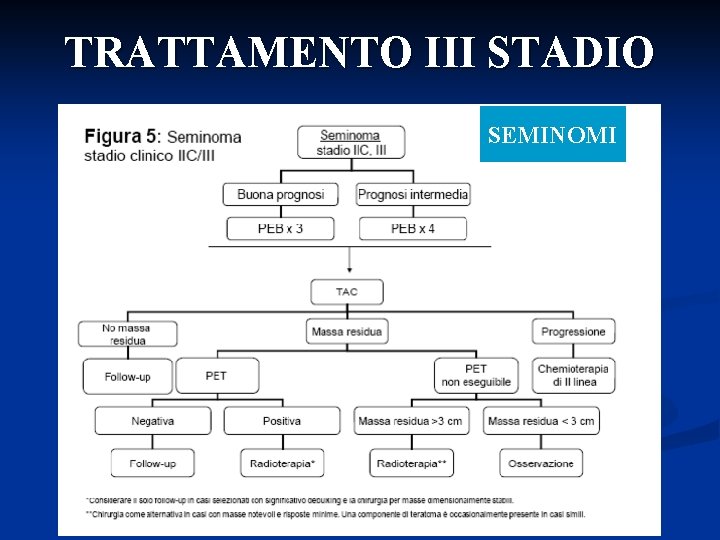
TRATTAMENTO III STADIO NON-SEMINOMI n Chemioterapia: Cisplatino+Etoposide+Bleomicina (PEB) 3 cicli se buona prognosi n 4 cicli se prognosi intermedia o cattiva n Chirurgia dell’eventuale residuo di malattia

TRATTAMENTO III STADIO SEMINOMI

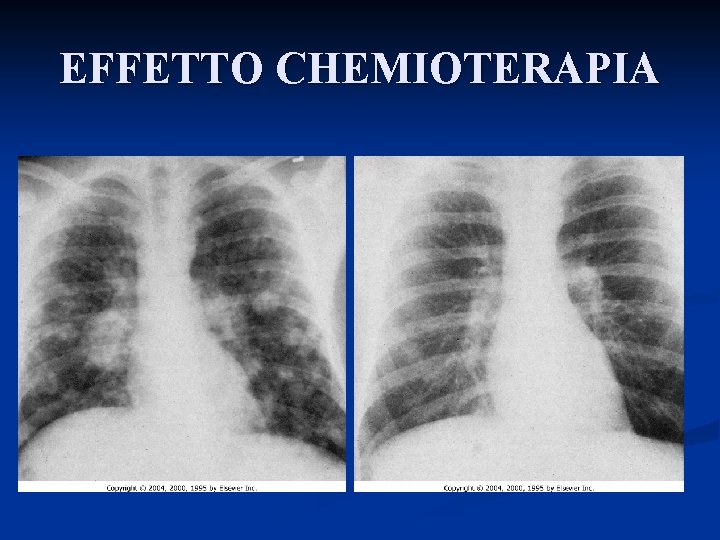
EFFETTO CHEMIOTERAPIA

Effetto chemioterapia

DOPO CHEMIOTERAPIA n n Monitoraggio marcatore e imaging Gestione malattia residua (M -): n Seminoma: n n n Residuo minimo osservazione Residuo > 3 cm: PET se + RT (unica indicazione della PET nei germinali!) Non seminoma: chirurgia del residuo n n n Teratoma Necrosi Neoplasia vitale

Il ruolo della chirurgia nel tumore del testicolo metastatico

Asportazione chirurgica post-chemioterapia di neoplasia residua Necrosi n Teratoma n Tumore a cellule germinali n Tumore a cellule non germinali n

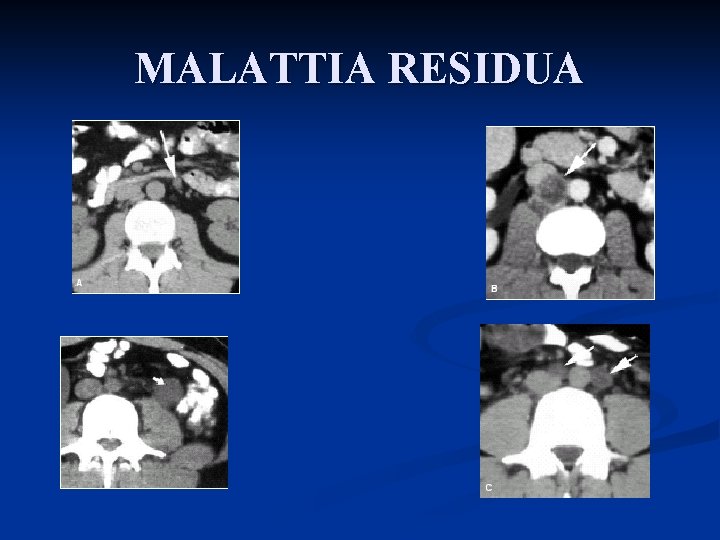
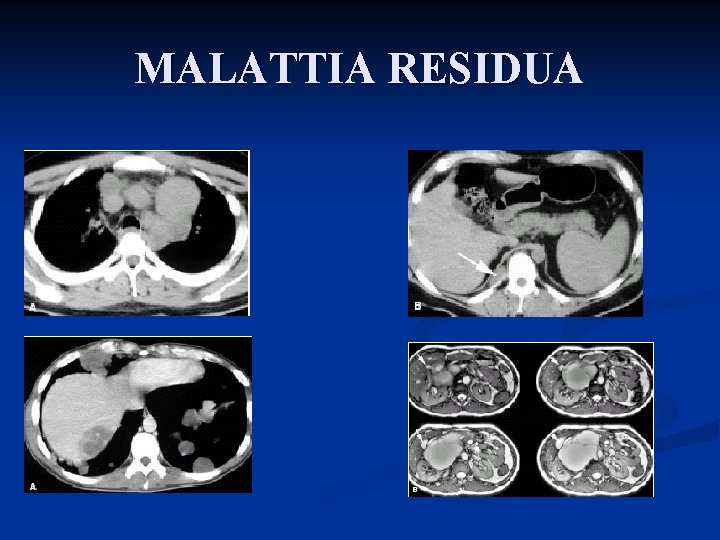
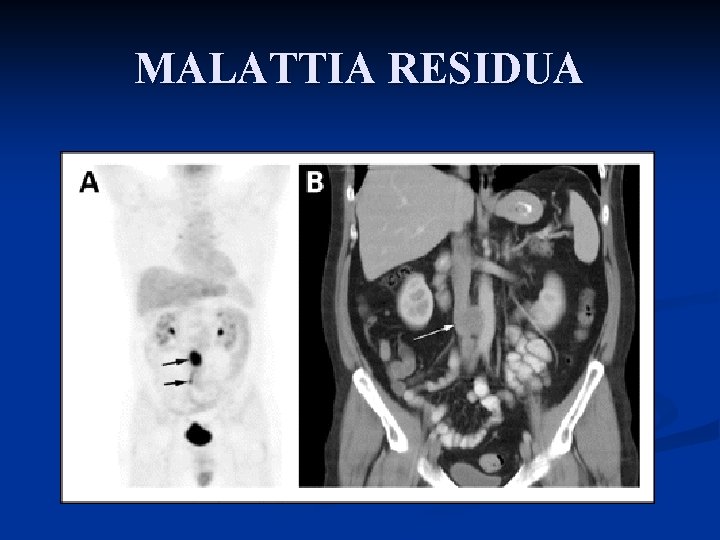
MALATTIA RESIDUA

MALATTIA RESIDUA

MALATTIA RESIDUA

Tumori germinali metastatici del testicolo: ruolo della chirurgia

Valore della RPLND dopo chemioterapia n Necrosi: procedura stadiante, nessun beneficio terapeutico per il paziente n Teratoma: procedura terapeutica, il teratoma non è chemiosensibile Il teratoma se non asportato può continuare a crescere comprimendo organi vicini, può degenerare in tumori non germinali, può crescere in maniera silenziosa

Valore della RPLND dopo chemioterapia n Tumore a cellule germinali: procedura terapeutica e stadiante n Tumore a cellule non germinali (sarcoma, adenocarcinoma o tumore neuroectodermico primitivo): procedura terapeutica

NEOPLASIE GERMINALI EXTRAGONADICHE n Possono insorgere a livello della linea mediana: Retroperitoneo n Mediastino n Pineale n n Trattamento mutuato dai germinali del testicolo



TUMORI GERMINALI Pensarci sempre nel giovane n Curabili, tranne quelli cattivi n Fondamentale approccio multidisciplinare n Expertise n Pensare a opzioni di cura ma pure tossicità n Fondamentale follow-up in senso stretto oncologico ma pure in funzione cardiovascolare… n
 Cream skimming sanità
Cream skimming sanità Sport integrato definizione
Sport integrato definizione Testicolo anatomia microscopica
Testicolo anatomia microscopica Osteocondromul
Osteocondromul Istituto toscano tumori
Istituto toscano tumori Traverso longmire
Traverso longmire Kraniofaringeom
Kraniofaringeom Ritardo diagnostico in oncologia risarcimento
Ritardo diagnostico in oncologia risarcimento Master oncologia infermieri
Master oncologia infermieri Oncologia sondrio
Oncologia sondrio Oncologia alghero
Oncologia alghero Dispense del corso di sistemi energetici
Dispense del corso di sistemi energetici Corso tutela del consumatore
Corso tutela del consumatore Corso vhdl
Corso vhdl Slide corso gru mobili
Slide corso gru mobili Slide corso rspp
Slide corso rspp Corso opem c.r.i. 2021 slide
Corso opem c.r.i. 2021 slide Haccp.ppt
Haccp.ppt Corso monosettimanale significato
Corso monosettimanale significato Open foam corso
Open foam corso Carlo crivelli self portrait
Carlo crivelli self portrait Slide corso macchine movimento terra
Slide corso macchine movimento terra Corso toscana 108
Corso toscana 108 Slide corso formazione segnaletica stradale
Slide corso formazione segnaletica stradale Presidente corso di laurea
Presidente corso di laurea Formazione dirigenti sicurezza ppt
Formazione dirigenti sicurezza ppt Corso tatuaggi asl lecce 2021
Corso tatuaggi asl lecce 2021 Corso somministratori cils
Corso somministratori cils $pus
$pus Slide corso antincendio rischio basso
Slide corso antincendio rischio basso Corso gascromatografia napoli
Corso gascromatografia napoli Corso ponteggi ppt
Corso ponteggi ppt Slide corso ple
Slide corso ple Corso primo soccorso slide
Corso primo soccorso slide Slide corso macchine movimento terra
Slide corso macchine movimento terra Corso negoziazione efficace
Corso negoziazione efficace Gestione per conto dello stato
Gestione per conto dello stato Slide corso rspp datore di lavoro rischio basso
Slide corso rspp datore di lavoro rischio basso Per una buona scrittura giuridica
Per una buona scrittura giuridica Corso dirigente accompagnatore calcio
Corso dirigente accompagnatore calcio Slide antincendio
Slide antincendio Corso responsabile logistica
Corso responsabile logistica Corso dirigente accompagnatore basket
Corso dirigente accompagnatore basket Questionario carroponte
Questionario carroponte Slide corso trattori agricoli
Slide corso trattori agricoli Corso di laurea in scienze della formazione primaria
Corso di laurea in scienze della formazione primaria Liceo sportivo correggio
Liceo sportivo correggio Relazione finale corso di formazione
Relazione finale corso di formazione Michael corso
Michael corso Formazione dpi 3 categoria vie respiratorie ppt
Formazione dpi 3 categoria vie respiratorie ppt Corso generale sicurezza sul lavoro
Corso generale sicurezza sul lavoro Corso allenatore di base basket
Corso allenatore di base basket Corso gascromatografia napoli
Corso gascromatografia napoli Slide corso sicurezza croce rossa
Slide corso sicurezza croce rossa Corso trattori agricoli ppt
Corso trattori agricoli ppt Corso oss poliambulanza
Corso oss poliambulanza Sicsi
Sicsi Corso linguistica computazionale
Corso linguistica computazionale Ensor expresionismo
Ensor expresionismo Face to face ecdl
Face to face ecdl Tandem uptodown
Tandem uptodown Corso icq
Corso icq Corso valutazione investimenti
Corso valutazione investimenti Corso di sociologia bagnasco barbagli cavalli
Corso di sociologia bagnasco barbagli cavalli Yo soy del sur ecos del rocio
Yo soy del sur ecos del rocio Laringo
Laringo Triangulo de calor
Triangulo de calor El calor es uno de los elementos del triángulo del fuego
El calor es uno de los elementos del triángulo del fuego Eugene ionesco
Eugene ionesco Preguntas sobre el sentido del tacto para niños
Preguntas sobre el sentido del tacto para niños Colores de la bandera sena
Colores de la bandera sena Problema de investigacion
Problema de investigacion Rosario al sagrado corazón de jesús
Rosario al sagrado corazón de jesús Sanidad interior espíritu, alma y cuerpo
Sanidad interior espíritu, alma y cuerpo Programa mais
Programa mais El matrimonio es un pacto con dios
El matrimonio es un pacto con dios Canción andalucía es mi tierra yo soy del sur
Canción andalucía es mi tierra yo soy del sur Normas del buen hablante y del buen oyente para niños
Normas del buen hablante y del buen oyente para niños Como prevenir el ciberbullying y el sexting
Como prevenir el ciberbullying y el sexting Organizador grafico del plato del buen comer
Organizador grafico del plato del buen comer Características del poema mio cid
Características del poema mio cid Tipos de planteamiento por su propósito
Tipos de planteamiento por su propósito Quien es la peregrina en la dama del alba
Quien es la peregrina en la dama del alba