HST 5 Les 1 herhaling hst 4 Ken

















































- Slides: 77

HST 5 Les 1: herhaling hst 4

Ken je elementen • Binas tabel 31 • Afkortingen uit je hoofd • Ag, Al, Ar, Au, Ba, Br, C, Ca, Cd, Cl, Cr, Cu, F, Fe, H, He, Hg, I, K, Mg, N, Na, Ne, Ni, O, P, Pb, Pt, S, Si, Sn, Zn (exameneis)

kommaformules • Verbinding: stof met moleculen die uit meerdere atoomsoorten bestaat. • Voorbeelden: – Koolwaterstoffen: C, H – Ijzeroxide: Fe, O • Een oxide is een verbinding van één element met zuurstof – Alcohol: C, H, O

Chemische reactie • Dit is een proces waarbij stoffen verdwijnen en nieuwe stoffen ontstaan. – Nieuwe stoffen betekent andere eigenschappen • In een reactievergelijking: Beginstof(fen) reactieproduct(en)

Reactieschema Hoe stel je een reactieschema in symbolen op voor de verbranding van koolstof?

Reactieschema 1 verbranding van koolstof • Wat zijn de beginstoffen? • Beginstoffen: koolstof en zuurstof • Wat zijn de reactieproducten? • Reactieproduct: koolstofdioxide

Reactieschema 2 verbranding van koolstof Schrijf het reactieschema in woorden op. koolstof + zuurstof koolstofdioxide

Reactieschema 3 verbranding van koolstof Zoek van elke stof het symbool of de kommaformule. koolstof = C zuurstof = O koolstofdioxide = C, O

Reactieschema 4 verbranding van koolstof Schrijf het reactieschema in symbolen op. C + O C, O Met toestandsaanduidingen. C(s) + O(g) C, O(g)

Reactieschema 5 verbranding van koolstof Controleer of elk symbool vóór de pijl ook na de pijl voorkomt. C + O C, O Voor de pijl staan de symbolen: C en O Achter de pijl staan ook: C en O

Overzicht Reactieschema in symbolen voor de verbranding van koolstof 1 Beginstoffen: Reactieproducten: 2 3 4 5 koolstof en zuurstof koolstofdioxide Reactieschema: koolstof + zuurstof koolstofdioxide koolstof = C zuurstof = O koolstofdioxide = C, O C(s) + O(g) C, O(g) Voor de pijl: C en O Achter de pijl: C en O

5. 1: moleculen en atomen • Wat is een molecuul? • Een molecuul is eenheid van een zuivere chemische stof. Het bestaat uit atomen • Wat is een atoom? • Een atoom is van alle (scheikundige) elementen de kleinste, nog als zodanig herkenbare, bouwsteen. Vrijwel alle scheikundige en natuurkundige eigenschappen van de op aarde voorkomende materie zijn gekoppeld aan de eigenschappen van atomen.

Wat moet ik me daarbij voorstellen? molecuul atoom

Iets eenvoudiger… Watermoleculen bestaan uit waterstofatomen (witte bolletjes) en zuurstof atomen (rode bolletjes).

Of… Moleculen van de stof koolstofdioxide bestaan uit koolstofatomen (zwarte bolletjes) en zuurstof atomen (rode bolletjes).

Wat gebeurt er bij een reactie? • Bron 3 blz 131 • Opnieuw rangschikken van atomen. – Atomen raken los van elkaar – Atomen maken nieuwe ‘groepjes’ – Dit zijn nieuwe moleculen en dus nieuwe stoffen.

Ontleedbaar of niet-ontleedbaar • Een stof met moleculen van één atoomsoort is niet ontleedbaar (± 100) • IJzer (Fe) • Waterstof (H) • Zuurstof (O) • Een stof met moleculen van meerdere atoomsoorten is wel ontleedbaar (± 20 miljoen) • • Water Alcohol Suiker Benzine

Zijn ze ooit gezien? Oordeel zelf:

Periodiek systeem • Tabel 31 Binas

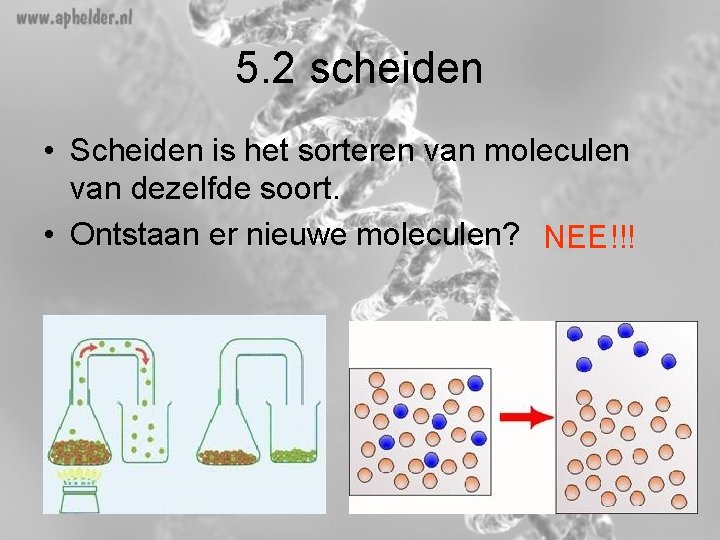
5. 2 scheiden • Scheiden is het sorteren van moleculen van dezelfde soort. • Ontstaan er nieuwe moleculen? NEE!!!

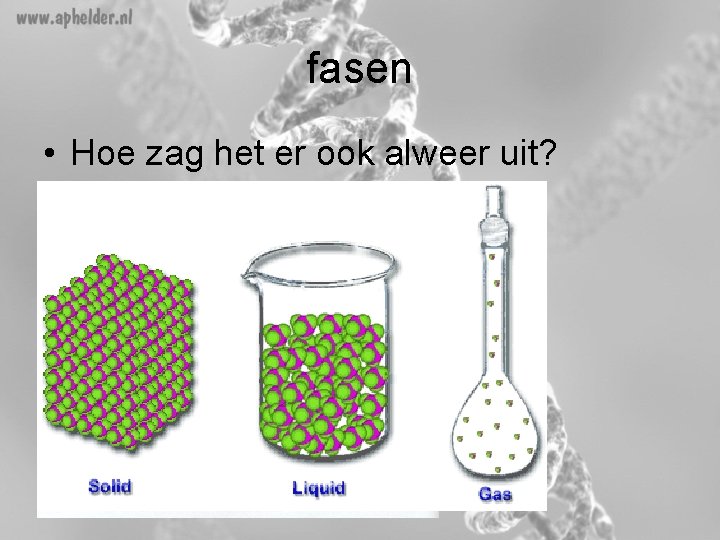
fasen • Hoe zag het er ook alweer uit?

Moleculen bij een fasenovergang • Veranderen de moleculen? NEE!!! • Wat gebeurt er met de moleculen? – Ze raken verder van elkaar af of komen dichter bij elkaar. – De onderlinge aantrekkingskracht wordt groter of kleiner


filmpje

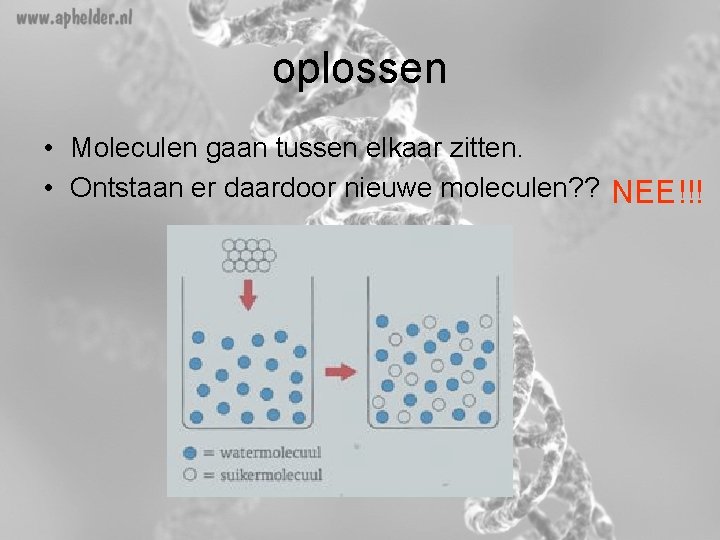
oplossen • Moleculen gaan tussen elkaar zitten. • Ontstaan er daardoor nieuwe moleculen? ? NEE!!!

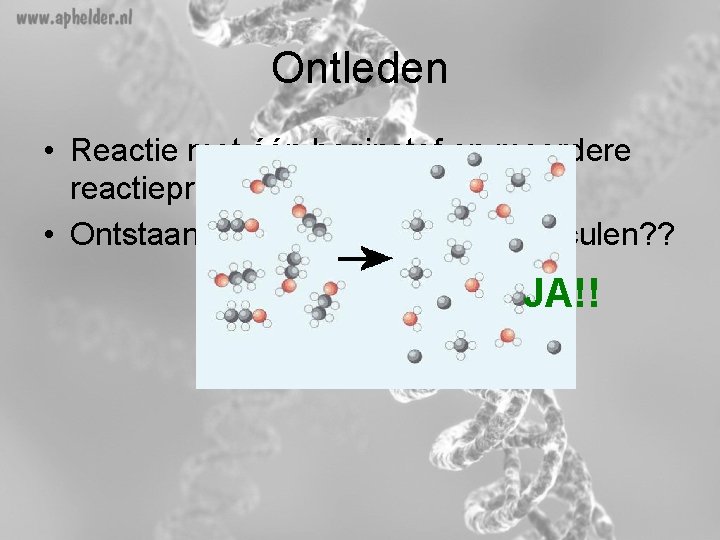
Ontleden • Reactie met één beginstof en meerdere reactieproducten • Ontstaan er daardoor nieuwe moleculen? ? JA!!

Scheiden en ontleden • Verschil – Bij scheiden ontstaan geen nieuwe stoffen. Je sorteert de verschillende moleculen. Ze waren al aanwezig. – Bij ontleden ontstaan wel nieuwe stoffen. Dit is een chemische reactie.

demo • Ontleding van suiker – Welke stoffen ontstaan er? – Waarom is dit een ontleding?

5. 3 molecuulformules • • Kommaformule wordt molecuulformule Molecuulformule geeft meer informatie Lezen en schrijven van scheikunde Gebruik van modellen – Kleur – Grootte atomen – Beperkt – Verschillende modellen laten zien

Moleculen als model

Wat is een molecuulformule? • Dit is een schrijfwijze voor het noteren van moleculen. Ze laten zien welke atoomsoorten in de moleculen voorkomen en hoeveel atomen van elke soort in het molecuul voorkomen. • Getallen in de formule – Voor de molecuulformule: aantal moleculen. (coëfficient) – In de molecuulformule: aantal atomen van één soort. (index)

Molecuulformule (wat moet ik me erbij voorstellen? ) 3 H 2 O

Voorbeelden 1. Vier Water moleculen 1. 2. 3. 4. coëfficient Verbinding waterstof en zuurstof-atomen H, O (l) (kommaformule) H 2 O (l) (molecuulformule) Twee atomen waterstof en één atoom zuurstof 4 H 2 O Geen index Index

Voorbeelden 2. drie Koolstofdioxide-moleculen 1. 2. 3. 4. coëfficient Verbinding zuurstof en koolstof C, O (g) (kommaformule) CO 2 (g) (molecuulformule) Één atoom koolstof en twee atomen zuurstof 3 CO 2 Index

Voorbeelden 3. Een molecuul methaan (hoofdbestanddeel aardgas) 1. 2. 3. 4. Verbinding van koolstof en waterstof C, H(g) (kommaformule) CH 4(g) (molecuulformule) Één atoom koolstof en 4 atomen waterstof Coëfficient? ? CH 4 Index

Voorbeelden 4. Drie moleculen difosforpentaoxide Verbinding van fosfor en oxide Wat is een oxide? ? P, O(s) (kommaformule) P 2 O 5(s) (molecuulformule) twee atomen fosfor en 5 atomen zuurstof 3 P 2 O 5(s) Index

Handige rijtjes (1) Bron 20 e j t i u e ! ! z ! d n f e o K ho Niet-ontleedbare stoffen Waterstof H 2(g) Stikstof N 2(g) Zuurstof O 2(g) Fluor F 2(g) Chloor Cl 2(g) Broom Br 2(l) Jood I 2(s) IJzer Fe(s) Zwavel S(s) Ontleedbare stoffen Water Ammoniak Koolstofdioxide Zwaveldioxide Glucose Alcohol Zwavelzuur Methaan (aardgas) In je boek met potlood erbij schrijven H 2 O(l) NH 3(g) CO 2(g) SO 2(g) C 6 H 12 O 6(s) C 2 H 6 O(l) H 2 SO 4(l) CH 4(g)

Handige rijtjes (2) (Bron 23) (Bron 22) e j t i u e ! ! z ! d n f e o K ho Voorvoegsels mono di tri tetra penta 1 2 3 4 5 verbindingen van één element met zuurstof -oxide jood -jodide fluor -fluoride chloor -chloride zwavel -sulfide Broom -bromide

Handige rijtjes (3) Belangrijkste atoomsoorten H Waterstof He Helium C Koolstof N Stikstof F Fluor O Zuurstof Ne Neon Na Natrium Mg Magnesium Al Aluminium P Fosfor S Zwavel Cl Chloor K Kalium Ca Calcium Fe Cu Br Ag I (hoofdletter i) Au IJzer Koper Broom Zilver Jood Goud

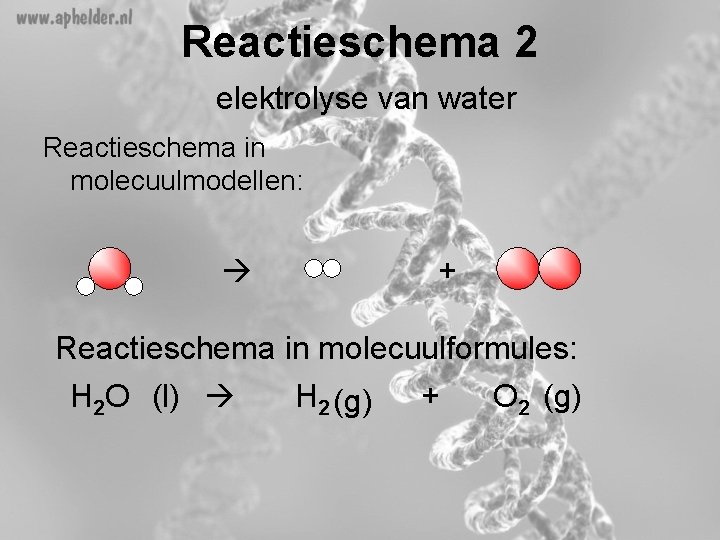
Reactieschema opstellen Een voorbeeld: Een reactieschema met molecuulformules voor de elektrolyse van water.

Reactieschema 1 elektrolyse van water Reactieschema in woorden: waterstof + zuurstof Reactieschema in kommaformules: H, O H + O

Reactieschema 2 elektrolyse van water Reactieschema in molecuulmodellen: + Reactieschema in molecuulformules: H 2 O (l) H 2 (g) + O 2 (g)

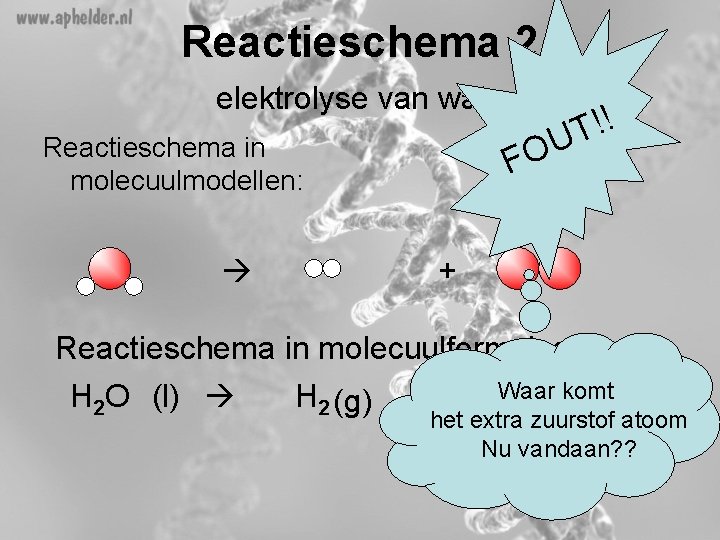
Reactieschema 2 elektrolyse van water Reactieschema in molecuulmodellen: !! T U FO + Reactieschema in molecuulformules: Waar komt H 2 O (l) H 2 (g) + O (g) 2 het extra zuurstof atoom Nu vandaan? ?

5. 4 reactievergelijkingen • Reactieschema kloppend maken • Reactieschema reactievergelijking Het aantal atomen van één soort is voor en na de pijl gelijk

Afspraken • Aan molecuulformules mag je niets veranderen. • Het getal voor de molecuulformules (coëfficient) is altijd zo klein mogelijk • Controleer alle atoomsoorten nauwkeurig

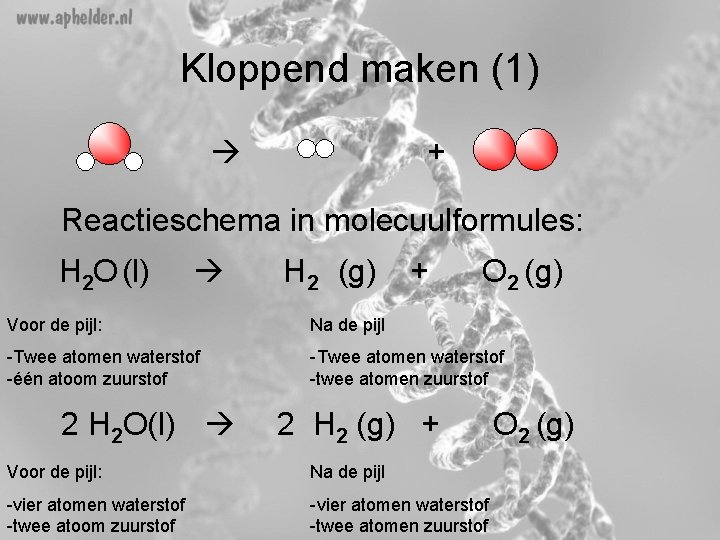
Kloppend maken (1) + Reactieschema in molecuulformules: H 2 O (l) H 2 (g) + O 2 (g) Voor de pijl: Na de pijl -Twee atomen waterstof -één atoom zuurstof -Twee atomen waterstof -twee atomen zuurstof 2 H 2 O(l) 2 H 2 (g) + Voor de pijl: Na de pijl -vier atomen waterstof -twee atoom zuurstof -vier atomen waterstof -twee atomen zuurstof O 2 (g)

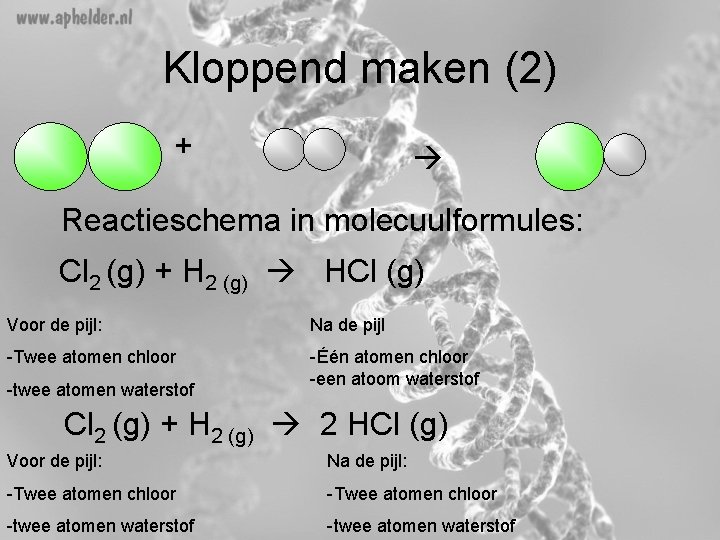
Kloppend maken (2) + Reactieschema in molecuulformules: Cl 2 (g) + H 2 (g) HCl (g) Voor de pijl: Na de pijl -Twee atomen chloor -Één atomen chloor -een atoom waterstof -twee atomen waterstof Cl 2 (g) + H 2 (g) 2 HCl (g) Voor de pijl: Na de pijl: -Twee atomen chloor -twee atomen waterstof

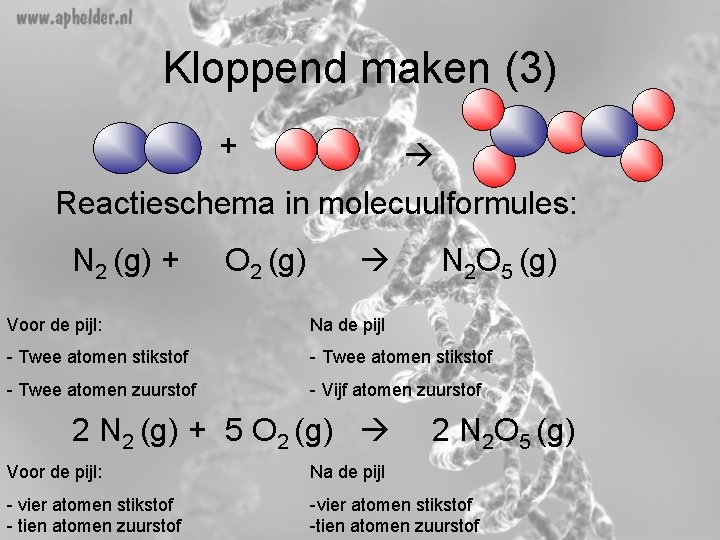
Kloppend maken (3) + Reactieschema in molecuulformules: N 2 (g) + O 2 (g) N 2 O 5 (g) Voor de pijl: Na de pijl - Twee atomen stikstof - Twee atomen zuurstof - Vijf atomen zuurstof 2 N 2 (g) + 5 O 2 (g) 2 N 2 O 5 (g) Voor de pijl: Na de pijl - vier atomen stikstof - tien atomen zuurstof -vier atomen stikstof -tien atomen zuurstof

Antwoorden 5. 4 Reactievergelijkingen

54 a) o. a. ‘Marlboro’ b) Reactievergelijkingen zien er over de hele wereld hetzelfde uit.

55 In Bron 29

56 Bij een reactie is het aantal atomen constant

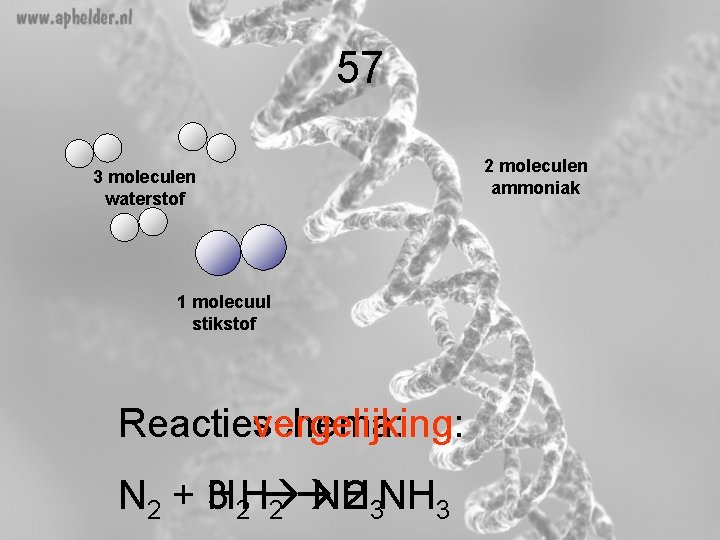
57 3 moleculen waterstof 1 molecuul stikstof Reactieschema: Reactievergelijking: N 2 + 3 H 2 H NH 2 3 NH 3 2 2 moleculen ammoniak

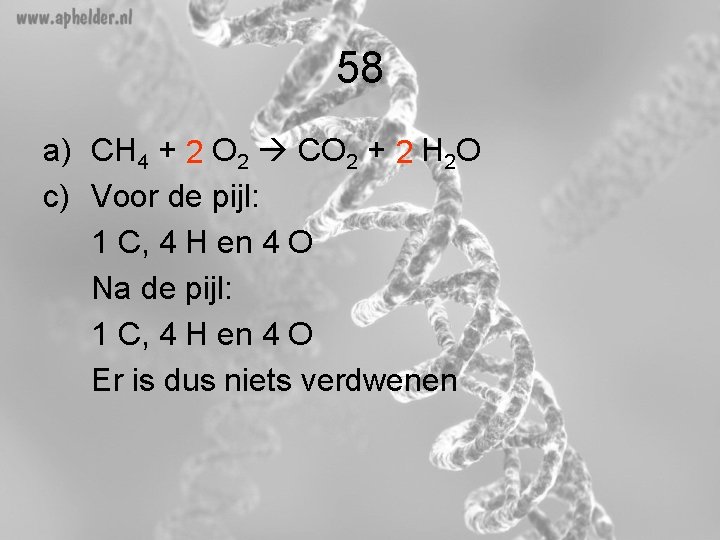
58 a) CH 4 + 2 O 2 CO 2 + 2 H 2 O c) Voor de pijl: 1 C, 4 H en 4 O Na de pijl: 1 C, 4 H en 4 O Er is dus niets verdwenen

59 a) Bij het kloppend maken mag je de molecuulformules van de stoffen niet veranderen omdat een andere molecuulformule een andere stof voorstelt. b) Om een reactieschema kloppend te maken mag je alleen iets veranderen aan het aantal moleculen

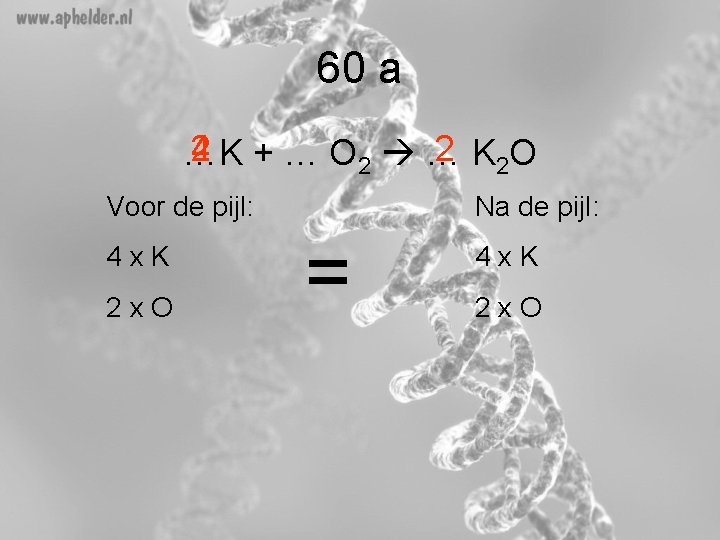
60 a 2 + … O 2 … 4 2 K 2 O …K Voor de pijl: 4 x. K 2 x. O Na de pijl: = 4 x. K 2 x. O

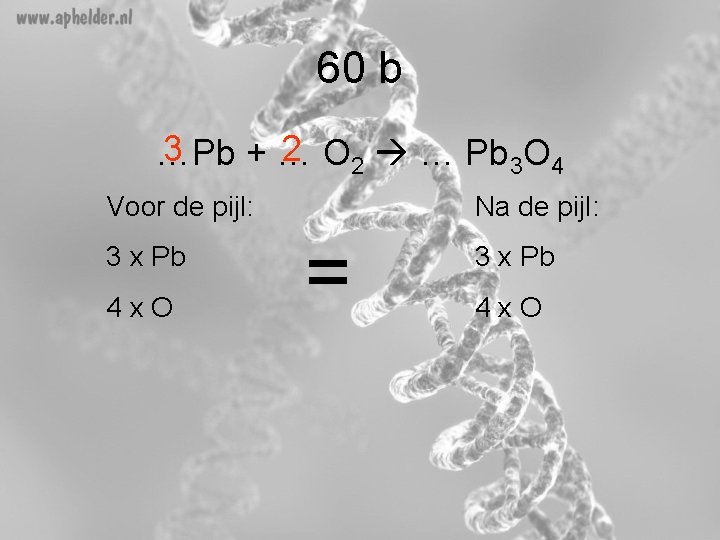
60 b 3 2 O 2 … Pb 3 O 4 …Pb +… Voor de pijl: 3 x Pb 4 x. O Na de pijl: = 3 x Pb 4 x. O

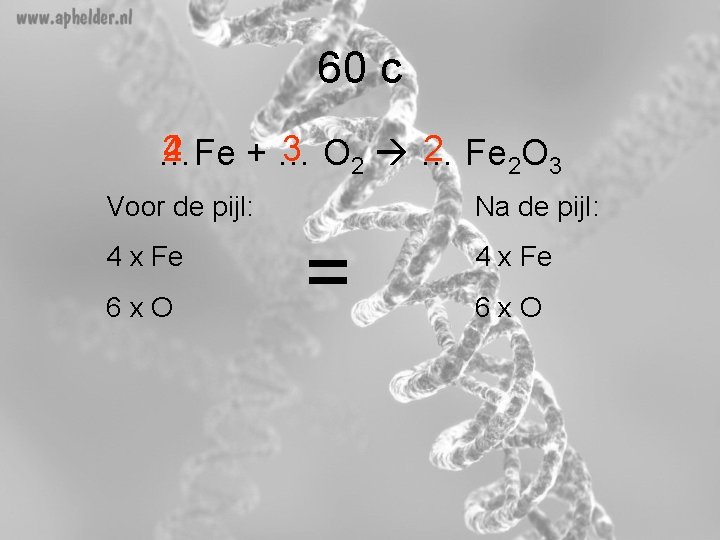
60 c 2 4 3 O 2 … 2 Fe 2 O 3 …Fe +… Voor de pijl: 4 x Fe 6 x. O Na de pijl: = 4 x Fe 6 x. O

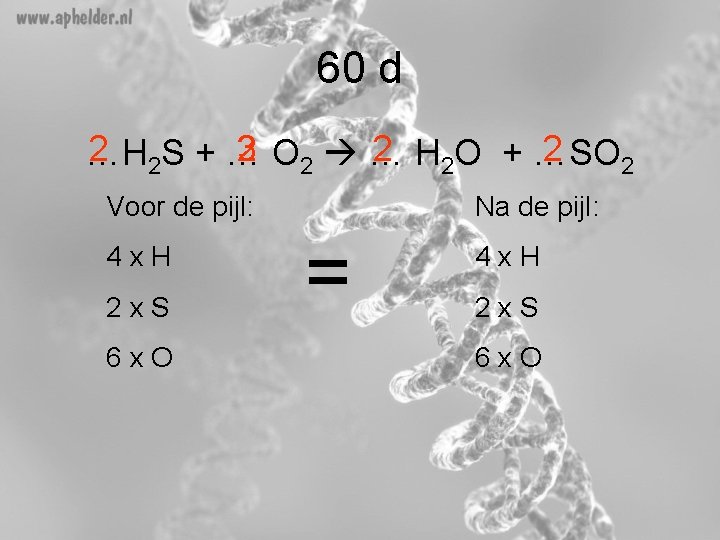
60 d 2 2 S + … 3 O 2 … 2 2 H 2 O + …SO 2 …H 2 Voor de pijl: 4 x. H 2 x. S 6 x. O Na de pijl: = 4 x. H 2 x. S 6 x. O

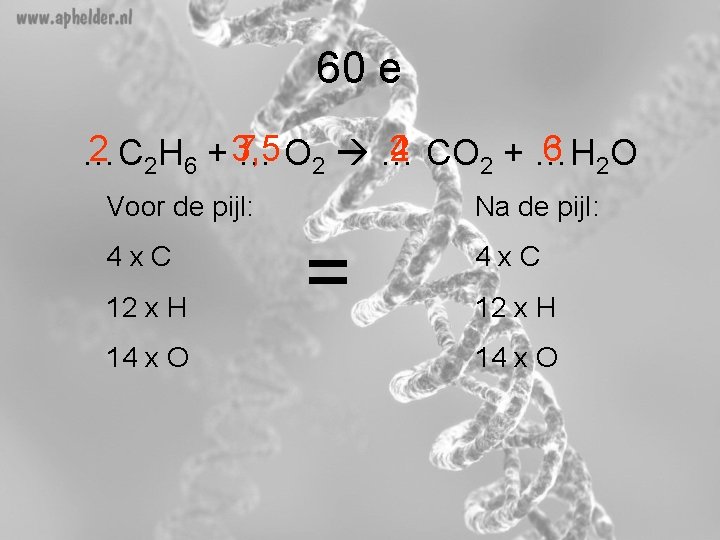
60 e 2 2 H 6 + 3, 5 7 2 CO 2 + …H 4 3 2 O 6 …C … O 2 … Voor de pijl: 4 x. C 12 x H 14 x O Na de pijl: = 4 x. C 12 x H 14 x O

60 f 3 C … 2 Fe + …CO 3 …Fe 2 O 3 + … Voor de pijl: 2 x Fe 3 x. O 3 x. C Na de pijl: = 2 x Fe 3 x. O 3 x. C

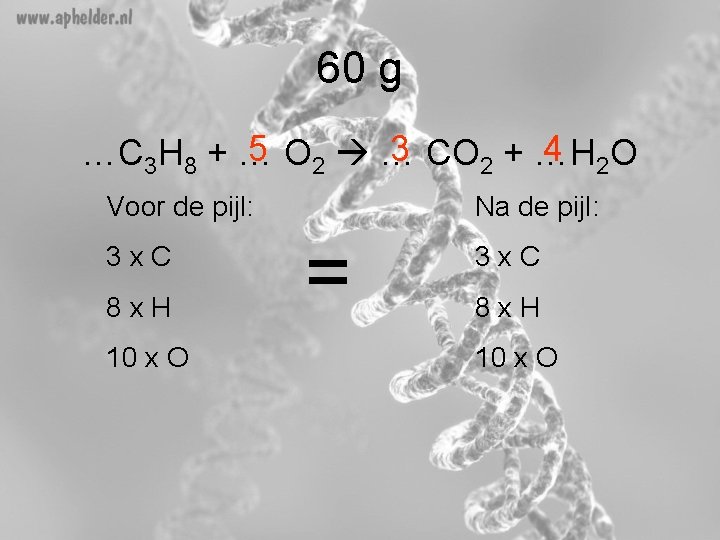
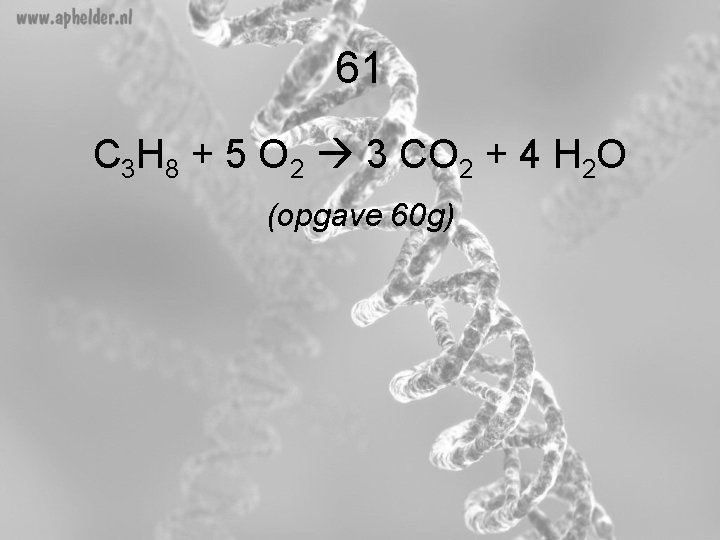
60 g 5 O 2 … 3 CO 2 + …H 4 2 O …C 3 H 8 + … Voor de pijl: 3 x. C 8 x. H 10 x O Na de pijl: = 3 x. C 8 x. H 10 x O

61 C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O (opgave 60 g)

62 a) Een reactievergelijking is een kloppend reactieschema met formules b) - reactieschema in woorden - reactieschema met molecuulformules - kloppend maken - reactievergelijking - controle

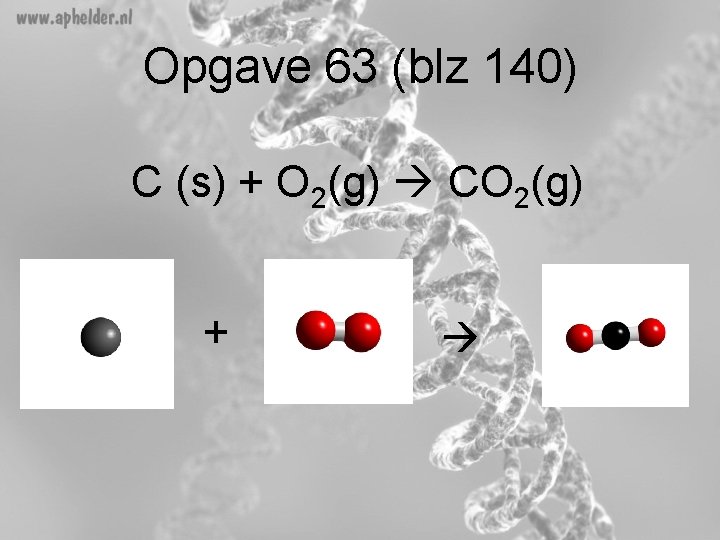
Opgave 63 (blz 140) a) Verbranding van koolstof tot koolstofdioxide Wat zijn de beginstoffen? - Koolstof (Symbool C) Zuurstof (verbranding!!) (symbool O 2) Wat zijn de reactieproducten? - koolstofdixode (symbool CO 2) C (s) + O 2(g) CO 2(g)

Opgave 63 (blz 140) C (s) + O 2(g) CO 2(g) +

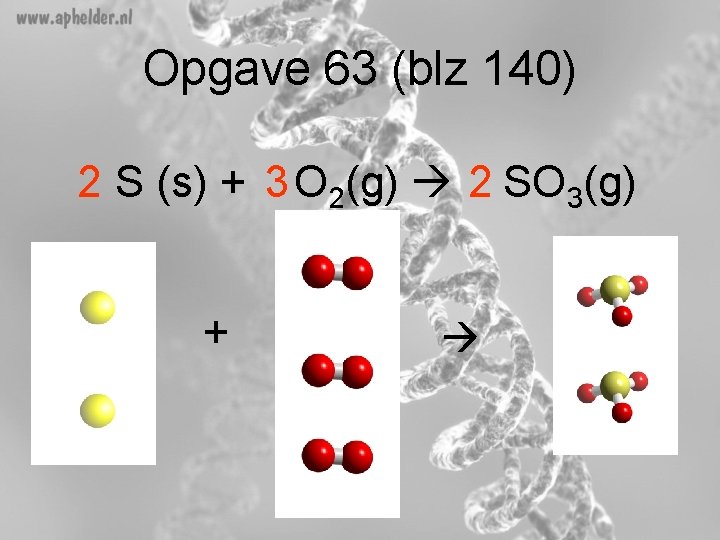
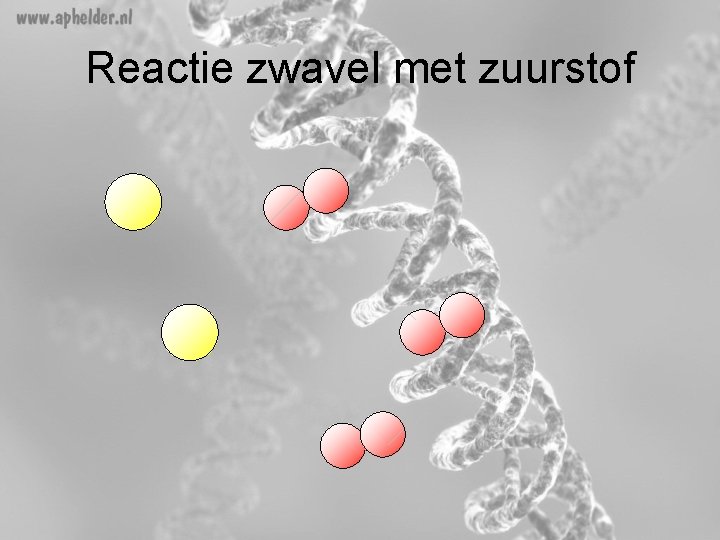
Opgave 63 (blz 140)(vervolg) b) Verbranding van zwavel tot zwaveltrioxide Wat zijn de beginstoffen? - zwavel Zuurstof (verbranding!!) Wat zijn de reactieproducten? - zwaveltrioxide

Opgave 63 (blz 140) 2 S (s) + 3 O 2(g) 2 SO 3(g) +

Reactie zwavel met zuurstof

Opgave 63 (blz 140)(vervolg) c) Verbranding van magnesium tot magnesiumoxide Wat zijn de beginstoffen? - magnesium Zuurstof (verbranding!!) Wat zijn de reactieproducten? - magnesiumoxide

Opgave 63 (blz 140) 2 Mg (s) + O 2(g) 2 Mg. O (s) +

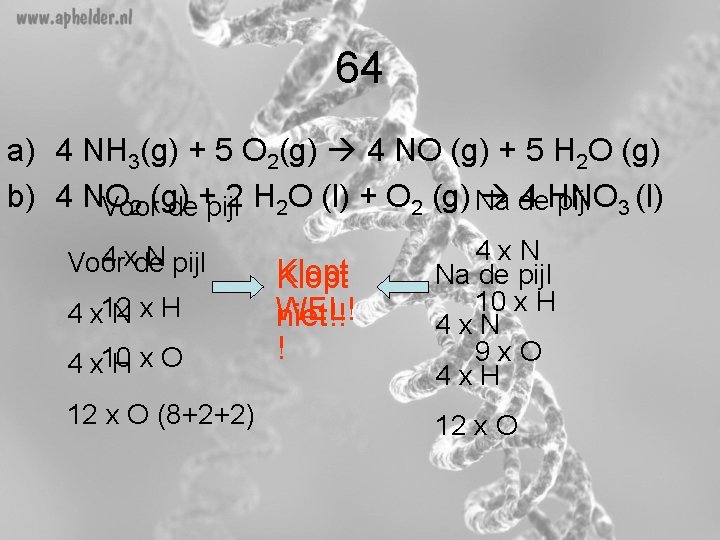
64 a) 4 NH 3(g) + 5 O 2(g) 4 NO (g) + 5 H 2 O (g) b) 4 NO 2 H 2 O (l) + O 2 (g) Na de 4 HNO pijl 3 (l) 2 (g) Voor de+pijl 4 xde N pijl Voor 4 x 12 Nx. H 4 x 10 Hx. O 12 x O (8+2+2) Klopt WEL! niet!! ! 4 x. N Na de pijl 10 x H 4 x. N 9 x. O 4 x. H 12 x O

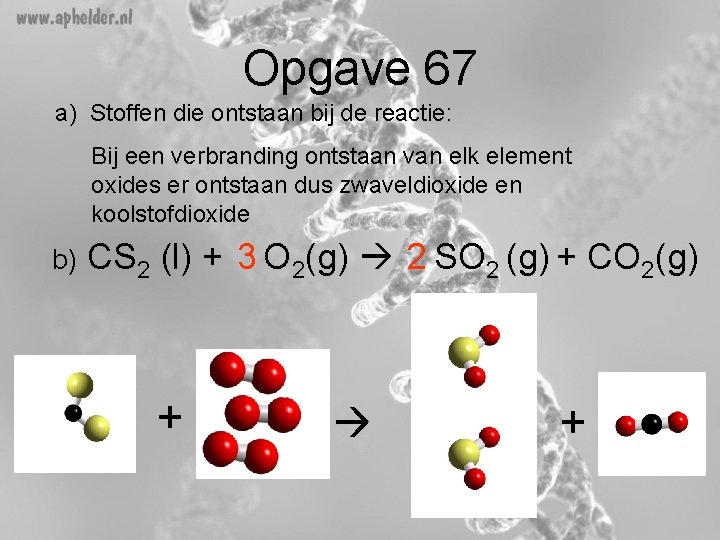
Opgave 67 a) Volledige Verbranding van vloeistof koolstofdisulfide Wat zijn de beginstoffen? - Koolstofdisulfide (formule CS 2) Zuurstof (verbranding!!) Wat zijn de reactieproducten? - koolstofdioxide - zwaveldioxide

Opgave 67 a) Stoffen die ontstaan bij de reactie: Bij een verbranding ontstaan van elk element oxides er ontstaan dus zwaveldioxide en koolstofdioxide b) CS 2 (l) + 3 O 2(g) 2 SO 2 (g) + CO 2(g) + +

5. 5 atoommassa en molecuulmassa • Elk atoom heeft een massa. Deze is al gemeten en dus bekend. • Overzicht van atoommassa’s staan in binas tabel 30. (hoef je niet uit je hoofd te kennen) • Periodiek systeem • Als een atoommassa heeft, heeft een molecuul ook massa

Voorbeelden atoommassa • Afbeelding binas

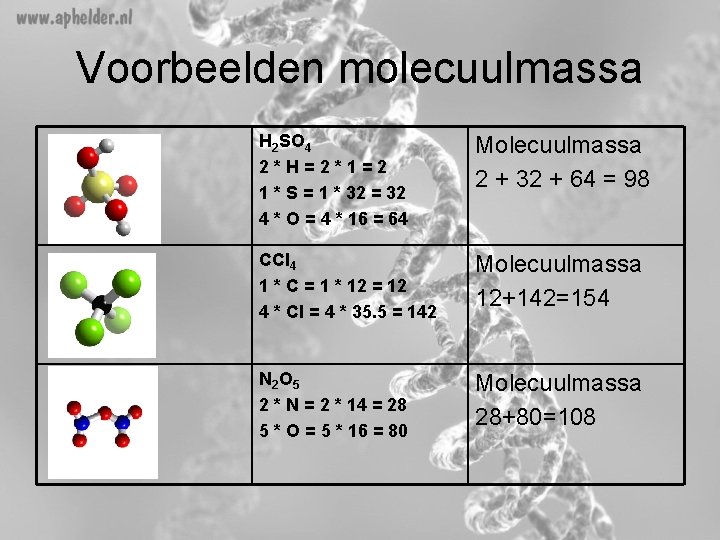
Voorbeelden molecuulmassa H 2 SO 4 2*H=2*1=2 1 * S = 1 * 32 = 32 4 * O = 4 * 16 = 64 Molecuulmassa 2 + 32 + 64 = 98 CCl 4 1 * C = 1 * 12 = 12 4 * Cl = 4 * 35. 5 = 142 Molecuulmassa 12+142=154 N 2 O 5 2 * N = 2 * 14 = 28 5 * O = 5 * 16 = 80 Molecuulmassa 28+80=108
 Mexican hst
Mexican hst Dehis.hst
Dehis.hst Sindikat telekomunikacija
Sindikat telekomunikacija Hst-sfn
Hst-sfn Hst realview
Hst realview Hst image
Hst image Les parts de la flor
Les parts de la flor Le texte expressif
Le texte expressif Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Les constellations les plus connues
Les constellations les plus connues Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Le train de la vie grand corps malade
Le train de la vie grand corps malade Savantement
Savantement Les lettres en français
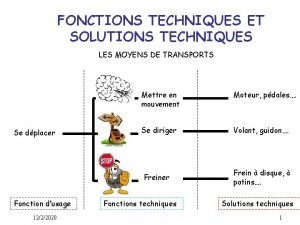
Les lettres en français Fonctions et solutions techniques
Fonctions et solutions techniques Les promesses de dieu ne failliront jamais
Les promesses de dieu ne failliront jamais Je moi tu toi
Je moi tu toi Quesqu un marqueur de relation
Quesqu un marqueur de relation Allez vous en sur les places
Allez vous en sur les places Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde Les voitures les plus rapides du monde
Les voitures les plus rapides du monde L'horloge stratégique
L'horloge stratégique Parts de la fulla
Parts de la fulla Calorie dragibus
Calorie dragibus Preactionneurs
Preactionneurs Une autre fin pour la ficelle
Une autre fin pour la ficelle Tu aimes manger
Tu aimes manger Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Vous invariable ou variable
Vous invariable ou variable Applied business statistics ken black
Applied business statistics ken black Ken klingenstein
Ken klingenstein Ken heing
Ken heing Paul hersey ken blanchard situational leadership
Paul hersey ken blanchard situational leadership Ken davidian
Ken davidian Ken fishkin
Ken fishkin Ken birman
Ken birman Ken fishkin
Ken fishkin Ken deeter
Ken deeter Ken kellermann
Ken kellermann Ken slade
Ken slade Ken robuck
Ken robuck As i was saying by augustus gluten
As i was saying by augustus gluten Ken deeter
Ken deeter Medscope university of maryland
Medscope university of maryland Ken durose
Ken durose Ken guidry levee
Ken guidry levee Ken follett bibliography
Ken follett bibliography Ken oyama
Ken oyama Ken ducatel
Ken ducatel Ba mid career fellowship
Ba mid career fellowship Ken grewal
Ken grewal Ken eglinton
Ken eglinton Ken morin
Ken morin Ken carslaw
Ken carslaw Ken nathens lawyer toronto
Ken nathens lawyer toronto Reaxys umd
Reaxys umd Dontologie
Dontologie Ken cheung columbia
Ken cheung columbia Ken charles barger
Ken charles barger Vampire diaries caleb
Vampire diaries caleb Ken forbus
Ken forbus Als je veel van iemand houdt
Als je veel van iemand houdt Ken
Ken Ken bielsko biała
Ken bielsko biała Sjkc ken boon
Sjkc ken boon Biografia de ken robinson
Biografia de ken robinson Ken black chapter 4 solutions
Ken black chapter 4 solutions Ken klingenstein
Ken klingenstein Ken robinson ecu
Ken robinson ecu Ipv meaning
Ipv meaning Ken betwa link project
Ken betwa link project Wodurch trocknet sekundenkleber
Wodurch trocknet sekundenkleber Ken-ichi kawarabayashi
Ken-ichi kawarabayashi Ken e. kopp
Ken e. kopp Ken blanchard situational leadership ii
Ken blanchard situational leadership ii Saxophone là gì
Saxophone là gì Presentation helper
Presentation helper Ken birman
Ken birman