GAYA YANG MENGUKUHKAN ATOM DALAM MOLEKUL ATAU IONION


































- Slides: 53

GAYA YANG MENGUKUHKAN ATOM DALAM MOLEKUL ATAU ION-ION

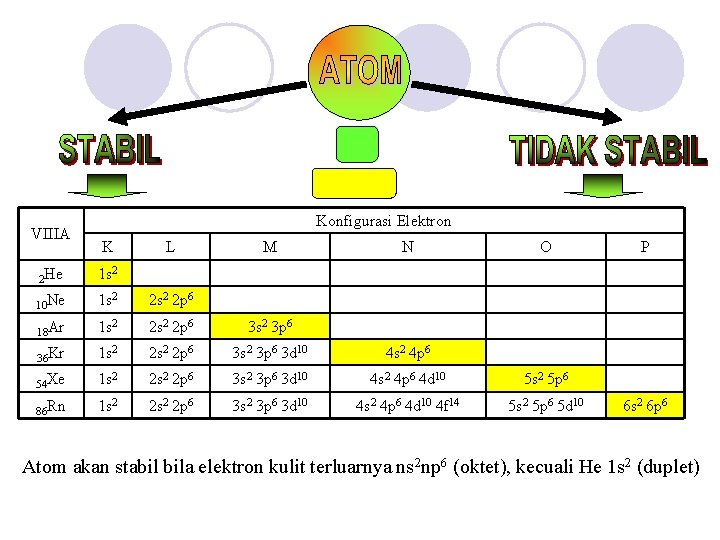
VIIIA Konfigurasi Elektron K L M N O 2 He 1 s 2 10 Ne 1 s 2 2 p 6 18 Ar 1 s 2 2 p 6 3 s 2 3 p 6 36 Kr 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 54 Xe 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p 6 86 Rn 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 4 f 14 5 s 2 5 p 6 5 d 10 P 6 s 2 6 p 6 Atom akan stabil bila elektron kulit terluarnya ns 2 np 6 (oktet), kecuali He 1 s 2 (duplet)

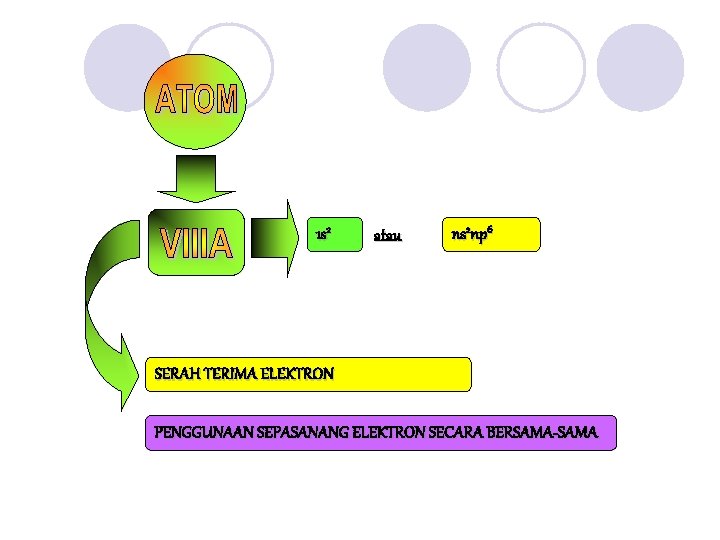
1 s 2 atau ns 2 np 6 SERAH TERIMA ELEKTRON PENGGUNAAN SEPASANANG ELEKTRON SECARA BERSAMA-SAMA

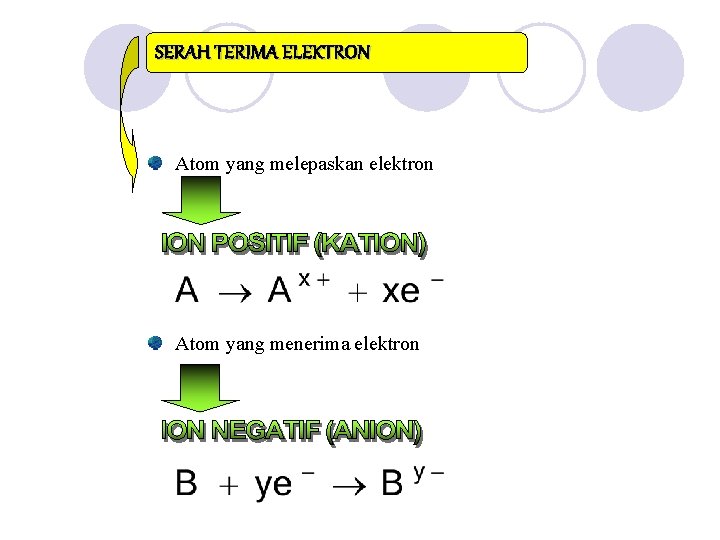
SERAH TERIMA ELEKTRON Atom yang melepaskan elektron Atom yang menerima elektron

GAYA TARIK MENARIK ANTARA ION POSITIF (KATION) DAN ION NEGATIF (ANION)



DIDASARKAN PADA NAMA ION LOGAM YANG BERMUATAN POSITIF DAN ION NEGATIF DITAMBAH AKHIRAN IDA

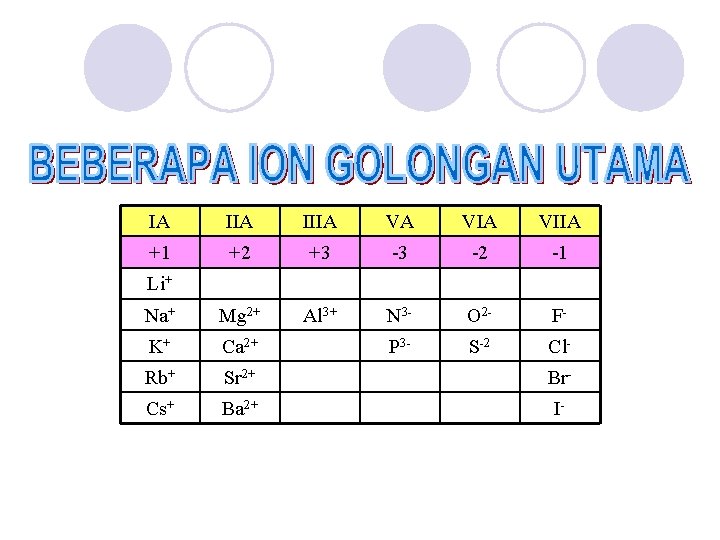
IA IIIA VA VIIA +1 +2 +3 -3 -2 -1 Na+ Mg 2+ Al 3+ N 3 - O 2 - F- K+ Ca 2+ P 3 - S-2 Cl- Rb+ Sr 2+ Br- Cs+ Ba 2+ I- Li+


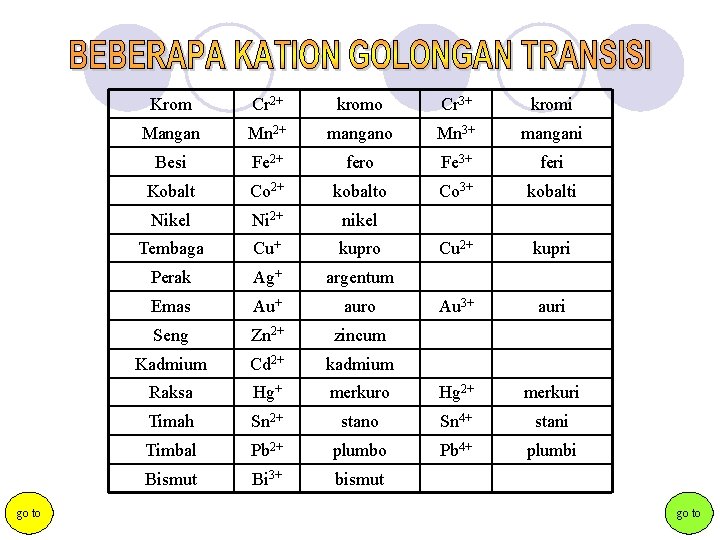
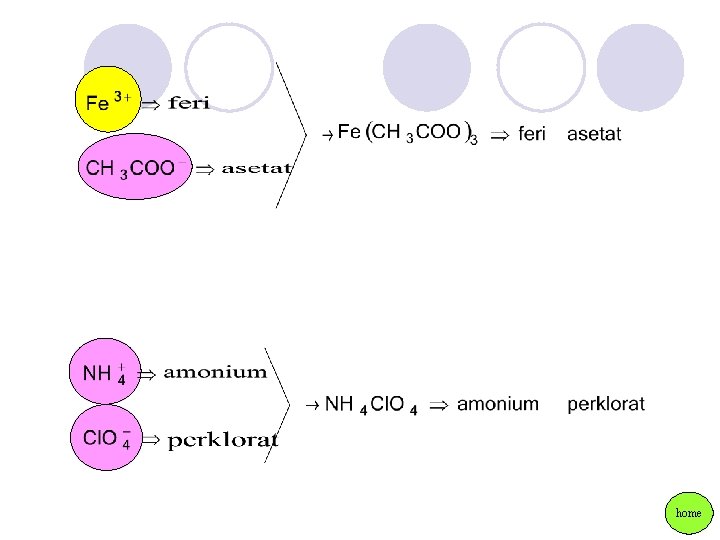
go to Krom Cr 2+ kromo Cr 3+ kromi Mangan Mn 2+ mangano Mn 3+ mangani Besi Fe 2+ fero Fe 3+ feri Kobalt Co 2+ kobalto Co 3+ kobalti Nikel Ni 2+ nikel Tembaga Cu+ kupro Cu 2+ kupri Perak Ag+ argentum Emas Au+ auro Au 3+ auri Seng Zn 2+ zincum Kadmium Cd 2+ kadmium Raksa Hg+ merkuro Hg 2+ merkuri Timah Sn 2+ stano Sn 4+ stani Timbal Pb 2+ plumbo Pb 4+ plumbi Bismut Bi 3+ bismut go to


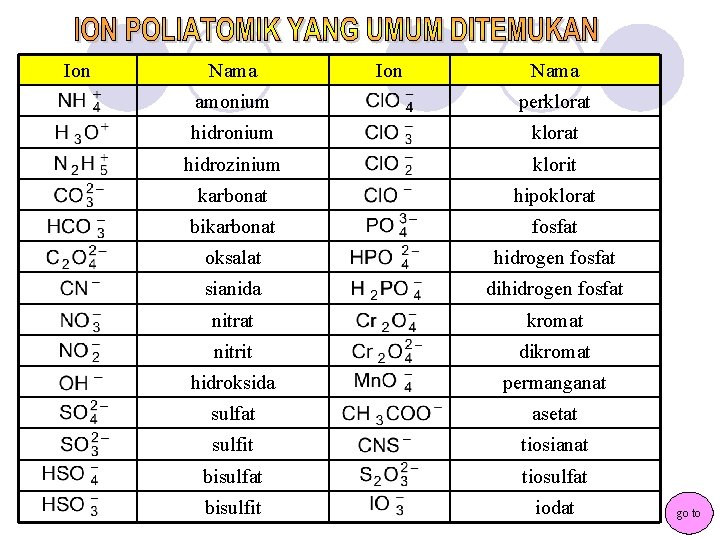
Ion Nama amonium perklorat hidronium klorat hidrozinium klorit karbonat hipoklorat bikarbonat fosfat oksalat hidrogen fosfat sianida dihidrogen fosfat nitrat kromat nitrit dikromat hidroksida permanganat sulfat asetat sulfit tiosianat bisulfat tiosulfat bisulfit iodat go to

home

PENGGUNAAN SEPASANANG ELEKTRON SECARA BERSAMA G. N. LEWIS (1916) IRVING LANGMUIR









DIDASARKAN PADA NAMA KEDUA UNSUR PEMBENTUKNYA SECARA BERURUTAN DITAMBAH AKHIRAN IDA

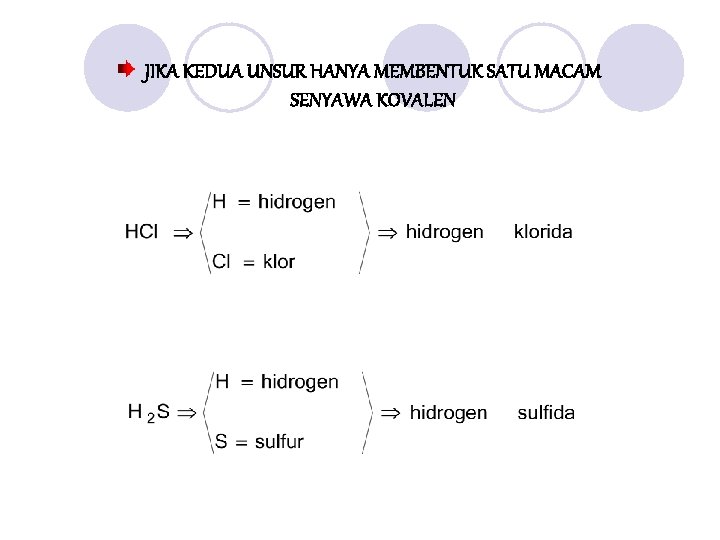
JIKA KEDUA UNSUR HANYA MEMBENTUK SATU MACAM SENYAWA KOVALEN

JIKA KEDUA UNSUR MEMBENTUK DUA MACAM SENYAWA KOVALEN ATAU LEBIH, PEMBERIAN NAMA HARUS MENGGUNAKAN AWALAN 1 mono 6 heksa 2 di 7 hepta 3 tri 8 okta 4 tetra 9 nona 5 penta 10 deka

JIKA UNSUR PERTAMA INDEKSNYA HANYA SATU, MAKA UNSUR PERTAMA TIDAK DIBERI AWALAN DAN UNSUR KEDUA DIBERI AWALAN DAN AKHIRAN IDA

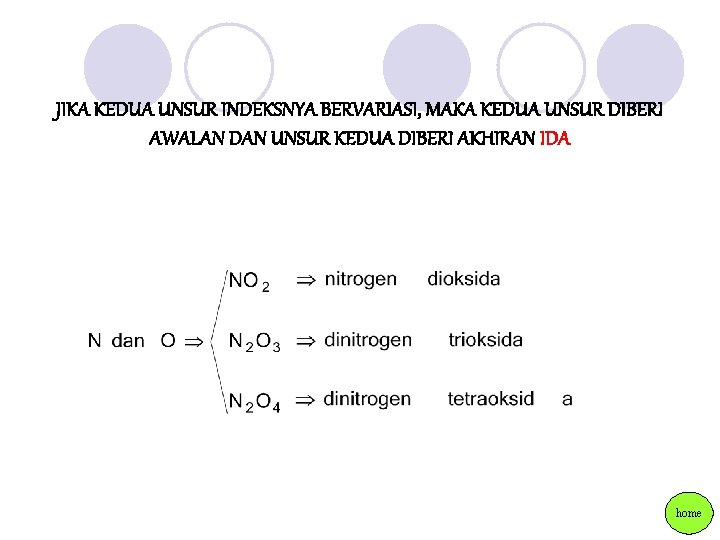
JIKA KEDUA UNSUR INDEKSNYA BERVARIASI, MAKA KEDUA UNSUR DIBERI AWALAN DAN UNSUR KEDUA DIBERI AKHIRAN IDA home

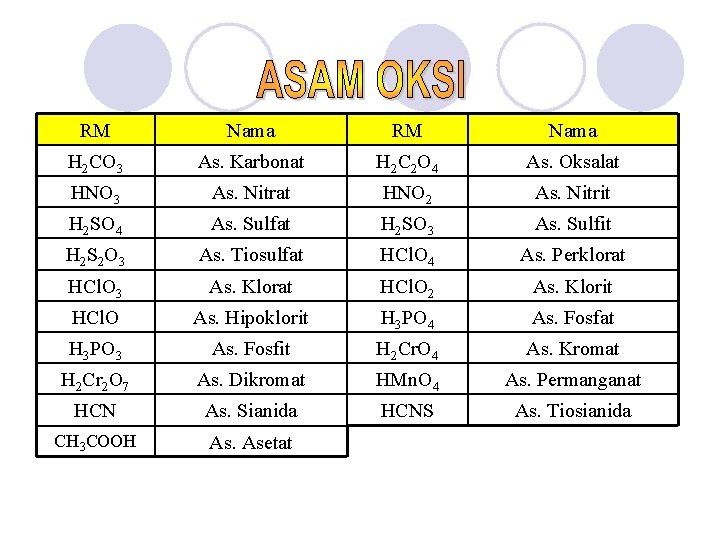
ASAM OKSI SENYAWA ORGANIK

RM Nama H 2 CO 3 As. Karbonat H 2 C 2 O 4 As. Oksalat HNO 3 As. Nitrat HNO 2 As. Nitrit H 2 SO 4 As. Sulfat H 2 SO 3 As. Sulfit H 2 S 2 O 3 As. Tiosulfat HCl. O 4 As. Perklorat HCl. O 3 As. Klorat HCl. O 2 As. Klorit HCl. O As. Hipoklorit H 3 PO 4 As. Fosfat H 3 PO 3 As. Fosfit H 2 Cr. O 4 As. Kromat H 2 Cr 2 O 7 As. Dikromat HMn. O 4 As. Permanganat HCN As. Sianida HCNS As. Tiosianida CH 3 COOH As. Asetat

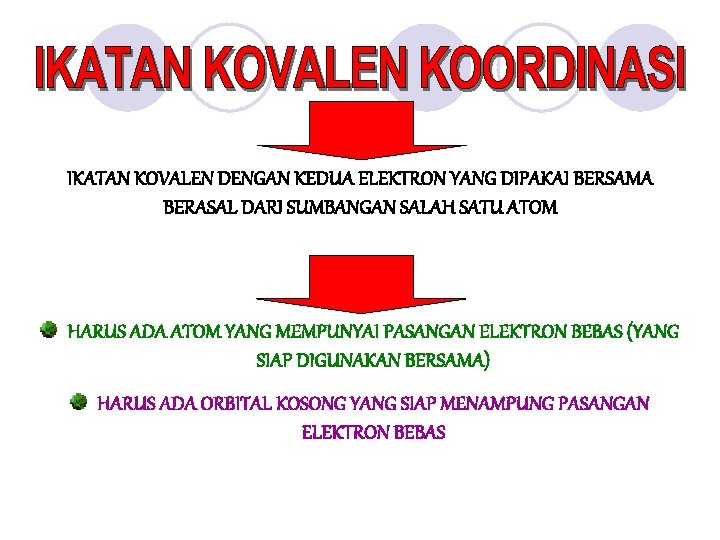
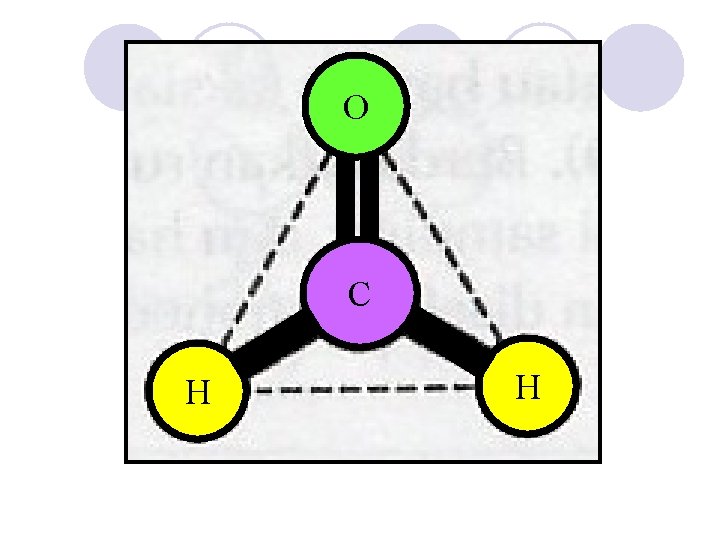
IKATAN KOVALEN DENGAN KEDUA ELEKTRON YANG DIPAKAI BERSAMA BERASAL DARI SUMBANGAN SALAH SATU ATOM HARUS ADA ATOM YANG MEMPUNYAI PASANGAN ELEKTRON BEBAS (YANG SIAP DIGUNAKAN BERSAMA) HARUS ADA ORBITAL KOSONG YANG SIAP MENAMPUNG PASANGAN ELEKTRON BEBAS



IKATAN ANTARA DUA BUAH ATOM TERBENTUK MELALUI SALING TINDIH DUA ORBITAL ATOM (SATU ORBITAL BERASAL DARI TIAP ATOM)


Pertindihannya lebih besar, sehingga ikatannya lebih kuat Pertindihannya lebih kecil, sehingga ikatannya lebih lemah


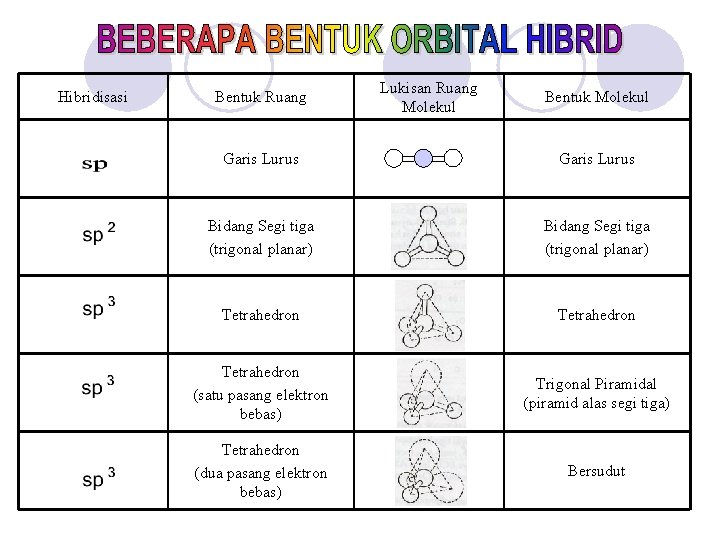
PROSES PENGGABUNGAN (PERKAWINAN) BEBERAPA ORBITAL SUATU ATOM DAN KEMUDIAN DITATA ULANG SEHINGGA MELAHIRKAN ORBITAL BARU YANG EKIVALEN DALAM MOLEKUL

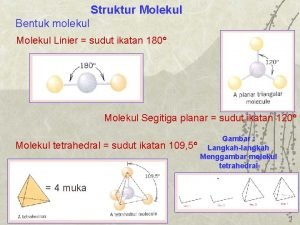
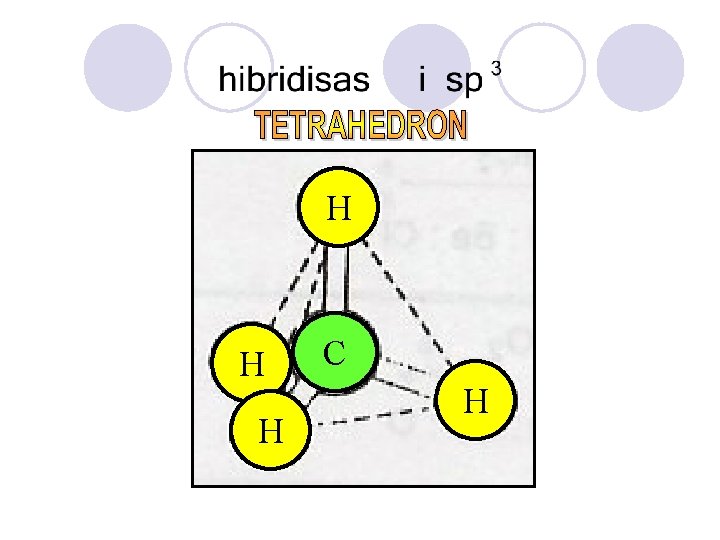
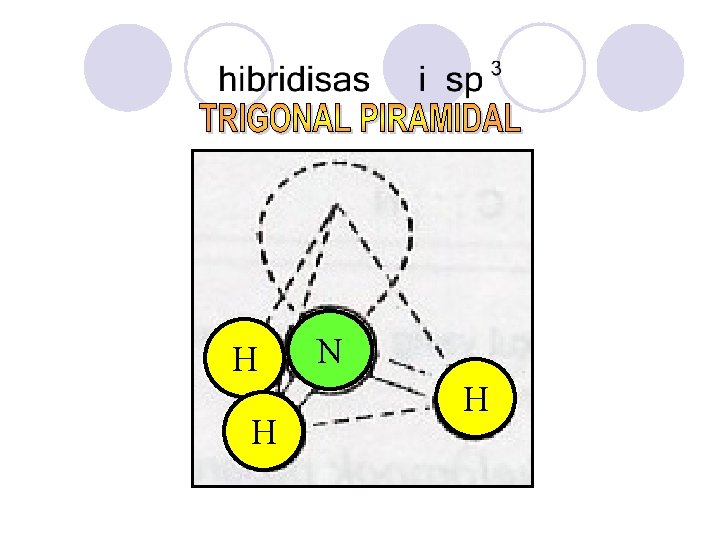
Hibridisasi Bentuk Ruang Lukisan Ruang Molekul Bentuk Molekul Garis Lurus Bidang Segi tiga (trigonal planar) Tetrahedron (satu pasang elektron bebas) Trigonal Piramidal (piramid alas segi tiga) Tetrahedron (dua pasang elektron bebas) Bersudut

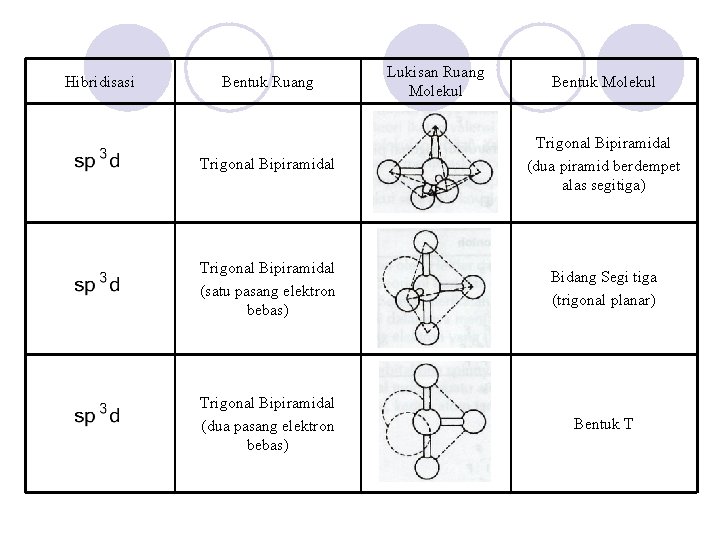
Hibridisasi Bentuk Ruang Lukisan Ruang Molekul Bentuk Molekul Trigonal Bipiramidal (dua piramid berdempet alas segitiga) Trigonal Bipiramidal (satu pasang elektron bebas) Bidang Segi tiga (trigonal planar) Trigonal Bipiramidal (dua pasang elektron bebas) Bentuk T

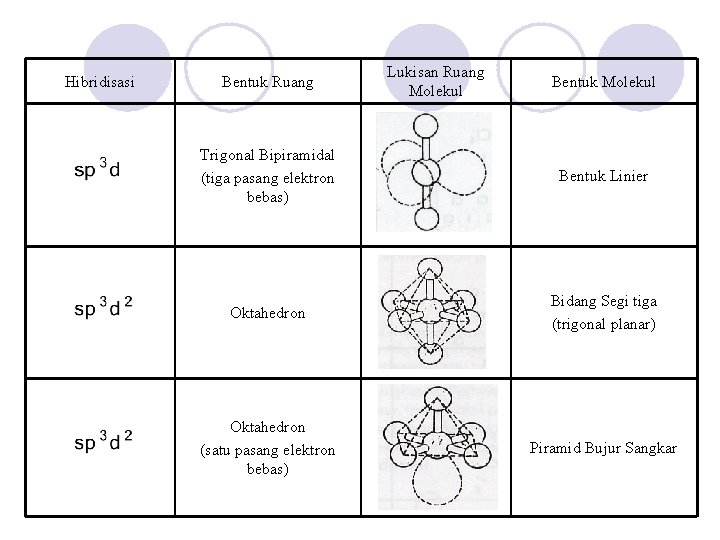
Hibridisasi Bentuk Ruang Lukisan Ruang Molekul Bentuk Molekul Trigonal Bipiramidal (tiga pasang elektron bebas) Bentuk Linier Oktahedron Bidang Segi tiga (trigonal planar) Oktahedron (satu pasang elektron bebas) Piramid Bujur Sangkar

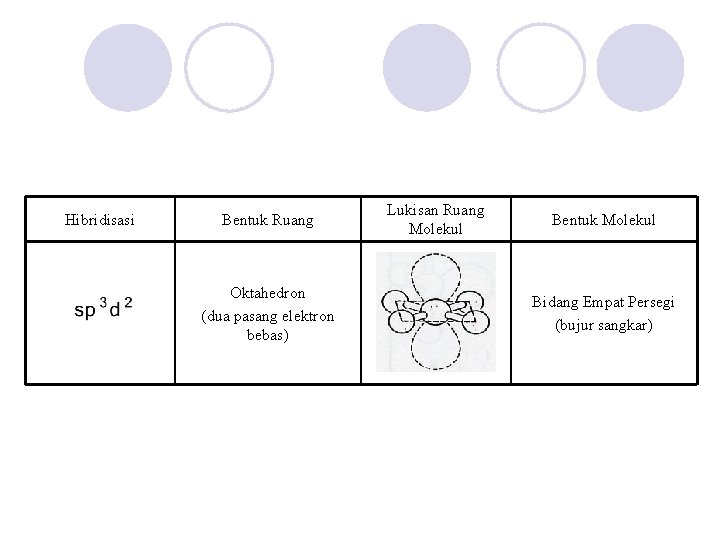
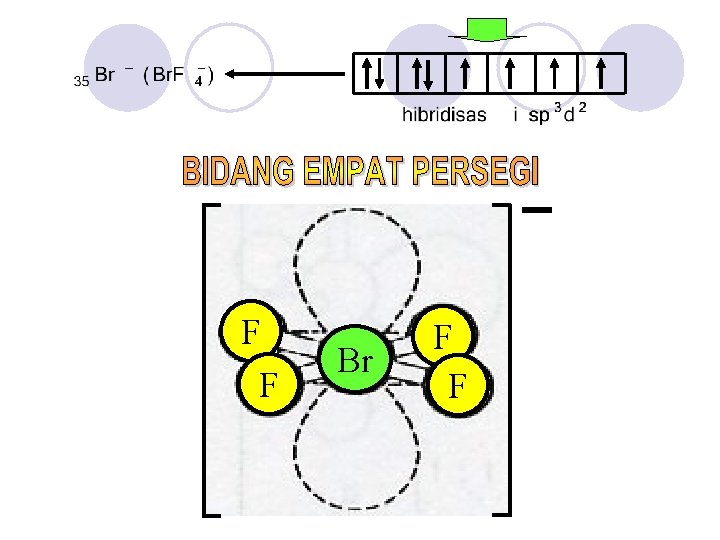
Hibridisasi Bentuk Ruang Oktahedron (dua pasang elektron bebas) Lukisan Ruang Molekul Bentuk Molekul Bidang Empat Persegi (bujur sangkar)


H H H C H


H H N H


F F Br F F


YANG MENGALAMI HIBRIDISASI HANYA ORBITAL YANG MEMBENTUK IKATAN SIGMA, SEDANGKAN IKATAN PI DALAM IKATAN RANGKAP TIDAK DIHITUNG


O C H H

 Peta konsep gaya antar molekul
Peta konsep gaya antar molekul Saturated
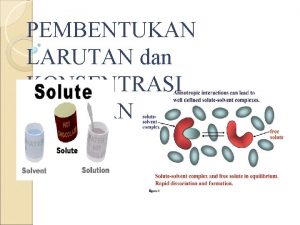
Saturated Perbedaan molekul dan campuran
Perbedaan molekul dan campuran Hibridisasi atom c pada molekul hcoh adalah
Hibridisasi atom c pada molekul hcoh adalah Gaya basa simile nyaéta gaya basa
Gaya basa simile nyaéta gaya basa Ayunan dapat bergerak karena ada
Ayunan dapat bergerak karena ada Berapa gram massa 5 mol emas(ar au= 197)
Berapa gram massa 5 mol emas(ar au= 197) Enzim yang boleh menghidrolisiskan molekul laktosa
Enzim yang boleh menghidrolisiskan molekul laktosa Pengertian rumus molekul
Pengertian rumus molekul The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Kelemahan teori atom bohr
Kelemahan teori atom bohr Gaya adalah
Gaya adalah Seseorang telah melakukan usaha jika
Seseorang telah melakukan usaha jika Tarikan atau dorongan yang
Tarikan atau dorongan yang Massa dari 6,02 x 1022 atom mg (ar mg = 24) adalah
Massa dari 6,02 x 1022 atom mg (ar mg = 24) adalah Obat yang mudah menguap atau terurai harus disimpan dalam
Obat yang mudah menguap atau terurai harus disimpan dalam Nyatakan 112 derajat 40 dalam bentuk desimal
Nyatakan 112 derajat 40 dalam bentuk desimal Menyerahkan sesuatu benda
Menyerahkan sesuatu benda Contoh peran keluarga ditengah gaya hidup modern
Contoh peran keluarga ditengah gaya hidup modern Gambar gaya geser
Gambar gaya geser Penggunaan klinik gaya pada tubuh manusia adalah
Penggunaan klinik gaya pada tubuh manusia adalah Satuan gaya dalam si adalah…. *
Satuan gaya dalam si adalah…. * Tahap dorongan dalam renang gaya punggung adalah
Tahap dorongan dalam renang gaya punggung adalah Dalam ilmu pengetahuan istilah gaya bisa diartikan sebagai
Dalam ilmu pengetahuan istilah gaya bisa diartikan sebagai Prvky symetrie molekul
Prvky symetrie molekul Sudut ikatan kimia
Sudut ikatan kimia Besar sudut tetrahedral
Besar sudut tetrahedral Volume gas no2 pada keadaan standar
Volume gas no2 pada keadaan standar Ninhidrin reaksiyonu
Ninhidrin reaksiyonu Molekul unsur
Molekul unsur Molecular geometry chart
Molecular geometry chart Gambar ikatan hidrogen
Gambar ikatan hidrogen Lewisovy vzorce
Lewisovy vzorce Bentuk molekul ax6
Bentuk molekul ax6 Dihidrobiopterin redüktaz
Dihidrobiopterin redüktaz Lösin enkefalin nedir
Lösin enkefalin nedir Molar derişim formülü
Molar derişim formülü Vee omadused
Vee omadused Sebuah tabung yang volumenya 1 liter mempunyai lubang
Sebuah tabung yang volumenya 1 liter mempunyai lubang Struktur dan fungsi nukleus
Struktur dan fungsi nukleus Logika molekul organisme hidup
Logika molekul organisme hidup Grafit ve elmas erime noktası
Grafit ve elmas erime noktası 2 etoksi 2 metil propana
2 etoksi 2 metil propana Molekul dna
Molekul dna Prediksikan bentuk molekul dan sudut ikatan senyawa pf3
Prediksikan bentuk molekul dan sudut ikatan senyawa pf3 Cara meramalkan bentuk molekul
Cara meramalkan bentuk molekul Bentuk molekul sf3
Bentuk molekul sf3 Atomik yapılı element
Atomik yapılı element Molekul dna
Molekul dna Proses pembentukan molekul
Proses pembentukan molekul Karbon dan klorin
Karbon dan klorin Struktura molekul
Struktura molekul Vibrasi molekul adalah
Vibrasi molekul adalah Dnk molekul
Dnk molekul