CORSO Di CHIMICA ANALITICA II Analisi gravimetrica Lanalisi
















![STEP: [1] Periodo di induzione Formazione di precipitati Il tempo che trascorre dall’istante del STEP: [1] Periodo di induzione Formazione di precipitati Il tempo che trascorre dall’istante del](https://slidetodoc.com/presentation_image_h/0a55a788c546fba96780e1caa63f3550/image-17.jpg)















- Slides: 33

CORSO Di CHIMICA ANALITICA II

Analisi gravimetrica L’analisi gravimetrica consiste nella trasformazione del costituente da determinare in un composto poco solubile: PRECIPITAZIONE L’esecuzione di un saggio gravimetrico comporta la conoscenza della solubilità del precipitato, il controllo dei fattori che la influenzano e la ricerca delle condizioni migliori per ottenere un precipitato puro e di composizione stechiometrica. Nell’analisi gravimetrica si procede aggiungendo sempre un eccesso della soluzione del reattivo precipitante.

La pesata La determinazione della massa del campione da analizzare è la prima operazione che deve essere eseguita per tutte le analisi. A seconda della quantità di sostanza da pesare e dell’ accuratezza con cui si vuole determinare il peso si utilizzano bilance diverse. ü ü Tecniche Analitiche Semimicro Micro ± 0. 1 g ± 0. 1 mg ± 0. 001 mg

Regole di pesata 1. 2. 3. 4. 5. 6. 7. 8. Non toccare pesi ed oggetti (usare pinze) Pesare a temperatura ambiente Non mettere prodotti chimici direttamente sui piatti Usare recipienti idonei (Pesafiltri) Chiudere lo sportello della bilancia Non lasciare pesi sulla bilancia una volta terminata la pesata Riposizionare il cursore (Zero) Introdurre il campione con delicatezza ed in sequenze determinare: a. Pesare prima il recipiente vuoto (tara) b. Aggiungere la sostanza dentro il recipiente.

Bilancia a un piatto: misura più rapida (bracci disuguali). Sia l’oggetto da pesare che i pesi sono applicati dalla stessa parte del giogo. Il bilanciamento non è quindi realizzato aggiungendo pesi, ma togliendo una quantità di peso pari all’oggetto. Il giogo è perciò sottoposto ad un carico totale costante e quindi la sensibilità della bilancia è indipendente dal carico BILANCE TECNICHE o ANALITICHE ELETTRONICHE: (calibrazione automatica) ü Analitiche ü Semimicro ü Micro ± 0. 1 mg ± 0. 001 mg

ACCURATEZZA: La bilancia è accurata quando ponendo masse uguali sui due piattelli il giogo raggiunge la stessa posizione di equilibrio che assumeva a piatti scarichi. STABILITA’: La bilancia è stabile se spostando il giogo dalla posizione orizzontale esso ritorna alla posizione di equilibrio, senza assumere una posizione di falso equilibrio. SENSIBILITA’: E’ il numero di divisione della scala di cui si sposta il puntale per il carico di 1 mg. PRONTEZZA: Una bilancia è pronta quando non ha un periodo di oscillazione troppo lungo. PORTATA: E’ il carico massimo su cui si può sottoporre una bilancia (200 g).

Peso costante di un crogiolo La determinazione del peso costante di un recipiente assume particolare importanza nell’analisi quantitativa in quanto indica il peso che un contenitore raggiunge dopo essere stato sottoposto più volte ad identici trattamenti termici. Un recipiente ha raggiunto un peso costante, ad una certa temperatura, quando sottoposto a riscaldamento alla temperatura stabilita e successivo raffreddamento in essiccatore, il suo peso varia al massimo entro ± 0. 2 mg. Crogiolo T = 700°C (muffola) T = 2 h t. raffr. = 20’

ESSICCATORE: L’essiccatore è un recipiente chiuso nel cui interno vi è un’atmosfera di bassa umidità. Serve ad evitare che certi recipienti o certe sostanze assorbano umidità dall’aria. ! Non può servire ad essiccare Il bordo superiore dell’essiccatore e il bordo inferiore del coperchio sono smerigliati ed entrambi devono essere lubrificati con un film di grasso che permetta la tenuta del recipiente. ü L’essiccatore è diviso in due parti da una piastra di porcellana provvista di fori che permettono la circolazione dell’aria. ü Sul fondo dell’essiccatore si pone il prescelto essiccante. Gel di silice impregnato con Co. Cl 2 ? INDICATORE DELLO STATO DI UMIDITA’

Fattori che influenzano la solubilità di un precipitato E’ importante considerare tutte le condizioni che favoriscono la miglior formazione del precipitato e che rendono minime le perdite per solubilità Ks costituisce l’elemento fondamentale per stabilire se la precipitazione può avvenire e può essere considerata quantitativa. Calcolare il prodotto si solubilità di Mg. F 2 , sapendo che questo composto ha una solubilità di 74, 78 mg/L e un p. m. = 62. 32 S = 1. 2 × 10 -3 M Ks = [Mg 2+] [F-]2 = 4 s 3 = 6. 9 × 10 -9 Calcolare la solubilità di Ag 2 Cr. O 4 Ks = 2. 0 × 10 -12 Ks=4 s 3= 2. 0 10 -12 M

La solubilità di un precipitato in certe condizioni sperimentali può differire notevolmente da quella calcolata dal prodotto di solubilità. I principali fattori che possono influenzare la solubilità di un elettrolita sono: 1) 2) 3) 4) 5) 6) Presenza di elettroliti inerti (effetto sale) Solvente Variazioni di temperatura Presenza di un ione a comune p. H Presenza di leganti 1) La maggior parte degli elettroliti poco solubili, manifesta un incremento, certe volte anche marcato, della solubilità per la presenza di elettroliti completamente estranei agli ioni del precipitato. -log fi = 0. 5 Zi 2 µ 1/2 (1+µ 1/2) f= coefficiente di attività; µ= forza ionica µ= ½ Σᵢ Ci Zi 2

log (S/So) = 0. 5 Zi+ Zi- (µ 1/2 – µ 0) So = solubilità del sale S = solubilità del sale dopo l’aggiunta dell’elettrolita µ 0= forza ionica µ= forza ionica dopo l’aggiunta dell’elettrolita s (Ba. SO 4) aumenta per la presenza di KNO 3 Ks = f. Ba 2+ ∙[Ba 2+] ∙f. SO 42 -∙ [SO 42 -] -log fi = 0. 5 Zi 2 µ 1/2 (1+µ 1/2) f= coefficiente di attività; µ= forza ionica [salina] Ks= f. Ba 2+ [Ba 2+] ∙ f. SO 42 - [SO 42 -] < [Ba 2+] [SO 42 -] S=(Ks/ f. Ba 2+ f. SO 42 - )1/2 Aumento della solubilità rispetto a soluzioni in acqua distillata.

2 Effetto del solvente Generalmente la solubilità dei composti inorganici diminuisce per l’aggiunta di etanolo, acetone, etc. La solubilità di Ca. SO 4 diminuisce in una soluzione di etanolo: H 2 O L’effetto della diminuzione della solubilità per l’aggiunta del solvente organico aumenta con l’aumento della carica del catione e dell’anione del composto poco solubile. 3 Effetto della temperatura Eccetto per alcune sostanze come il citrato di calcio la solubilità aumenta con la temperatura. Nel periodo iniziale di formazione del precipitato si sfrutta l’aumento della solubilità per avere un precipitato migliore, successivamente si filtra e si lava a freddo il precipitato.

4 Effetto dello ione a comune Ba. SO 4(s) ⇄ Ba 2+ + SO 42 Kps = 1. 08 ∙ 10 -10 [SO 4 - ] = 1. 04 ∙ 10 -5 M Ripeto lo stesso esperimento in una soluzione K 2 SO 4 0. 010 M 0. 010 + [Ba 2+] -8 M Quale sarà la concentrazione di ioni calcio all’equilibrio in una soluzione satura di Ca. F 2 e contenente Na. F 0. 0100 M? Ca. F 2(s) ⇄ Ca 2+ + 2 F- Kps = [Ca 2+] [F-]2 = 5. 3 ∙ 10 -9 = = [Ca 2+] [0, 01]2 [Ca 2+] = 5. 3 ∙ 10 -5 M Kps = [Ca 2+] [F-]2 = 4 s 3 s= 1. 1 ∙ 10 -3 M

5 AB Effetto del p. H Ks = 5 ∙ 104 B base protonabile Kb = 2 ∙ 10 -11 n s=? p. H=3 -3 p. H Idrossidi per tutti i sali contenenti cationi che sono acidi forti Precipitazione frazionata

6 Effetto dei leganti L’aggiunta di una soluzione di un legante (L) ad un sale poco solubile (BA) ne può aumentare la solubilità per effetto della formazione di complessi. S = [A] = [B] + [BL 2 ] + … …+ [BLn ] S = [B] (1 + K 1 [L] + K 1 K 2 [L]2 + …+ K 1 K 2 … Kn [L]n ) Moltiplico S = [A] S 2 = [B] [A] (1 + K 1 [L] + K 1 K 2 [L]2 + …. + K 1 K 2 … Kn [L]n )

Calcolare la solubilità di Ag. I (Ks = 9. 0 ∙ 10 -17 ) in NH 3 0. 1 M, sapendo che lo ione Ag+ forma con NH 3 i complessi. Ag (NH 3 )+ K 1 = 1. 6 ∙ 103 Ag (NH 3 )+2 K 2 = 6. 3 ∙ 103 S = [I- ] = [Ag+ ] + [Ag (NH 3)+ ] + [Ag (NH 3 )+2 ] S = 9. 0 ∙ 10 -17 [1+ (1. 6 ∙ 103 ∙ 0. 1) + (6. 3 ∙ 103 ∙ (0. 1)2 )] = S = 2. 3 10 -10 S 2 = [B] [A] (1 + K 1 [L] + K 1 K 2 [L]2 + …. + K 1 K 2 … Kn [L]n )
![STEP 1 Periodo di induzione Formazione di precipitati Il tempo che trascorre dallistante del STEP: [1] Periodo di induzione Formazione di precipitati Il tempo che trascorre dall’istante del](https://slidetodoc.com/presentation_image_h/0a55a788c546fba96780e1caa63f3550/image-17.jpg)
STEP: [1] Periodo di induzione Formazione di precipitati Il tempo che trascorre dall’istante del mescolamento dei reagenti fino all’apparire di un precipitato visibile. [2] La nucleazione Il processo di precipitazione avviene mediante nucleazione e cioè attraverso la formazione di nuclei o aggregati elementari primari che successivamente aumentano di dimensioni. REATTIVO A REATTIVO B SOLUZIONE SATURA (comparsa di nuclei) ACCRESCIMENTO DI NUCLEI Microcristalli Cristalli ben formati PARTICELLE COLLOIDALI (non filtrabili) colloidali aggregati colloidali

La formazione di un composto poco solubile è sfruttata per trovare le migliori condizioni per trasformare uno ione da dosare in un precipitato che possa essere: ü Filtrabile ü Pesabile in forma chimica definita Tecnica operativa della precipitazione Il reattivo precipitante deve: ü Reazione quantitativa ü Precipitato filtrabile e lavabile ü Specifico o selettivo ü Esente da impurezze Digestione: variazioni strutturali di natura irreversibile che avvengono in un precipitato dopo la sua precipitazione. → caldo → migliora la purezza e la filtrabilità del precipitato. Filtrazione: separazione delle acque madri (filtro di carta) Lavaggio ed essiccamento

Calcoli dell’analisi gravimetrica % sostanza = ( g di sostanza ∙ 100) / g campione trovata Nella maggior parte dei casi il precipitato non è la sostanza cercata!

Errore assoluto = (14. 72% - 14. 72%) = 0. 03% Campione incognito Ba. Cl 2 ∙ 2 H 2 O + ϰ

Determinazione del residuo secco magro del latte Una delle analisi richieste dalla legge sul latte è la determinazione del residuo secco magro (RSM) Partita di latte → 15 RSM < 8. 5% Legge 169/89 Direttiva 92/46/CEE Non sono commerciabili

Si vuole determinare la purezza di un lotto di cloruro di potassio. Trattando un campione da 0. 2500 g di KCl con un eccesso di Ag. NO 3, si è avuta la formazione di 0. 2999 g di Ag. Cl. 1) Calcolare le moli di KCl nel campione analizzato e la % p/p di KCl 1 : 1 ↙ ↘ Analita composto finale % p/p(KCl)= (2. 092 ∙ 10 -3 × 75. 55) /0. 2500 = 63. 22%

2) La precipitazione di Ag. Cl viene normalmente considerata completa, tuttavia si commette un errore, perché? Calcolare le moli di Cl- non precipitate sapendo che il precipitato si forma da circa 100. 0 m. L di soluzione in cui: [Ag+ ] = 1. 0 ∙ 10 -2 M Ks = [Ag+ ] [Cl- ] = 1. 8 ∙ 10 -10 (mol Cl- non precipitate = 1. 8 ∙ 10 -8 mol/L ∙ 0. 100 L = 1. 8 ∙ 10 -9 mol)

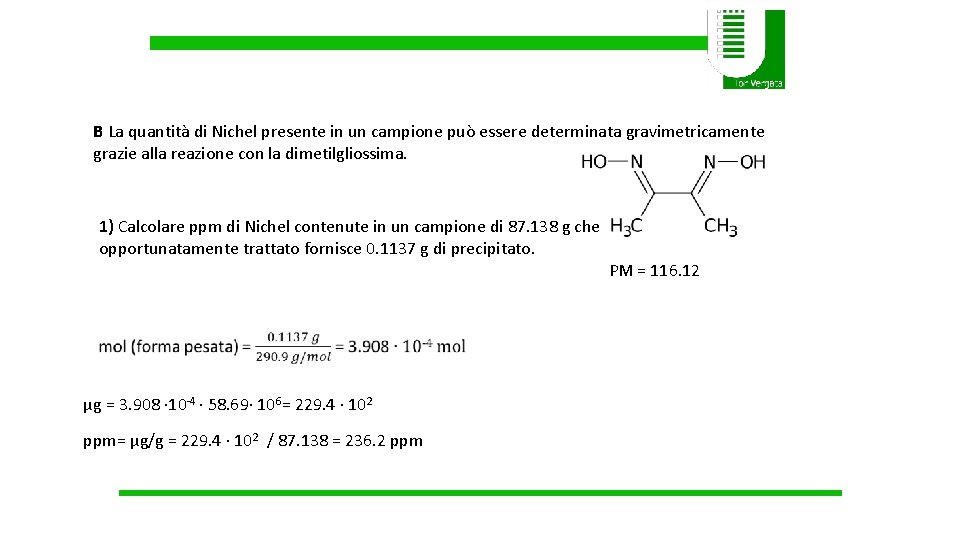
B La quantità di Nichel presente in un campione può essere determinata gravimetricamente grazie alla reazione con la dimetilgliossima. 1) Calcolare ppm di Nichel contenute in un campione di 87. 138 g che opportunatamente trattato fornisce 0. 1137 g di precipitato. PM = 116. 12 µg = 3. 908 ∙ 10 -4 ∙ 58. 69∙ 106= 229. 4 ∙ 102 ppm= µg/g = 229. 4 ∙ 102 / 87. 138 = 236. 2 ppm

C) Un campione da 1. 050 g H 2 SO 4 e HNO 3 viene trattato con Pb(NO 3)2 in eccesso. Il precipitato bianco Pb. SO 4 pesa 0. 7010 g. Un secondo campione uguale al primo viene titolato con 48. 70 m. L di una soluzione di Na. OH 0. 257 M. Calcolare la % p/p dei due acidi nel campione.

mol H 2 SO 4 = 2. 311 ∙ 10 -3 ∙ PM H 2 SO 4 = 2. 311 ∙ 10 -3 ∙ 98. 08 2° campione mol Na. OH = 48. 70 ∙ 0. 257 = 12. 52 mmol

mmol Na. OH= mmmol HNO 3+2 mmol H 2 SO 4 mmmol HNO 3= mmol Na. OH- 2 mmol H 2 SO 4= 12. 52 -2× 2. 311= 12. 52 -4. 622=7. 898 g. HNO 3 =7. 898 ∙ 103 × 63. 01= 0. 4976 % p/p= (0. 4976/1. 050) × 100= 47. 39%

d) Calcolare la % p/p Fe contenuto in una pastiglia di integratore minerale sapendo che una pastiglia sciolta (g = 1. 0573) in HCI e trattata con NH 4 OH separa un idrossido di Fe (III) dalla cui calcinazione si ottengono 0. 4083 g di Fe 2 O 3. mol Fe = 2 mol (Fe 2 O 3) g Fe = mol Fe 2 O 3 ∙ 2 PM (Fe) = 2. 557 ∙ 10 -3 ∙ 2 ∙ 55. 84 = 285. 6 ∙ 10 -3



NEL CAMPIONE INCOGNITO CALCOLARE LA % DI CLORURO DI BARIO

Conoscendo i valori di Ks per gli idrossidi di ferro (III) e zinco (II) [Fe 3+ ] [OH- ]3 = 1. 1 ∙ 10 -36 [Zn 2+ ] [OH- ]2 = 1. 8 ∙ 10 -14 Si calcoli se è possibile separarli quantitativamente come idrossidi da una soluzione 0. 1 M 1. 8 ∙ 10 -14 = 0. 1 [OH- ]2 [OH- ] = 4. 3 ∙ 10 -7 M [OH- ] → [Fe 3+ ] in soluzione? 3 M

Precipitato: ü Filtrabile ü Lavato con facilità ü Composto con stechiometria nota Filtrabile con cristalli sufficientemente grandi → no cristalli piccoli – no colloidi Pur essendo la soluzione satura, il precipitato si forma lentamente e si deve raggiungere un certo grado di sovrasaturazione perché inizi la precipitazione vera e propria.
 Analisi gravimetrica
Analisi gravimetrica Chimica analitica ambientale
Chimica analitica ambientale Soluzione satura
Soluzione satura Etapas da análise gravimétrica
Etapas da análise gravimétrica Juicio sintetico a priori
Juicio sintetico a priori Vectori regula paralelogramului
Vectori regula paralelogramului Quimica analitica ii
Quimica analitica ii Epidemiología analítica
Epidemiología analítica Fase analitica
Fase analitica Passe a frase para a voz passiva
Passe a frase para a voz passiva Conclusión de la geometría
Conclusión de la geometría Voz passiva analítica e sintética
Voz passiva analítica e sintética Percezione sincretica
Percezione sincretica Analitica trascendentale
Analitica trascendentale Passare da forma parametrica a cartesiana
Passare da forma parametrica a cartesiana Frases com voz ativa
Frases com voz ativa Movilizacion analitica simple
Movilizacion analitica simple Objetivos especificos
Objetivos especificos Ficha de leitura estrutura
Ficha de leitura estrutura Propiedades analiticas
Propiedades analiticas Dalla forma implicita alla forma esplicita
Dalla forma implicita alla forma esplicita Descartes geometria analitica
Descartes geometria analitica Símbolos de auditoría
Símbolos de auditoría Mecanica analitica
Mecanica analitica Alta acurácia e baixa precisão
Alta acurácia e baixa precisão Ultracentrifuga analitica
Ultracentrifuga analitica Validazione di un metodo analitico
Validazione di un metodo analitico Control de calidad microbiologia
Control de calidad microbiologia Auditoría funcional
Auditoría funcional O'que são vozes verbais
O'que são vozes verbais Epidemiologia experimental
Epidemiologia experimental Parabola geometria analitica
Parabola geometria analitica Rúbrica holistica
Rúbrica holistica Tura analítica
Tura analítica
























































