Lanalisi qualitativa inorganica Lanalisi qualitativa consiste nellanalisi dei













- Slides: 17

L’analisi qualitativa inorganica

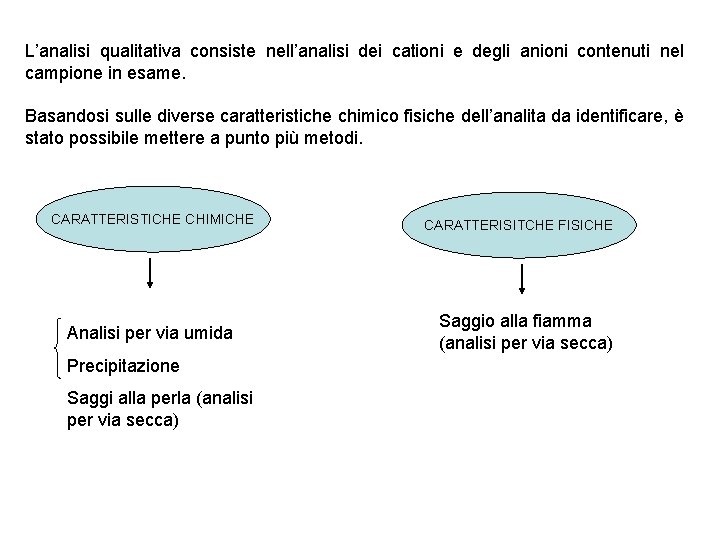
L’analisi qualitativa consiste nell’analisi dei cationi e degli anioni contenuti nel campione in esame. Basandosi sulle diverse caratteristiche chimico fisiche dell’analita da identificare, è stato possibile mettere a punto più metodi. CARATTERISTICHE CHIMICHE Analisi per via umida Precipitazione Saggi alla perla (analisi per via secca) CARATTERISITCHE FISICHE Saggio alla fiamma (analisi per via secca)

Analisi dei cationi per via umida Consideriamo una miscela contenente, ad esempio: Ag+ , Pb++ , Hg 2++ , Al+++ , Fe+++ , Cr+++ , Mn++ Non esiste nessun reattivo che reagisce in maniera specifica con i diversi ioni, infatti i cationi e gli anioni interferiscono l’uno con l’altro. In pratica, gli ioni non vengono separati singolarmente ma in gruppi sfruttando il loro comportamento rispetto a determinati reattivi, detti REATTIVI DI GRUPPO. È per tale motivo che l’analisi si dice SISTEMATICA.

Reattivi del gruppo GRUPPO REATTIVO CATIONI PRECIPITATI VI Gruppo (gruppo del volframio e dei cloruri insolubili) 1° reattivo: HCl ~ 3 N WVI WO 3 (bianco) Ag. Cl (bianco) Hg 2 Cl 2 (bianco) Pb. Cl 2 (bianco) V Gruppo (gruppo dell'arsenico o delle solfoanidridi) 2° reattivo: H 2 S (p. H < 0, 5) As. III, As. II, Sb. III, Sb. V, Sn. IV As 2 S 3, As 2 S 5 (gialli) Sb 2 S 3, Sb 2 S 5 (arancione) Sn. S 2 (giallo) Pb 2+, Sn 2+, Bi 3+, Hg 2+, Cu 2+, Cd 2+ Pb. S (nero) Sn. S (bruno) Bi 2 S 3 (bruno-nero) Hg. S (nero) Cu. S (nero) Cd. S (giallo) Al 3+, Fe 3+, Cr 3+, Mn 2+ Al(OH)3 (bianco) Fe(OH)3 (rosso bruno) Cr(OH)3 (grigio-verde) Mn(OH)2 (bianco-bruno) IV Gruppo (gruppo del piombo o dei solfossidi) 2° reattivo: H 2 S (p. H < 0, 5) III Gruppo (gruppo dell'alluminio): sottogruppo degli idrossidi 3° reattivo: NH 4 OH + NH 4 Cl (p. H ~ 9) III Gruppo (sottogruppo dei solfuri) 4° reattivo: NH 4 OH + NH 4 Cl + (NH 4)2 S (p. H ~ 9) Zn 2+, Co 2+, Ni 2+, Mn 2+ Zn. S (bianco) Co. S (nero) Ni. S (nero) Mn. S (rosa) II Gruppo (gruppo dei metalli alcalino terrosi) reattivi vari Ba 2+, Sr 2+, Ca 2+, Mg 2+ composti vari I Gruppo (gruppo dei metalli alcalini) reattivi vari K+, Na+, NH 4+ composti vari

Analisi per via umida La ricerca sistematica dei cationi per via umida richiede che la sostanza da analizzare venga disciolta in un opportuno solvente. Prima però della dissoluzione è necessario ricercare, ed eventualmente eliminare, particolari sostanze - cianocomplessi, silicati , biossido di silicio -, la cui presenza disturberebbe l'andamento dell'analisi

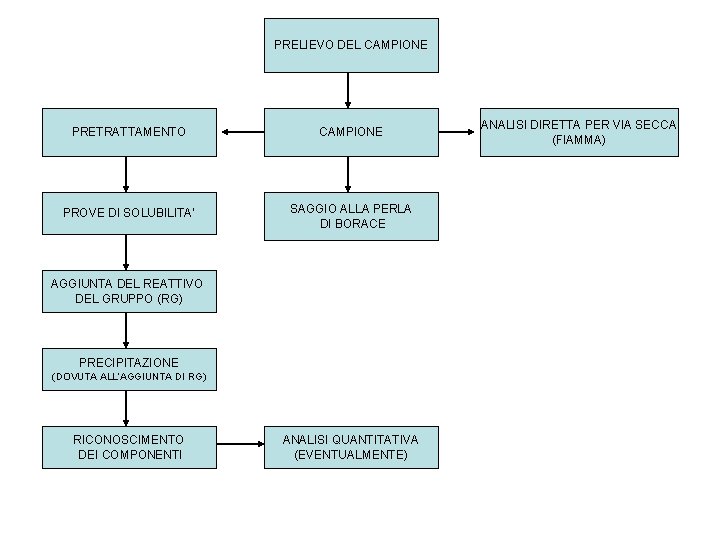
PRELIEVO DEL CAMPIONE PRETRATTAMENTO CAMPIONE PROVE DI SOLUBILITA’ SAGGIO ALLA PERLA DI BORACE AGGIUNTA DEL REATTIVO DEL GRUPPO (RG) PRECIPITAZIONE (DOVUTA ALL’AGGIUNTA DI RG) RICONOSCIMENTO DEI COMPONENTI ANALISI QUANTITATIVA (EVENTUALMENTE) ANALISI DIRETTA PER VIA SECCA (FIAMMA)

Le prove di solubilità vengono effettuate su piccole quantità di sostanza (circa 30 mg in provetta) prove successive a temperatura ambiente o a caldo con acqua, HCl (acido cloridrico) diluito e concentrato, acido nitrico (HNO 3) diluito e concentrato ed eventualmente acqua regia (HCl c + HNO 3 c 3: 1 V/V). Questi saggi sono molto utili perché permettono di escludere, con l’aiuto delle tabelle di solubilità dei sali, la presenza di diversi analiti. Esempi: • si supponga che il campione sia solubile in acqua fredda, ciò esclude la presenza di composti insolubili come Ag. Cl, Ag. Br, etc. ciò però non elimina la possibilità che ci possa essere lo ione Ag+ che può essere presente sottoforma di Ag. NO 3, solubile in H 2 O; • si ipotizzi, invece, che il campione sia solubile in acqua calda. Ciò indica che il campione possiede analiti con un valore di Kps (costante di solubilità) medio; il caso tipico è quello del cloruro di piombo (Pb. Cl 2); • il campione trattato con HNO 3 si solubilizza completamente, gli analiti eventualmente presenti sono quelli solubili in acido come l’idrossido ferrico (Fe(OH)3) e l’idrossido ferroso (Fe(OH)2).

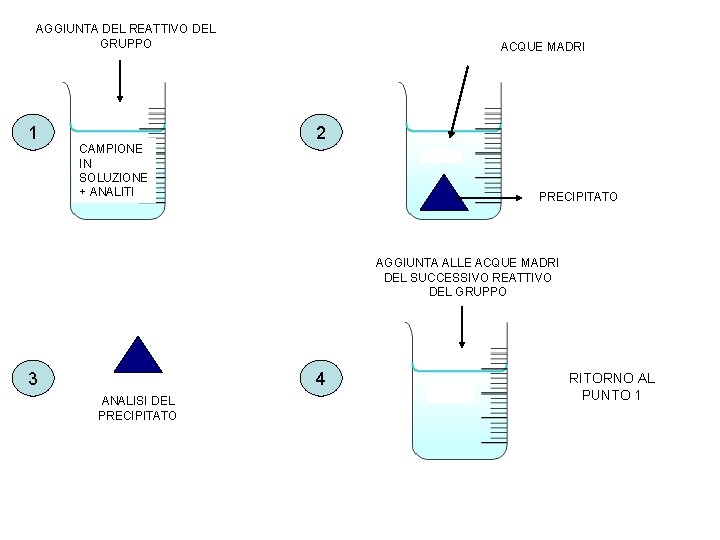
Aggiunta del reattivo del gruppo Una volta che il campione è stato portato in soluzione, si può procedere con l’aggiunta del reattivo del gruppo. Generalmente si procede così come descritto nella slide successiva.

AGGIUNTA DEL REATTIVO DEL GRUPPO 1 CAMPIONE IN SOLUZIONE + ANALITI ACQUE MADRI 2 PRECIPITATO AGGIUNTA ALLE ACQUE MADRI DEL SUCCESSIVO REATTIVO DEL GRUPPO 3 4 ANALISI DEL PRECIPITATO RITORNO AL PUNTO 1

Analisi degli anioni per via umida Al contrario di quanto avviene per i cationi, per gli anioni non esiste alcuna analisi sistematica, ciò vuol dire che sono ricercati per via umida. L’analisi degli anioni viene effettuata a partire da una soluzione basica di Na 2 CO 3 che serve ad eliminare le interferenze colorimetriche causate dalla presenza di Ferro, Manganese, Nichel. La soluzione viene quindi analizzata per verificare la presenza di anioni riducenti e di anioni ossidanti.

RICERCA DI ANIONI RIDUCENTI Una parte della soluzione è acidificata con H 2 SO 4 e riscaldata intorno a 60 -70°C in maniera tale da allontanare l’eccesso di carbonato (CO 32 -) e bicarbonato (CO 3 -) sottoforma di CO 2. Alla soluzione di acido solforico si aggiunge poi il permanganato di potassio (KMn. O 4), un potente agente ossidante, che impartisce una colorazione viola. In ambiente riducente la soluzione si scolora 3 Mn. O 42 - + 4 H+ → 2 Mn. O 4 - + Mn. O 2 + 2 H 2 O; ciò potrebbe indicare la presenza di anioni riducenti quali: I-; Br-, S 2 -; SO 32 -; S 2 O 52 -. RICERCA DI ANIONI OSSIDANTI Ad una parte della soluzione è aggiunto H 2 S che è un agente fortemente riducente. La formazione di un precipitato di zolfo indica la presenza di anioni riducenti. Si può operare anche aggiungendo alla soluzione HI che, in presenza di molecole ossidanti, si riduce a I 2 che colora la soluzione di giallo. In alternativa, poi si può aggiungere la salda d’amido che è incolore in presenza di I- ed azzurra in presenza di I 2.

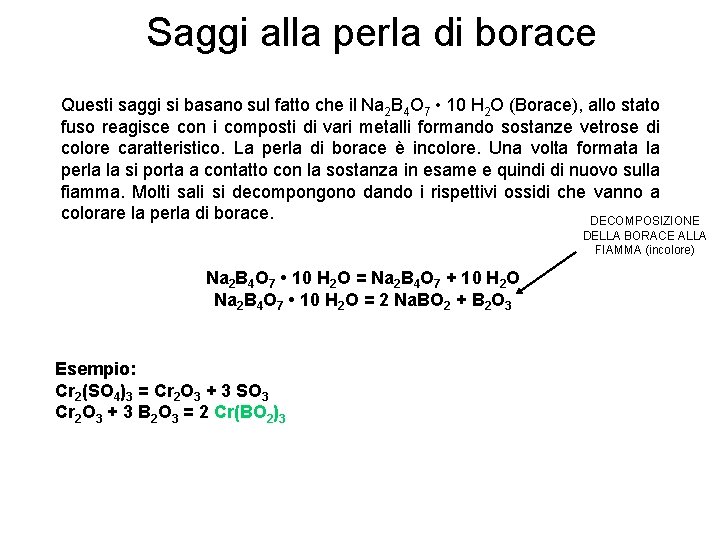
Saggi alla perla di borace Questi saggi si basano sul fatto che il Na 2 B 4 O 7 • 10 H 2 O (Borace), allo stato fuso reagisce con i composti di vari metalli formando sostanze vetrose di colore caratteristico. La perla di borace è incolore. Una volta formata la perla la si porta a contatto con la sostanza in esame e quindi di nuovo sulla fiamma. Molti sali si decompongono dando i rispettivi ossidi che vanno a colorare la perla di borace. DECOMPOSIZIONE DELLA BORACE ALLA FIAMMA (incolore) Na 2 B 4 O 7 • 10 H 2 O = Na 2 B 4 O 7 + 10 H 2 O Na 2 B 4 O 7 • 10 H 2 O = 2 Na. BO 2 + B 2 O 3 Esempio: Cr 2(SO 4)3 = Cr 2 O 3 + 3 SO 3 Cr 2 O 3 + 3 B 2 O 3 = 2 Cr(BO 2)3

Il metodo delle perle di borace consiste nel fondere qualche cristallo di borace in una piccola perla su cui far aderire qualche cristallo del composto in esame ed immergendo quindi la perla nella regione riducente e poi nella regione ossidante della fiamma di un becco di Bunsen. Gli ioni presenti nel composto impartiscono alla perla dei colori caratteristici, indicativi della loro presenza. FIAMMA OSSIDATA Fonte: www. territorioscuola. com SALE DI: COLORE SVILUPPATO DALLA FIAMMA OSSIDANTE Rame Verde Manganese Violetto Nichelio Bruno-violetto Ferro Rosso-giallo Cromo Rosso-giallo Cobalto Azzurro

Saggio alla fiamma Questi saggi si basano sulle proprietà che hanno i sali di molti elementi, in prevalenza appartenenti al i e ii gruppo, di impartire colorazioni caratteristiche alla fiamma di un becco Bunsen. Le colorazioni sono dovute all’emissione di radiazioni luminose causate da transizioni degli elettroni di valenza dell’atomo che possono così saltare da un orbitale ad un altro a contenuto energetico maggiore. Potranno formare composti colorati solo quegli atomi o ioni che nella loro configurazione elettronica esterna presenteranno possibili spostamenti di elettroni. Le lunghezze d’onda delle radiazioni emesse sono caratteristiche dell’elemento considerato.

Colorazioni alla fiamma Fiamma rossa Sali di litio, stronzio, calcio (quest’ultima è più fugace). Fiamma gialla Sali di sodio. Fiamma verde Sali di bario, rame, fosfati (umettare con H 2 SO 4), acido borico. Fiamma azzurra Cloruro di rame e ossidi di Bi, As, Sb, Pb. Fiamma violetta Sali di potassio

I metodi appena descritti sono ormai superati. Per determinare la concentrazione di cationi e ioni in diverse matrici alimentari si ricorre all’impiego di tecniche strumentali che, quindi, prevedono l’uso di macchinari sofisticati come, ad esempio: • spettrometria ad assorbimento atomico (AAS) • Inductively coupled plasma-mass spectrometry) (ICP-MS)

Blibliografia e sitografia • Douglas A. Skoog, Donald M. West F. James Holler; Chimica analitica una introduzione; edizioni Edi. Ses • www. prweb. it • www. farmaciaunina. it (Appunti del corso del prof Caliendo Giuseppe; Dipartimento di chimica farmaceutica e tossicologica) • http: //dicasm. ing. unibo. it • www. chimicando. it • www. wikipedia. it