Corso Di CHIMICA ANALITICA II il titolo di






![Allora si opera in ambiente neutro, oppure si riduce [O 2] in soluzione aggiungendo Allora si opera in ambiente neutro, oppure si riduce [O 2] in soluzione aggiungendo](https://slidetodoc.com/presentation_image_h2/0a4f6233ad8a7bad7a794c62e55833c9/image-7.jpg)















- Slides: 22

Corso Di CHIMICA ANALITICA II

il “titolo” di H 2 O 2 nei prodotti commerciali rappresenta il contenuto di prodotto attivo ed è espresso in: volumi di O 2 (a 0°C e a 760 mm. Hg) ottenibili dalla decomposizione di H 2 O 2 presente in un volume unitario del prodotto commerciale. % in volume (grammi di H 2 O 2 in 100 ml soluzione) P. M. H 2 O 2 = 34. 02 1 equivalente di H 2 O 2 a quanti litri di O 2 a C. N. corrisponde? H 2 O 2 → H 2 O + ½ O 2 1 mole di O 2 a C. N. = 22. 4 litri ½ mole di O 2 a C. N. = 11. 2 litri 1 equivalente di H 2 O 2 darà 5. 6 litri di O 2. H 2 O 2 si conserva in polietilene perché la rugosità del vetro favorisce la decomposizione.

IODIMETRIA E IODOMETRIA Il sistema I 2 / 2 I- (E 0 = + 0. 535 V) può agire da ossidante o da riducente a seconda del potenziale del composto con cui reagisce. Titolazioni dirette: IODIMETRIA lo iodio ossidante Titolazioni indirette: IODOMETRIA lo ioduro riducente I 2 + 2 e � 2 I- Composti riducenti titolati con lo iodio: S 4 O 62 - + 2 H+ + 2 e- ⇆ 2 HS 2 O 3 - E 0 = + 0. 2 V S + 2 H+ + 2 e- ⇄ H 2 S E 0 = + 0. 142 V Sn 4+ + 2 e- ⇄ Sn 2+ SO 42 - + 4 H+ + 2 e- ⇄ H 2 SO 3 + H 2 O E 0 = + 0. 15 V E 0 = + 0. 172 V IODIMETRIA I 2 OSSIDANTE

2 I- �I 2 + 2 e I- RIDUCENTE Sistemi ossidanti rispetto allo ioduro: Mn. O 4 - + 8 H+ + 5 e- ⇄ Mn 2+ + 4 H 2 O E 0 = + 1. 51 V Cl 2 + 2 e- ⇄ 2 Cl- E 0 = + 1. 36 V Cr 2 O 72 - + 14 H+ + 6 e- ⇄ 2 Cr 3+ + 7 H 2 O E 0 = + 1. 33 V IODOMETRIA E I 2 / 2 I- è indipendente dal p. H per valori < 8; a p. H maggiori: I 2 + 2 OH- ⇄ IO - + I- + H 2 O e 3 IO- ⇄ IO 3 - + 2 I- (disproporzione) Lo iodio è scarsamente solubile, si opera in eccesso di I- che forma un complesso solubile I 3 - (I 2 + I- ⇄ I 3 -)

NOTA: i metodi iodimetrici e iodometrici sono caratterizzati dall’avere un indicatore molto sensibile a tracce di iodio (salda d’amido) oppure amido colloidale che assorbe I 3 quindi fissa in superficie tracce di iodio come I 3 - ed impartisce al colloide un colore BLU VIOLA che rivela una concentrazione di iodio pari a 2 ∙ 10 -5 M purché sia I- > 4 ∙ 10 -4 M. Nelle titolazioni iodometriche la salda d’amido va aggiunta in prossimità dell’equivalenza per evitare l’assorbimento troppo profondo di I 3 - che renderebbe il viraggio poco netto. Fattori che posso influenzare negativamente la sensibilità dell’indicatore: 1. Evitare alta temperatura (minore sensibilità dell’indicatore) 2. ambiente troppo acido (idrolisi dell’indicatore) 3. Presenza di solventi organici (ETANOLO AL 50%).

TITOLAZIONE: freddo, ambiente acquoso, relativamente acido. Il metodo più diffuso è la Iodometria (I- funziona da riducente). Il metodo si dice indiretto in quanto la soluzione di ioduro è trattata a p. H opportuno con l’ossidante in esame. Lo iodio liberato è titolato con adatto riducente (tiosolfato) in presenza di salda d’amido sino a scomparsa di colore. NOTA: se l’ambiente è troppo acido (es. quando è presente un sistema riducente come Mn. O 4 -, Cr 2 O 72 -) si può avere l’ossidazione dello ioduro da parte dell’O 2 dell’aria O 2 + 4 H+ + 4 e- 2 H 2 O E 0 = + 1. 231 Ossidazione dello ioduro da parte dell’O 2 dell’aria
![Allora si opera in ambiente neutro oppure si riduce O 2 in soluzione aggiungendo Allora si opera in ambiente neutro, oppure si riduce [O 2] in soluzione aggiungendo](https://slidetodoc.com/presentation_image_h2/0a4f6233ad8a7bad7a794c62e55833c9/image-7.jpg)
Allora si opera in ambiente neutro, oppure si riduce [O 2] in soluzione aggiungendo Na. HCO 3 che libera CO 2, sposta l’aria disciolta e diminuisce la p. O 2 nella fase gassosa. Si titola con una beuta a tappo smeriglio, avendo cura, dopo la titolazione (formazione di iodio) di sollevare poco il tappo e di lavarlo con una soluzione di KI per riportare in soluzione lo iodio che per la sua volatilità aveva aderito al tappo e alle pareti della beuta.

Preparazione della salda d’amido 5 gr di amido solubile sono stemperati in un mortaio con poca acqua distillata sino ad avere una pasta piuttosto fluida. Si versa la pasta cautamente in 1 litro di H 2 O bollente e si prosegue l’ebollizione per circa 1 minuto. Dopo raffreddamento al liquido (limpido) si aggiungono circa 0. 03 g di Hg. I 2 che impedisce la fermentazione dell’amido. (conservazione per qualche mese)

Preparazione soluzione di Na 2 S 2 O 3 ≈ 0. 1 N Il tiosolfato è facilmente ottenibile allo stato puro ma essendo efflorescente (Proprietà di un composto idrato di perdere l'acqua di cristallizzazione a contatto con l'aria) non può essere considerata sostanza madre. Na 2 S 2 O 3 ∙ 5 H 2 O Na 2 S 2 O 3 è un forte riducente ed ossidandosi dà prodotti S 4 O 62 -, SO 32 -, SO 42 -. Il potenziale S 4 O 62 - + 2 H+ + 2 e- ⇄ 2 HS 2 O 3 - a p. H = 0 è + 0. 2 V, per cui se l’ossidante ha un potenziale più alto del tiosolfato quest’ultimo può essere ossidato a tetrationato e lo I 2 è l’ossidante adatto (E 0 = + 0. 535). In ambiente molto acido lo S 2 O 32 - + H+ ⇄ HSO 3 - + S è instabile e reagisce con H+ (disproporzione) S 2 O 32 - + H+ ⇄ HS 2 O 3 - ⇄ HSO 3 - + S Teniamo conto delle reazioni di ossidazione che lo ione S 2 O 32 - e HSO 3 - danno con lo I 2.

2 S 2 O 32 - + I 2 ⇄ S 4 O 62 - + 2 I- (1) HSO 3 - + I 2 + H 2 O ⇄ HSO 4 - + 2 I- + 2 H+ (2) Quindi se S 2 O 32 - si decompone in HSO 3 - e S la sua normalità aumenta. Infatti nella reazione con I 2 il peso equivalente del tiosolfato è pari al peso molecolare, mentre il peso equivalente del bisolfito è la metà del peso molecolare. Es. una soluzione di S 2 O 32 - a normalità iniziale N in cui una parte X (eq / L) si trasforma in HSO 3 - si avrà: La normalità all’equilibrio sarà N–X+2 X=N+X

Si ha quindi un aumento del titolo ed un intorbidimento della soluzione dovuto ad S. In ambiente alcalino e luce diretta si ha l’ossidazione del tiosolfato da parte di O 2 dell’aria: S 2 O 32 - + 2 O 2 + H 2 O ⇄ 2 SO 42 - + 2 H+ Con conseguente diminuzione del titolo della soluzione.

Standardizzazione della soluzione di Na 2 S 2 O 3 circa 0. 1 N Il titolo di S 2 O 32 - è effettuato con I 2 ottenuto trattando un noto numero di equivalenti di un acido ossidante in soluzione acida per acido minerale con un eccesso di KI si può usare come sistema ossidante: KMn. O 4 titolato o K 2 Cr 2 O 7 o KIO 3 come sostanze madri. Con sostanze madri Reattivi: HCl, Na. HCO 3, KI, K 2 Cr 2 O 7 o KIO 3 puri Indicatore: salda d’amido Reazioni Cr 2 O 72 - + 6 I- + 14 H+ 3 I 2 + 2 Cr 3+ + 7 H 2 O Oppure: IO 3 - + 6 H+ + 5 I- 3 I 2 + 3 H 2 O • Il viraggio è blu → verde per il bicromato • Il viraggio è blu → incolore per lo iodato

TITOLAZIONE DI UN CAMPIONE DI RAME Titolazione di prova con permanganato In una beuta a tappo smeriglio da 250 m. L si versano 50 m. L di H 2 O distillata, 15 ml di H 2 SO 4 (1 : 4 v/v) e 0. 2 – 0. 3 grammi di Na. HCO 3. Terminato lo sviluppo gassoso si aggiunge un volume esattamente noto [25. 00 ml] di KMn. O 4 0. 100 N. Si lavano con poca acqua distillata le pareti della beuta, si introducono 5 - 6 grammi di KI e si chiude rapidamente il tappo. Dopo riposo al buio per 5 minuti si sfila il tappo lavandolo con un getto (usare una spruzzetta) di KI in soluzione (preparata di recente) al 10% e si titola rapidamente con la soluzione di tiosolfato sino a colore giallo – bruno. A questo punto si aggiungono 2 ml di salda d’amido e si titola lentamente fino a viraggio da blu – violaceo a incolore. 2 Mn. O 4 - + 10 I- + 16 H+ 2 Mn 2+ + 5 I 2 + 8 H 2 O I 2 + 2 S 2 O 32 - 2 I- + S 4 O 62 -

I 3 - + 2 e 3 I- Eo = 0. 536 V Cu 2+ + e- Cu+ Eo = 0. 153 V DI SEGUITO SI TITOLA IL CAMPIONE INCOGNITO DI RAME Le semireazioni da considerare per la determinazione iodometrica del rame (II) sono le seguenti: Cu 2+ + I- + e- Cu. I(S) E = 0. 82 V e I 3 - + 2 e- 3 IE = 0. 536 V La differenza dei potenziali standard (ΔE = 0. 284 V), come pure un eccesso di ioni ioduro, assicura la completezza della reazione: 2 Cu 2+ + 5 I- I 3 - + 2 Cu. I(S) Tale reazione, infatti ha una costante di equilibrio pari a 102. ΔE / 0. 059 = 102. 0. 284/0. 059 = 4. 2. 109

Procedimento Una quantità esattamente pesata (4. 4 – 4. 5 g) del campione, opportunamente omogeneizzato con la spatolina di osso nel contenitore, viene sciolto e portato a volume con acqua distillata in un matraccio tarato da 250 ml. Si prelevano quindi esattamente 50. 00 m. L e si introducono in beuta a tappo smeriglio da 250 m. L. Dopo diluizione a circa 150 ml si tratta goccia con NH 4 OH (1: 5 v/v) sino a intorbidamento persistente. Si aggiungono 5 m. L di CH 3 COOH concentrato e 5 grammi di KI. Si chiude la beuta e dopo cauta agitazione si pone al riparo dalla luce per circa 5 minuti.

Quindi, si sfila il tappo lavandolo con la soluzione di KI al 10% (p/v) contenuta nella spruzzetta e si titola con il tiosolfato fino al colore giallo paglierino. Si aggiungono 2 m. L di salda d’amido e si prosegue la titolazione fino a scomparsa del colore blu - violaceo e comparsa di un colore bianco-latte del Cu. I (s) precipitato. Si aggiungono 2 g di tiocianato di ammonio (NH 4 CNS), si agita e si completa la titolazione nel caso di ricomparsa della colorazione violacea. Il precipitato Cu. I, formatosi in presenza di un eccesso di ioduro, adsorbe I 3 CNS- si scambia con I 3 - �Cu. CNS (p. Ks = 12. 7) � Assorbe preferenzialmente CNS (p. Ks (Cu. I)=12) Calcolare % Cu nel campione incognito


La titolazione Karl Fischer è un il metodo principalmente utilizzato per la misura del contenuto di acqua in tutti i tipi di sostanze, compresi prodotti farmaceutici e alimentari. La determinazione del contenuto di acqua è estremamente importante poiché può influenzare la stabilità del principio attivo nei farmaci. Prima della titolazione di Karl Fischer la quantità di acqua veniva quantificata misurando il contenuto in acqua per essiccamento del campione in stufa; quest’ultima, tuttavia presenta alcuni svantaggi in quanto è particolarmente lunga dovendo il campione in esame rimanere in stufa fino a costanza di peso. Inoltre se nel campione sono presenti composti volatili anche essi vengono allontanati dal campione insieme all’acqua determinando un errore nella determinazione.




 Chimica analitica ambientale
Chimica analitica ambientale Soluzioni sovrasature
Soluzioni sovrasature Microsoft ismap
Microsoft ismap Domanda conseguimento titolo unito
Domanda conseguimento titolo unito Potere di fatto
Potere di fatto Acquisto a titolo derivativo
Acquisto a titolo derivativo Riforma del titolo v
Riforma del titolo v Titolo virale
Titolo virale I diritti reali
I diritti reali Usucapione
Usucapione Acquisto a titolo derivativo
Acquisto a titolo derivativo Titolo saggio breve
Titolo saggio breve Tesina terza media sui diritti
Tesina terza media sui diritti Segnale di rischio biologico
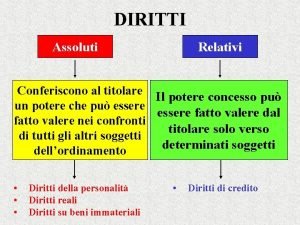
Segnale di rischio biologico Diritti assoluti
Diritti assoluti Titolo evento
Titolo evento Indice argomenti
Indice argomenti Contatto indiretto
Contatto indiretto Cromatografia fase inversa
Cromatografia fase inversa Passe as frases para voz passiva
Passe as frases para voz passiva Validazione analitica
Validazione analitica Frases na voz reflexiva
Frases na voz reflexiva Control de calidad microbiologico
Control de calidad microbiologico