CHAPITRE V SPECTROMETRIE DE MASSE I INTRODUCTION Cette





































- Slides: 65

CHAPITRE V SPECTROMETRIE DE MASSE

I - INTRODUCTION Cette technique est applicable pour des composés solides, liquides et gazeux. Elle permet : Détermination de la masse molaire Analyses structurales Explication des mécanismes de ruptures de liaisons… Analyses quantitatives : Limites de détection < nanogramme (parfois < picogramme)

APPLICATIONS PRATIQUES Biologie : Détermination de Masses molaires > 100000 (à 1 unité près) pour des macromolécules comme les proteïnes Etudes de pollution de l’environnement Détection de dopants chez les sportifs Sensibilité AVANTAGES DE LA TECHNIQUE Sélectivité Rapidité

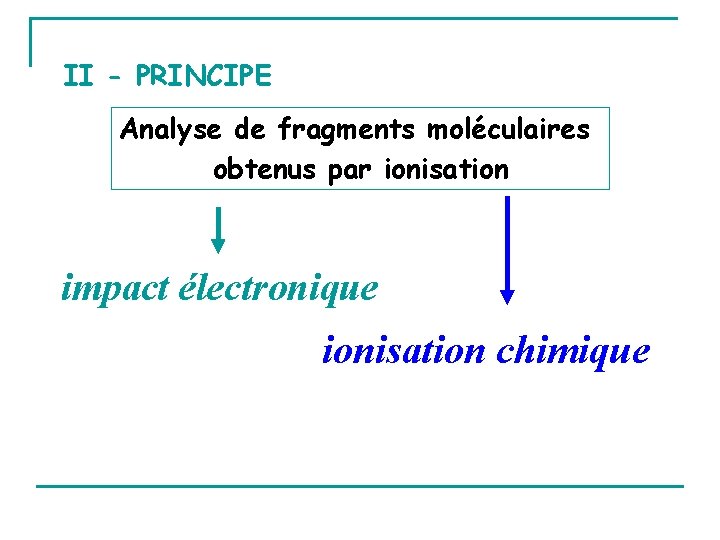
II - PRINCIPE Analyse de fragments moléculaires obtenus par ionisation impact électronique ionisation chimique

Ionisation : A-B-C + 1 e- A-B-C+. + 2 e. A-B-C+. : ion radical Fragmentations, radicaux ou molécules neutres Accélération des particules chargées par un champ électrique Déviation des particules chargées par un champ magnétique déviation proportionnelle à masse/charge : m/z Analyse : mesure de m/z de chaque fragment moléculaire Nombre d’ions ayant un m/z donné l’intensité du pic correspondant lié à

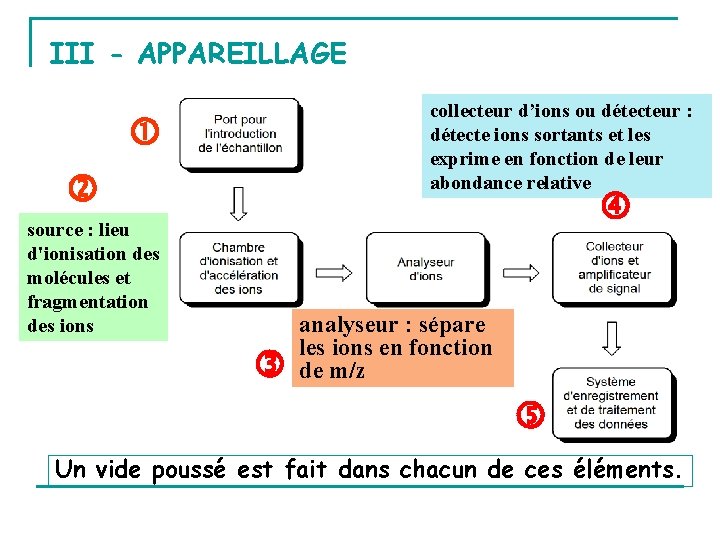
III - APPAREILLAGE collecteur d’ions ou détecteur : détecte ions sortants et les exprime en fonction de leur abondance relative source : lieu d'ionisation des molécules et fragmentation des ions analyseur : sépare les ions en fonction de m/z Un vide poussé est fait dans chacun de ces éléments.

III. 1 - Le système d'introduction de l’échantillon 1ère étape Introduction de l'échantillon dans la source d'ions GAZ et LIQUIDES VOLATILS A partir d’un ballon chauffé mis en communication avec source SOLIDES Tube avec filament + échantillon dissous dans un solvant organique et chauffé pour être vaporisé Echantillon dans la source : état gazeux

III. 2 - La source d’ions Plusieurs types selon le mode d'ionisation Le plus répandu : L'impact électronique Ionisation des molécules se fait dans la source. Source : chambre en acier inoxydable, ss vide ≈ 6. 10 -7 mm. Hg Electrons dans la source sont émis par un filament en rhénium, accélérés ss tension de 70 Volts Collisions entre molécules et électrons se font à 70 e. V : très énergétiques

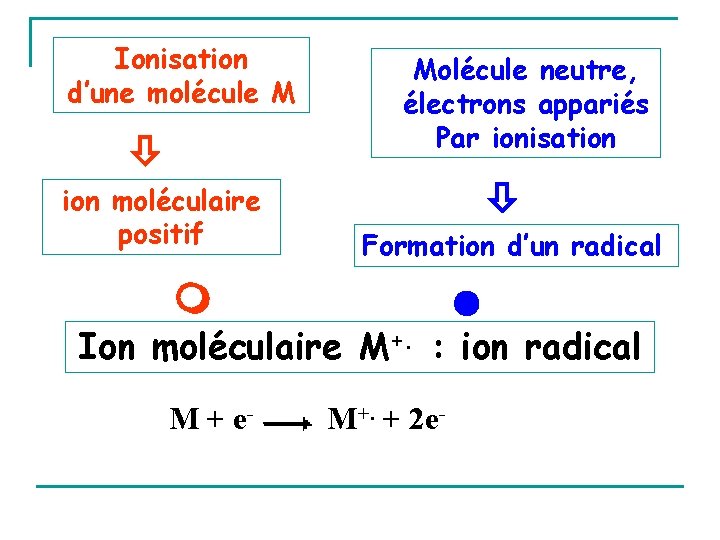
Ionisation d’une molécule M ion moléculaire positif Molécule neutre, électrons appariés Par ionisation Formation d’un radical Ion moléculaire M+. : ion radical M + e- M+. + 2 e-

Energie d’ionisation des molécules = 6 -12 e. V Energie des électrons accélérés = 70 e. V Excès d'énergie : sous forme d’énergie interne Fragmentation de l’ion moléculaire ou ion parent ions fils ou fragments

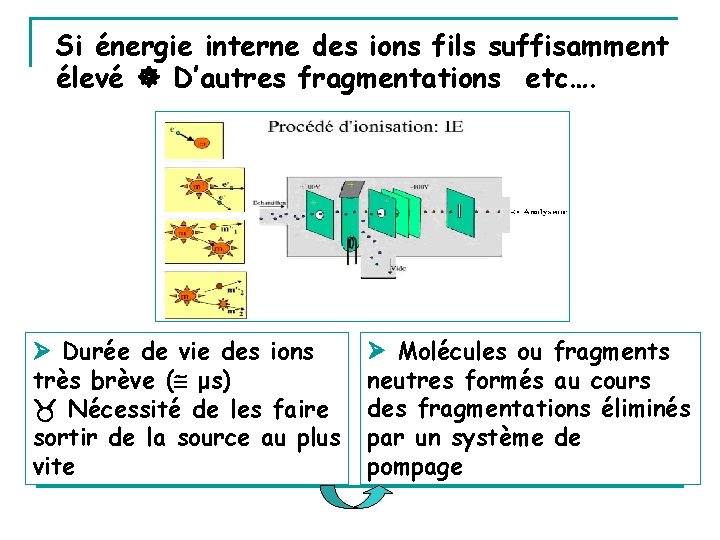
Si énergie interne des ions fils suffisamment élevé D’autres fragmentations etc…. Durée de vie des ions très brève ( μs) Nécessité de les faire sortir de la source au plus vite Molécules ou fragments neutres formés au cours des fragmentations éliminés par un système de pompage

III. 3 - Analyseur ou séparateur d’ions Ions positifs sont extraits de la source et focalisés vers le secteur analyseur de masse (ou séparateur d’ions). Trie des ions suivant m/z (en général, z = 1) Plusieurs types de séparateurs d’ions : - Séparateur à champ magnétique - Séparateur par champs électrique et magnétique - Séparateur par des champs électriques (Quadripôle) - Séparateur par des champs électriques (Trappe d’ions) - Séparateur par la vitesse des ions (Temps de vol)

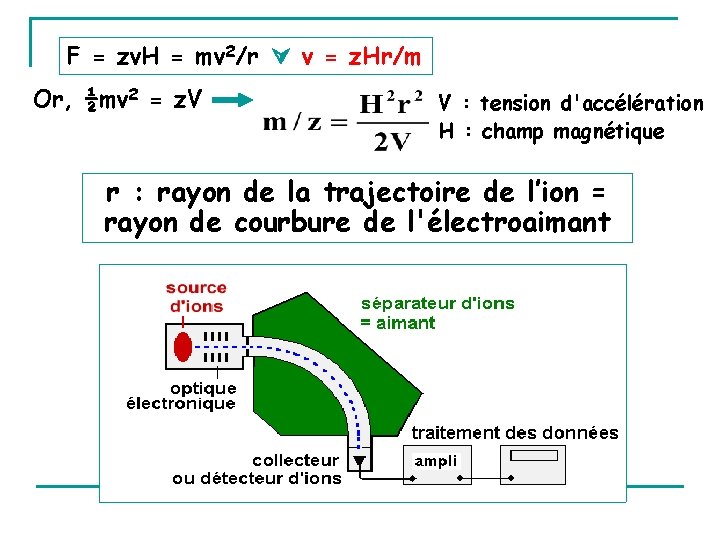
Cas d’un séparateur à champ magnétique Ion de masse m et de charge z accéléré dans la source sous une ddp = V A la sortie de la source, l’ion a une vitesse v et une énergie : Ecinétique = ½ mv 2 = z. V (énergie cinétique = énergie potentielle)

Dans un champ magnétique H : Application de la Loi de Laplace Ions de charge z et de vitesse v H subissent une force d’origine magnétique, s’équilibrant avec la force centrifuge : F = zv. H = mv 2/r v = z. Hr/m

F = zv. H = mv 2/r v = z. Hr/m Or, ½mv 2 = z. V V : tension d'accélération H : champ magnétique r : rayon de la trajectoire de l’ion = rayon de courbure de l'électroaimant

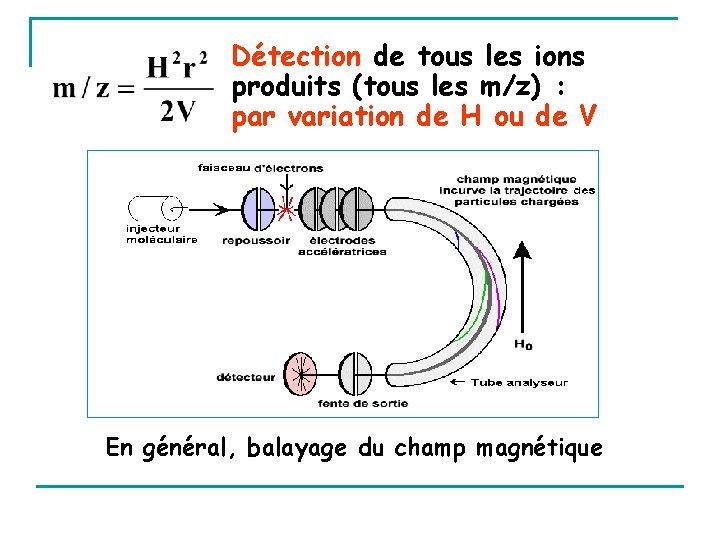
Détection de tous les ions produits (tous les m/z) : par variation de H ou de V En général, balayage du champ magnétique

III. 4 - Le collecteur d’ions Effet multiplicateur d’électrons Tubes en forme de corne placés sous haute tension (1 à 3 k. V) Ion entrant dans le collecteur émission secondaire de plusieurs électrons phénomène d’émission en cascade courant d’électrons appréciable détecté à la sortie du collecteur

III. 5 - Le système de traitement des données Les spectromètres de masse sont pilotés par un ordinateur. Opérations : a - Réglage et calibrage du spectromètre b - Acquisition et stockage des données c - Traitement des données et recherche dans les banques de spectres

IV - SPECTRE DE MASSE A la sortie du détecteur, on collecte les ions : - chargés positivement - vérifiant la condition (r : rayon de courbure de l'électroaimant) pic à une valeur m/z sur le spectre de masse

SPECTRE DE MASSE = Diagramme abscisse : m/z (en impact électronique, z presque toujours égale à 1) ordonnée : intensité abondance relative des ions Intensité du pic le plus intense du spectre : fixée arbitrairement à 100

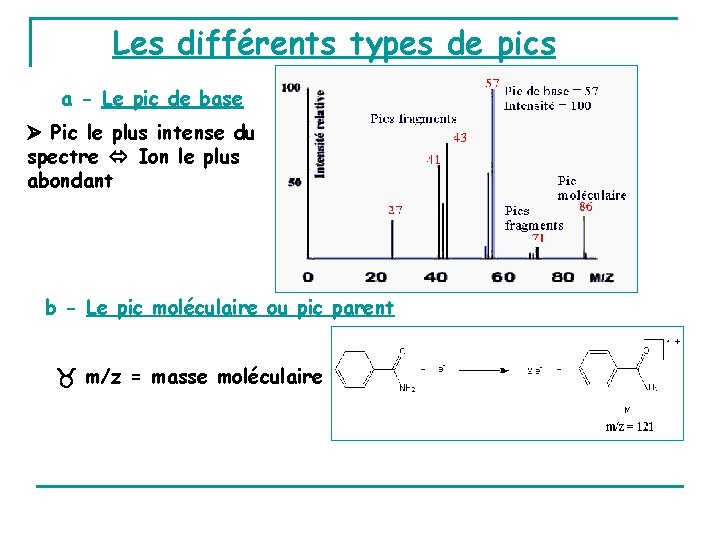
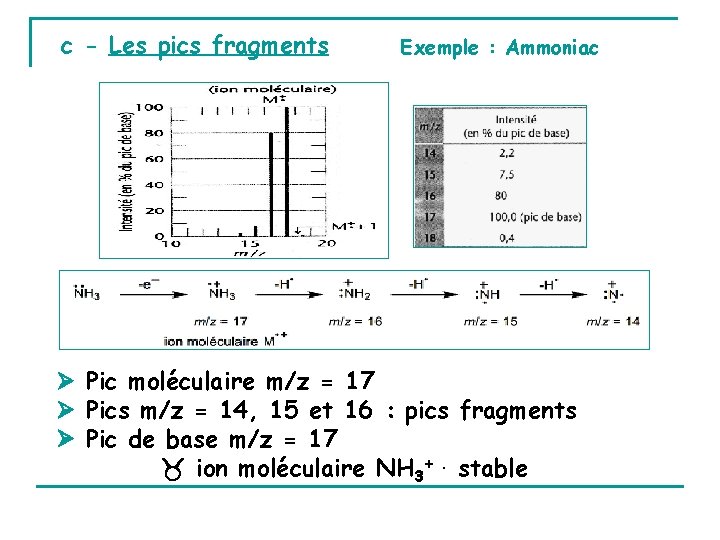
Les différents types de pics a - Le pic de base Pic le plus intense du spectre Ion le plus abondant b - Le pic moléculaire ou pic parent m/z = masse moléculaire

c - Les pics fragments Exemple : Ammoniac Pic moléculaire m/z = 17 Pics m/z = 14, 15 et 16 : pics fragments Pic de base m/z = 17 ion moléculaire NH 3+. stable

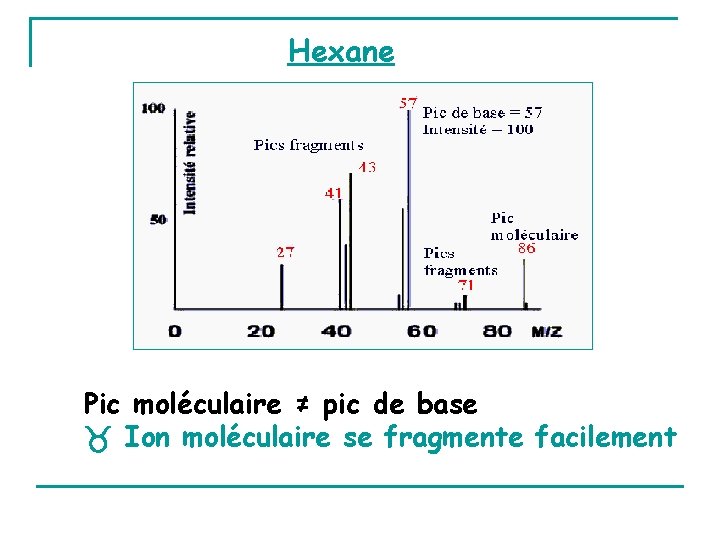
Hexane Pic moléculaire ≠ pic de base Ion moléculaire se fragmente facilement

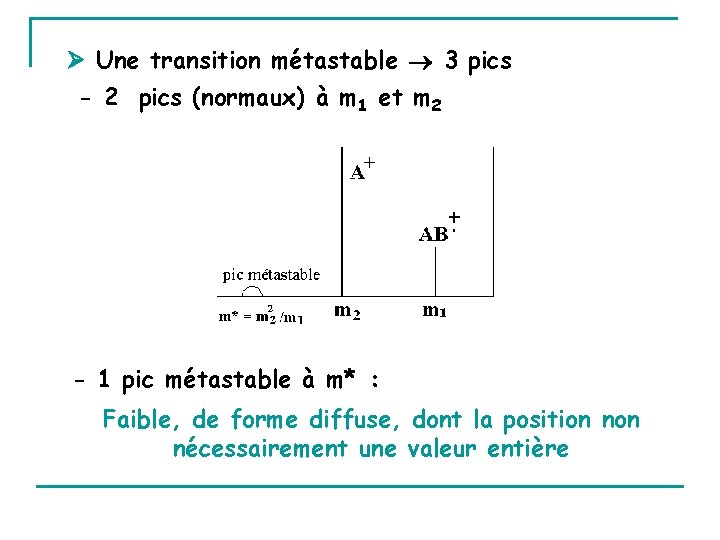
d - Le pic d’ion métastable Conditions normales : Ion moléculaire (ou fragment) formé dans la source est suffisamment stable pour atteindre le détecteur. pic sur la spectre Si durée de vie < qq μs ion métastable Ion métastable : se décompose en partie sur le trajet

Ion métastable : se décompose en partie sur le trajet AB+. A+ + B. Si la décomposition de AB+. (de masse m 1) a lieu entre source et analyseur Ion A+ (masse m 2) donne une trace sur le spectre à une masse apparente m* : m* = m 22/m 1 m* ≠ masse réélle

Une transition métastable 3 pics - 2 pics (normaux) à m 1 et m 2 - 1 pic métastable à m* : Faible, de forme diffuse, dont la position nécessairement une valeur entière

V - ANALYSE SPECTRALE Selon deux étapes Exploitation de l’ion moléculaire : masse moléculaire, parité, isotopes, masse exacte. . . Exploitation des ions fragments : détermination de la structure de la molécule

V. 1 - Masse moléculaire Masse de l’ion moléculaire = somme des masses des isotopes les plus abondants (12 C, 1 H, 16 O, . . ) des éléments présents dans la molécule. - Méthane 12 C 1 H 4: ion moléculaire à m/z = 16 - Benzamide C 7 H 7 NO Ion moléculaire M+. m/z = 121 7 x 12 C = 84 7 x 1 H = 7 1 x 14 N = 14 1 x 16 O = 16 M = 121 La spectrométrie de masse permet de déterminer la masse moléculaire d’une substance inconnue.

V. 2 - Parité de l’ion moléculaire REGLE DE LA PARITE Si le pic parent a une masse impaire La molécule contient un nombre impair d’éléments trivalents (N, P…) : Cx. Hy. Oz. Nw (w =1, 3, 5…) Exemple : Benzamide C 7 H 7 NO m/z = 121 Nombre d’atomes d’azote : 1 (impair).

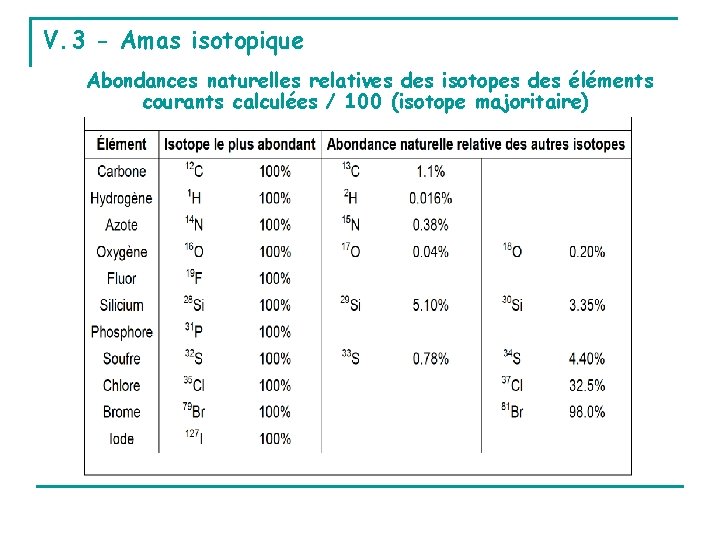
V. 3 - Amas isotopique Abondances naturelles relatives des isotopes des éléments courants calculées / 100 (isotope majoritaire)

Isotopes de faible abondance-Cas du carbone Exemple : CH 4 13 C 1 H 4 12 C 2 H 1 H 3 13 C 2 H 1 H 3 m/z = 17 m/z = 18 pic pic M + 1 M + 2 ……. Ces différents pics = Amas isotopique Intensités relatives des pics de l’amas isotopique selon abondance naturelle des différents isotopes de l’élément

Pic M+1 : * 13 C 1 H 4 : Abondance isotopique du carbone 13 = 1, 1% intensité du pic M+1 ≈ 1, 1% de celle du pic M (12 C ) 12 C 2 H 1 H 2 H = 0, 016% : Abondance isotopique du 3

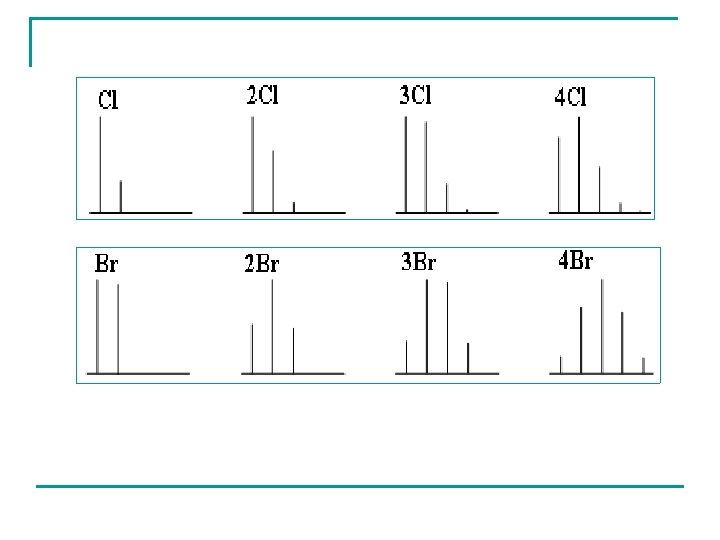
Nombre et intensités relatives des pics de l’amas isotopique RELATION (a+b)n a : abondance relative de l’isotope le plus léger b : abondance relative de l’isotope le plus lourd prise égale à l’unité n : nombre d’atomes de l’élément considéré

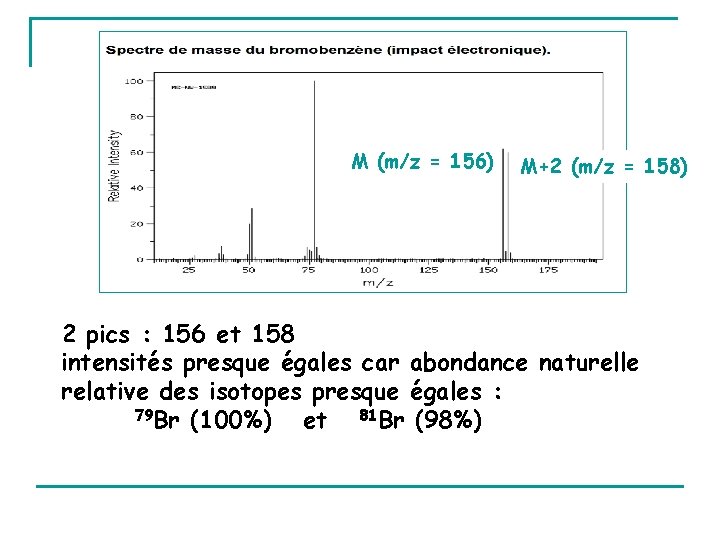
Isotopes d’abondance considérable Cas du chlore et du brome Isotope lourd (+2) est abondant Si la molécule contient n halogènes, l’intensité des pics de l’amas isotopique est donnée par la relation (a+b)n. Exemple 1 : CH 3 Br 79 Br: 100% a=1 81 Br: 98% b=1 (a+b)1 = a + b 1 1 M M+2 Amas isotopique : 2 pics M et M+2 d’intensité relative 1: 1

M (m/z = 156) M+2 (m/z = 158) 2 pics : 156 et 158 intensités presque égales car abondance naturelle relative des isotopes presque égales : 79 Br (100%) et 81 Br (98%)

Exemple 2 : CH 2 Cl 2 M = 84 35 Cl : 100% 37 Cl : 32, 5% a = 3 b = 1 (a+b)2 = a 2 + 2 ab + b 2 9 6 1 M M+2 M+4 3 pics M, M+2 et M+4 intensités relatives 9: 6: 1


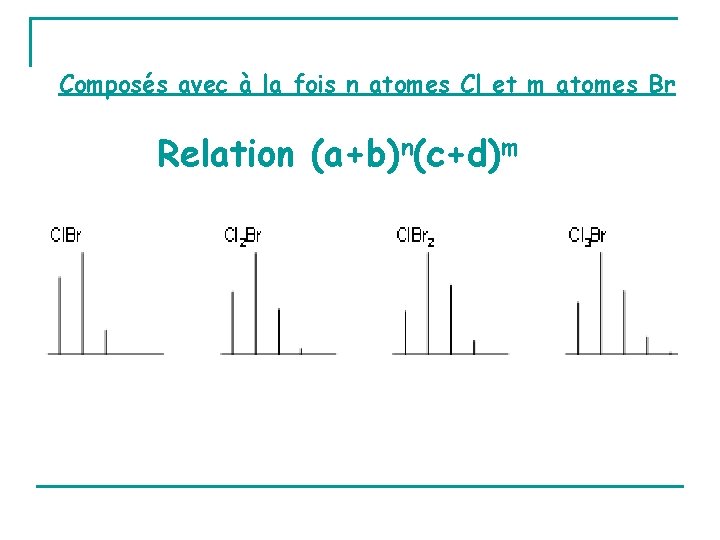
Composés avec à la fois n atomes Cl et m atomes Br Relation (a+b)n(c+d)m

V. 4 - Les fragmentations Analyse d'un spectre de masse - masse moléculaire formule brute mesure des rapports isotopiques d’un élément structure moléculaire En effet, les modes de fragmentation dépendent des groupes fonctionnels de la molécule

V. 4. 1 - Règles de base 3 facteurs favorisent le processus de fragmentation : Les liaisons faibles se coupent plus facilement. Les fragments stables se forment préférentiellement. Les fragmentations avec réarrangement sont favorisées par l’aptitude de certaines molécules ionisées à donner un état transitoire à six centres.

1ère étape Ionisation d’une molécule M = expulsion d’un électron d’une liaison ou d’un doublet libre : M + 1 e- M+. + 2 e. Hétéroatomes ionisation préférentielle sur l’un d’eux charge localisée sur l’hétéroatome En général, charge non localisée utilistion de crochets [ ]

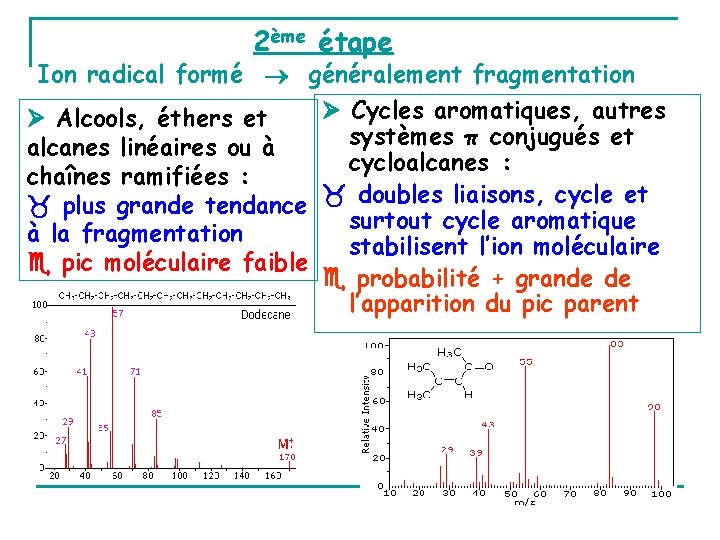
2ème étape Ion radical formé généralement fragmentation Cycles aromatiques, autres Alcools, éthers et systèmes π conjugués et alcanes linéaires ou à cycloalcanes : chaînes ramifiées : plus grande tendance doubles liaisons, cycle et surtout cycle aromatique à la fragmentation stabilisent l’ion moléculaire pic moléculaire faible probabilité + grande de l’apparition du pic parent

V. 4. 2 - Modes de fragmentation Probabilité de rupture d’une liaison est fonction de l’énergie de cette liaison et de la stabilité des ions formés Ruptures des liaisons sont : - simples - en α - avec réarrangement …

V. 4. 2. 1 - Ruptures simples Rupture simple = rupture d’une liaison σ A partir d’un ion radical, une rupture simple donne ion + radical Exemple : propane clivage de deux façons Fragmentation donnant m/z = 29 préférentielle Formation d’un cation plus stable pic à m/z = 29 plus intense que celui à m/z = 15

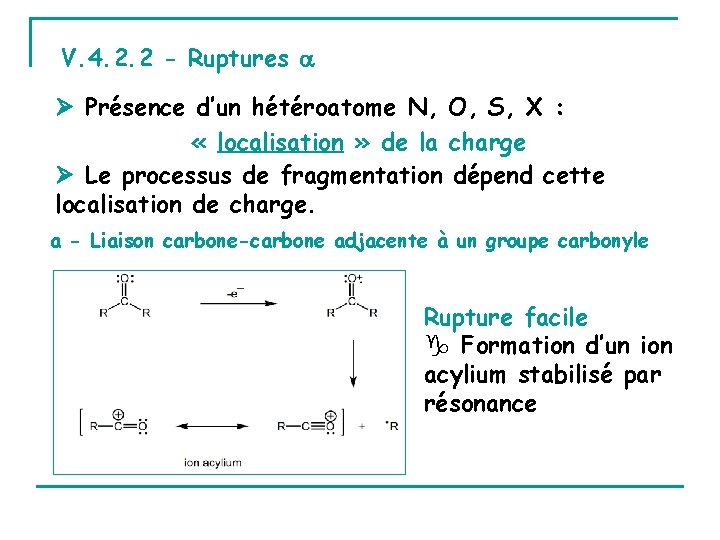
V. 4. 2. 2 - Ruptures Présence d’un hétéroatome N, O, S, X : « localisation » de la charge Le processus de fragmentation dépend cette localisation de charge. a - Liaison carbone-carbone adjacente à un groupe carbonyle Rupture facile g Formation d’un ion acylium stabilisé par résonance

Généralement Molécule R-CO-R’ (cétone, acide, ester…) : 4 ions fragments RCO+ R’CO+ R+ + et R’+ Fragments R R’+ minoritaires

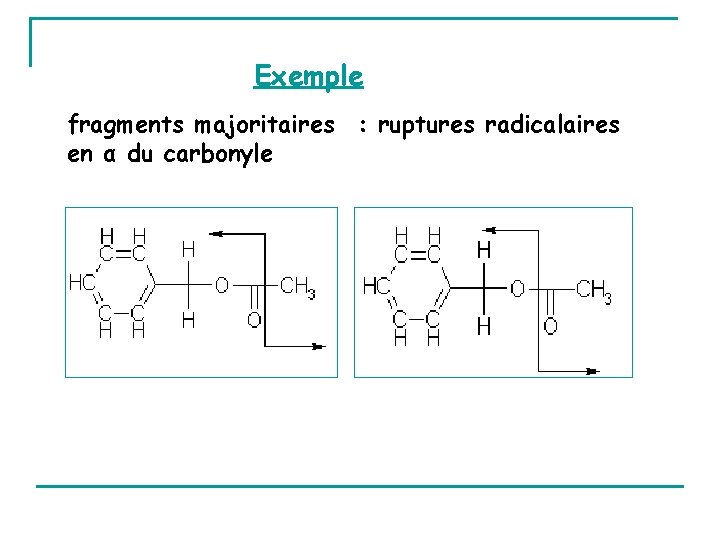
Exemple fragments majoritaires : ruptures radicalaires en α du carbonyle

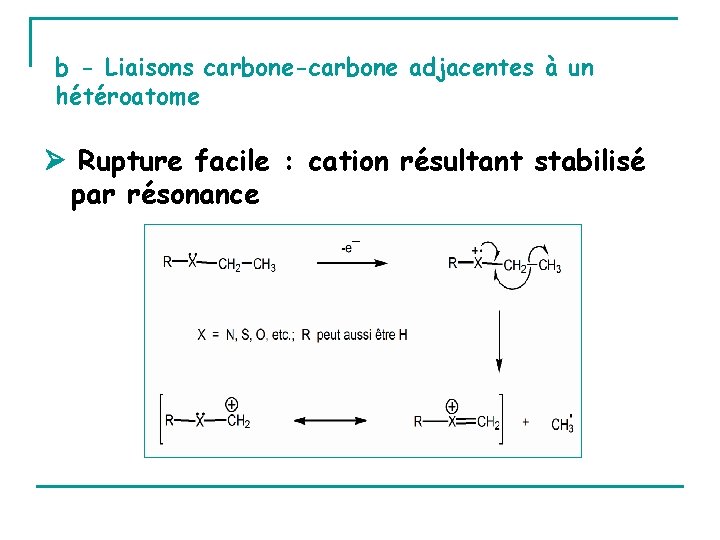
b - Liaisons carbone-carbone adjacentes à un hétéroatome Rupture facile : cation résultant stabilisé par résonance

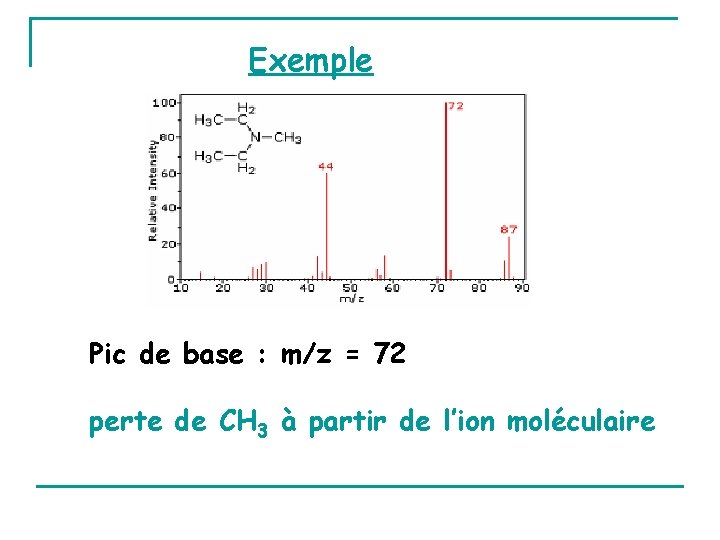
Exemple Pic de base : m/z = 72 perte de CH 3 à partir de l’ion moléculaire

V. 4. 2. 3 - Ruptures avec réarrangement Certains pics ne peuvent être attribués à une fragmentation simple ORIGINE : Recombinaison de certains ions fragments pics de réarrangement Réarrangement = fragmentation complexe A la fois rupture et création de liaisons Fragmentations avec réarrangement favorisées par Etat transitoire à 6 centres

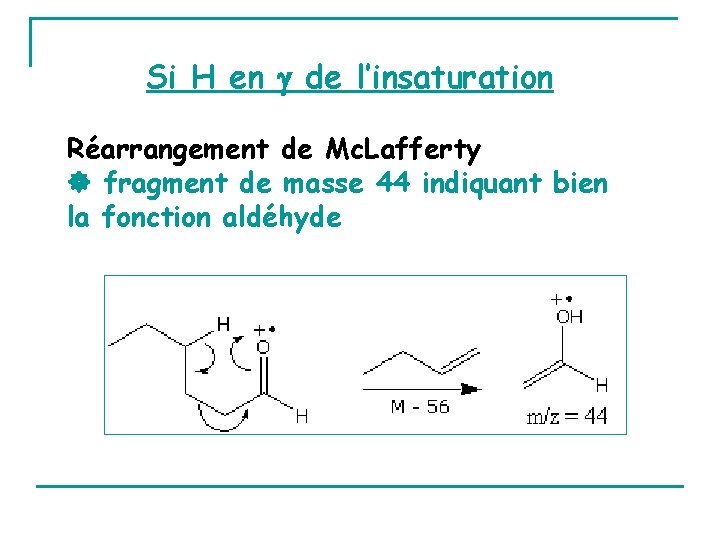
a - Réarrangement de Mc. Lafferty Pour des ions comportant une liaison C=O ou C=C avec existence d’un H en de l’insaturation Exemple Transfert de H sur le site ionisé par l’intermédiaire d’un mécanisme à six centres Elimination d’une molécule neutre d’éthylénique Formation d’un nouveau cation radical

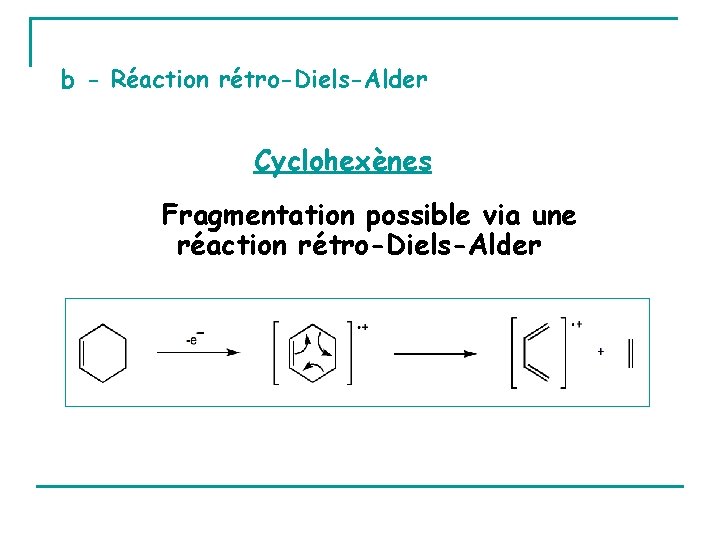
b - Réaction rétro-Diels-Alder Cyclohexènes Fragmentation possible via une réaction rétro-Diels-Alder

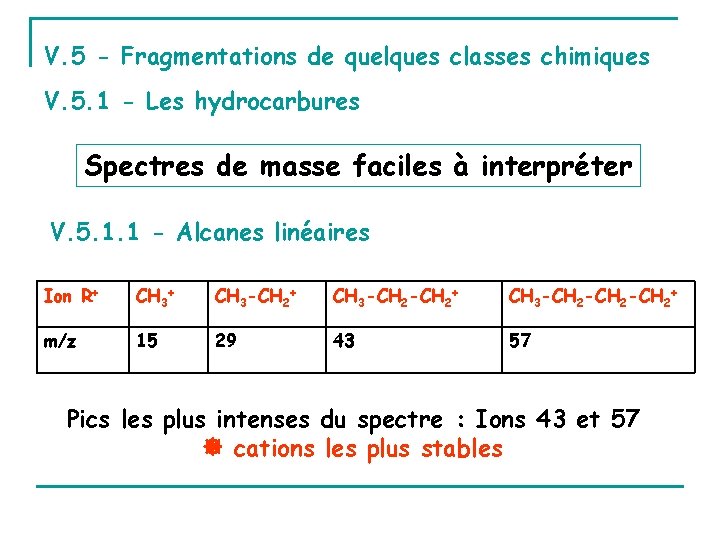
V. 5 - Fragmentations de quelques classes chimiques V. 5. 1 - Les hydrocarbures Spectres de masse faciles à interpréter V. 5. 1. 1 - Alcanes linéaires Ion R+ CH 3 -CH 2+ CH 3 -CH 2 -CH 2+ m/z 15 29 43 57 Pics les plus intenses du spectre : Ions 43 et 57 cations les plus stables

Cas de l’hexane : Pic parent à m/z = 86

V. 5. 1. 2 - Alcanes ramifiés Ramification plus grande probabilité de clivage à l’embranchement Carbocation plus substitué + stable Cas du néopentane Pic parent absent sur le spectre Ion moléculaire se fragmente rapidement carbocation tertiaire stable

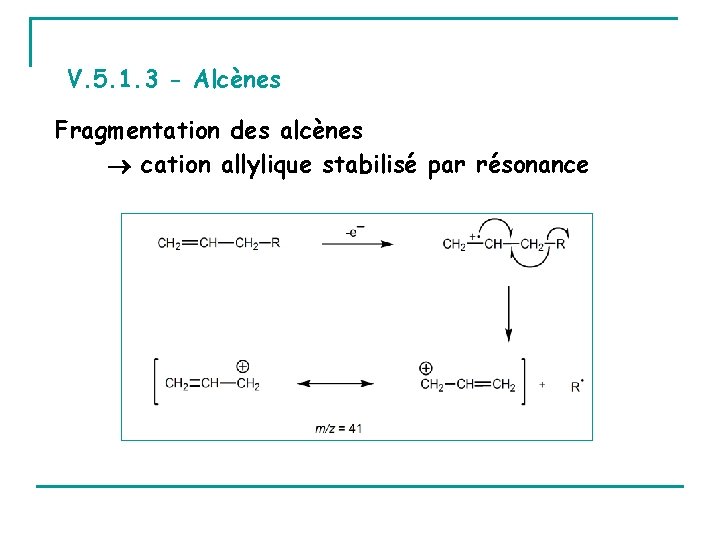
V. 5. 1. 3 - Alcènes Fragmentation des alcènes cation allylique stabilisé par résonance

V. 5. 1. 4 - Composés benzéniques Spectres de masse facilement interprétables Pic parent toujours important : ion moléculaire fortement stabilisé pour le cycle aromatique

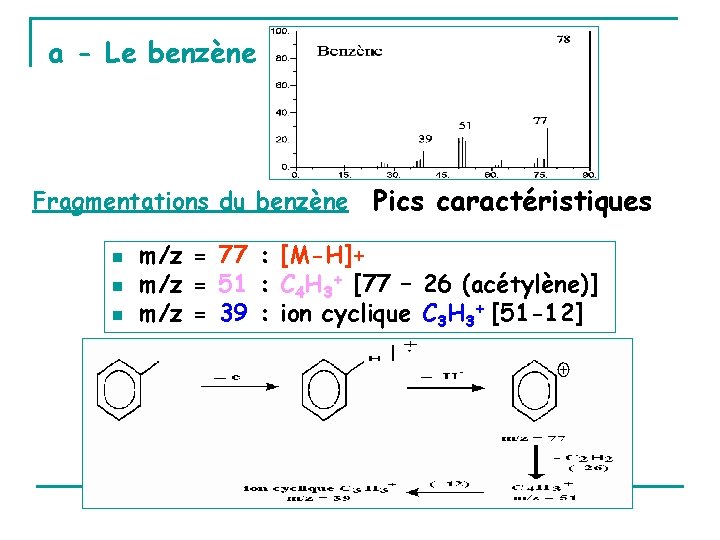
a - Le benzène Fragmentations du benzène n n n Pics caractéristiques m/z = 77 : [M-H]+ m/z = 51 : C 4 H 3+ [77 – 26 (acétylène)] m/z = 39 : ion cyclique C 3 H 3+ [51 -12]

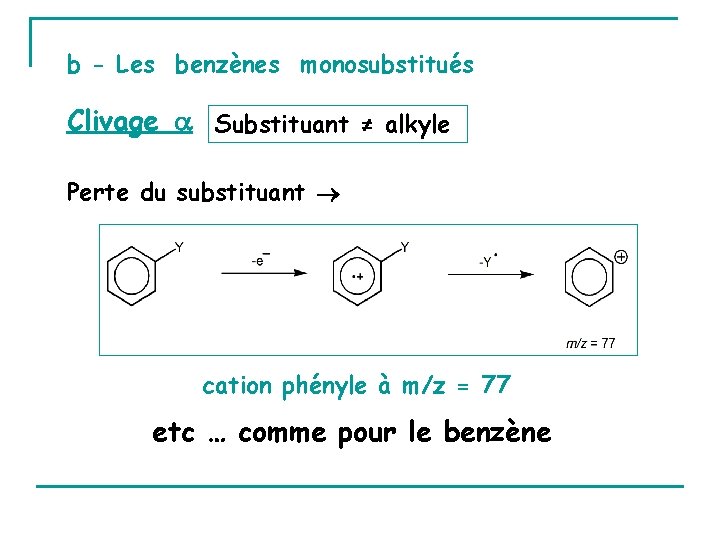
b - Les benzènes monosubstitués Clivage Substituant ≠ alkyle Perte du substituant cation phényle à m/z = 77 etc … comme pour le benzène

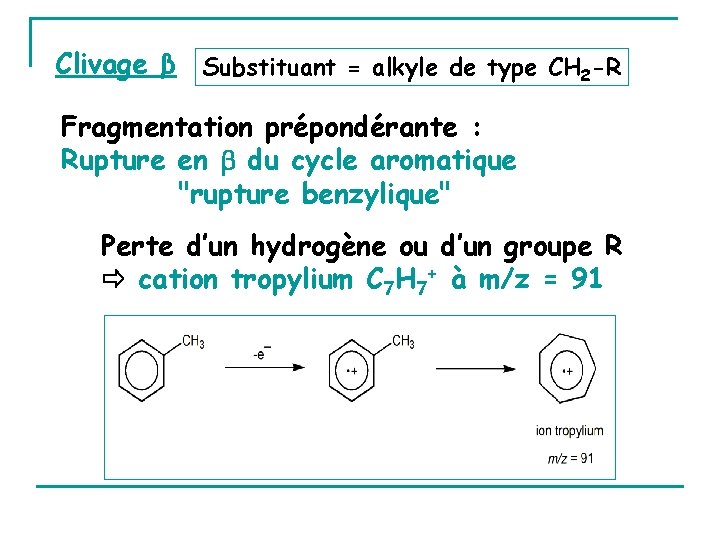
Clivage β Substituant = alkyle de type CH 2 -R Fragmentation prépondérante : Rupture en du cycle aromatique "rupture benzylique" Perte d’un hydrogène ou d’un groupe R cation tropylium C 7 H 7+ à m/z = 91

V. 5. 1. 5 - Alcools Pic parent souvent faible Fragmentation la plus importante : perte d’un groupe alkyle, préférentiellement le plus volumineux

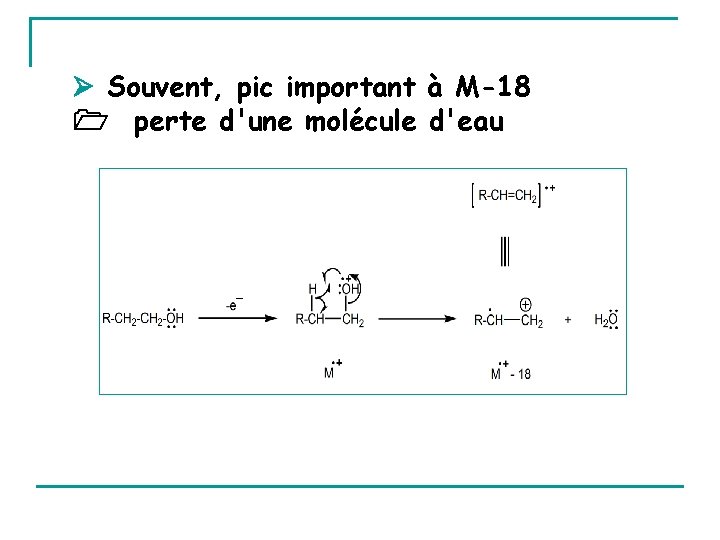
Souvent, pic important à M-18 perte d'une molécule d'eau

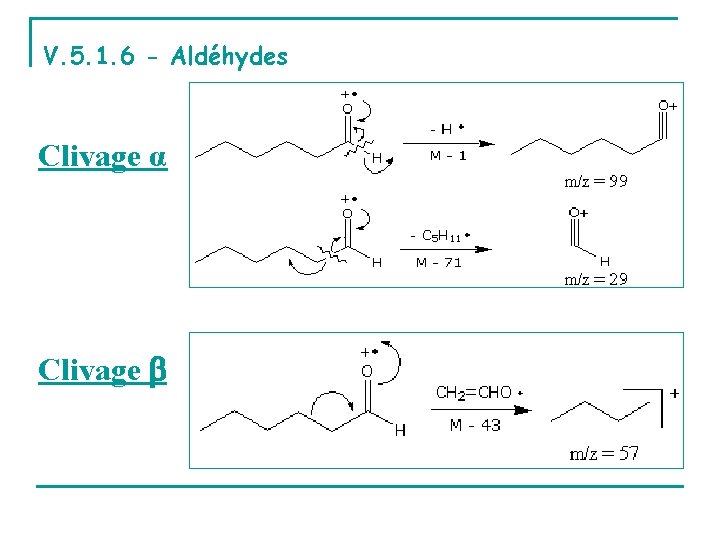
V. 5. 1. 6 - Aldéhydes Clivage α Clivage

Si H en de l’insaturation Réarrangement de Mc. Lafferty fragment de masse 44 indiquant bien la fonction aldéhyde

 Spectrométrie atomique
Spectrométrie atomique Fotomultiplier
Fotomultiplier Petit prince chapitre 24
Petit prince chapitre 24 Lecture analytique petit pays chapitre 30
Lecture analytique petit pays chapitre 30 Tirez pas sur le scarabée fiche de lecture
Tirez pas sur le scarabée fiche de lecture Petit prince résumé
Petit prince résumé Carel struycken taille
Carel struycken taille Calligramme vague
Calligramme vague J'ai cueilli cette fleur pour toi sur la colline
J'ai cueilli cette fleur pour toi sur la colline Schloss rantzenburg
Schloss rantzenburg A quoi sert une chanson si elle est désarmée the voice
A quoi sert une chanson si elle est désarmée the voice Que peut-on dire de cette situation ?
Que peut-on dire de cette situation ? Cette
Cette Demonstrative pronouns in french
Demonstrative pronouns in french Dans cette maison
Dans cette maison Prends cette rose aimable comme toi
Prends cette rose aimable comme toi Présentation pour l'école du sabbat
Présentation pour l'école du sabbat Que représente cette image
Que représente cette image Allez vous en sur les places et sur les parvis
Allez vous en sur les places et sur les parvis Question burger quiz nuggets
Question burger quiz nuggets Frazao torquato
Frazao torquato Quelle est cette montagne
Quelle est cette montagne Pourquoi cette question
Pourquoi cette question Durant cette semaine
Durant cette semaine Bilan de masse
Bilan de masse Masse salariale
Masse salariale Pyramide de masse
Pyramide de masse Masse atomique
Masse atomique Diagramma delle masse
Diagramma delle masse Sonnendurchmesser in km
Sonnendurchmesser in km Etalage de selection
Etalage de selection Formule densité
Formule densité Tableau de conversion volume litre masse
Tableau de conversion volume litre masse Masse atomique
Masse atomique Masse linéique acier
Masse linéique acier Masse linéique acier
Masse linéique acier What is the molar mass of calcium phosphate
What is the molar mass of calcium phosphate Masse volumique
Masse volumique Alessandro masse
Alessandro masse Ponderation kunst definition
Ponderation kunst definition Masseprocent
Masseprocent Confine tra due masse d'aria
Confine tra due masse d'aria La nazionalizzazione delle masse
La nazionalizzazione delle masse Masa molara
Masa molara Reazione acqua
Reazione acqua Enlarged spleen self test
Enlarged spleen self test Masse osseuse
Masse osseuse Tableau kg
Tableau kg La masse effective
La masse effective Unite masse molaire
Unite masse molaire Dcl physique
Dcl physique Masse vs poids
Masse vs poids Spectroscopie de masse
Spectroscopie de masse Relation densité
Relation densité La nazionalizzazione delle masse
La nazionalizzazione delle masse Levee en masse pronunciation
Levee en masse pronunciation Matthieu chapitre 3
Matthieu chapitre 3 Jean chapitre 8
Jean chapitre 8 Jean chapitre 5
Jean chapitre 5 Jean chapitre 6
Jean chapitre 6 Route de chlifa résumé
Route de chlifa résumé Maria chapdelaine résumé par chapitre
Maria chapdelaine résumé par chapitre Analyse chapitre 49 le dernier jour d'un condamné
Analyse chapitre 49 le dernier jour d'un condamné Chapitre xxvi le dernier jour d'un condamné
Chapitre xxvi le dernier jour d'un condamné Qui est le friauche dans le dernier jour d'un condamné
Qui est le friauche dans le dernier jour d'un condamné Le roi le petit prince
Le roi le petit prince