UNIVERZITET U NOVOM SADU PRIRODNOMATEMATIKI FAKULTET DEPARTMAN ZA

























- Slides: 41

UNIVERZITET U NOVOM SADU PRIRODNO-MATEMATIČKI FAKULTET DEPARTMAN ZA HEMIJU UVOD U ORGANSKU HEMIJU II

IZOMERIJA ORGANSKIH JEDINJENJA

IZOMERI 1. Jedinjenja sa istim brojem i vrstom atoma u molekulu, ili različitim vrstama, vezama i položajima funkcionalnih grupa u molekulu – STRUKTURNI IZOMERI 2. Jedinjenja sa različitim rasporedom atomskih grupa u krutim sistemima – GEOMETRIJSKI IZOMERI 3. Jedinjenja sa različitim rasporedom supstituenata na hiralnim C atomima – OPTIČKI IZOMERI

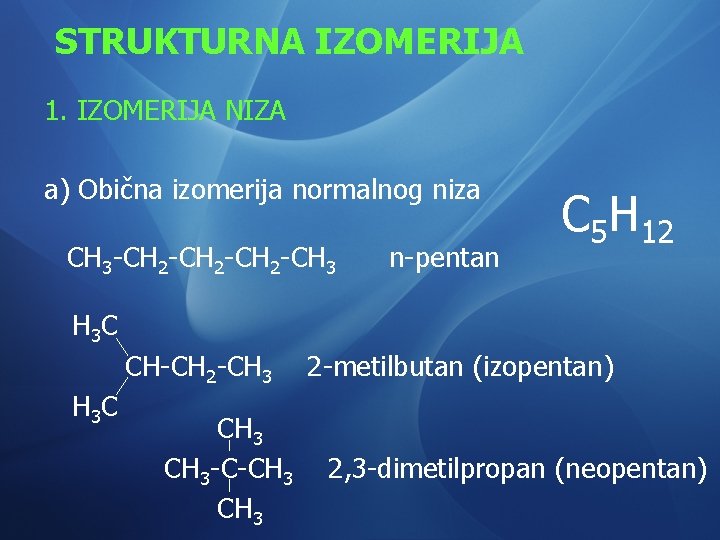
STRUKTURNA IZOMERIJA 1. IZOMERIJA NIZA a) Obična izomerija normalnog niza CH 3 -CH 2 -CH 3 n-pentan C 5 H 12 H 3 C CH-CH 2 -CH 3 C CH 3 -C-CH 3 2 -metilbutan (izopentan) 2, 3 -dimetilpropan (neopentan)

STRUKTURNA IZOMERIJA b) Izomerija bočnog niza kod aromatičnih jedinjenja 1, 2 -dimetilbenzen (o-ksilen) 1, 3 -dimetilbenzen (m-ksilen) C 8 H 10 1, 4 -dimetilbenzen (p-ksilen)

STRUKTURNA IZOMERIJA C 9 H 12 propilbenzen 1 -metil-3 etilbenzen etil-(2 -metil)-benzen 1 -metil-2 -etilbenzen 1, 2, 3 -trimetilbenzen 1, 2, 4 -trimetilbenzen 1, 3, 5 -trimetilbenzen (vicinalni) (asimetrični) (simetrični)

STRUKTURNA IZOMERIJA c) Izomerija prstena cikloheksan C 6 H 12 metilciklopentan

STRUKTURNA IZOMERIJA 2. IZOMERIJA POLOŽAJA a) Izomerija funkcionalnih grupa CH 3 -CHOH-CH 2 -COOH 4 -hidroksipentanska kiselina ( - hidroksipentanska kiselina) CH 3 -CH 2 -CHOH-CH 2 -COOH 3 -hidroksipentanska kiselina ( - hidroksipentanska kiselina) b) Izomerija dvostruke i trostruke veze CH 2=CH-CH 2 -CH 3 -CH=CH-CH 3 1 -buten 2 -buten

STRUKTURNA IZOMERIJA c) Izomerija supstituenata orto vicinalni meta asimetrični para simetrični

STRUKTURNA IZOMERIJA 3. IZOMERIJA FUNKCIONALNIH GRUPA a) Kiseline i estri CH 3 -COOH HCOOCH 3 b) Alkoholi i etri CH 3 -CH 2 OH CH 3 -O-CH 3 c) Aldehidi i ketoni CH 3 -CH 2 CHO CH 3 -CO-CH 3 d) 10, 20 i 30 amini CH 3 -CH 2 -NH 2 CH 3 CH 2 NHCH 3 N(CH 3)3 e) Monohidroksikiseline i hidroksialdehidi CH 3 -CHOH-COOH CH 2 OH-CHO

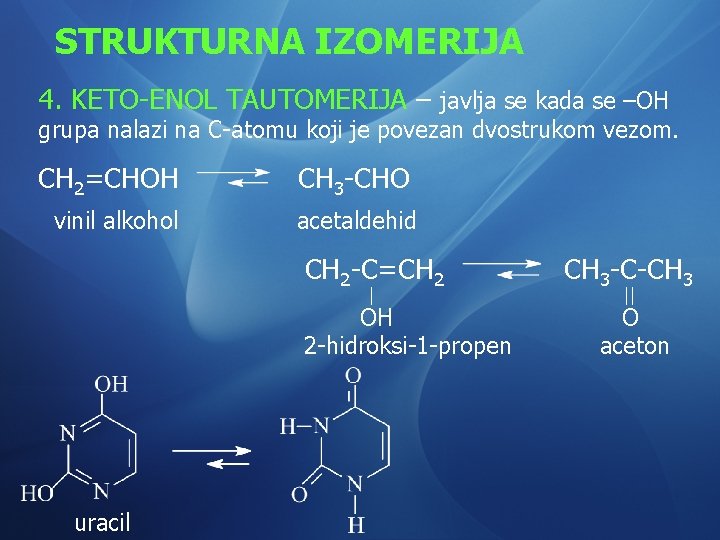
STRUKTURNA IZOMERIJA 4. KETO-ENOL TAUTOMERIJA – javlja se kada se –OH grupa nalazi na C-atomu koji je povezan dvostrukom vezom. CH 2=CHOH vinil alkohol CH 3 -CHO acetaldehid CH 2 -C=CH 2 OH 2 -hidroksi-1 -propen uracil CH 3 -C-CH 3 O aceton

• Ako je izomerija posledica različitog prostornog rasporeda atoma u molekulu tj. izomeri imaju istu strukturu, a različite perspektivne formule radi se o PROSTORNOJ IZOMERIJI ili STEREOIZOMERIJI. • Stereoizomerija može biti: • Geometrijska • Optička izomerija

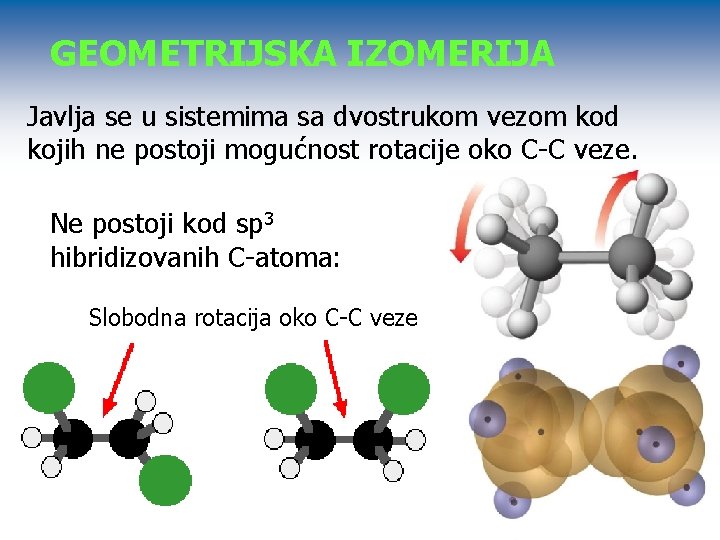
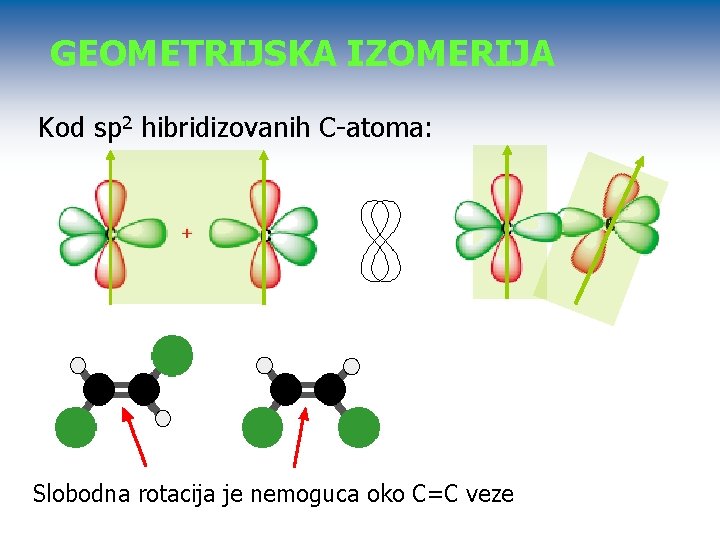
GEOMETRIJSKA IZOMERIJA Javlja se u sistemima sa dvostrukom vezom kod kojih ne postoji mogućnost rotacije oko C-C veze. Ne postoji kod sp 3 hibridizovanih C-atoma: Slobodna rotacija oko C-C veze


GEOMETRIJSKA IZOMERIJA Kod sp 2 hibridizovanih C-atoma: Slobodna rotacija je nemoguca oko C=C veze

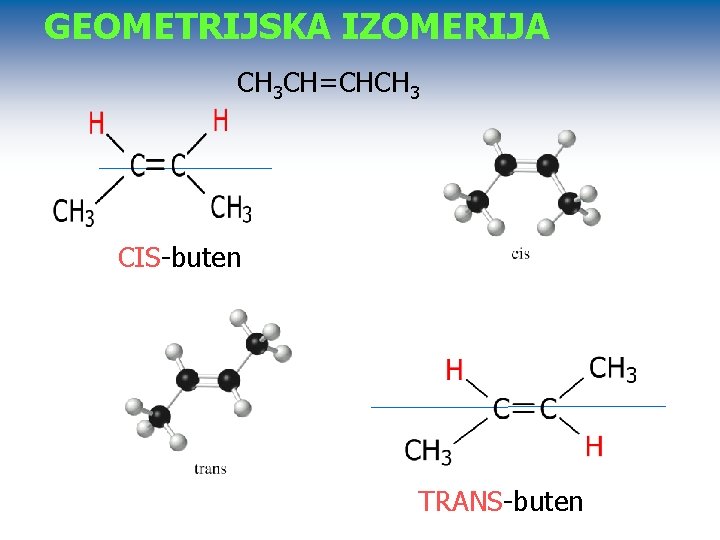
GEOMETRIJSKA IZOMERIJA CH 3 CH=CHCH 3 CIS-buten TRANS-buten

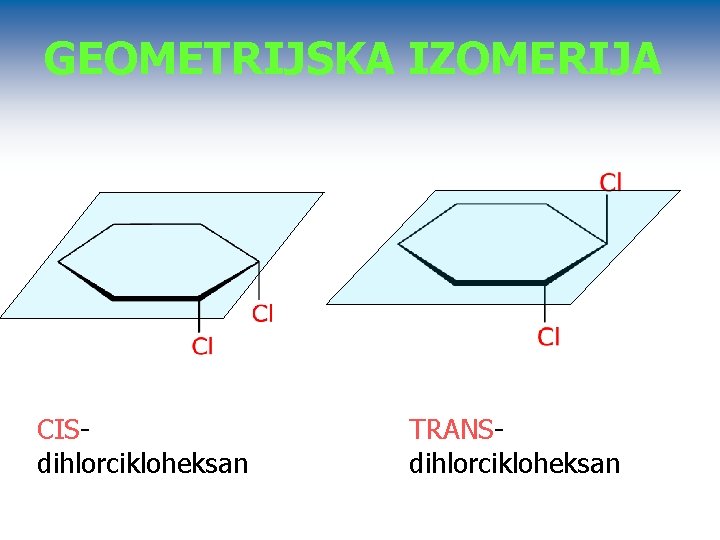
GEOMETRIJSKA IZOMERIJA CISdihlorcikloheksan TRANSdihlorcikloheksan

OPTIČKA IZOMERIJA

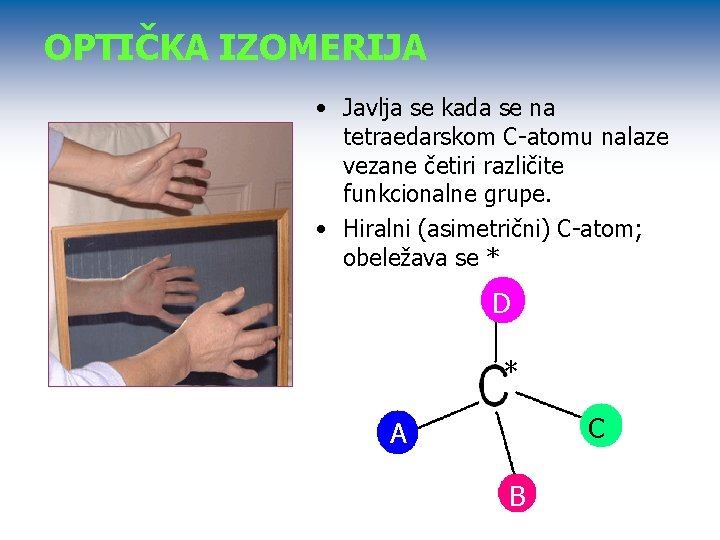
OPTIČKA IZOMERIJA • Javlja se kada se na tetraedarskom C-atomu nalaze vezane četiri različite funkcionalne grupe. • Hiralni (asimetrični) C-atom; obeležava se * D * C A B

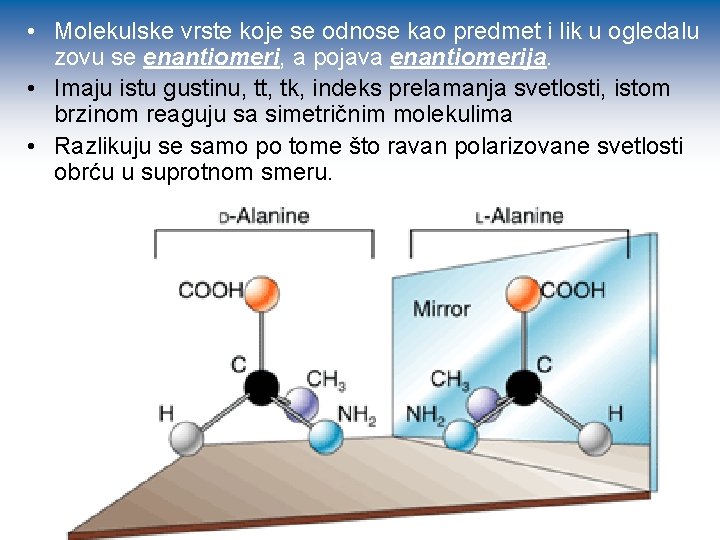
• Molekulske vrste koje se odnose kao predmet i lik u ogledalu zovu se enantiomeri, a pojava enantiomerija. • Imaju istu gustinu, tt, tk, indeks prelamanja svetlosti, istom brzinom reaguju sa simetričnim molekulima • Razlikuju se samo po tome što ravan polarizovane svetlosti obrću u suprotnom smeru.

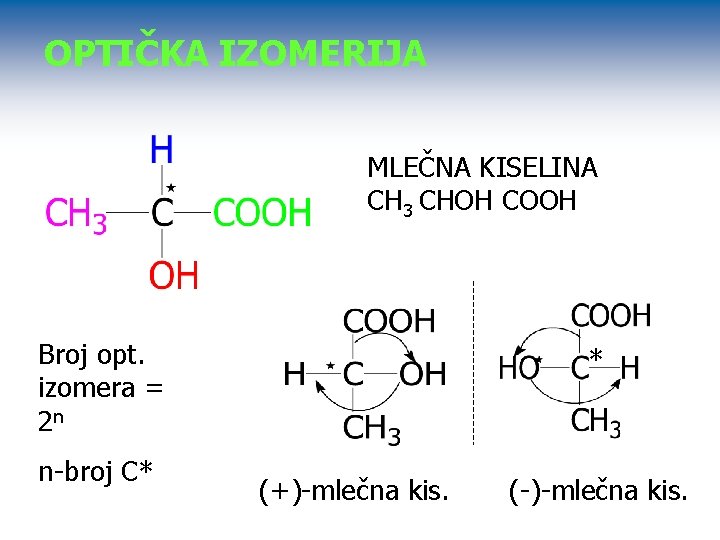
OPTIČKA IZOMERIJA MLEČNA KISELINA CH 3 CHOH COOH Broj opt. izomera = 2 n n-broj C* * A (+)-mlečna kis. (-)-mlečna kis. B

OPTIČKA IZOMERIJA • Npr. vinska kiselina – ima 2 hiralna C-atoma, pa se očekuju 4 optički aktivna oblika. (+)-vinska kis. (-)-vinska kis. mezo-vinska kis. B

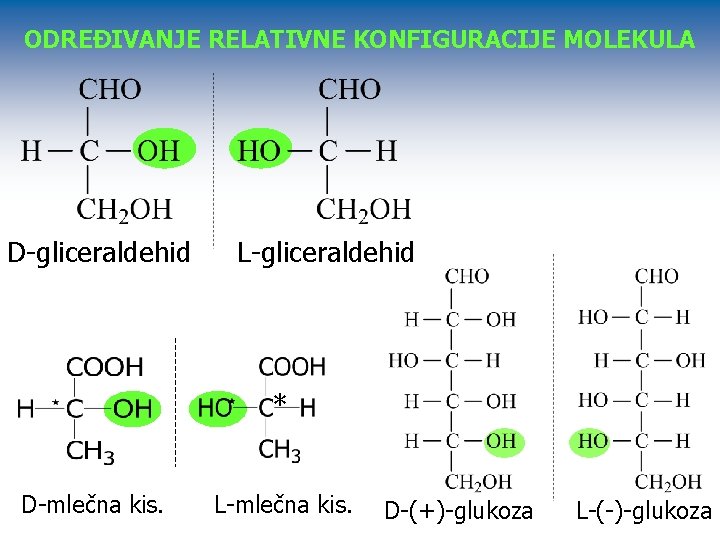
ODREĐIVANJE RELATIVNE KONFIGURACIJE MOLEKULA D-gliceraldehid L-gliceraldehid * D-mlečna kis. L-mlečna kis. B D-(+)-glukoza L-(-)-glukoza

PREDSTAVLJANJE ORGANSKIH JEDINJENJA

• Empirijske formule – daju kvalitativan sastav jedinjenja i relativne odnose elemenata u jedinjenjima. Npr. 40% C, 6, 66% H i 53, 34% O C: H: O = 1: 2: 1 CH 2 O • Molekulska formula predstavlja celobrojni umnožak empirijske formule CH 2 O; CH 2 O • 2 = C 2 H 4 O 2 (sirćetna kiselina, metilformijat, glikolaldehid) • Zbog mogućnosti da 3 različita jedinjenja imaju istu molekulsku formulu uvodi se strukturna formula u kojoj se obeležava svaka pojedinačna veza.

• Racionalne formule – u njima su označene samo određene veze • Pogodne su za prikazivanje cikličnih i aromatičnih jedinjenja, kao i dugih lanaca C-atoma. Benzen Steranski sistem prstenova -D-glukopiranoza

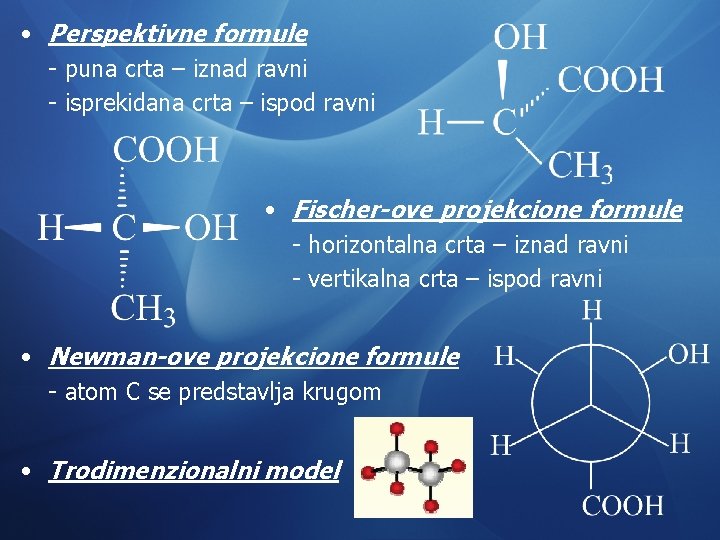
• Perspektivne formule - puna crta – iznad ravni - isprekidana crta – ispod ravni • Fischer-ove projekcione formule - horizontalna crta – iznad ravni - vertikalna crta – ispod ravni • Newman-ove projekcione formule - atom C se predstavlja krugom • Trodimenzionalni model

VRSTE REAKCIJA • Postoji pet klasa reakcija. U svakoj od njih dolazi do raskidanja kovalentne veze: a) Homolitičko raskidanje A : B A + B CH 3 -CH 3 + CH 3 b) Heterolitičko raskidanje A : B A+ + B CH 3 -CH 3+ + : CH 3 • Pri heterolitičkom raskidanju veze koju gradi ugljenik nastaju karbanjon (: CH 3 ) i karbenijum jon (CH 3+)

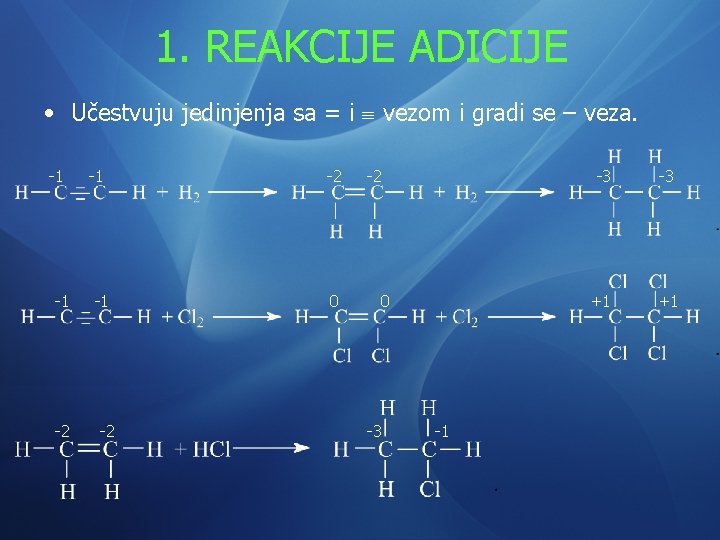
1. REAKCIJE ADICIJE • Učestvuju jedinjenja sa = i vezom i gradi se – veza. -1 -1 -2 -2 0 -3 -1 -3 -3 +1 +1

2. REAKCIJE ELIMINACIJE • Izdvajaju se manji molekuli pri čemu se najčešće formira nezasićeno jedinjenje dehidratacija - H 2 dehidrohalogenovanje dehidrogenizacija dekarboksilacija

3. REAKCIJE SUPSTITUCIJE • Dolazi do zamene jednog ili više atoma nekim drugim atomom ili atomskom grupom ½ O 2 - H 2 O ½ O 2 • Mogu biti nukleofilne, elektrofilne ili radikalske reakcije • Može doći do promene oksidacionog broja, ali ne mora.

4. REAKCIJE PREMEŠTANJA • Dolazi do premeštanja atoma ili atomskih grupa u okviru jednog jedinjenja i nastaje drugo 5. REAKCIJE OKSIDOREDUKCIJE 3 CH 3 CH 2 OH + 2 K 2 Cr 2 O 7 + 8 H 2 SO 4 3 CH 3 COOH + 2 Cr 2(SO 4)3 + 2 K 2 SO 4 + 11 H 2 O 5 CH 2=CH 2 + 2 KMn. O 4 + 3 H 2 SO 4 + 2 H 2 O 5 CH 2 OH-CH 2 OH + 2 Mn. SO 4 + K 2 SO 4

NOMENKLATURA ORGANSKIH JEDINJENJA

IUPAC (International Union of Pure and Applied Chemistry) - SISTEMSKA NOMENKLATURA

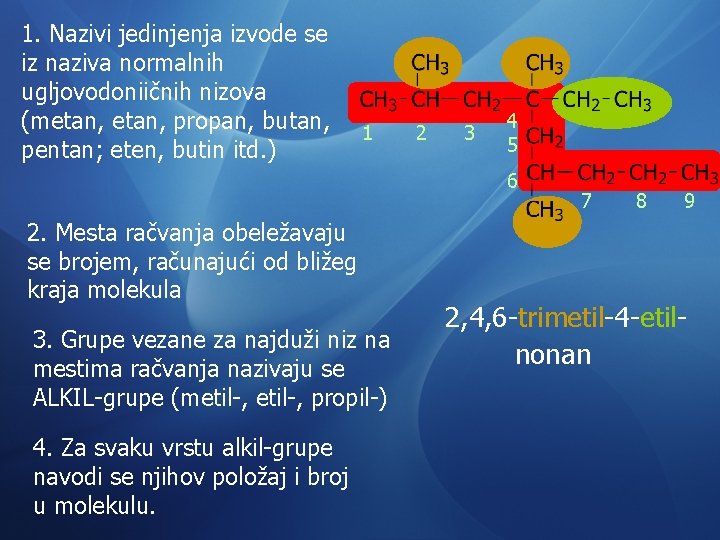
1. Nazivi jedinjenja izvode se iz naziva normalnih ugljovodoniičnih nizova (metan, propan, butan, pentan; eten, butin itd. ) 1 2 3 4 5 6 2. Mesta račvanja obeležavaju se brojem, računajući od bližeg kraja molekula 3. Grupe vezane za najduži niz na mestima račvanja nazivaju se ALKIL-grupe (metil-, propil-) 4. Za svaku vrstu alkil-grupe navodi se njihov položaj i broj u molekulu. 7 8 9 2, 4, 6 -trimetil-4 -etilnonan

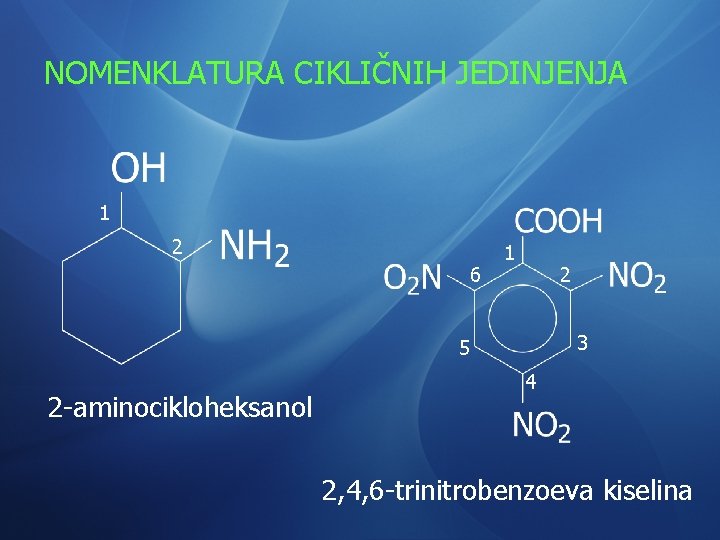
NOMENKLATURA CIKLIČNIH JEDINJENJA 1 2 6 1 2 3 5 2 -aminocikloheksanol 4 2, 4, 6 -trinitrobenzoeva kiselina

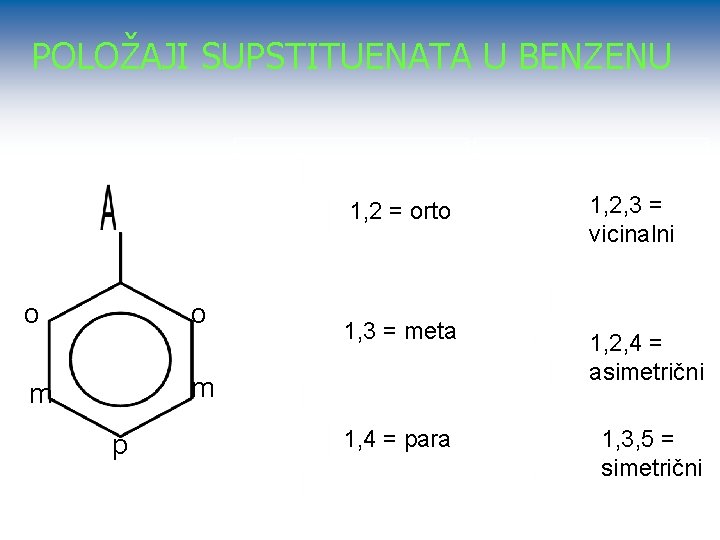
POLOŽAJI SUPSTITUENATA U BENZENU o o m m p 1, 2 = orto 1, 2, 3 = vicinalni 1, 3 = meta 1, 2, 4 = asimetrični 1, 4 = para 1, 3, 5 = simetrični

TRIVIJALNI NAZIVI HCOOH – mravlja kiselina aspirin

Imena poznatih molekula veoma komplikovane strukture Složeni molekuli izolovani iz prirodnog materijala uvek nose trivijalne nazive jer je u većini slučajeva praktično nemoguće dati im sistemski naziv. Vitamin B 12

KLASE ORGANSKIH JEDINJENJA • Ugljovodonici • Zasićeni – alkani • Nezasićeni – alkeni, polieni, alkini, ciklični, aromatični • Alkilhalogenidi (C-X) • Alkoholi i fenoli (funkcionalna grupa –OH) • Karbonilna jedinjenja (funkcionalna grupa C=O) • Aldehidi (R-CHO) • Ketoni (R 2 C=O)

KLASE ORGANSKIH JEDINJENJA • Karboksilne kiseline (funkcionalna grupa –COOH) • Funkcionalni derivati karboksilnih kiselina • Halogenidi (R-COX) • Estri (R 1 COOR 2) • Etri (C-O-C) • Amini (C-N) • Tioli (C-SH) • Sulfidi (C-S-C) • Anhidridi (R 1 -COOOC-R 2) • Amidi (RCONH 2)
 Univerzitet u novom sadu erasmus
Univerzitet u novom sadu erasmus Univerzitet u novom sadu konkursi
Univerzitet u novom sadu konkursi Univerzitet crne gore masinski fakultet
Univerzitet crne gore masinski fakultet Direktni sporazum po novom zakonu o javnim nabavkama
Direktni sporazum po novom zakonu o javnim nabavkama Wniosek o powołanie świadka wzór
Wniosek o powołanie świadka wzór Sąd drugiej instancji dla sądu okręgowego
Sąd drugiej instancji dla sądu okręgowego Masoud sadjadi
Masoud sadjadi Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za geografiju
Departman za geografiju Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za hemiju
Departman za hemiju Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Hamiltonova kontura
Hamiltonova kontura Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Nezavisni univerzitet banja luka
Nezavisni univerzitet banja luka Univerzitet u kragujevcu
Univerzitet u kragujevcu Slobomir p univerzitet
Slobomir p univerzitet Vojna akademija master
Vojna akademija master Veljko mijuskovic
Veljko mijuskovic Ekonomski fakultet vitez
Ekonomski fakultet vitez Akreditacija evropskog univerziteta brčko
Akreditacija evropskog univerziteta brčko Visoka medicinska skola specijalizacija
Visoka medicinska skola specijalizacija Slobomir p univerzitet
Slobomir p univerzitet Univerzitet odbrane vojna akademija
Univerzitet odbrane vojna akademija Slobomir p univerzitet
Slobomir p univerzitet Erythrazma
Erythrazma Fakultet za poslovne studije banja luka
Fakultet za poslovne studije banja luka Univerzitet istocno sarajevo
Univerzitet istocno sarajevo Univerzitet u kiseljaku
Univerzitet u kiseljaku Nezavisni univerzitet banja luka
Nezavisni univerzitet banja luka Kriminalistički fakultet banja luka
Kriminalistički fakultet banja luka Univerzitet sinergija
Univerzitet sinergija Univerzitet u skoplju
Univerzitet u skoplju Univerzitet odbrane
Univerzitet odbrane Tehniki
Tehniki Poljoprivredni fakultet novi sad predmeti
Poljoprivredni fakultet novi sad predmeti Ekonomski fakultet podgorica master studije
Ekonomski fakultet podgorica master studije Fakultet za informatiku i računarstvo
Fakultet za informatiku i računarstvo Regnerekefølge
Regnerekefølge Grf bg
Grf bg Fakultet organizacionih nauka smerovi
Fakultet organizacionih nauka smerovi





























































