Universidad Austral de Chile Facultad de Ciencias Instituto

































- Slides: 66

Universidad Austral de Chile Facultad de Ciencias Instituto de Química Introducción a los Modelos Básicos de la Química Profesor: Gabriel Vallejos C. 5. EVALUACIÓN 5. 1. Tres Pruebas Escritas de desarrollo con una ponderación de 25% c/u. Promedio de prácticos 25%. 5. 2. Una Prueba Sustitutiva. Esta Prueba sólo podrán rendirla aquellos alumnos que por motivos debidamente justificados, no pudieron rendir alguna de las tres anteriores (Art. 21 Reglamento Académico Estudiantil de Pre-Grado, 1994 - 1995). 5. 3. El Examen Final es rendido por todo alumno cuyo promedio de presentación sea inferior a 5. 0 y superior a 3. 5. Calificación Final = Nota de presentación * 0, 70 + Nota del examen * 0, 30

Referencias Química General 1. Chang, R. Química; Mc. Graw-Hill: México, 2002. 2. Petrucci, R. H. ; Harwood, W. S. ; Herring, F. G. Química General; Pearson Educación, S. A. : Madrid, 2003. 3. Brown, T. L. ; Le. May, H. E. ; Bursten, B. E. ; Burdge, J. R. Química, la Ciencia Central; Pearson Educación, S. A. : México, 2004. Química Orgánica 1. Carey, F. A. Química Orgánica; Mc. Graw-Hill: México, 2006. 2. Pine, S. H. ; Hendrickson, J. B. ; Cram, D. J. ; Hammond, G. S. Química Orgánica; Mc. Graw-Hill: México, 1988. 3. Solomons, T. W. G. Química Orgánica; Limusa Wiley: México, 2000.



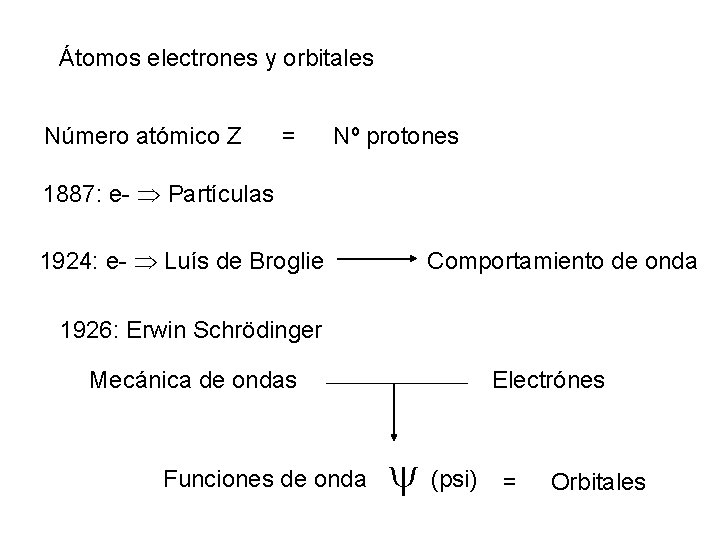
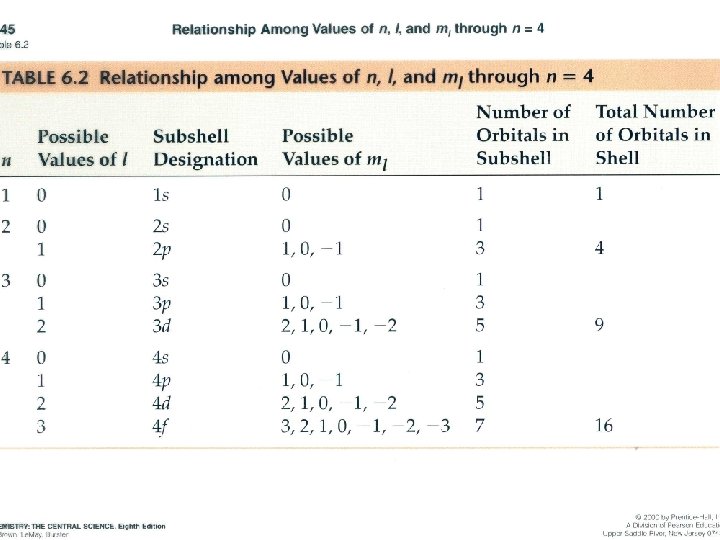
Átomos electrones y orbitales Número atómico Z = Nº protones 1887: e- Partículas 1924: e- Luís de Broglie Comportamiento de onda 1926: Erwin Schrödinger Mecánica de ondas Funciones de onda Electrónes (psi) = Orbitales










Ejemplo… Orbitales s Config. Electrón. Hidrógeno: Forma esférica 1 s 1 Propiedad de espín de los e- (+ ½ ; - ½) Principio de exclusión de Pauli Orbital 2 e- con espines desapareados Principio de exclusión de Pauli Regla de Hund Ej. Microbus

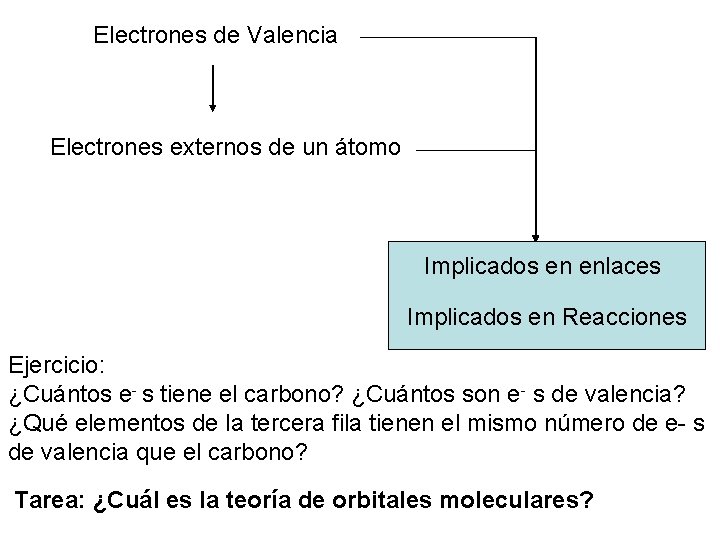
Electrones de Valencia Electrones externos de un átomo Implicados en enlaces Implicados en Reacciones Ejercicio: ¿Cuántos e- s tiene el carbono? ¿Cuántos son e- s de valencia? ¿Qué elementos de la tercera fila tienen el mismo número de e- s de valencia que el carbono? Tarea: ¿Cuál es la teoría de orbitales moleculares?

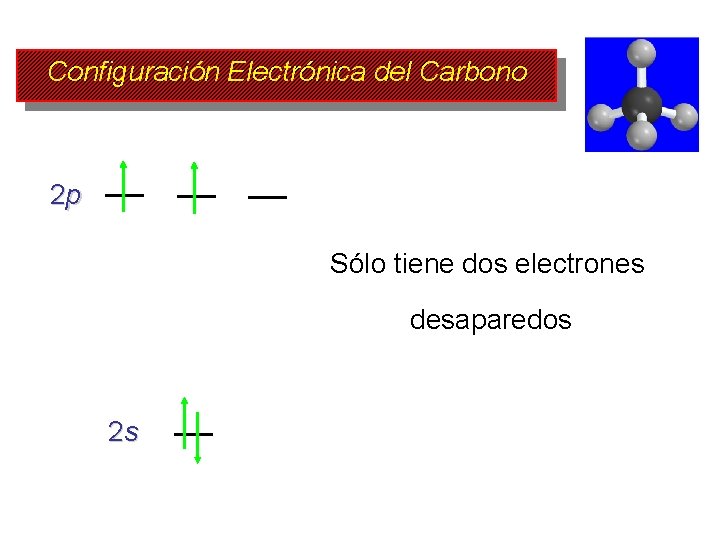
Estructura del Metano Estructura Tetraédrica Ángulos de enlace = 109. 5° Distancias de enlace = 110 pm Pero la estructura es inconsistente con la configuración electrónica del Carbono

Configuración Electrónica del Carbono 2 p Sólo tiene dos electrones desaparedos 2 s

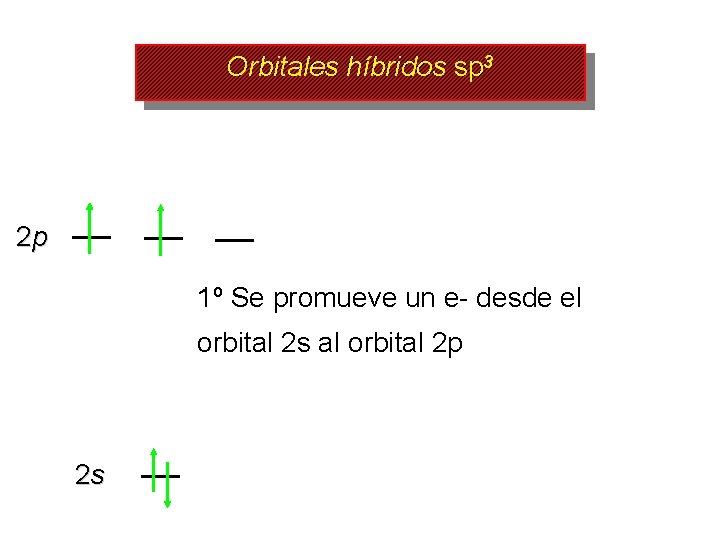
Orbitales híbridos sp 3 2 p 1º Se promueve un e- desde el orbital 2 s al orbital 2 p 2 s

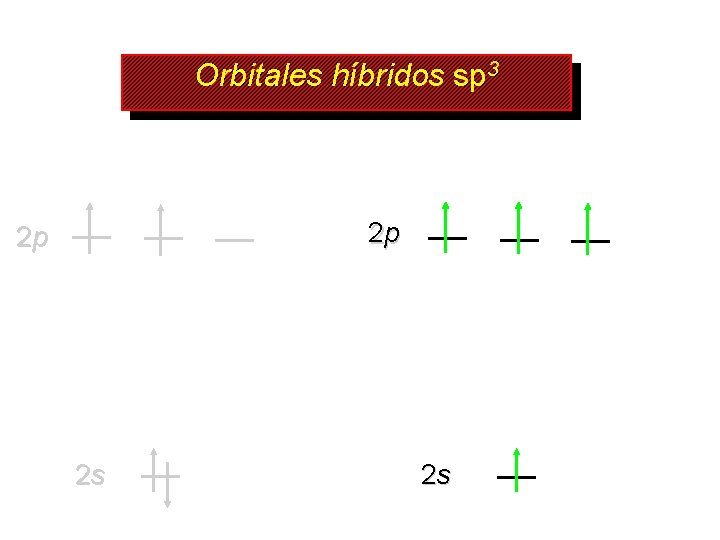
Orbitales híbridos sp 3 2 p 2 p 2 s 2 s

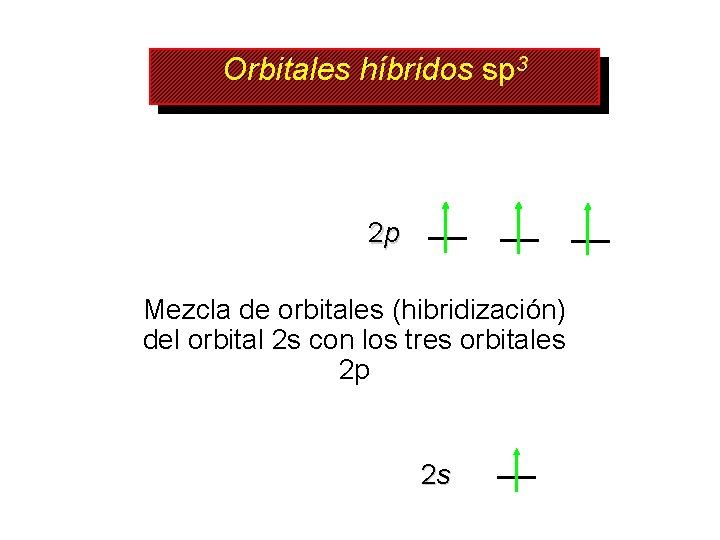
Orbitales híbridos sp 3 2 p Mezcla de orbitales (hibridización) del orbital 2 s con los tres orbitales 2 p 2 s

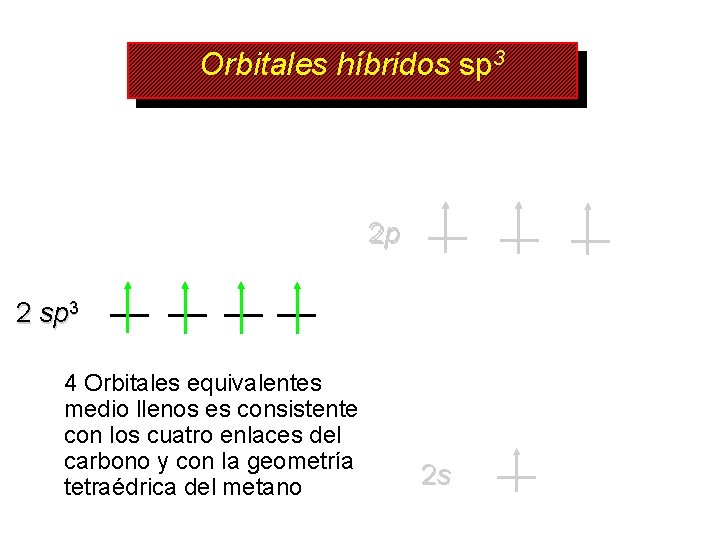
Orbitales híbridos sp 3 2 p 2 sp 3 4 Orbitales equivalentes medio llenos es consistente con los cuatro enlaces del carbono y con la geometría tetraédrica del metano 2 s

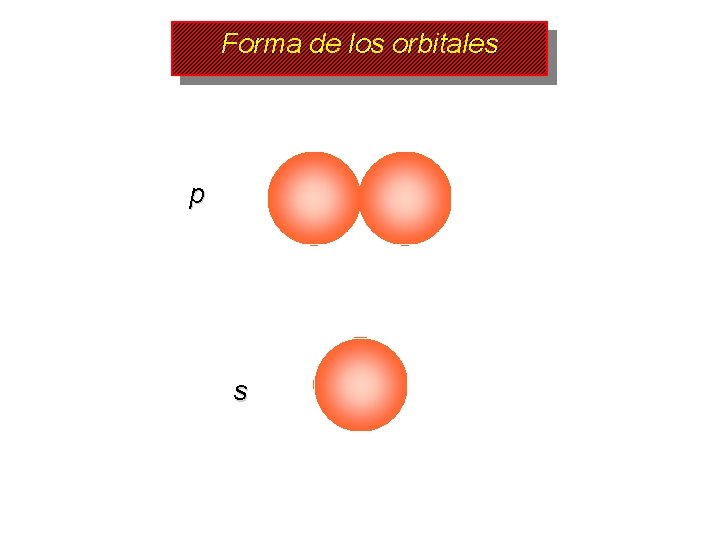
Forma de los orbitales p s

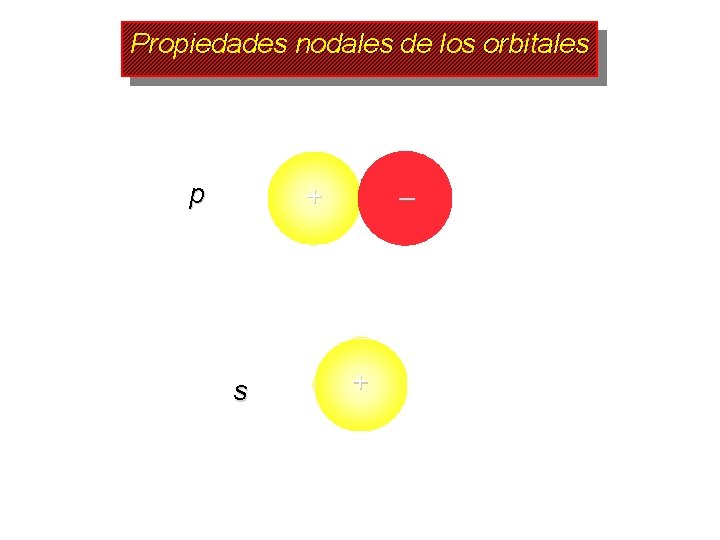
Propiedades nodales de los orbitales p + s – +

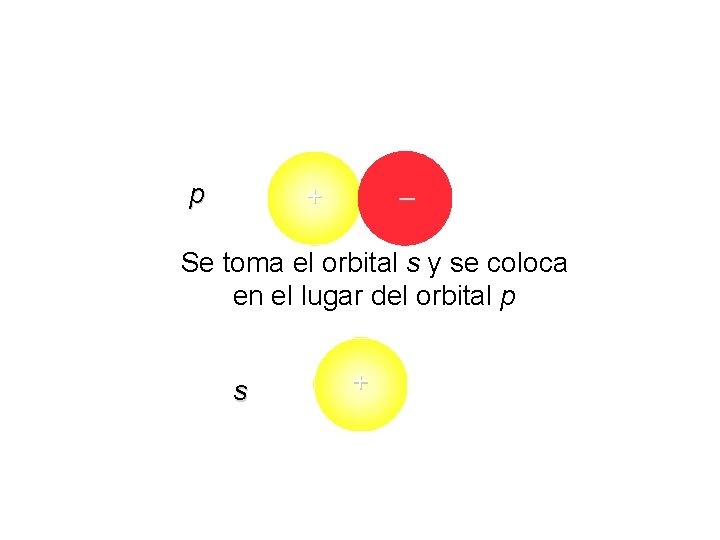
p + – Se toma el orbital s y se coloca en el lugar del orbital p s +

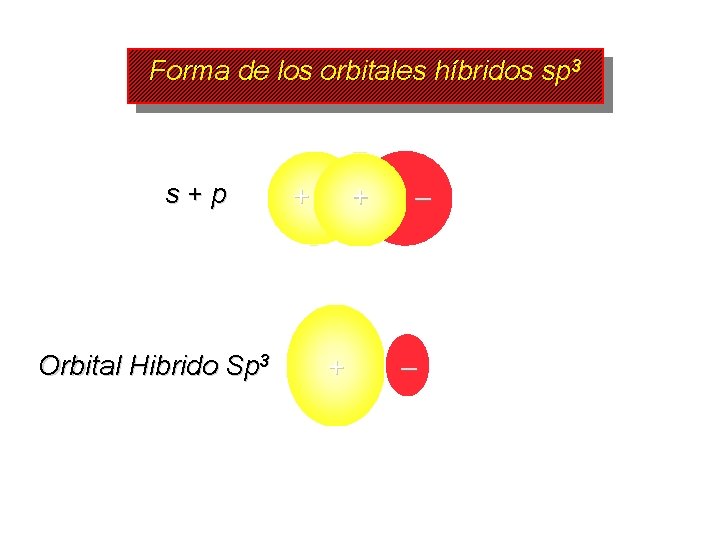
Forma de los orbitales híbridos sp 3 s+p Orbital Hibrido Sp 3 + + + – –

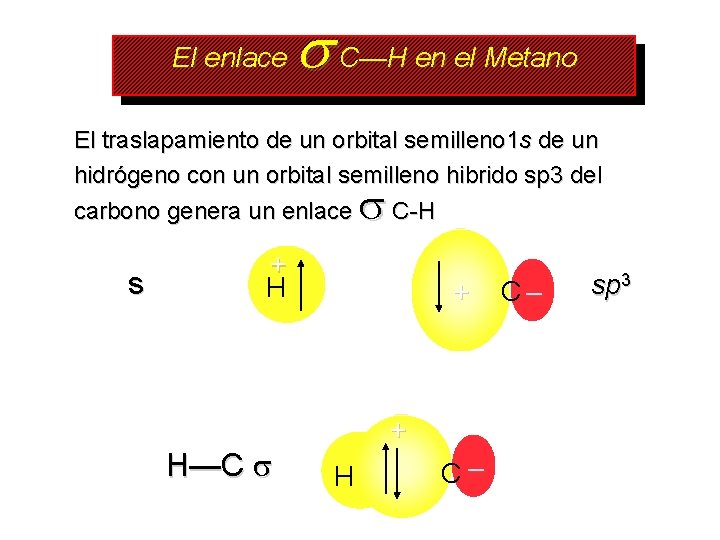
El enlace C—H en el Metano El traslapamiento de un orbital semilleno 1 s de un hidrógeno con un orbital semilleno hibrido sp 3 del carbono genera un enlace C-H s + H H—C + + H C– C– sp 3

Justification for Orbital Hybridization consistent with structure of methane allows formation of 4 bonds rather than 2 bonds involving sp 3 hybrid orbitals are stronger than those involving s-s overlap or p-p overlap

sp 3 Hybridization and Bonding in Ethane

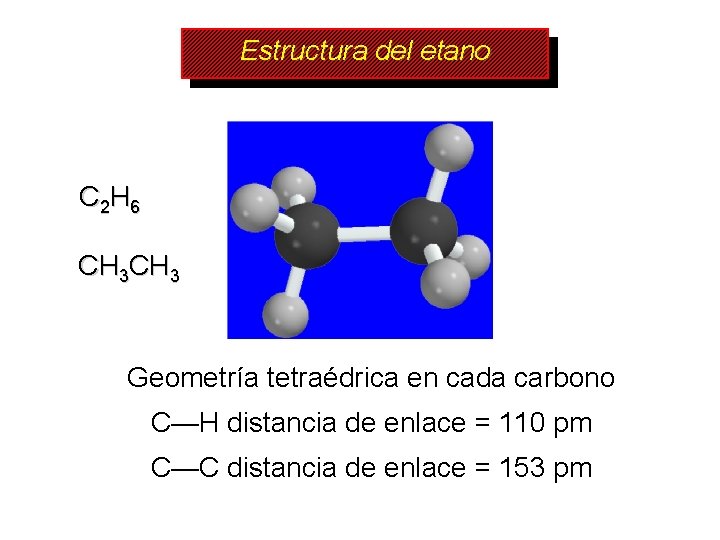
Estructura del etano C 2 H 6 CH 3 Geometría tetraédrica en cada carbono C—H distancia de enlace = 110 pm C—C distancia de enlace = 153 pm

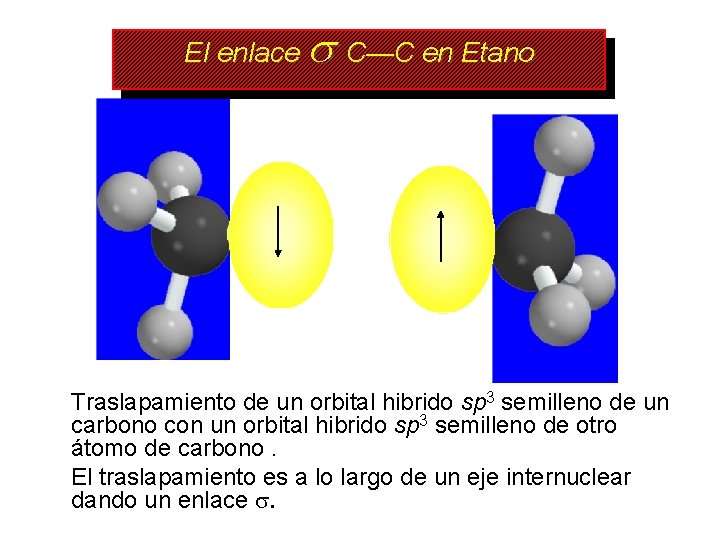
El enlace C—C en Etano Traslapamiento de un orbital hibrido sp 3 semilleno de un carbono con un orbital hibrido sp 3 semilleno de otro átomo de carbono. El traslapamiento es a lo largo de un eje internuclear dando un enlace .

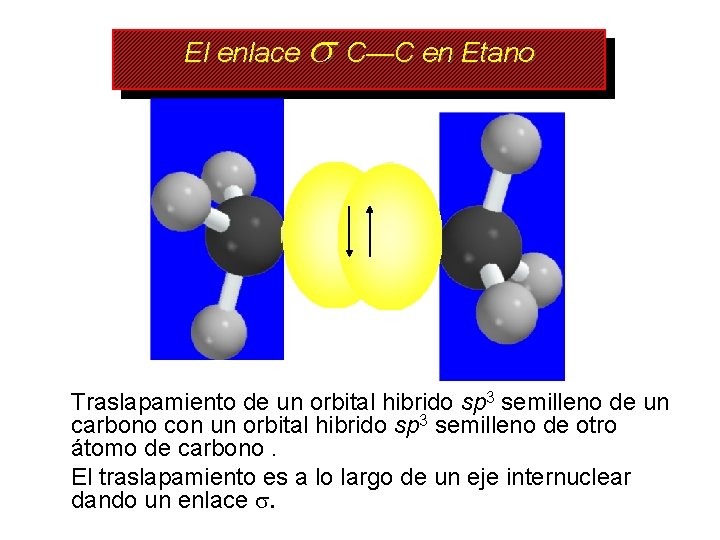
El enlace C—C en Etano Traslapamiento de un orbital hibrido sp 3 semilleno de un carbono con un orbital hibrido sp 3 semilleno de otro átomo de carbono. El traslapamiento es a lo largo de un eje internuclear dando un enlace .

sp 2 Hybridization and Bonding in Ethylene

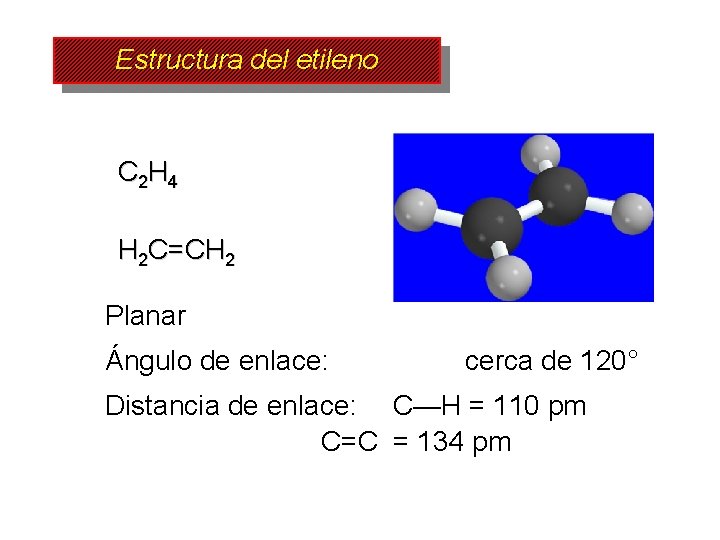
Estructura del etileno C 2 H 4 H 2 C=CH 2 Planar Ángulo de enlace: cerca de 120° Distancia de enlace: C—H = 110 pm C=C = 134 pm

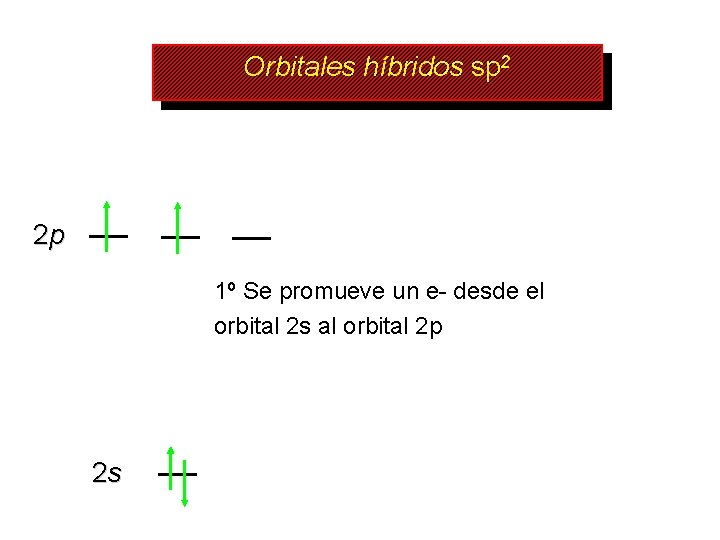
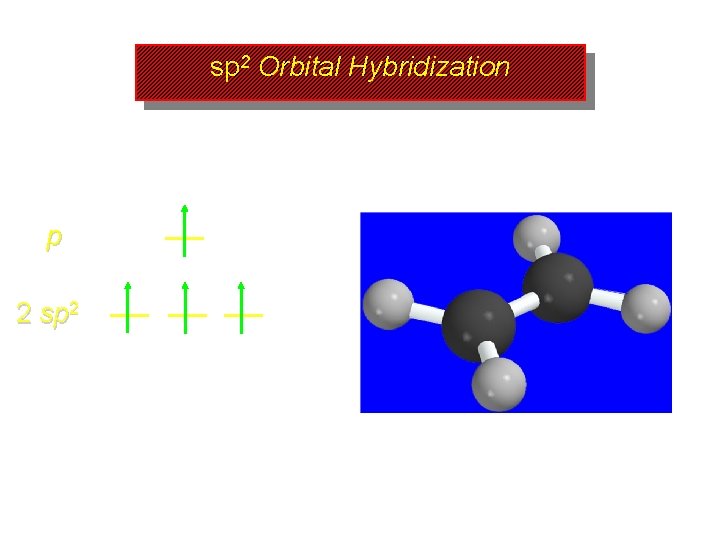
Orbitales híbridos sp 2 2 p 1º Se promueve un e- desde el orbital 2 s al orbital 2 p 2 s

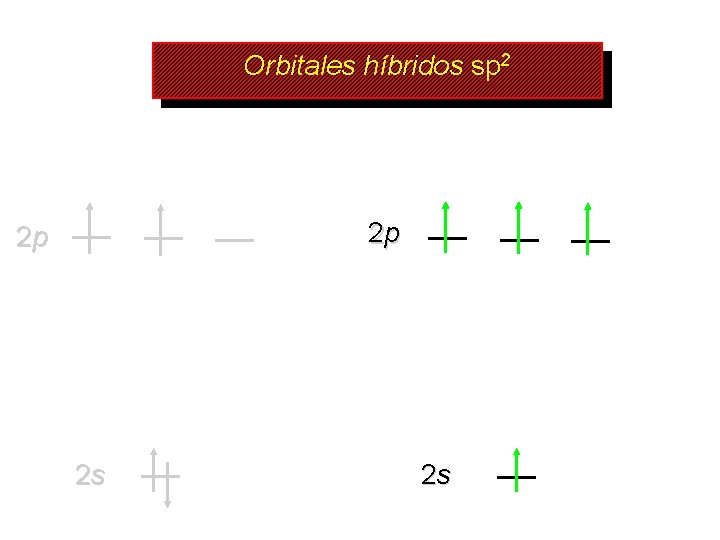
Orbitales híbridos sp 2 2 p 2 p 2 s 2 s

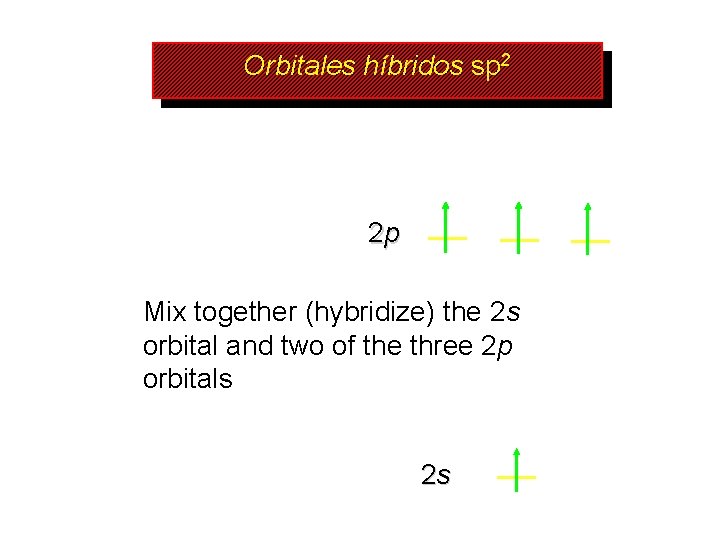
Orbitales híbridos sp 2 2 p Mix together (hybridize) the 2 s orbital and two of the three 2 p orbitals 2 s

sp 2 Orbital Hybridization 2 p 2 sp 2 3 equivalent half-filled sp 2 hybrid orbitals plus 1 p orbital left unhybridized 2 s

sp 2 Orbital Hybridization p 2 sp 2 2 of the 3 sp 2 orbitals are involved in bonds to hydrogens; the other is involved in a bond to carbon

sp 2 Orbital Hybridization p 2 sp 2

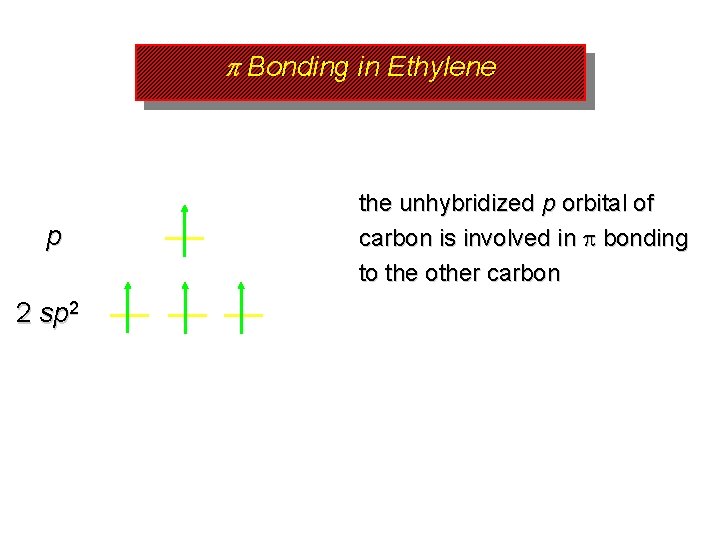
p Bonding in Ethylene p 2 sp 2 the unhybridized p orbital of carbon is involved in bonding to the other carbon

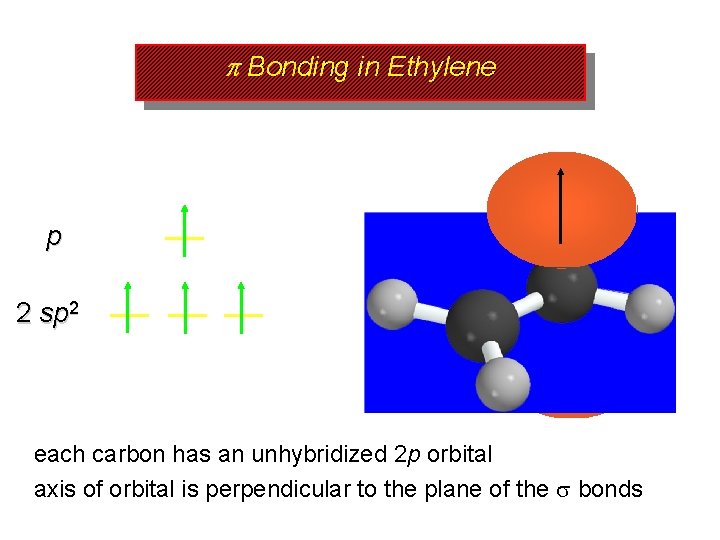
p Bonding in Ethylene p 2 sp 2 each carbon has an unhybridized 2 p orbital axis of orbital is perpendicular to the plane of the bonds

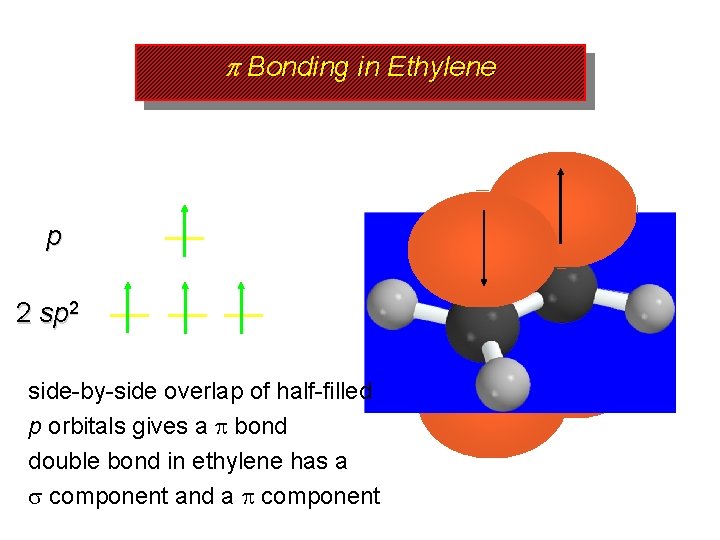
p Bonding in Ethylene p 2 side-by-side overlap of half-filled p orbitals gives a bond double bond in ethylene has a component and a component

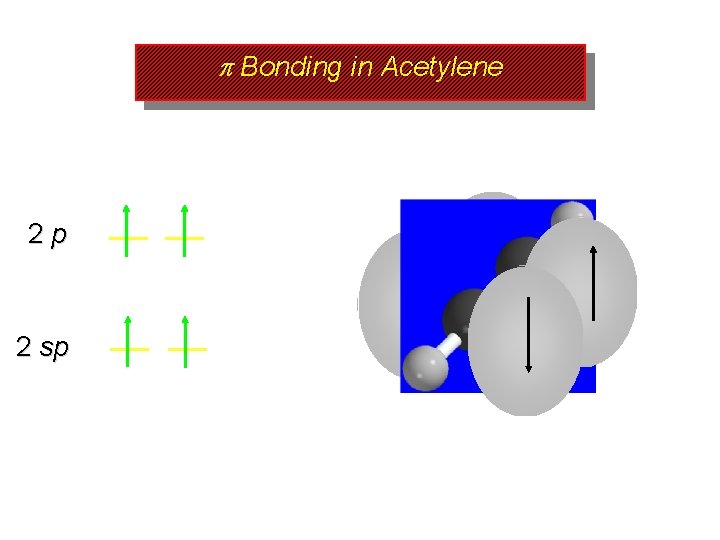
sp Hybridization and Bonding in Acetylene

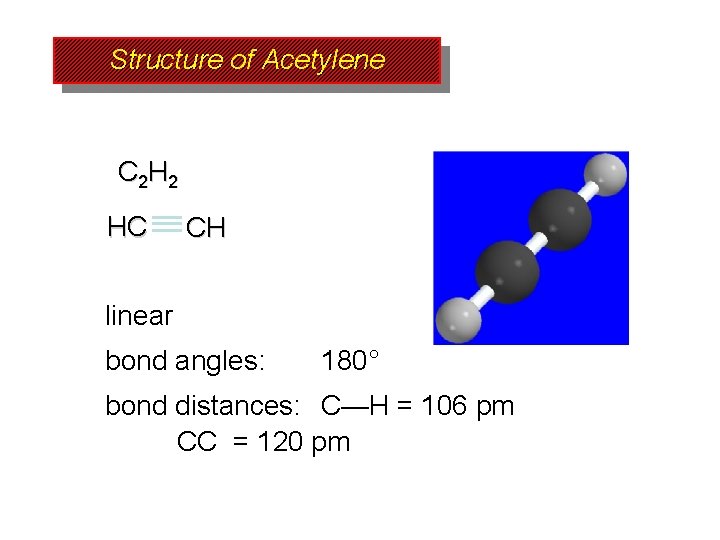
Structure of Acetylene C 2 H 2 HC CH linear bond angles: 180° bond distances: C—H = 106 pm CC = 120 pm

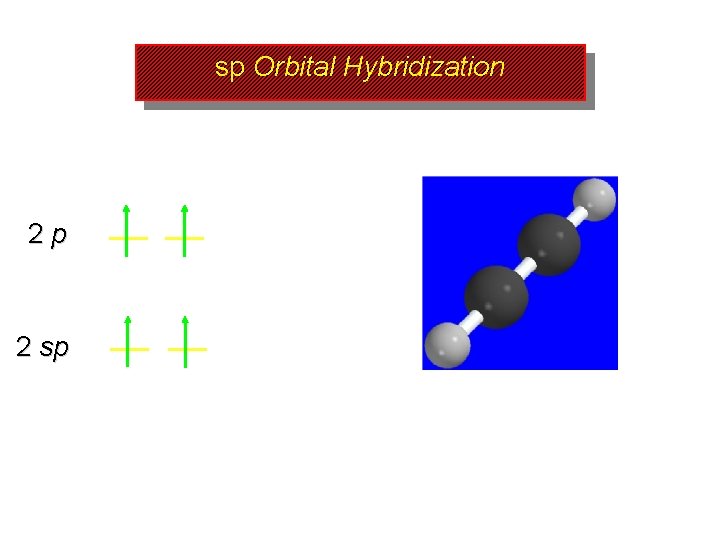
sp Orbital Hybridization 2 p Promote an electron from the 2 s to the 2 p orbital 2 s

sp Orbital Hybridization 2 p 2 p 2 s 2 s

sp Orbital Hybridization 2 p Mix together (hybridize) the 2 s orbital and one of the three 2 p orbitals 2 s

sp Orbital Hybridization 2 p 2 p 2 sp 2 equivalent half-filled sp hybrid orbitals plus 2 p orbitals left unhybridized 2 s

sp Orbital Hybridization 2 p 2 sp 1 of the 2 sp orbitals is involved in a bond to hydrogen; the other is involved in a bond to carbon

sp Orbital Hybridization 2 p 2 sp

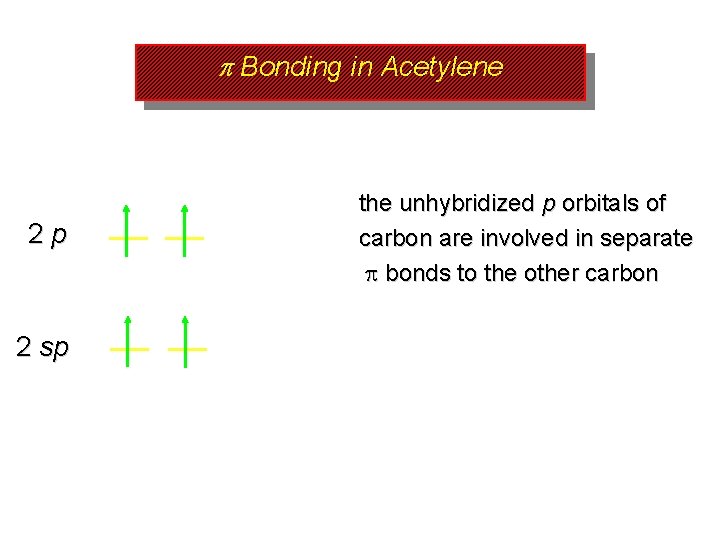
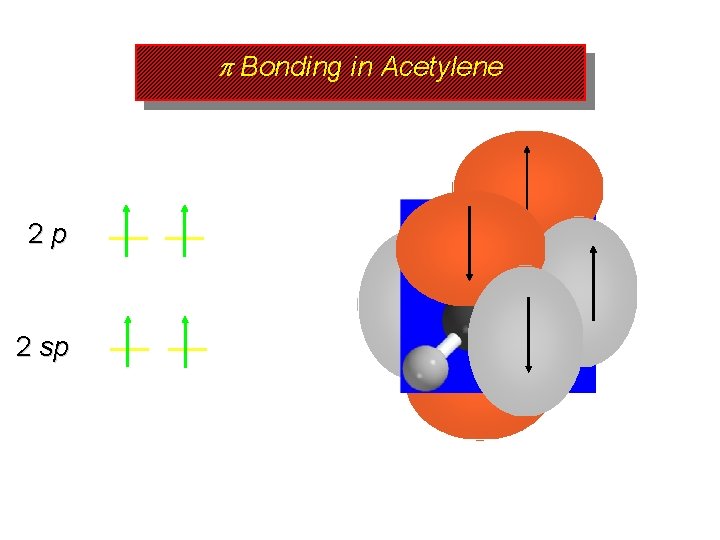
p Bonding in Acetylene 2 p 2 sp the unhybridized p orbitals of carbon are involved in separate bonds to the other carbon

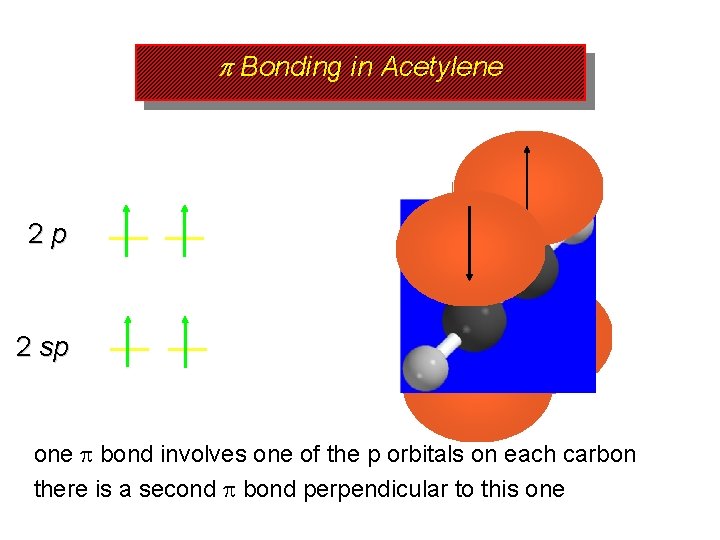
p Bonding in Acetylene 2 p 2 sp one bond involves one of the p orbitals on each carbon there is a second bond perpendicular to this one

p Bonding in Acetylene 2 p 2 sp

p Bonding in Acetylene 2 p 2 sp

1. 19 Which Theory of Chemical Bonding is Best?

Three Models Lewis most familiar—easiest to apply Valence-Bond (Orbital Hybridization) provides more insight than Lewis model ability to connect structure and reactivity to hybridization develops with practice Molecular Orbital potentially the most powerful method but is the most abstract requires the most experience to use effectively

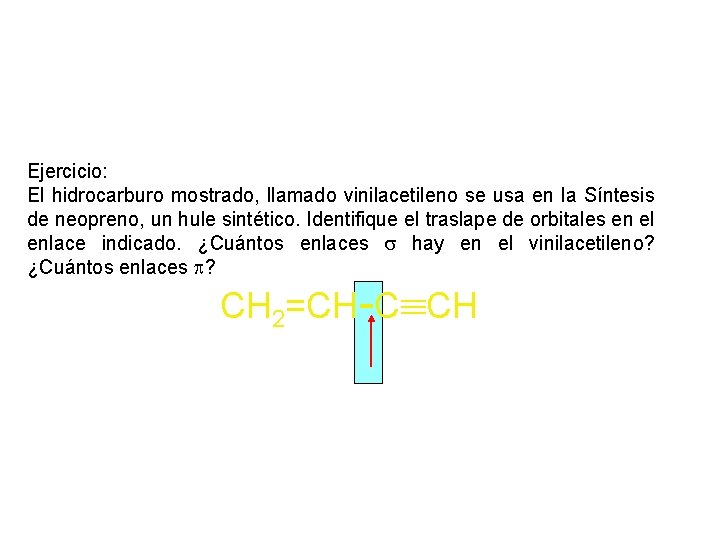
Ejercicio: El hidrocarburo mostrado, llamado vinilacetileno se usa en la Síntesis de neopreno, un hule sintético. Identifique el traslape de orbitales en el enlace indicado. ¿Cuántos enlaces hay en el vinilacetileno? ¿Cuántos enlaces ? CH 2=CH-C CH

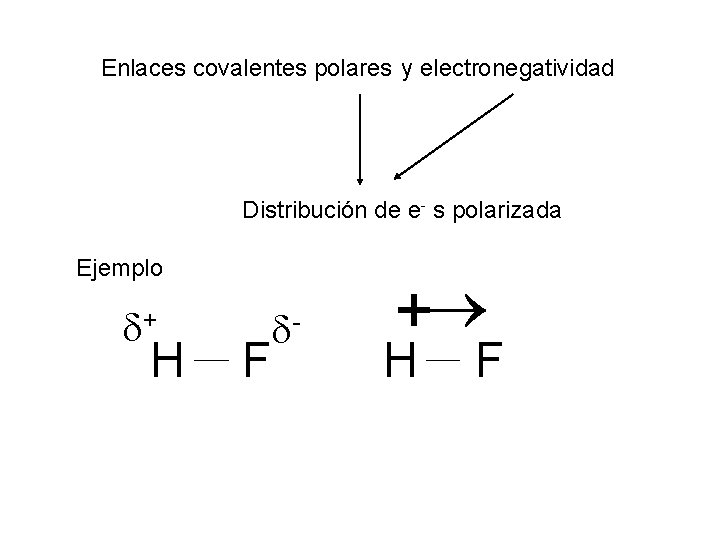
Enlaces covalentes polares y electronegatividad Distribución de e- s polarizada Ejemplo + H F - + H F

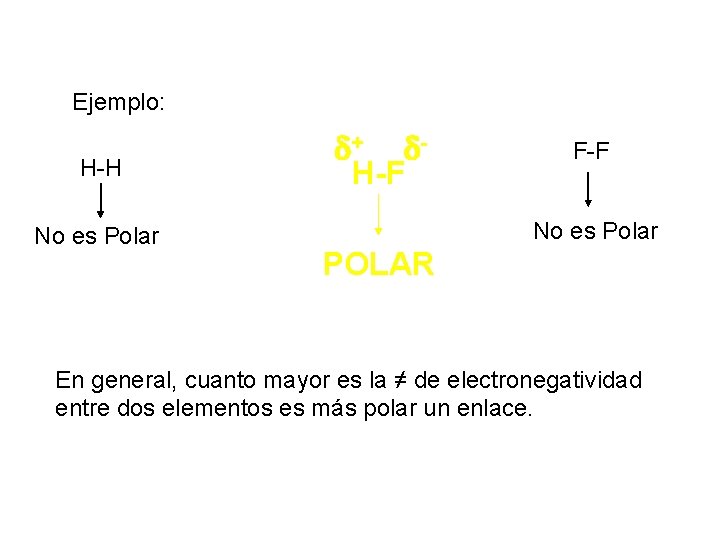
Ejemplo: H-H No es Polar + H-F F-F No es Polar POLAR En general, cuanto mayor es la ≠ de electronegatividad entre dos elementos es más polar un enlace.

Algunas electronegatividades: H 2, 1 C 2, 5 N 3, 0 O 3, 5 Si 1, 8 S 2, 5 Ejercicio: ¿En cuál de los compuestos CH 4, NH 3, H 2 O, Si. H 4 o H 2 S es Mayor el para el hidrógeno? ¿En cuál el hidrógeno lleva Carga parcial negativa?

La polaridad de una molécula se puede apreciar por su “momento dipolar” =e*d Carga del electrón = 4, 80*10 -10 unidades electrostáticas (ues) d promedio de una molécula = 1*10 -8 cm 1 Debye (D) = 1*10 -18 ues * cm H-F = 1, 7 *10 -18 ues * cm = 1, 7 D Las clases de Rx que experimenta una molécula con Frecuencia pueden relacionarse con el tamaño y dirección de los dipolos de los enlaces




 Universidad austral de chile facultad de medicina
Universidad austral de chile facultad de medicina Casosclinicosnn.med.br
Casosclinicosnn.med.br Unionpyme easy software contable gratuito
Unionpyme easy software contable gratuito Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Thin and thick smear
Thin and thick smear Facultad de ciencias medicas y biologicas dr ignacio chavez
Facultad de ciencias medicas y biologicas dr ignacio chavez Bangolou
Bangolou Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad de ciencias quimicas unach
Facultad de ciencias quimicas unach Universidad austral medicina
Universidad austral medicina Comidas tipicas de la zona central chile
Comidas tipicas de la zona central chile Regiones naturales de chile
Regiones naturales de chile Mapa zona sur de chile
Mapa zona sur de chile Cultura de la zona austral
Cultura de la zona austral Características de la zona sur de chile
Características de la zona sur de chile Afiche zonas naturales de chile
Afiche zonas naturales de chile Universidad de carabobo facultad de derecho
Universidad de carabobo facultad de derecho Facultad de informatica universidad de panama
Facultad de informatica universidad de panama Panam universidad
Panam universidad Clasificacion histologica de nefritis lupica
Clasificacion histologica de nefritis lupica Universidad san martin de porres facultad de derecho
Universidad san martin de porres facultad de derecho Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Universidad de carabobo facultad de odontologia
Universidad de carabobo facultad de odontologia Facultad de medicina universidad de la sabana
Facultad de medicina universidad de la sabana Instituto superior de ciencias medicas de la habana
Instituto superior de ciencias medicas de la habana Iscs - instituto superior de ciencias de la salud
Iscs - instituto superior de ciencias de la salud Universidad de ciencias medicas sancti spiritus
Universidad de ciencias medicas sancti spiritus Pontificia universidad católica de chile
Pontificia universidad católica de chile Derecho universidad de chile
Derecho universidad de chile Escala de sueldos universidad de chile 2020
Escala de sueldos universidad de chile 2020 Anyconnect universidad de chile
Anyconnect universidad de chile The austral realm
The austral realm Colegio austral valdivia
Colegio austral valdivia Características de la zona sur de chile
Características de la zona sur de chile Grau de psicologia uab
Grau de psicologia uab Aulica don bosco san luis
Aulica don bosco san luis Facultad de psicologia
Facultad de psicologia Facultad de derecho oruro
Facultad de derecho oruro Uv campus minatitlan
Uv campus minatitlan Facultad de auditoria
Facultad de auditoria Uedi campus virtual
Uedi campus virtual Facultad farmacia ull
Facultad farmacia ull Potencia y voluntad
Potencia y voluntad Lmad plan de estudios
Lmad plan de estudios Facultad de lenguas ccia registro
Facultad de lenguas ccia registro Organigrama de la facultad de ingeniería.
Organigrama de la facultad de ingeniería. Facultad de odontologia usac
Facultad de odontologia usac Facultad de medicina campeche
Facultad de medicina campeche Facultad de bioanalisis
Facultad de bioanalisis Portada facultad de derecho
Portada facultad de derecho Universidad veracruzana campus xalapa
Universidad veracruzana campus xalapa Servicio social facultad de arquitectura
Servicio social facultad de arquitectura Facultad miguel enriquez
Facultad miguel enriquez Facultad derecho ugr
Facultad derecho ugr Antrofilicos
Antrofilicos Facultad natural
Facultad natural Escolares arquitectura unam
Escolares arquitectura unam Facultad de economia oruro
Facultad de economia oruro Definicion de derecho subjetivo
Definicion de derecho subjetivo Facultad de derecho ufm
Facultad de derecho ufm Facultad de turismo en san marcos
Facultad de turismo en san marcos























































































