TEMA EL TOMO Fsica y Qumica 2 ESO




































- Slides: 46

TEMA: EL ÁTOMO Física y Química 2º ESO Colegio Compañía de María “La Enseñanza”

ÍNDICE 1. 2. 3. 4. 5. 6. 7. ¿Qué es la materia? La historia del átomo. La carga eléctrica. La estructura del átomo. Elementos químicos. Isótopos. Iones.

¿Qué es la materia? • Materia es todo aquello que tiene una masa y ocupa un volumen. • La química estudia la composición de la materia y los cambios que ocurren en ella. • Pero… ¿De qué está compuesta la materia?

¿Qué es la materia? • La materia está compuesta por ÁTOMOS. • El ÁTOMO es la unidad más pequeña que constituye la materia y que tiene las propiedades de un elemento químico. • Cada sólido, líquido, gas y plasma se compone de átomos neutros o ionizados. • Pero…. ¿Cómo se descubrió?

La historia del átomo LOS PRIMEROS ESTUDIOS DE LA MATERIA • Los primeros estudios fueron hace más de 2000 años. • Los griegos pensaban que la materia estaba hecha por partículas, pero constituidas por los elementos: tierra, fuego, agua y aire.

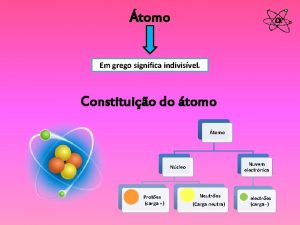
La historia del átomo DEMÓCRITO (GRECIA S. V a. C. ) • Fue un filósofo griego. • Creía que si una piedra se divide en dos mitades, estas siguen siendo esencialmente piedra. • Razonó que si se continuaba dividiendo la piedra en partes más pequeñas llegaríamos a una parte indivisible. • Denominó a las partículas más pequeñas con el nombre de “átomos”, que significa indivisible.

La historia del átomo DEMÓCRITO (GRECIA S. V a. C. ) • La teoría de Demócrito fue rechazada por Aristóteles, uno de los filósofos más influentes de la época, y fue ignorada durante más de 2000 años.

La historia del átomo JHON DALTON (Comienzos del S. XIX: 1803) • A partir de 1700 d. C. se empezó a investigar acerca de la materia. • Pero no fue hasta 1800 d. C. cuando Jhon Dalton desarrolló la primera teoría atómica.

La historia del átomo LA TEORÍA DE DALTON. • Todos los elementos estaban compuestos por átomos invisibles. • Los átomos de un mismo elemento eran iguales. • Había átomos de diferentes elementos que tenían distinta masa. • Los compuestos estaban formados por átomos de distintos elementos.

La historia del átomo J. J. THOMSON (Comienzos del S. XX: 1904) • Haciendo experimentos con rayos catódicos descubrió que a veces los átomos emitían una partícula negativa mucho más pequeña que denominó electrón. • ¡Los átomos ya no eran indivisibles! • Postuló la “teoría del pudding de pasas”

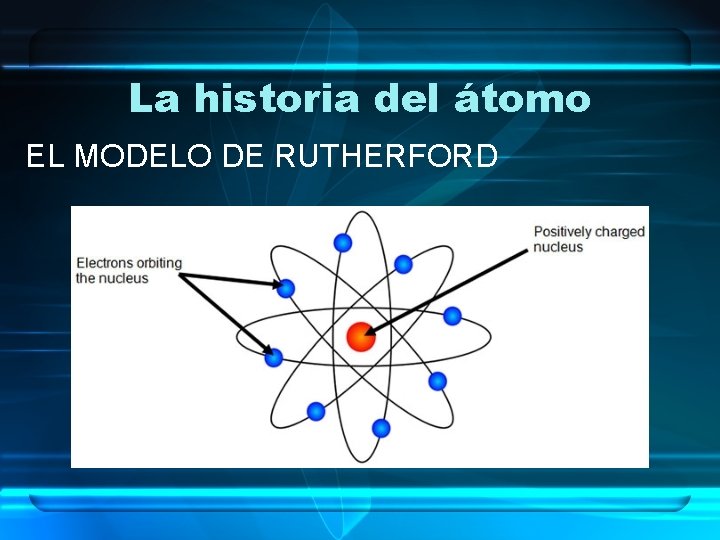
La historia del átomo RUTHERFORD (Comienzos del S. XX: 1911) • !Realizó un experimento con una lámina de oro que dio resultados sorprendentes!

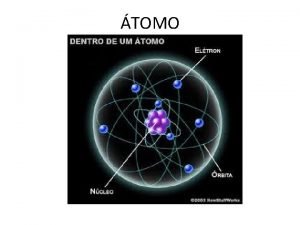
La historia del átomo EL MODELO DE RUTHERFORD • La mayor parte de los átomos eran ESPACIO VACÍO. • Los átomos poseían un centro denso que denominó NÚCLEO. • El NÚCLEO tenía carga POSITIVA. • Los ELECTRONES ORBITABAN alrededor del NÚCLEO. • Se denominó MODELO PLANETARIO.

La historia del átomo EL MODELO DE RUTHERFORD

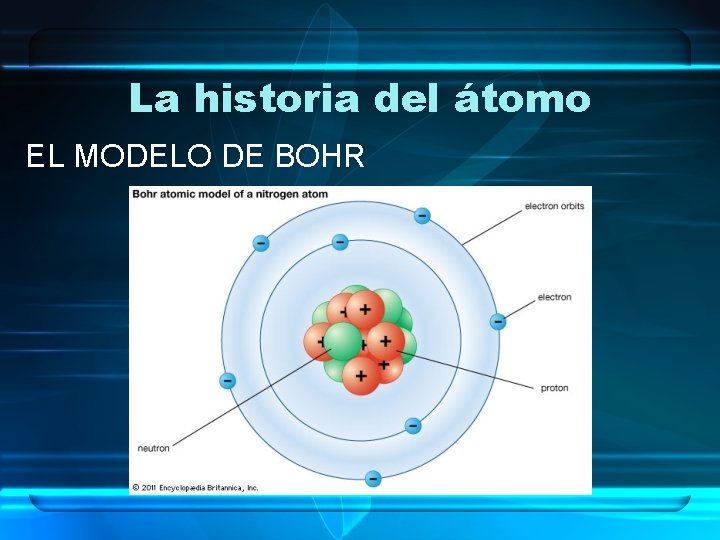
La historia del átomo BOHR (Comienzos del S. XX: 1913) • Fue discípulo de Rutherford. • Creó un nuevo modelo basado en el Modelo Planetario, en el que añadió: – Los ELECTRONES orbitaban el núcleo en ÓRBITAS FIJAS. – Se liberaba o absorbía ENERGÍA cuando los ELECTRONES CAMBIABAN de ÓRBITA.

La historia del átomo EL MODELO DE BOHR

La historia del átomo Schrödinger y Heisenberg (Comienzos del S. XX: 1920) • El modelo de Bohr funcionaba muy bien para el átomo de hidrógeno, pero para otros átomos difería un poco. • Mejoraron el modelo.

LA CARGA ELÉCTRICA LOS FENÓMENOS ELÉCTRICOS EN LA MATERIA

LA CARGA ELÉCTRICA Los fenómenos eléctricos pueden ser: • Atractivos: las partículas se atraen. • Repulsivos : las partículas se repelen.

LA CARGA ELÉCTRICA • La carga eléctrica es la responsable de los fenómenos eléctricos. • Existen dos tipos de carga eléctrica denominamos positiva y negativa. que • Las cargas que tienen distinto signo se atraen. • Las cargas que tienen el mismo signo se repelen.

LA CARGA ELÉCTRICA

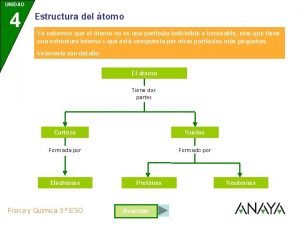
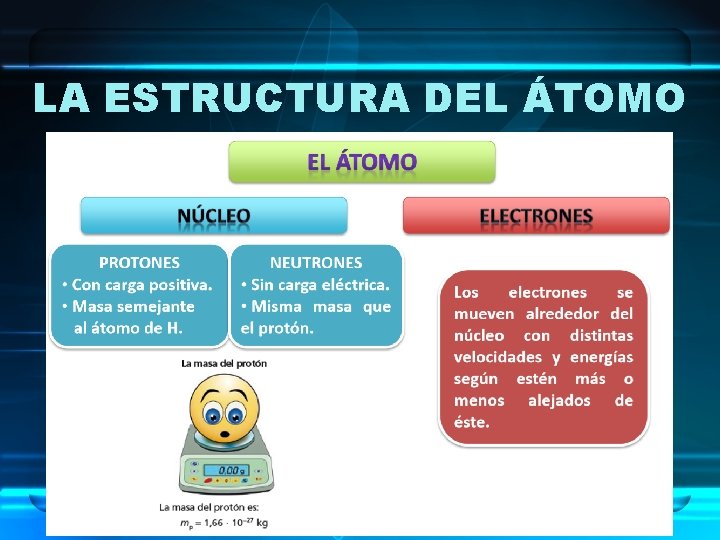
LA ESTRUCTURA DEL ÁTOMO • El átomo está compuesto por: –PROTONES (p+) Carga + –NEUTRONES (n) Sin carga –ELECTRONES (e-) Carga -

LA ESTRUCTURA DEL ÁTOMO • El átomo está compuesto por: – Un núcleo, que: • Contiene nucleones: protones y neutrones • Es muy pequeño. • Contiene toda la masa del átomo. – Una región fuera del núcleo, que contiene electrones, los cuales se mueven en unas órbitas alrededor del núcleo denominadas niveles de energía.

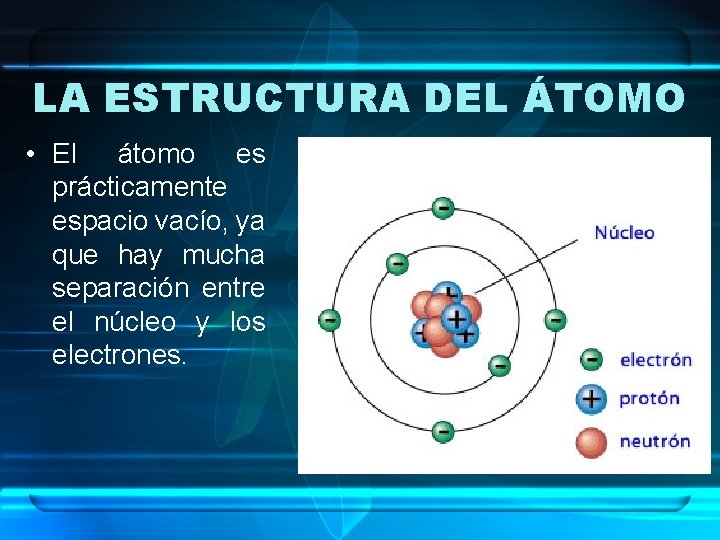
LA ESTRUCTURA DEL ÁTOMO • El átomo es prácticamente espacio vacío, ya que hay mucha separación entre el núcleo y los electrones.

LA ESTRUCTURA DEL ÁTOMO CARACTERÍSTICAS DE LAS PARTÍCULAS SUBATÓMICAS: • Protón (p+), es una partícula que, – Forma parte de los núcleos de todos los átomos. – Posee una masa semejante a la del neutrón y semejante a la del átomo de hidrógeno (H). – Tienen carga eléctrica positiva (+).

LA ESTRUCTURA DEL ÁTOMO CARACTERÍSTICAS DE LAS PARTÍCULAS SUBATÓMICAS: • Neutrón (n), es una partícula que, – Forma parte de los núcleos de todos los átomos. – Posee una masa semejante a la del protón y similar a la del átomo de hidrógeno (H). – No tiene carga eléctrica, es neutro.

LA ESTRUCTURA DEL ÁTOMO CARACTERÍSTICAS DE LAS PARTÍCULAS SUBATÓMICAS: • Electrón (e-), es una partícula que, – Se encuentra en niveles de energía alrededor del núcleo. – Poseen una masa que se considera despreciable, ya que es muy pequeña en comparación con la masa de protones y neutrones. – Tienen carga eléctrica negativa (-).

LA ESTRUCTURA DEL ÁTOMO

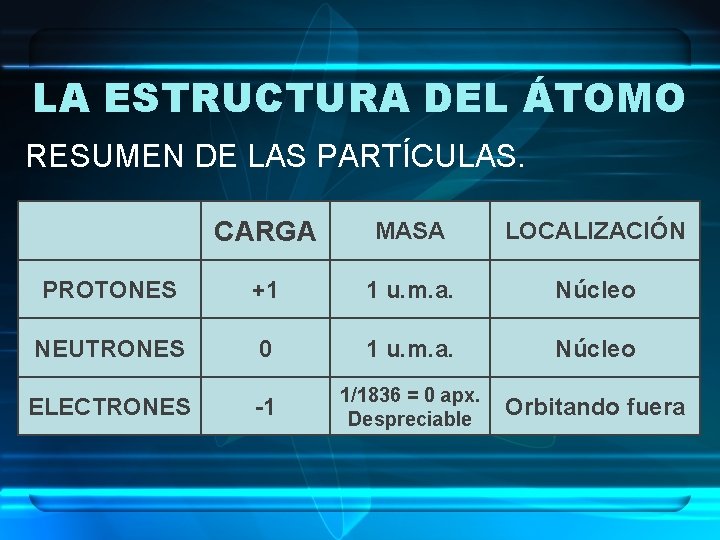
LA ESTRUCTURA DEL ÁTOMO RESUMEN DE LAS PARTÍCULAS. CARGA MASA LOCALIZACIÓN PROTONES +1 1 u. m. a. Núcleo NEUTRONES 0 1 u. m. a. Núcleo ELECTRONES -1 1/1836 = 0 apx. Despreciable Orbitando fuera

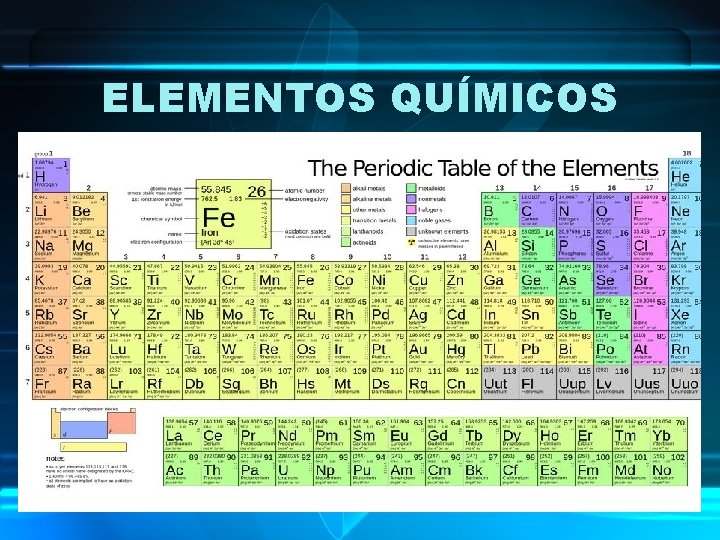
ELEMENTOS QUÍMICOS ELEMENTOS: • Un elemento es un tipo de materia que contiene el mismo tipo de átomos. • Los distintos átomos que se han encontrado en la naturaleza se han clasificado en lo que se conoce como “la tabla periódica de los elementos”. • Los átomos de los distintos elementos se diferencian en el número de partículas subatómicas que tienen.

ELEMENTOS QUÍMICOS

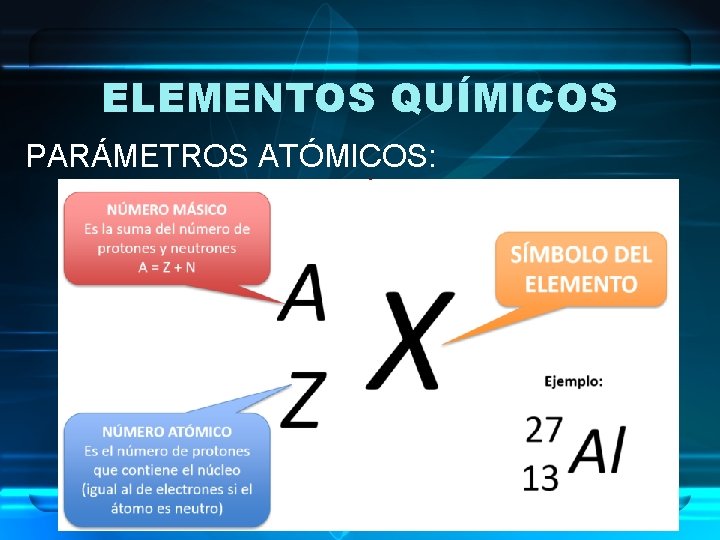
ELEMENTOS QUÍMICOS PARÁMETROS ATÓMICOS: • Número atómico (Z): número de protones que contiene el núcleo de un átomo. • Número másico (A): suma del número de protones y neutrones que contiene el núcleo del átomo. Nos indica la masa del átomo en u o u. m. a. (unidad de masa atómica).

ELEMENTOS QUÍMICOS PARÁMETROS ATÓMICOS:

ELEMENTOS QUÍMICOS PARÁMETROS ATÓMICOS: ¡El número atómico (Z) es único para cada elemento!, es como el DNI de cada elemento.

ELEMENTOS QUÍMICOS PARÁMETROS ATÓMICOS: • Ejemplo: ¿Cuántas partículas subatómicas tiene el siguiente elemento?

ELEMENTOS QUÍMICOS Número de partículas subatómicas en un átomo neutro: • Número de protones: (p+ = Z) • Número de neutrones: (n = A – Z) • Número de electrones: (e- = p+) En los átomos neutros el número de protones y electrones es igual.

ELEMENTOS QUÍMICOS PARÁMETROS ATÓMICOS: • Ejercicios: Busca en la tabla periódica y di el número atómico, número másico, número de protones y número de neutrones que posee cada uno de los siguientes elemento: • Oro, Cobre, Aluminio, Cobalto, Wolframio e Hidrógeno. • Ag, S, Cl, Mn, Mg y Pt.

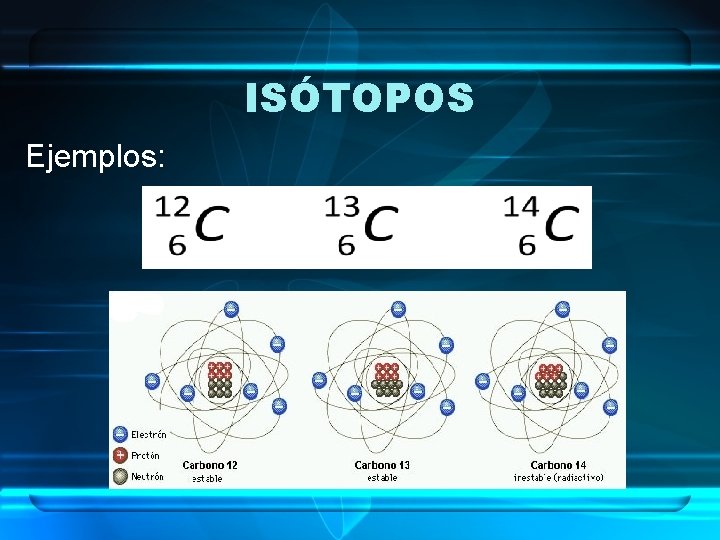
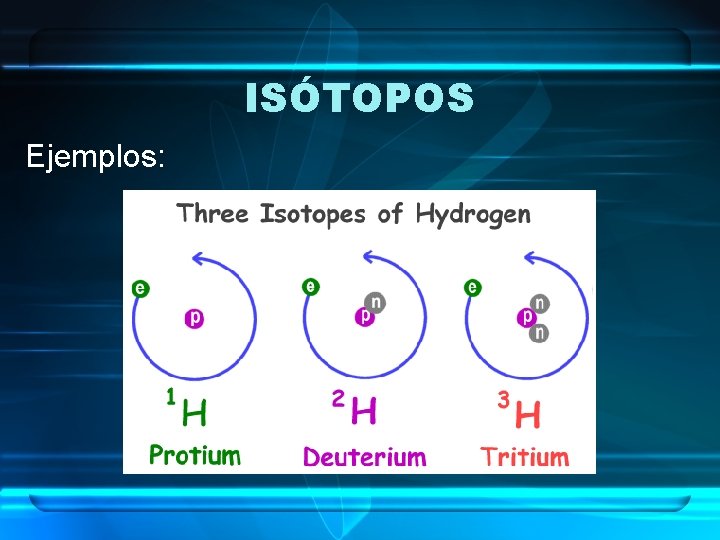
ISÓTOPOS • Son átomos de un mismo elemento que tienen distinto número másico (A). • Por tanto, se diferencian en que su núcleo contiene distinto número de neutrones. • Es decir, tienen mismo número de protones pero distinto número de neutrones.

ISÓTOPOS Ejemplos:

ISÓTOPOS Ejemplos:

ISÓTOPOS USOS DE LOS ISÓTOPOS: Los isotopos radiactivos son los más ampliamente usados en diversos campos, entre los que están • • Agricultura Ganadería Metalurgia Ingeniería de motores • Medicina • Investigaciones biológicas • Antropología • Geología • Historia • Esterilización de alimentos enlatados • Industria de los plásticos Por ejemplo, existe la llamada prueba del Carbono 14 con el cual es posible determinar de qué época datan restos arqueológicos.

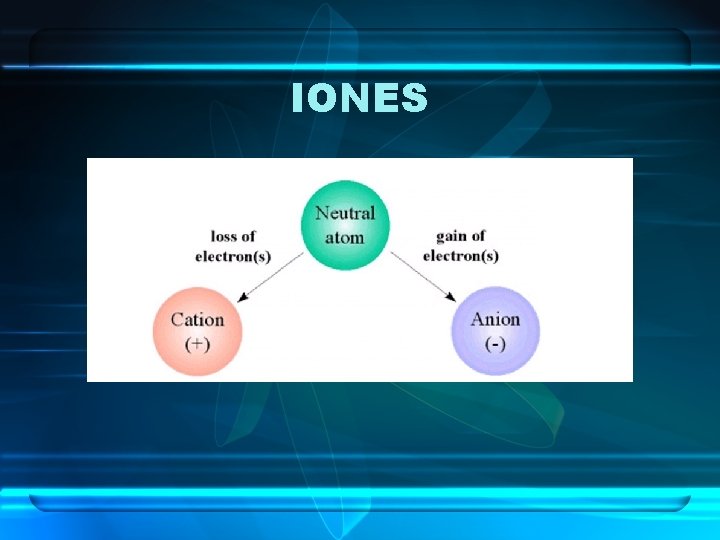
IONES Cuando los átomos dejan de ser neutros se convierten en IONES

IONES • Un ION es un átomo que ha ganado o ha perdido electrones. • El proceso por el cual el átomo gana o pierde electrones se denomina ionización. Se puede producir por fricción, descargas eléctricas, altas temperaturas, colisiones…

IONES ANIONES Y CATIONES • Un átomo que gana electrones adquiere carga neta negativa y se denomina ion negativo o anión. • Un átomo que pierde electrones adquiere carga neta positiva y se denomina ion positivo o catión.

IONES CATIÓN ANIÓN

IONES

IONES
 Operaciones algebraicas 2 eso
Operaciones algebraicas 2 eso Simbologia electrica 2 eso
Simbologia electrica 2 eso Ed
Ed Electrización por frotamiento ejemplos
Electrización por frotamiento ejemplos Fsica
Fsica Fsica
Fsica Particula en movimiento
Particula en movimiento Vector unitario
Vector unitario Aceleracion tangencial formula
Aceleracion tangencial formula Grandezas
Grandezas Resolução
Resolução Esta compuesto
Esta compuesto Fsica
Fsica Movimento
Movimento Division de la fisica clasica
Division de la fisica clasica Fsica
Fsica I y j vectores
I y j vectores Fsica
Fsica Apoyo fijo movil y empotrado
Apoyo fijo movil y empotrado Fsica
Fsica Fsica
Fsica Fsica
Fsica Fsica
Fsica 4
4 Fsica
Fsica Fsica
Fsica Que es entrevista estructurada
Que es entrevista estructurada Naturalisme seniman
Naturalisme seniman Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Subtema
Subtema Tema general y tema delimitado ejemplos
Tema general y tema delimitado ejemplos Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Tomo el jugo en un a. cuchillo b. vaso c. plato
Tomo el jugo en un a. cuchillo b. vaso c. plato Esde tomo 2
Esde tomo 2 Codigo nacional de electricidad tomo iv
Codigo nacional de electricidad tomo iv 1 tomo
1 tomo Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Tomo podstenšek
Tomo podstenšek E+a galaxy
E+a galaxy Partes del tomo
Partes del tomo Mensajes selectos tomo 1 pdf
Mensajes selectos tomo 1 pdf Tomo fix
Tomo fix Mensajes selectos tomo 1
Mensajes selectos tomo 1 Ajla tomo
Ajla tomo Tomo mano romanas veimare
Tomo mano romanas veimare Tömő utca onkológia
Tömő utca onkológia Estructura del atomo
Estructura del atomo