Fsica y Qumica 3 ESO gua interactiva para














- Slides: 23

Física y Química 3º ESO: guía interactiva para la resolución de ejercicios CLASIFICACIÓN DE LA MATERIA Mezclas, disoluciones y dispersiones I. E. S. Élaios Departamento de Física y Química I. E. S. Élaios de Física y Química Departamento

§ Clasificación de los sistemas. Índice © Composición de una disolución. ª Solubilidad y temperatura. § Ejercicio 1 © Ejercicio 11 § Ejercicio 2 ª Ejercicio 12 § Ejercicio 3 ª Ejercicio 13 © Ejercicio 4 ª Ejercicio 14 © Ejercicio 5 ª Ejercicio 15 © Ejercicio 6 ª Ejercicio 16 © Ejercicio 7 ª Ejercicio 17 © Ejercicio 8 ª Ejercicio 18 © Ejercicio 9 © Ejercicio 10 I. E. S. Élaios Departamento de Física y Química

Ayuda • • • Los sistemas en los que se puede distinguir sus componentes a simple vista o con ayuda de una lupa se denominan mezclas heterogéneas o, simplemente, mezclas. Los sistemas en los que no se puede distinguir sus componentes a simple vista o con ayuda de una lupa o microscopio se denominan disoluciones. Los sistemas en los que el tamaño de las partículas de los componentes es tal que no puede verse con la lupa pero sí con el microscopio se denominan dispersiones o coloides. I. E. S. Élaios Departamento de Física y Química

Ayuda Porcentaje en masa (% en masa). Indica la masa de soluto disuelto en 100 g de disolución. Se calcula mediante: • • Una disolución es una mezcla homogénea de dos o más sustancias. Cuando una sustancia se disuelve en otra decimos que es soluble en la otra sustancia. La sustancia que se disuelve en otra y que, por tanto, se encuentra en menor proporción, se denomina soluto. La sustancia que disuelve a otra u otras y que, por tanto, se encuentra en mayor proporción, se denomina disolvente. La composición de una disolución expresa la cantidad de soluto disuelta en una determinada cantidad de disolvente. Una disolución diluida contiene una cantidad de soluto muy pequeña comparada con la cantidad de disolvente. Una disolución concentrada contiene una gran cantidad de soluto respecto a la cantidad de disolvente. Porcentaje en volumen (% en volumen). Expresa el volumen de soluto disuelto en 100 volúmenes de disolución. Se calcula mediante: Concentración en masa (r). Indica la masa de soluto que se encuentra disuelta en una unidad de volumen de disolución. Se mide en gramos por litro (g/l) o en miligramos por litro (mg/l). Se obtiene mediante: I. E. S. Élaios Departamento de Física y Química

Ayuda ® ® Hay sustancias que son solubles en cualquier proporción (por ejemplo, el alcohol y el agua), pero otras sólo lo son hasta un cierto límite (por ejemplo, la sal de la cocina en agua). Llega un momento en el que el soluto añadido no se disuelve más, aunque agitemos. Se dice entonces que la disolución está saturada de soluto. Se denomina solubilidad a la máxima masa de una sustancia que puede disolverse en un volumen determinado –o en una masa determinada- de disolvente. La solubilidad mide, entonces, en g/100 cm 3 de agua o en g/100 g de agua. Cada sustancia tiene una solubilidad diferente en un determinado disolvente. Por esta razón se dice que la solubilidad es una propiedad característica. Como propiedad característica sirve para identificar las sustancias. Se sabe que, por ejemplo, la solubilidad del azúcar es mayor cuando la leche está caliente. En general, la solubilidad de una sustancia sólida en un disolvente líquido aumenta con la temperatura. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 1 Clasifica los siguientes sistemas químicos en mezcla heterogénea, disolución y dispersión: agua de mar, granito, humo, aleación de cobre y níquel, vino, colonia, leche, aire, bronce y mayonesa. Agua de mar filtrada Granito Humo Aleación de cobre y níquel Vino Colonia Leche Aire Bronce Mayonesa Disolución Mezcla Dispersión Disolución Dispersión Disolución Dispersión Haz clic para ver la solución I. E. S. Élaios Departamento de Física y Química

EJERCICIO 2 Estás en la cocina y dispones de los siguientes alimentos: harina, azúcar, aceite de oliva, huevos batidos, vinagre, aceite de girasol y agua. Utilizando dichos alimentos indica cómo prepararías los siguientes sistemas químicos: Una mezcla heterogénea de dos sólidos Una mezcla heterogénea de dos líquidos Una dispersión sólido-líquido Una dispersión líquido-líquido Una disolución de un sólido en un líquido Una disolución de un líquido en otro líquido Harina y azúcar Agua y aceite (de oliva o de girasol) Harina y agua, batiéndolo bien Huevos y aceite (mayonesa) Azúcar y agua Vinagre y agua o los dos aceites Haz clic para ver la solución I. E. S. Élaios Departamento de Física y Química

EJERCICIO 3 Clasifica los siguientes sistemas químicos en mezcla heterogénea, disolución y dispersión a partir de las imágenes que se muestran. Agua de manantial Disolución Moneda de 2 € (parte dorada) Disolución Granito Mezcla heterogénea Niebla Dispersión Espuma de afeitar Dispersión Natillas (sólo) Dispersión I. E. S. Élaios Departamento de Física y Química

EJERCICIO 4 Una disolución contiene 30 g de azúcar en 400 g de agua. ¿Cuál es el porcentaje en masa de azúcar en esta disolución? # Escribe la expresión matemática del porcentaje en masa en función de las masas del soluto y del disolvente. # ¿Cuál es la masa de soluto? Masa de soluto = 30 g de azúcar # ¿Cuál es la masa de disolvente? Masa de disolvente = 400 g de agua # Calcula el porcentaje en masa de azúcar. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 5 El yodo es una sustancia sólida que se disuelve en alcohol. Un farmacéutico toma una porción de alcohol y disuelve en ella 4 g de yodo; después, añade más alcohol hasta tener 500 g de disolución. Calcula el porcentaje en masa de yodo en la disolución obtenida. # Escribe la expresión matemática del porcentaje en masa en función de las masas del soluto y de la disolución. # ¿Cuál es la masa de soluto? Masa de soluto = 4 g de yodo # ¿Cuál es la masa de disolución? Masa de disolución = 500 g # Calcula el porcentaje en masa de yodo. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 6 El porcentaje en volumen de alcohol etílico en un vino de la tierra suele ser del 12, 5%. Durante una comida, un individuo ingiere media botella de 75 cm 3 de vino. ¿Qué volumen de alcohol etílico ha incorporado a su cuerpo? # Escribe la expresión matemática del porcentaje en volumen en función de los volúmenes del soluto y de la disolución. # A partir de la expresión anterior, escribe el volumen de soluto en función del resto de las magnitudes. # ¿Cuál es el volumen de disolución? Volumen de disolución = 37, 5 cm 3 de vino # Calcula el volumen de soluto. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 7 Se disuelven 50 g de azúcar en agua hasta obtener 2 litros de disolución. (a) Calcula la concentración en masa (g/l) de la disolución obtenida. (b) ¿Qué volumen de esta disolución hemos de tomar para que contenga 5 g de azúcar? # Escribe la expresión de la concentración en masa, en función de la masa de soluto y el volumen de disolución # Calcula la concentración en masa de la disolución de azúcar. # Despeja el volumen de disolución en la expresión de la concentración en masa. # Calcula el volumen de disolución que contiene los 5 g de azúcar. I. E. S. Élaios Departamento de Física y Química

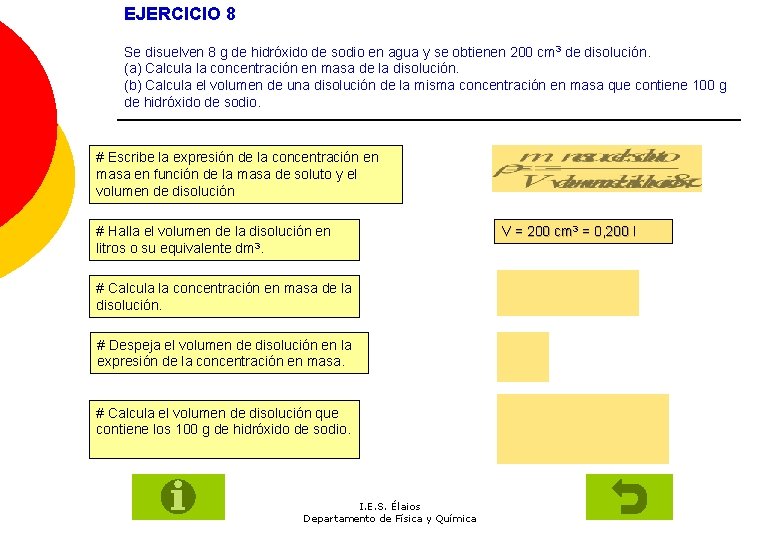
EJERCICIO 8 Se disuelven 8 g de hidróxido de sodio en agua y se obtienen 200 cm 3 de disolución. (a) Calcula la concentración en masa de la disolución. (b) Calcula el volumen de una disolución de la misma concentración en masa que contiene 100 g de hidróxido de sodio. # Escribe la expresión de la concentración en masa en función de la masa de soluto y el volumen de disolución # Halla el volumen de la disolución en litros o su equivalente dm 3. # Calcula la concentración en masa de la disolución. # Despeja el volumen de disolución en la expresión de la concentración en masa. # Calcula el volumen de disolución que contiene los 100 g de hidróxido de sodio. I. E. S. Élaios Departamento de Física y Química V = 200 cm 3 = 0, 200 l

EJERCICIO 9 Explica con detalle cómo prepararías 250 cm 3 de una disolución de cloruro de sodio de composición en masa 20 g/l. # Vamos a calcular, en primer lugar, la masa de soluto que se necesita; para ello, despeja la masa de soluto en la expresión de la concentración en masa. # Calcula la masa de soluto (cloruro de sodio). # Describe el procedimiento que seguirías para prepara la citada disolución, incluyendo los aparatos utilizados. 1. Se pesan 5 g de cloruro de sodio en una balanza. 2. Se añade agua al recipiente que contiene el cloruro de sodio y se agita hasta que se disuelva. 3. Se vierte esta disolución en un matraz aforado de 250 cm 3. 4. Se añade agua al matraz hasta el enrase. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 10 Al analizar el agua de un río se encuentra que contiene 6 mg de nitratos en 200 ml. Calcula la concentración en nitratos del agua del río, expresando el resultado en g/l y en mg/l. # Expresa la masa de soluto en gramos y el volumen de disolución en litros. Masa de soluto = 0, 006 g de nitratos Volumen de disolución = 0, 2 l # Calcula la concentración en nitratos en g/l. # Expresa la concentración anterior en mg/l. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 11 Mortadelo y Filemón preparan dos disoluciones. La disolución del primero contiene 2, 5 g de cloruro de potasio en 200 cm 3 de disolución y la del segundo 5 g del mismo soluto en 500 cm 3 de disolución. ¿Cuál es más concentrada? Razona la respuesta. # Calcula la concentración en masa de la disolución preparada por Mortadelo. # Calcula la concentración en masa de la disolución preparada por Filemón. # ¿Qué disolución es más concentrada? Es más concentrada la primera disolución, ya que contiene más masa de soluto por unidad de volumen de disolución –por cada litro de disolución-. I. E. S. Élaios Departamento de Física y Química

EJERCICIO 12 A 25 ºC se disuelve como máximo 180 g de nitrato de sodio en 200 g de agua. (a) ¿Qué significa que esta disolución esté saturada? (b) ¿Cuál es la solubilidad del nitrato de sodio en agua a esa temperatura? (c) Si se disuelve 50 g de nitrato de sodio en 100 g de agua a 25 ºC, ¿se obtiene una disolución saturada? Razona la respuesta. # Contesta al apartado (a). Significa que dicha disolución no admite más soluto: se ha disuelto la máxima masa posible. # Contesta al apartado (b). Si 200 g de agua se disuelve como máximo 180 g de nitrato de sodio, en 100 g de agua se disolverá la mitad de soluto; por lo tanto, la solubilidad es 90 g de nitrato / 100 g de agua. # Contesta al apartado (c). No se obtiene una disolución saturada, ya que los 100 g de disolvente admiten hasta 90 g de nitrato de sodio y sólo se ha disuelto 50 g de dicho nitrato. I. E. S. Élaios Departamento de Física y Química

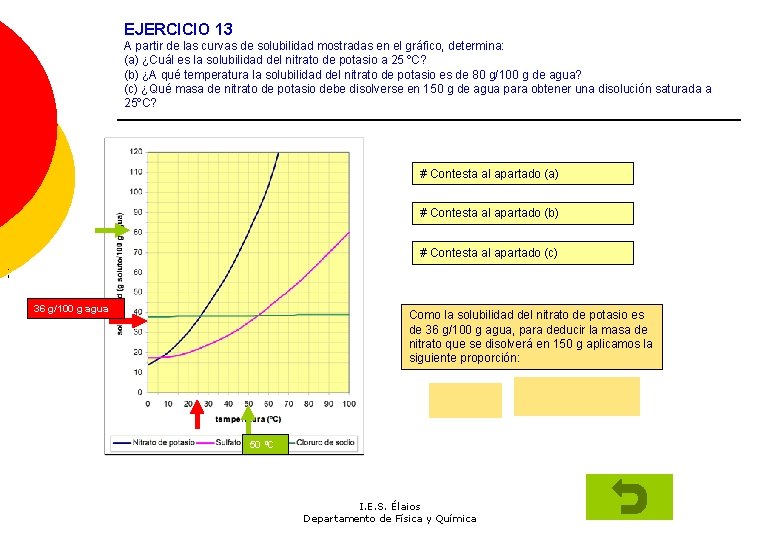
EJERCICIO 13 A partir de las curvas de solubilidad mostradas en el gráfico, determina: (a) ¿Cuál es la solubilidad del nitrato de potasio a 25 ºC? (b) ¿A qué temperatura la solubilidad del nitrato de potasio es de 80 g/100 g de agua? (c) ¿Qué masa de nitrato de potasio debe disolverse en 150 g de agua para obtener una disolución saturada a 25ºC? # Contesta al apartado (a) # Contesta al apartado (b) # Contesta al apartado (c) ; 36 g/100 g agua Como la solubilidad del nitrato de potasio es de 36 g/100 g agua, para deducir la masa de nitrato que se disolverá en 150 g aplicamos la siguiente proporción: 50 ºC I. E. S. Élaios Departamento de Física y Química

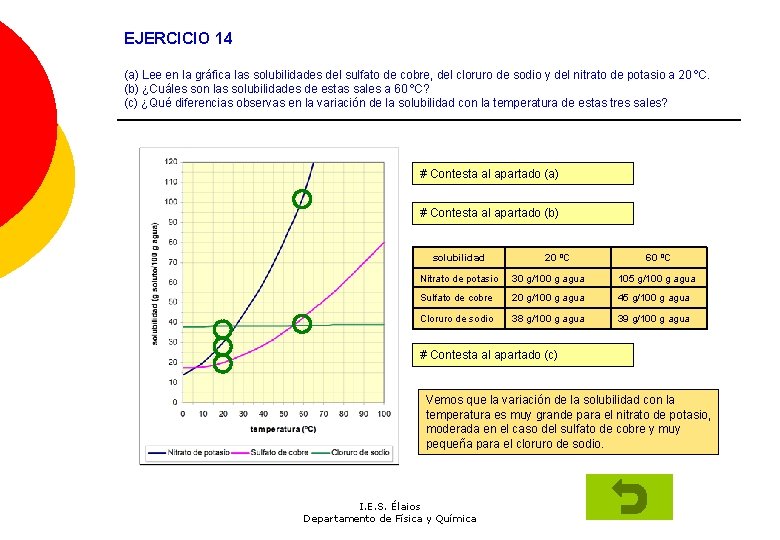
EJERCICIO 14 (a) Lee en la gráfica las solubilidades del sulfato de cobre, del cloruro de sodio y del nitrato de potasio a 20 ºC. (b) ¿Cuáles son las solubilidades de estas sales a 60 ºC? (c) ¿Qué diferencias observas en la variación de la solubilidad con la temperatura de estas tres sales? # Contesta al apartado (a) # Contesta al apartado (b) solubilidad 20 ºC 60 ºC Nitrato de potasio 30 g/100 g agua 105 g/100 g agua Sulfato de cobre 20 g/100 g agua 45 g/100 g agua Cloruro de sodio 38 g/100 g agua 39 g/100 g agua # Contesta al apartado (c) Vemos que la variación de la solubilidad con la temperatura es muy grande para el nitrato de potasio, moderada en el caso del sulfato de cobre y muy pequeña para el cloruro de sodio. I. E. S. Élaios Departamento de Física y Química

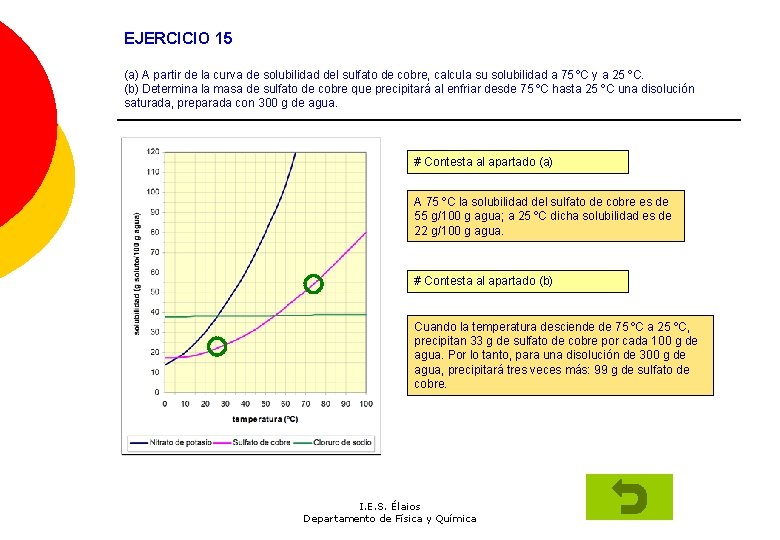
EJERCICIO 15 (a) A partir de la curva de solubilidad del sulfato de cobre, calcula su solubilidad a 75 ºC y a 25 ºC. (b) Determina la masa de sulfato de cobre que precipitará al enfriar desde 75 ºC hasta 25 ºC una disolución saturada, preparada con 300 g de agua. # Contesta al apartado (a) A 75 ºC la solubilidad del sulfato de cobre es de 55 g/100 g agua; a 25 ºC dicha solubilidad es de 22 g/100 g agua. # Contesta al apartado (b) Cuando la temperatura desciende de 75 ºC a 25 ºC, precipitan 33 g de sulfato de cobre por cada 100 g de agua. Por lo tanto, para una disolución de 300 g de agua, precipitará tres veces más: 99 g de sulfato de cobre. I. E. S. Élaios Departamento de Física y Química

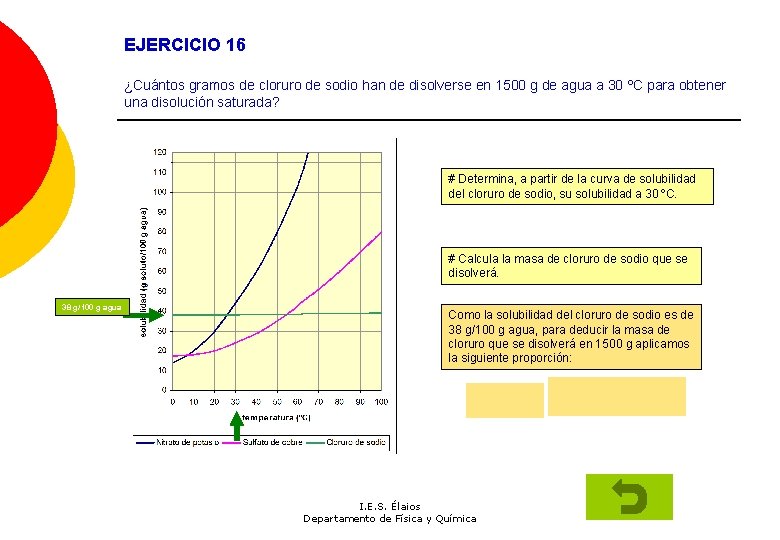
EJERCICIO 16 ¿Cuántos gramos de cloruro de sodio han de disolverse en 1500 g de agua a 30 ºC para obtener una disolución saturada? # Determina, a partir de la curva de solubilidad del cloruro de sodio, su solubilidad a 30 ºC. # Calcula la masa de cloruro de sodio que se disolverá. 38 g/100 g agua Como la solubilidad del cloruro de sodio es de 38 g/100 g agua, para deducir la masa de cloruro que se disolverá en 1500 g aplicamos la siguiente proporción: I. E. S. Élaios Departamento de Física y Química

EJERCICIO 17 (a) Si añadimos 45 g de nitrato de potasio a 100 g de agua a 20 ºC y agitamos, ¿qué masa de nitrato de potasio se disolverá? ¿Qué masa quedará sin disolver? (b) ¿Qué pasará si intentamos disolver los 45 g de nitrato de potasio en 200 g de agua a 20 ºC? # Determina, a partir de la curva de solubilidad del nitrato de potasio, su solubilidad a 20 ºC. Después, contesta al apartado (a). Como la solubilidad del nitrato de potasio a 20 ºC es de 30 g/100 g agua, se disolverá 30 g de nitrato y quedará sin disolver 15 g de dicha sal. # Contesta al apartado (b) 30 g/100 g agua Una masa de 200 g de agua a 20 ºC admite que se disuelva en ella hasta un máximo de 60 g de nitrato de potasio. Por lo tanto, los 45 g de nitrato se disolverán completamente, obteniéndose una disolución que no está saturada. I. E. S. Élaios Departamento de Física y Química

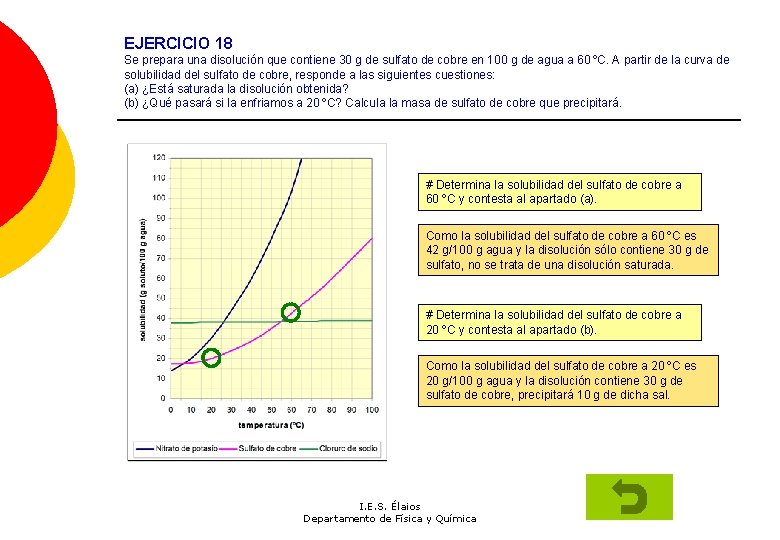
EJERCICIO 18 Se prepara una disolución que contiene 30 g de sulfato de cobre en 100 g de agua a 60 ºC. A partir de la curva de solubilidad del sulfato de cobre, responde a las siguientes cuestiones: (a) ¿Está saturada la disolución obtenida? (b) ¿Qué pasará si la enfriamos a 20 ºC? Calcula la masa de sulfato de cobre que precipitará. # Determina la solubilidad del sulfato de cobre a 60 ºC y contesta al apartado (a). Como la solubilidad del sulfato de cobre a 60 ºC es 42 g/100 g agua y la disolución sólo contiene 30 g de sulfato, no se trata de una disolución saturada. # Determina la solubilidad del sulfato de cobre a 20 ºC y contesta al apartado (b). Como la solubilidad del sulfato de cobre a 20 ºC es 20 g/100 g agua y la disolución contiene 30 g de sulfato de cobre, precipitará 10 g de dicha sal. I. E. S. Élaios Departamento de Física y Química
 Agua gua gua
Agua gua gua Perspectiva interactiva
Perspectiva interactiva Metoda diamantului schema
Metoda diamantului schema La lectura interactiva
La lectura interactiva Teoría de la comunicación digital interactiva
Teoría de la comunicación digital interactiva Cubul metoda interactiva
Cubul metoda interactiva Afa cartas de porte
Afa cartas de porte Cuerpos geometricos senati
Cuerpos geometricos senati Zona interactiva dreamweaver
Zona interactiva dreamweaver Aceleracion centripeta formula
Aceleracion centripeta formula Ramas de la física moderna
Ramas de la física moderna Fsica
Fsica Produto escalar
Produto escalar Trabajo neto ciclo de carnot
Trabajo neto ciclo de carnot Apoyo fijo movil y empotrado
Apoyo fijo movil y empotrado Lógica
Lógica Fsica
Fsica Movimento retardado
Movimento retardado Mapa mental movimento uniforme
Mapa mental movimento uniforme Ed
Ed Unidades de medida
Unidades de medida Fsica
Fsica I y j fisica
I y j fisica Força centripeta
Força centripeta













































