Tema 13 1 Fsica y qumica 1 de







- Slides: 27

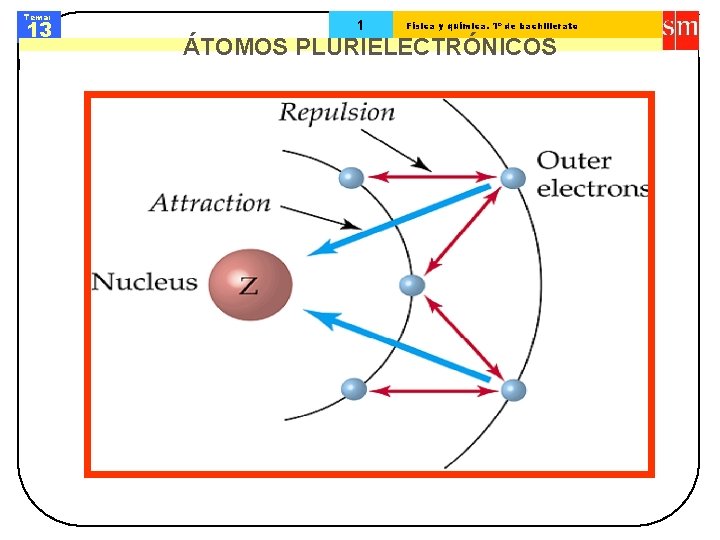
Tema: 13 1 Física y química. 1º de bachillerato ÁTOMOS PLURIELECTRÓNICOS

Tema: 13 1 Física y química. 1º de bachillerato ÁTOMOS PLURIELECTRÓNICOS 1) Aumento de la carga nuclear (Z) • El orbital es más estable • El electrón es más difícil de remover 2) Aumento de las repulsiones electrónicas v Más electrones en el mismo orbital v Más electrones en orbitales internos • El orbital se desestabiliza • El electrón es más fácil de remover v Electrones en orbitales de diferente penetración • El orbital más penetrante es más estable • Penetración: s > p > d > f

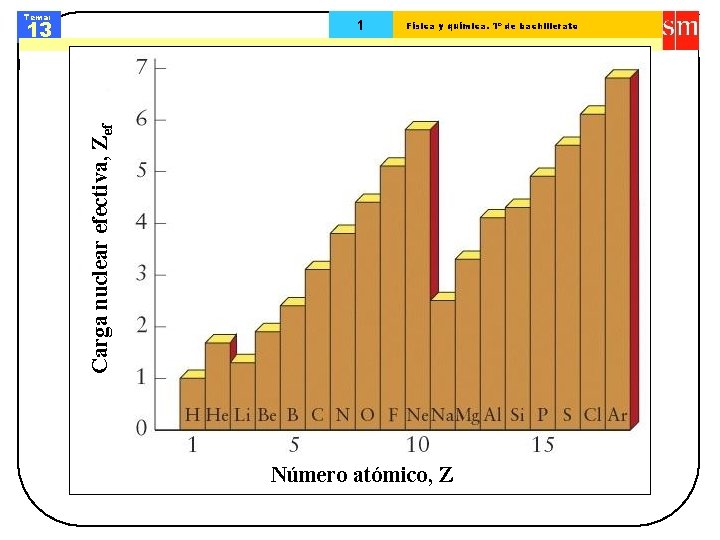
Tema: 13 Física y química. 1º de bachillerato Carga nuclear efectiva, Zef 1 Número atómico, Z

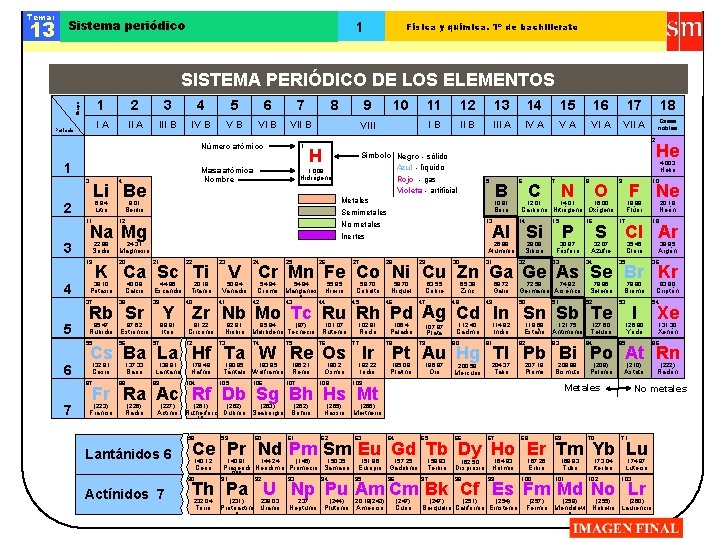
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato SISTEMA PERIÓDICO DE LOS ELEMENTOS Grupo 1 2 IA Periodo II A 3 III B 4 5 IV B 6 VB VI B 7 3 Li Be 6, 94 2 Litio 11 3 19 4 Potasio Calcio Símbolo Negro - sólido Azul - líquido Rojo - gas Violeta - artificial Metales Semimetales No metales 44, 96 Escandio 87, 62 88, 91 Rubidio Estroncio Itrio 57 20, 18 Titanio 40 23 24 25 26 27 28 Bario 88 138, 91 89 VA Vanadio 41 91, 22 Circonio 54, 94 Cromo Manganes o 42 92, 91 Niobio 73 178, 49 Hafnio 104 Francio (226) Radio (227) (261) 43 95, 94 (97) Molibdeno Tecnecio 74 75 180, 95 183, 85 Tántalo Wolframio 105 106 (262) (263) Actinio Rutherford Dubnio Seaborgio io 58 Lantánidos 6 18 VII A Gases nobles 5 B 10, 81 Boro 13 29 6 C 8 O 14, 01 9 59 140, 12 60 55, 85 Hierro 44 58, 70 Cobalto 45 101, 07 Rutenio 76 58, 70 Niquel 46 102, 91 Rodio 77 186, 21 Renio 107 190, 2 Osmio 108 28, 09 Silicio 32 15 P 30, 97 Fósforo 33 F Ne 16, 00 16 S 32, 07 18, 99 17 Torio Neón 18 Cl Ar 35, 45 Cloro 35 39, 95 Argón 36 63, 55 65, 38 Cobre 47 69, 72 Zinc 48 Galio 49 72, 59 74, 92 Germanio Arsénico 50 51 78, 96 Selenio 52 192, 22 Iridio 106, 4 Paladio 78 107, 87 Plata 79 112, 40 Cadmio 80 114, 82 Indio 81 118, 69 121, 75 Estaño Antimonio 82 83 (262) Bohrio 61 (265) Hassio 62 127, 60 Telurio 84 79, 90 Bromo 53 I 126, 90 Yodo 85 140, 91 144, 24 (145) 150, 35 195, 09 Platino 196, 97 Oro 200, 59 Mercurio 204, 37 Talio 207, 19 Plomo 208, 98 Bismuto (209) Polonio (210) Astato Metales 92 93 94 64 65 157, 25 Europio Gadolinio 95 (231) 238, 03 Protoactini Uranio o 237 (244) Neptunio Plutonio 20, 18(243) Americio Xe 131, 30 Xenón 66 67 68 69 70 96 158, 93 Terbio 97 162, 50 Disprosio 98 164, 93 Holmio 99 167, 26 Erbio 100 168, 93 Tulio 71 101 173, 04 Iterbio 102 (247) Curio (247) (251) (254) Berquelio Californio Einstenio (257) (258) (255) (222) Radón No metales Meitnerio 151, 96 54 86 (266) 63 83, 80 Criptón Pt Au Hg Tl Pb Bi Po At Rn 174, 97 Lutecio 103 Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr 232, 04 20, 18 Flúor Azufre 34 109 Praseodi Neodimio Promecio Samario mio 91 90 He 10 Carbono Nitrógeno Oxígeno 14 31 N 12, 01 Al Si 30 7 Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Cerio Actínidos 7 17 4, 003 Fr Ra Ac Rf Db Sg Bh Hs Mt (223) VI A Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te 72 Lantano IV A 16 V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 50, 94 Cs Ba La Hf Ta W Re Os Ir 137, 33 15 Helio Aluminio 22 14 III A 26, 98 39 56 13 II B Inertes 21 40, 08 85, 47 Cesio IB Magnesio 38 132, 91 12 24, 31 Rb Sr Y 87 7 Berilio K Ca Sc Ti 39, 10 55 6 1, 008 Hidrógeno 9, 01 20 37 5 H Na Mg Sodio 11 VIII 12 22, 99 10 2 1 Masa atómica Nombre 4 9 VII B Número atómico 1 8 (260) Fermio Mendelevi Nobelio Laurencio o

Tema: 13 1 Física y química. 1º de bachillerato TABLA PERIÓDICA q Ley periódica q Grupos y períodos

Tema: 13 1 Física y química. 1º de bachillerato

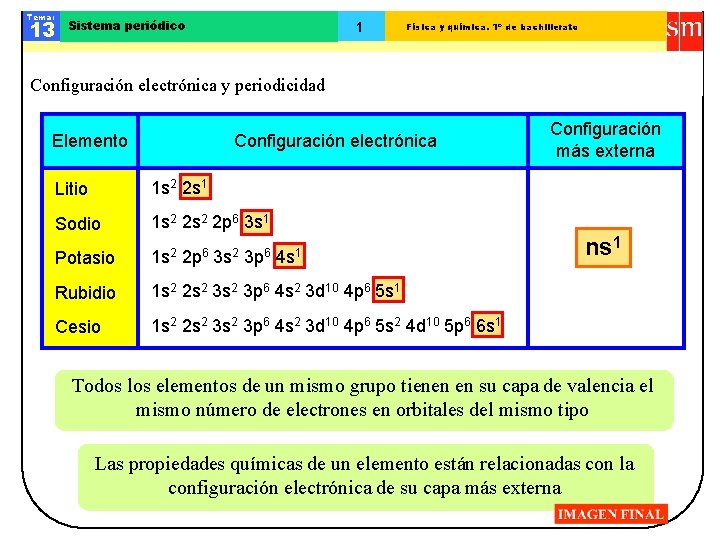
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Configuración electrónica y periodicidad Elemento Configuración electrónica Litio 1 s 2 2 s 1 Sodio 1 s 2 2 p 6 3 s 1 Potasio 1 s 2 Rubidio 1 s 2 2 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 1 Cesio 1 s 2 2 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 1 2 p 6 3 s 2 3 p 6 4 s 1 Configuración más externa ns 1 Todos los elementos de un mismo grupo tienen en su capa de valencia el mismo número de electrones en orbitales del mismo tipo Las propiedades químicas de un elemento están relacionadas con la configuración electrónica de su capa más externa

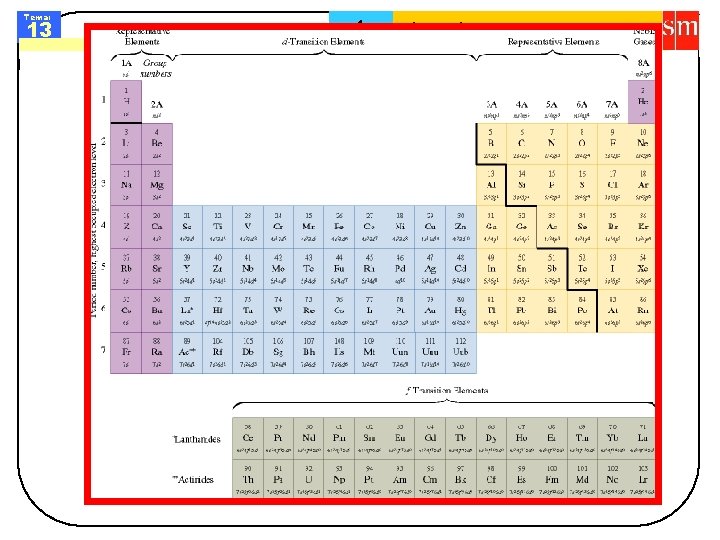
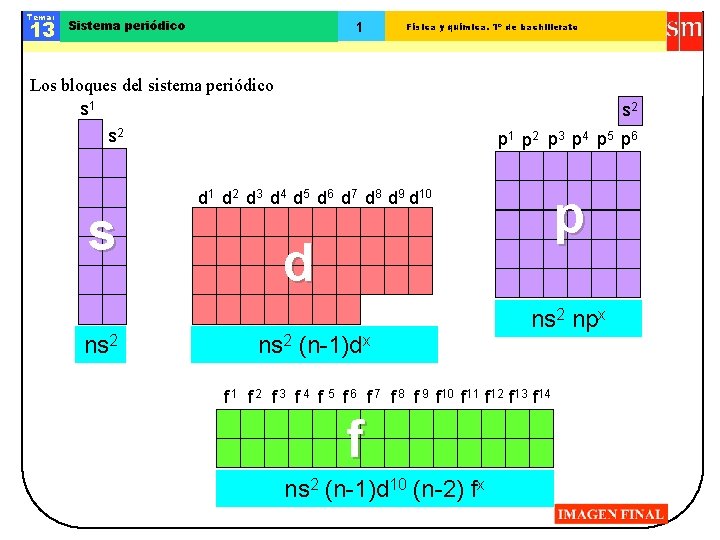
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Los bloques del sistema periódico s 1 s 2 s ns 2 p 1 p 2 p 3 p 4 p 5 p 6 p d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9 d 10 d ns 2 (n-1)dx ns 2 npx f 1 f 2 f 3 f 4 f 5 f 6 f 7 f 8 f 9 f 10 f 11 f 12 f 13 f 14 f ns 2 (n-1)d 10 (n-2) fx

Tema: 13 1 Física y química. 1º de bachillerato PROPIEDADES PERIÓDICAS MAGNITUDES DE TAMAÑO Volumen Atómico (Va) MAGNITUDES ENERGÉTICAS Potencial de Ionización (PI) Electroafinidad (EA) Radio Atómico (Ra) Radio Covalente (Rc) Electronegatividad (EN)

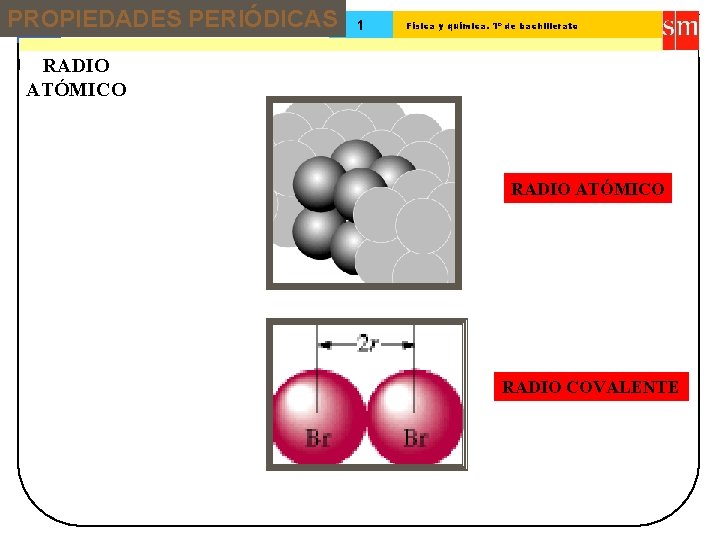
PROPIEDADES PERIÓDICAS 13 Tema: 1 Física y química. 1º de bachillerato RADIO ATÓMICO RADIO COVALENTE

PROPIEDADES PERIÓDICAS 13 Tema: RADIO ATÓMICO 1 Física y química. 1º de bachillerato

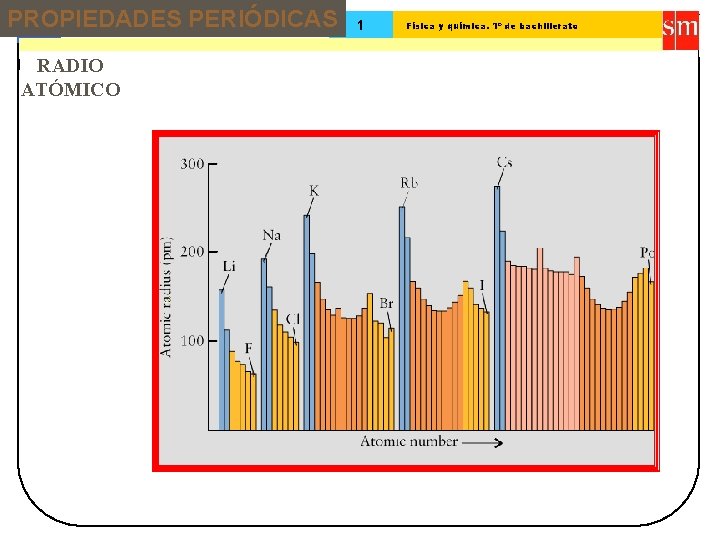
PROPIEDADES PERIÓDICAS 13 Tema: RADIO ATÓMICO 1 Física y química. 1º de bachillerato

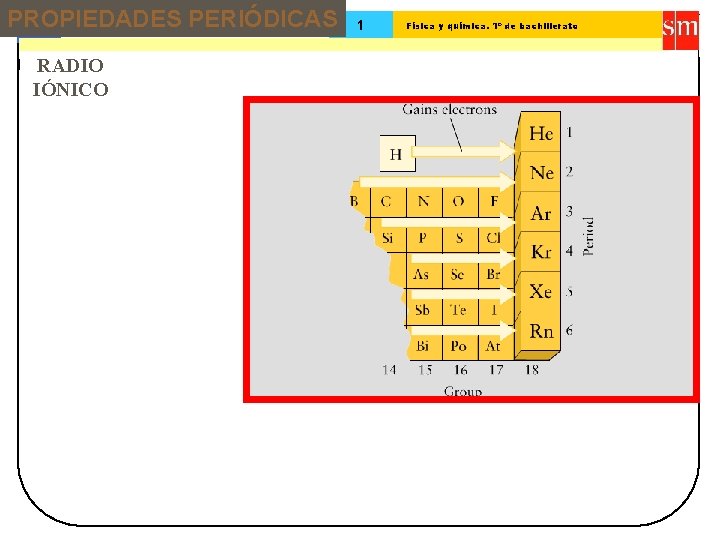
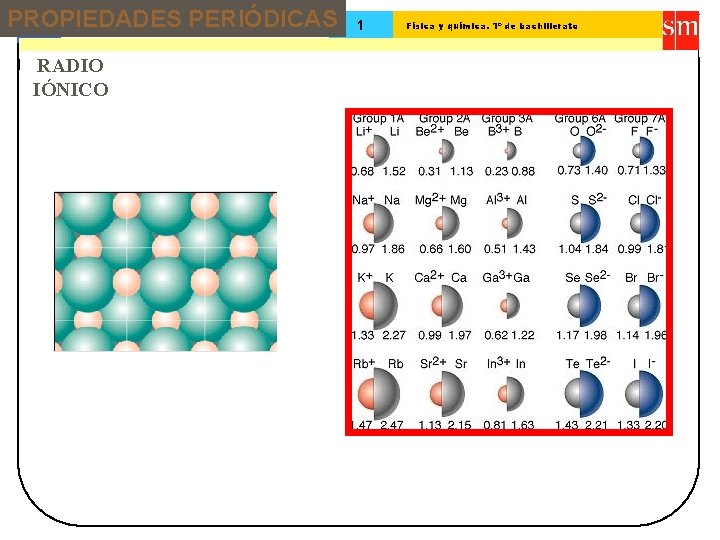
PROPIEDADES PERIÓDICAS 13 Tema: RADIO IÓNICO 1 Física y química. 1º de bachillerato

PROPIEDADES PERIÓDICAS 13 Tema: RADIO IÓNICO 1 Física y química. 1º de bachillerato

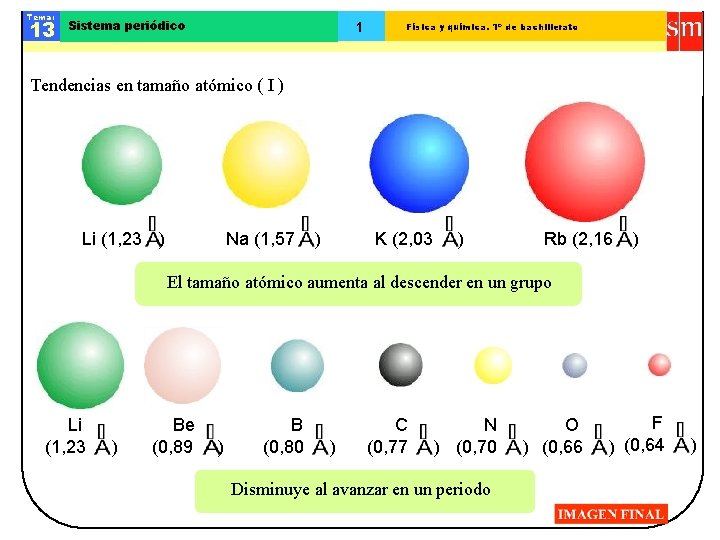
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Tendencias en tamaño atómico ( I ) Li (1, 23 ) Na (1, 57 ) K (2, 03 ) Rb (2, 16 ) El tamaño atómico aumenta al descender en un grupo Li (1, 23 ) Be (0, 89 ) B (0, 80 ) C (0, 77 N ) (0, 70 Disminuye al avanzar en un periodo O ) (0, 66 F ) (0, 64 )

PROPIEDADES PERIÓDICAS 13 Tema: RADIO IÓNICO 1 Física y química. 1º de bachillerato

Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Pierde 1 e. Li (1, 23 Li + ( 0, 68 ) ) Los iones positivos (cationes) son siempre menores que los átomos neutros a partir de los que se forman Tendencias en tamaño atómico ( II ) Gana 1 e. F ( 0, 64 ) F ( 1, 36 ) Los iones negativos (aniones) son siempre mayores que los átomos neutros a partir de los que se forman

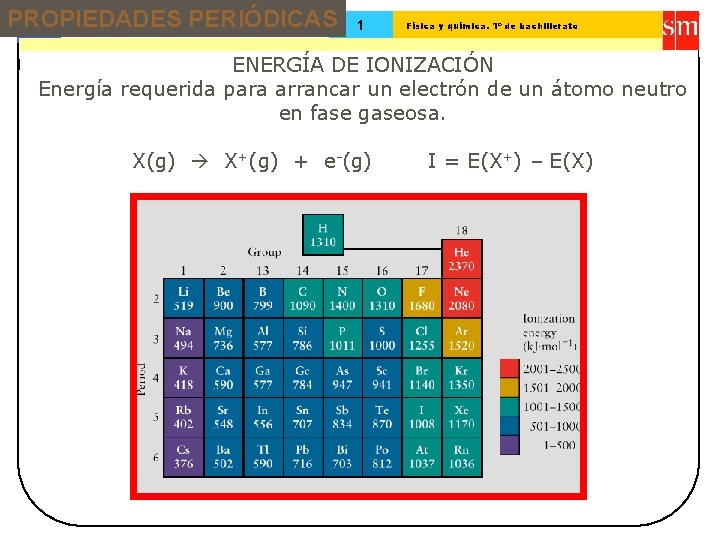
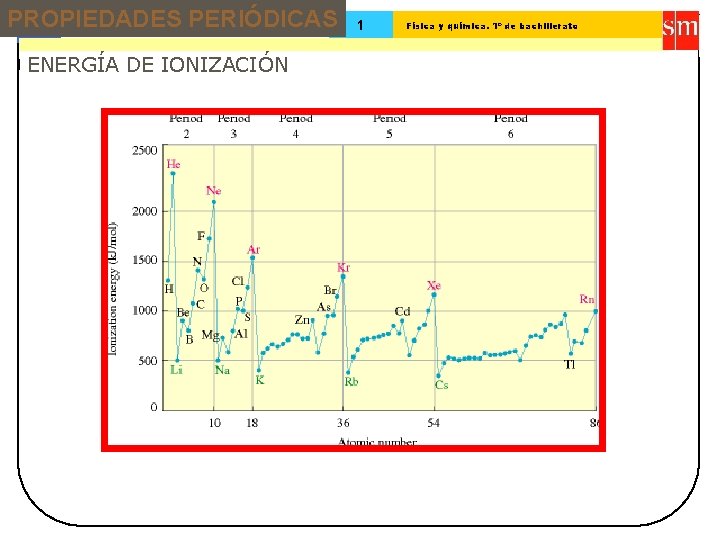
PROPIEDADES PERIÓDICAS 13 Tema: 1 Física y química. 1º de bachillerato ENERGÍA DE IONIZACIÓN Energía requerida para arrancar un electrón de un átomo neutro en fase gaseosa. X(g) X+(g) + e-(g) I = E(X+) – E(X)

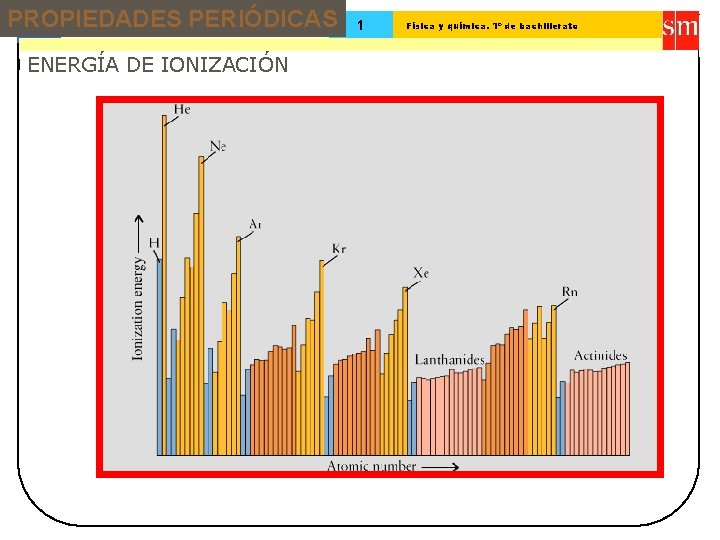
PROPIEDADES PERIÓDICAS 13 Tema: ENERGÍA DE IONIZACIÓN 1 Física y química. 1º de bachillerato

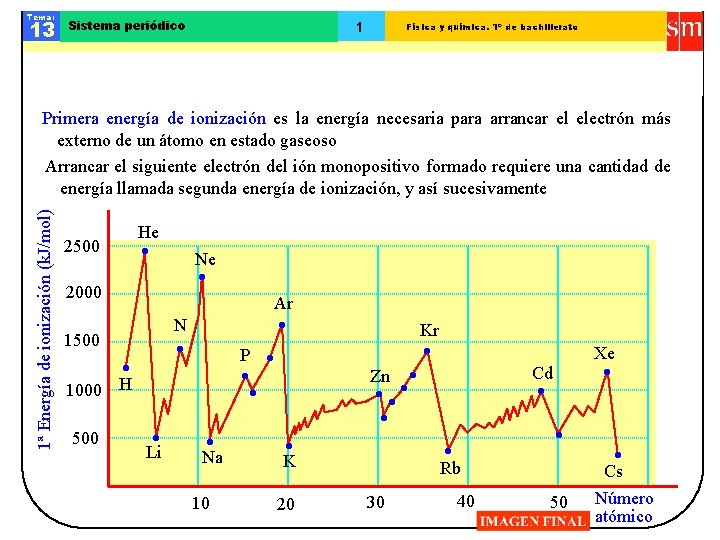
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato 1ª Energía de ionización (k. J/mol) Primera energía de ionización es la energía necesaria para arrancar el electrón más externo de un átomo en estado gaseoso Arrancar el siguiente electrón del ión monopositivo formado requiere una cantidad de energía llamada segunda energía de ionización, y así sucesivamente 2500 2000 He Ne Ar N Tendencias en la energía de ionización Kr 1500 P Zn H 1000 500 Li Na K Rb 10 20 30 40 Xe Cd 50 Cs Número atómico

PROPIEDADES PERIÓDICAS 13 Tema: ENERGÍA DE IONIZACIÓN 1 Física y química. 1º de bachillerato

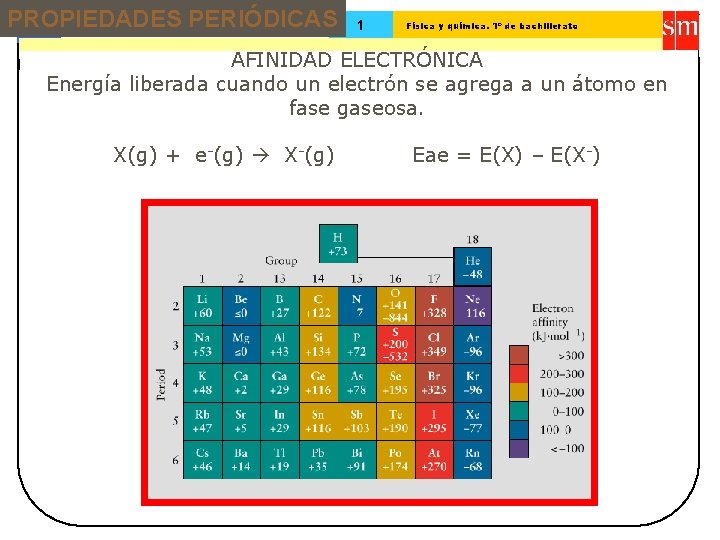
PROPIEDADES PERIÓDICAS 13 Tema: 1 Física y química. 1º de bachillerato AFINIDAD ELECTRÓNICA Energía liberada cuando un electrón se agrega a un átomo en fase gaseosa. X(g) + e-(g) X-(g) Eae = E(X) – E(X-)

Tema: 13 1 Física y química. 1º de bachillerato Carácter metálico: elementos de la izquierda de la tabla periódica. Aumenta con Z en el grupo. Los óxidos metálicos en agua dan hidróxidos y los no metálicos dan ácidos. Estado de oxidación: Corresponden a pérdida o ganancia de e- para dar configuración de capa completa. Es (+) para metales y (-) para no metales. Electronegatividad: Es la tendencia de los átomos unidos en un enlace químico a atraer los electrones. Aumenta de izquierda a derecha en el período y disminuye de arriba hacia abajo en el grupo

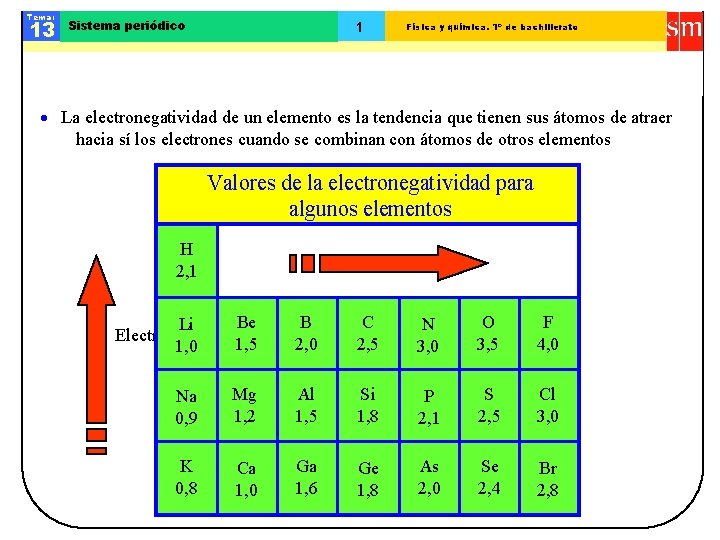
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato La electronegatividad de un elemento es la tendencia que tienen sus átomos de atraer hacia sí los electrones cuando se combinan con átomos de otros elementos Valores de la electronegatividad para algunos elementos H 2, 1 Be Li Electronegatividad 1, 5 1, 0 B 2, 0 C 2, 5 N 3, 0 O 3, 5 F 4, 0 Na 0, 9 Mg 1, 2 Al 1, 5 Si 1, 8 P 2, 1 S 2, 5 Cl 3, 0 K 0, 8 Ca 1, 0 Ga 1, 6 Ge 1, 8 As 2, 0 Se 2, 4 Br 2, 8

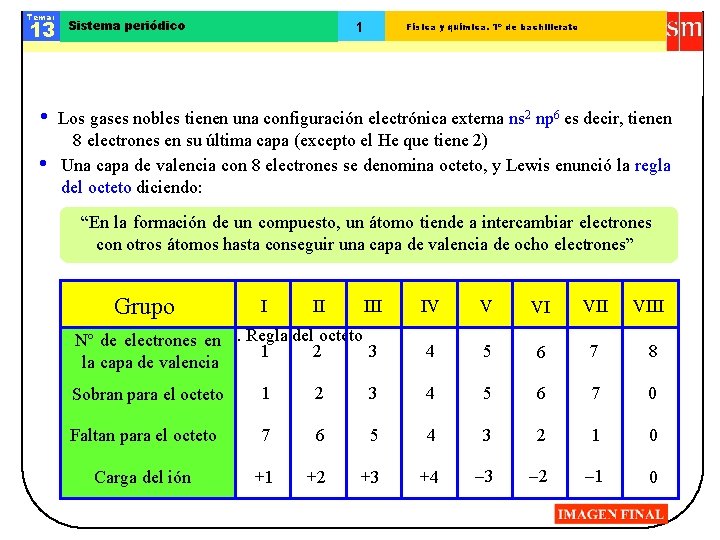
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Los gases nobles tienen una configuración electrónica externa ns 2 np 6 es decir, tienen 8 electrones en su última capa (excepto el He que tiene 2) Una capa de valencia con 8 electrones se denomina octeto, y Lewis enunció la regla del octeto diciendo: “En la formación de un compuesto, un átomo tiende a intercambiar electrones con otros átomos hasta conseguir una capa de valencia de ocho electrones” Grupo I II III gases nobles. Nº de. Los electrones en Regla del octeto 1 2 3 la capa de valencia IV V VI VIII 4 5 6 7 8 Sobran para el octeto 1 2 3 4 5 6 7 0 Faltan para el octeto 7 6 5 4 3 2 1 0 Carga del ión +1 +2 +3 +4 -3 -2 -1 0

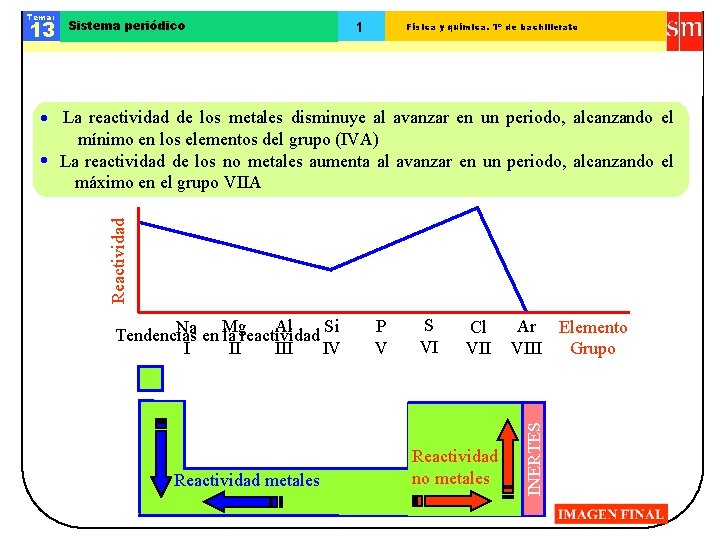
Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Reactividad La reactividad de los metales disminuye al avanzar en un periodo, alcanzando el mínimo en los elementos del grupo (IVA) La reactividad de los no metales aumenta al avanzar en un periodo, alcanzando el máximo en el grupo VIIA Reactividad metales P V S VI Cl VII Reactividad no metales Ar Elemento VIII Grupo INERTES Si Al Na en Mg Tendencias la reactividad IV II I

Tema: 13 Sistema periódico 1 Física y química. 1º de bachillerato Tabla periódica muda 1 2 3 4 5 6 7
 Fsica
Fsica Reacciones estatica
Reacciones estatica Fsica
Fsica Fsica
Fsica Fsica
Fsica Fsica
Fsica I y j fisica
I y j fisica Lógica
Lógica Fsica
Fsica Fsica
Fsica Identicos
Identicos Produto escalar
Produto escalar Fsica
Fsica Fsica
Fsica Expresion vectorial
Expresion vectorial Ay cosa
Ay cosa Aceleracion formula
Aceleracion formula Grandezas fisicas
Grandezas fisicas Fsica
Fsica Resolução
Resolução Magnitudes del movimiento
Magnitudes del movimiento Movimento acelerado e retardado
Movimento acelerado e retardado Fsica
Fsica Fsica
Fsica Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Ejemplo de delimitacion del tema
Ejemplo de delimitacion del tema Subtema
Subtema Subtemas de una entrevista
Subtemas de una entrevista