SOLUCIONES Y SU CONCENTRACIN SEMANAS 8 2020 Licda











































- Slides: 44

SOLUCIONES Y SU CONCENTRACIÓN SEMANAS 8 - 2020 Licda: Isabel Fratti de Del Cid Diapositivas con imágenes cortesía de Licda: Lilian Guzmán Formas de expresar la concentración de las soluciones Parte I Definición de Solución Diluida, Concentrada, Saturada, Insaturada, Sobresaturada Parte II A-Porcentajes: m/m , m/v , v/v B-Partes por millón: ( ppm )

En ésta semana, se verá la forma de expresar la concentración de o los solutos presentes en las soluciones en términos relativos como: Diluido Concentrado. O usando como base el dato de la solubilidad del soluto en 100 g de agua. En este caso se maneja así: Solución Saturada Solución Insaturada Solución Sobresaturada

Solución Diluida y Concentrada. • Diluida: Solución que contiene comparativamente una cantidad pequeña de soluto. • Concentrada: solución que contiene comparativamente una cantidad relativamente grande de soluto.

Solución saturada Solución que contiene la máxima cantidad de soluto que se puede disolver a una temperatura dada ( 20 0 C). Ej : Una solución que contenga 36 g de Na. Cl en 100 g de H 2 O, debido a que ese valor corresponde a la solubilidad del Na. Cl en agua, constituye una solución saturada a esa temperatura.

Solución Insaturada y sobresaturada. Insaturada ó subsaturada: Contiene menos soluto que una solución saturada. Ej : menos de 36 g de Na. Cl en 100 g de agua Sobresaturada: posee más soluto disuelto a cierta temperatura que una solución saturada. Ej: más de 36 g de Na. Cl en 100 g de agua.

Las soluciones sobresaturadas son inestables y el exceso de soluto se cristaliza con el tiempo. Piense. A algunas mieles con el tiempo se les cristaliza el azúcar. Serán soluciones sobresaturadas? . Reto: Busque en internet como hacer un bosque de Aspirina y al tenerlo lo trae a mostrar al laboratorio.

También se verá la forma de expresar la concentración de las soluciones usando relaciones matemáticas conocidas como unidades «físicas» . Generalmente relacionan masa / masa ; masa/ volumen , volumen/ volumen. Se les dice «físicas» ya que en los cálculos no es necesario determinar el peso molecular, peso fórmula, peso equivalente, Equivalentes, moles de el o los solutos presentes. Se usan porcentajes o proporciones en que se encuentran los componentes en las mezclas.

Porcentaje peso/peso : % p/p también conocido como (%m/m ) % p/p = masa de soluto x 100 masa de solución %p/p = masa de soluto x 100 (masa de soluto + masa de solvente)* * se debe sumar cuando nos dan por separado la cantidad de soluto y la cantidad de solvente, para obtener la masa de la solución.

Solución al 15 % p/p de Urea Una solución al 15 % p/p se prepara disolviendo 15 g de cualquier soluto ( en 85 g de agua( o en otro solvente indicado) * Con esto podemos decir que en 100 g de solución hallaremos 15 g de urea y 85 g de agua. o cualquier proporción, Ej: 7. 5 g de urea en 42. 5 g de agua

El % p/p se usa mucho sobre todo en medicamentos tópicos como cremas, lociones, ungüentos. Ejemplo: Efudix, una crema indicada para el tratamiento de verrugas y queratosis. Contiene 2. 5 g de Fluorouracilo en 50 g de crema. Calcule en base a éste dato el % p/p de fluorouracilo en la crema. % de Flurouracilo = 2. 5 g de fluorouracilo x 100 50 g de crema = 5. 0 % m/m ó 5. 0 % p/p Nota: aquí el fluorouracilo es el soluto ( 2. 5 g)y la masa total de la mezcla( crema) ( 50 g) , es la masa de la solución.

EJERCICIOS Ej. 1 Calcule el % p/p de una solución que contiene 68 g de glucosa disueltos en 185 gramos de agua(NOTE QUE SE DA POR SEPARADO EL PESO DEL SOLUTO Y SOLVENTE, POR LO TANTO DEBEN SUMARSE PARA OBTENER EL PESO DE LA SOLUCIÓN) %p/p = 68 g soluto x 100 = 68 g soluto +185 g solvente %p/p= 68 g soluto x 100 = 26. 67 % p/p 253 g solución También es válido reportar 26. 67 % m/m

Ej. 2 -Calcule el % p/p de una solución preparada disolviendo 160 gramos de cloruro de Magnesio ( Mg. Cl 2) en agua hasta obtener 960 g de solución. ( note que al decir solución ya se incluye la masa del soluto y el solvente, por lo tanto no debe realizarse esa suma, es decir NO se debe sumar 160 g+960 g). Procedimiento: use la formula recomendada: %p/p = masa de soluto x 100 masa de solución % p/p = 160 g x 100 =16. 67 % p/p 960 g

Ej: 3 -Cuántos gramos de una solución 6. 5 % p/p, se pueden obtener con 85 gramos de urea. A- Una forma de resolverlo es usando factores: g solución = 100 g de solución x 85 g de urea = 1, 307. 69 g de solución 6. 5 g de urea B- Usando la fórmula y despejando g de solución %p/p = g soluto x 100 g solución este hay que despejar g solución = g soluto x 100 = 85 g x 100 = 1, 307. 69 g solución % p/p 6. 5 % p/p

Resuelva ejercicio 8. 33 inciso a del libro vea la respuesta.

Una pomada se prepara disolviendo 2. 5 g de Mentol en 88 g de Petrolato ( Vaselina solida). Calcule el % p/p de Mentol en esa pomada

Porcentaje p/v ó m/v % p/v Es la más común y usada, ya que la mayoría de medicamentos son sólidos , se pesan y se busca que se disuelvan en un líquido, como el agua. Ejemplo soluciones masivas parenterales ó soluciones intravenosas ( Sueros ). Ejemplo las soluciones fisiológicas, más comunes: Solución de dextrosa ( glucosa) al 5 % p/v : 5 g de glucosa disueltas hasta alcanzar en 100 m. L de solución. Solución salina ó suero fisiológico : Solución al 0. 9 % p/v de Na. Cl ( cloruro de sodio): 0. 9 g de Na. Cl disueltos en 100 m. L de solución.

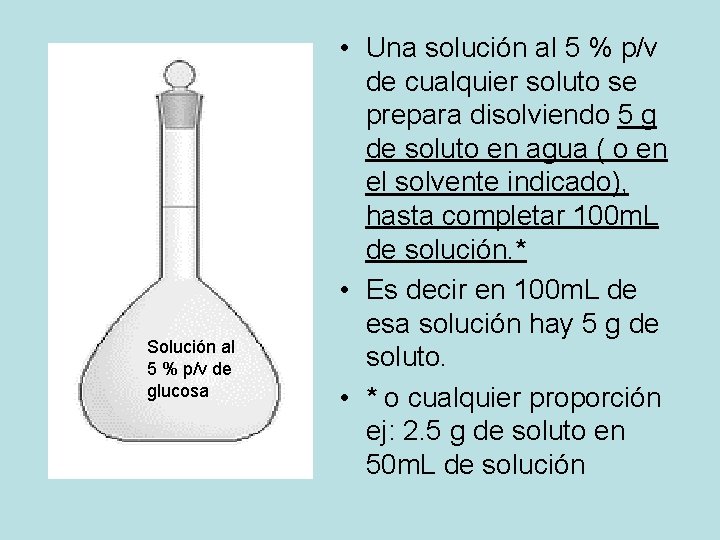
Solución al 5 % p/v de glucosa • Una solución al 5 % p/v de cualquier soluto se prepara disolviendo 5 g de soluto en agua ( o en el solvente indicado), hasta completar 100 m. L de solución. * • Es decir en 100 m. L de esa solución hay 5 g de soluto. • * o cualquier proporción ej: 2. 5 g de soluto en 50 m. L de solución

Otros ejemplos de soluciones intravenosas cuyos componentes están en % p/v. ( es decir cantidad de gramos en 100 m. L de solución ) Solución Principios activos ( solutos) en g por 100 m. L de solución ( % p/v) Indicaciones Hartman Cloruro de sodio ( Na. Cl) Cloruro de Potasio ( KCl) Cloruro de Calcio ( Ca. Cl 2 ) Lactato de sodio (C 3 H 5 O 2 Na) Acidosis orgánica e inorgánica. Pacientes quirúrgicos Disminuye incidencia de hipotensión Suero vitaminado al 5 % Glucosa Clorhidrato de tiamina Nicotinamida Riboflavina Piridoxina 0. 6 g 0. 03 g 0. 02 g 0. 31 g 5. 0 g 0. 5 mg ( 5 x 10 -4 g) 5. 0 mg ( 5 x 10 -3 g ) 0. 75 mg (7. 5 g x 10 -4 g) 0. 54 mg ( 5. 4 x 10 -4 g) Nutriente parenteral : reposición y aporte calórico. Deficiencia vitamínica del complejo B y electrolitos. Tx de Cetosis en desnutrición, diarrea o vómitos.

Ejercicios Porcentaje p/v : % p/v ó % m/v • % p/v = g de soluto x 100 m. L de solución Ejemplo. Calcule el % p/v de una solución que contiene 8. 9 g de Ca. Cl 2, disueltos en 250 m. L de solución. % p/v = 8. 9 g de Ca. Cl 2 x 100 = 3. 56 % p/v 250 m. L

a) Calcule el % p/v de una solución preparada disolviendo 6. 4 g de sacarosa ( azúcar) en agua hasta obtener 500 m. L de solución. % p/v = 6. 4 g de sacarosa x 100 = 1. 28 % p/v. 500 m. L de solución b) Cuantos gramos de sacarosa necesito para preparar 800 m. L de la solución anterior? A) Forma de resolverlo usando factores de conversión. g de urea = 1. 28 g de sacarosa x 800 m. L de solución = 10. 24 g sacarosa 100 m. L de solución B-Forma de resolverlo: despejando g soluto de la fórmula: Despejar % p/v = g soluto x 100 m. L de solución g soluto = % p/v x m. L de solución = 1. 28 % p/v x 800 m. L = 10. 24 g sacarosa • 100

Ej: Cuantos L de una solución al 3, 9 % m / v de Cloruro de potasio ( KCl) pueden preparase con 15 g de cloruro de potasio. A) RESOLVER USANDO FACTORES DE CONVERSION m. L de solución = 100 m. L de solución x 15 g de KCl 3. 9 g de KCl = 384. 62 m. L de solución = 0. 384 L B) Resolver despejando de la ecuación m. L de solución % p/v = g soluto x 100 m. L de solución despejar éste valor. m. L de solución = g soluto x 100 = 15 g x 100 = 384. 62 m. L % p/v 3. 9 % Que equivale a 0. 384 L

Calcule el % p/v de cada uno de los componentes de la solución Hartman ( ver diapositiva donde se encuentra el dato o vea semana 8 guías de estudio ) a) % p/v de Na. Cl b) % p/v de KCl

Continuación ejercicio solución Hartman c)% p/v Ca. Cl 2 = d)%p/v Lactato de sodio =

Calcule el % p/v de una solución intravenosa del antibiótico AMIKACINA, si contiene 500 mg de Amikacina en 2 m. L de solución.

Porcentaje Volumen /Volumen : % v/v Esta unidad de concentración es útil cuando tanto el soluto como el solvente son líquidos y es más fácil medir los volúmenes que determinar los pesos. Se calcula de la siguiente forma: % v/v = m. L de soluto x 100 m. L de solución Ej: Se preparó una solución disolviendo 250 m. L de alcohol isopropilico en agua hasta obtener 1650 m. L de solución. Calcule el % v/v = 250 m. L x 100 = 15. 15 % v/v 1650 m. L

Solución al 30 % v /v de etanol Una solución al 30 % v/v de cualquier soluto se prepara disolviendo 30 m. L de ese soluto en agua ( u otro solvente) hasta obtener 100 m. L de solución. No se prepara con 30 m. L de soluto y 70 m. L de solvente, ya que en la mezcla de líquidos los volúmenes no son aditivos ( es decir 30 m. L de etanol + 70 m. L de agua no dan exactamente 100 m. L de solución) Pero si podemos afirmar que en 100 m. L de solución hay 30 m. L de soluto *. * O cualquier otra proporción: Ej: en 50 m. L de solución hay 15 m. L de soluto.

Ejercicios sobre: Porcentaje Volumen / Volumen : % v/v Ej: Se preparó una solución disolviendo 250 m. L de alcohol isopropilico en agua hasta obtener 1650 m. L de solución. Calcule el % v/v = 250 m. L x 100 = 15. 15 % v/v 1650 m. L

Un enjuague bucal contiene 22. 5 % v/v de alcohol. Cuántos m. L de alcohol hay en un frasco de enjuague bucal de 750 m. L? A- Resolver usando factores de conversión m. L de alcohol = 22. 5 m. L de alcohol x 750 m. Lde enjuague 100 m. L de enjuague = 168. 75 m. L de alcohol

B)También puede resolverlo, despejándolo de la fórmula: • • despejar éste dato % v/v = m. L de soluto x 100 m. L de solución m. L de soluto = % v/v x m. L de solución 100 m. L de alcohol= 22. 5 % v/v x 750 m. L 100 = 168. 75 m. L de alcohol

Cuántos m. L de una solución que contenga 7. 8 %v/v de aceite pueden prepararse con 50 m. L de aceite. A-Resolver usando factores de conversión m. L de solución =100 m. L de solución x 50 m. L de aceite 7. 8 m. L de aceite = 641. 03 m. L de solución. B- Resolver despejando en la fórmula los m. L de solución : % v/v = m. L de soluto x 100 m. L de solución despejar éste m. L de solución = m. L de soluto x 100 % v/v = 50 m. L de aceite x 100 = 641. 03 m. L 7. 8 % v/v

Partes por Millón ppm Usada cuando se desea expresar cantidades muy pequeñas de sustancias en volúmenes muy grandes de muestra. Ej. la concentración de contaminantes en agua, aire ó suelo. Se usará ppm = mg de soluto Litro de muestra

Ej: Cuántas partes por millón de Pb +2, hay en una muestra de agua, que contiene 8. 4 mg de Pb+2 en 9 OO m. L* de esa muestra de agua. Use fórmula de ppm: Ppm = mg de soluto ( o sustancia) litro de muestra ( o solución ) • ppm = 8. 4 mg = 9. 33 mg/L ó bien : 9. 33 ppm. O. 9 L *los 900 m. L deben convertirse a litros, pues la formula así lo pide. 900 m. L = 0. 9 L

1 -Cuántos mg de F- hay en 5 Litros de una muestra de agua que contiene 3. 7 ppm de ión fluoruro ( F- ). ? Procedimiento para resolverlo: Use fórmula : ppm = mg soluto o sustancia Litros de muestra Despeje mg de soluto: mg de soluto = ppm x litros de muestra Coloque datos: mg de F- = 3. 7 mg de F- x 5 Litros = 18. 5 mg F 1 litro

2 -Cuántos litros de una solución al 1. 95 ppm de un insecticida a base de piretrina, se pueden obtener con 30 mg de piretrina. ? Use fórmula y despeje litros. • ppm = mg L despejar • L = mg/ ppm • L = 30. 0 mg / 1. 95 mg/L 15. 38 L • Podemos preparar 15. 38 L con 30 mg de piretrina.

Dilución Proceso por el cuál se reduce la concentración de una solución, por adición de solvente lo que provoca un incremento en el volumen total de la solución, disminuyendo su concentración. El siguiente cálculo debe usarse para % v/v y % p/v no es aplicable a % p/p • Fórmula a usarse : C 1 x V 1 = C 2 x V 2 C 1 y V 1, son la concentración y volumen inicial C 2 y V 2. Son la concentración y volumen final Siempre después de una dilución C 2 < C 1 y V 2 >V 1 Ejemplos prácticos: si quiere poner menos espeso su café ( menos concentrado), le añade agua( aumenta su volumen) y disminuye su concentración.

Ejemplo de dilución • Ej. Se diluyen 70 m. L de una solución al 6. 2 % p/v hasta obtener 200 m. L de solución. Cuál es la concentración % p/v de la solución final. ? • Identifique los datos: C 1= 6. 2 % p/v ; V 1 = 70 m. L C 2 = ? V 2= 200 m. L Despeje C 2 en la fórmula C 1 x. V 1 = C 2 x. V 2 C 2 = C 1 x V 1 Coloque datos: V 2 • C 2 = 6. 2% p/v x 70 m. L de solución = 2. 17 % p/v 200 m. L de solución Note: que al diluir, la concentración se vuelve más pequeña, pasó de 6. 2 % p/v 2. 17 % p/v

Cont. Ejercicios de dilución A que volumen final hay que diluir 50 m. L, de una solución al 5. 6 % p/v, para que su concentración final sea 3. 1 % p/v. ? Datos: V 1= 50 m. L C 1= 5. 6 % p/v V 2 =? C 2 = 3. 1 % p/v • C 1 x V 1 = C 2 x V 2, despejar V 2: • V 2= C 1 x V 1 = 5. 6 % p/v x 50 m. L= 90. 32 m. L • C 2 3. 1 % p/v Note: como el v 2, es > que el v 1, como es de esperarse, pues para diluir algo, generalmente se añade solvente lo que incrementa su volumen.

Ejercicios: Realice los siguientes cálculos Calcule % p/p de una solución preparada con 35 g KCl y 125 g de H 2 0 Calcule % p/p de una solución preparada disolviendo 5. 0 g Ca. Cl 2 en agua hasta obtener 180. 0 g de solución.

A que volumen final deben diluirse 400 m. L de una solución al 6. 2 % p/v para obtener una solución al 2. 4 % p/v Cuantos litros de solución salina ( 0. 9 % p/v de Na. Cl) deben administrarse a un paciente que necesita 7. 2 g de Na. Cl al día.

Un paciente necesita 120 g de glucosa en las próximas 24 horas. Cuántos litros de una solución de glucosa al 5 % p/v, se le debe administrar.

Ej : Aplicación de los conceptos a la salud Niño de 6 años, pesa 40 lbs, se le debe administrar vía oral, una sola dosis de un medicamento, la cual debe ser 45 mg/Kg de peso La suspensión posee 250 mg med. / 5 m. L de suspensión. Cuantos m. Ls de suspensión debe administrarsele. ? Solución: Como la dosis del medicamento está por Kg de peso, debemos convertir el peso del niño de lbs a Kg. Peso en Kg = 1 Kg x 40 lbs = 18. 2 Kg 2. 2 lbs

• Ahora calcule los mg del medicamento a administrarse, de la siguiente forma mg medicamento= 45 mg x 18. 2 Kg peso Kg de peso = 819 mg del medicamento. Luego calcule los m. L de suspensión que debe dársele: m. L de suspensión = 5 m. L suspensión x 819 mg medicamento 250 mg del medicamento. = 16. 38 m. Lde suspensión.

El problema anterior, puede resolverse por factores estequiométricos en un solo planteamiento así: m. Lde suspensión = 5 m. L suspensión x 45 mg med. x 1 Kg x 40 lbs 250 mg med Kg de peso 2. 2 lbs = 16. 36 m. L de suspensión

La norma Coguanor NGO 29001 establece que el límite máximo aceptable de Cobre en el agua es 0. 05 mg/L que equivale a 0. 05 ppm) Si una muestra de agua de pozo posee 6. 5 mg de Cobre en 800 m. L de esa agua. Calcule: A) ppm de el agua del pozo. B) Se halla dentro del límite máximo aceptable que indica la norma de la Comisión Guatemalteca de Normas ( COGUANOR) ? Razone su respuesta.
 Cresta epidermica apical
Cresta epidermica apical Cativeiro babilonico
Cativeiro babilonico Feto de poucas semanas
Feto de poucas semanas Tabla de los latidos según las semanas de embarazo
Tabla de los latidos según las semanas de embarazo 12 semanas
12 semanas El 20% de 70 semanas equivale a días
El 20% de 70 semanas equivale a días 12 semanas
12 semanas Festa das semanas
Festa das semanas Calendario das semanas
Calendario das semanas 12 semanas
12 semanas V
V Feto com poucas semanas
Feto com poucas semanas Setenta semanas de daniel significado
Setenta semanas de daniel significado Calendario das semanas
Calendario das semanas 70 semanas estan determinadas
70 semanas estan determinadas Placenta y saco vitelino
Placenta y saco vitelino Cuál es la fecha
Cuál es la fecha Soluciones quimicas
Soluciones quimicas Propiedades de las soluciones
Propiedades de las soluciones Cuadro comparativo de soluciones químicas
Cuadro comparativo de soluciones químicas Esencia del conocimiento objetivismo
Esencia del conocimiento objetivismo Solucion
Solucion Cuadro comparativo de suspensiones coloides y soluciones
Cuadro comparativo de suspensiones coloides y soluciones V
V Terramicina presentaciones
Terramicina presentaciones Familia uniparametrica
Familia uniparametrica Solucion
Solucion Propiedades de las soluciones amortiguadoras
Propiedades de las soluciones amortiguadoras Novarum soluciones
Novarum soluciones Formula de las propiedades coligativas
Formula de las propiedades coligativas No puedo darte soluciones para todos los problemas
No puedo darte soluciones para todos los problemas Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Alquimia soluciones ambientales
Alquimia soluciones ambientales Solución concentrada
Solución concentrada Poema para los amigos
Poema para los amigos Solucion
Solucion Jorge luis borges a un amigo
Jorge luis borges a un amigo Ejercicios con oraciones impersonales
Ejercicios con oraciones impersonales 10 coloides
10 coloides Soluciones acidas
Soluciones acidas Analisis inverso ejercicios
Analisis inverso ejercicios Soluciones quimicas
Soluciones quimicas Sirh nuevo ingreso
Sirh nuevo ingreso Soluciones de cable instalaciones frigorificas
Soluciones de cable instalaciones frigorificas Tabla de goteo de soluciones por minuto
Tabla de goteo de soluciones por minuto