REVISION du COURS La transition entre deux tats































- Slides: 32

REVISION du COURS La transition entre deux états accessibles s’accompagne de l’absorption ou de l’émission d’un photon d’énergie égale à la différence de l’énergie des deux états. E = En- Ep = h h : 6, 623 10 -34 j. s (constante de Planck) ν : fréquence de rayonnement mis en jeu.

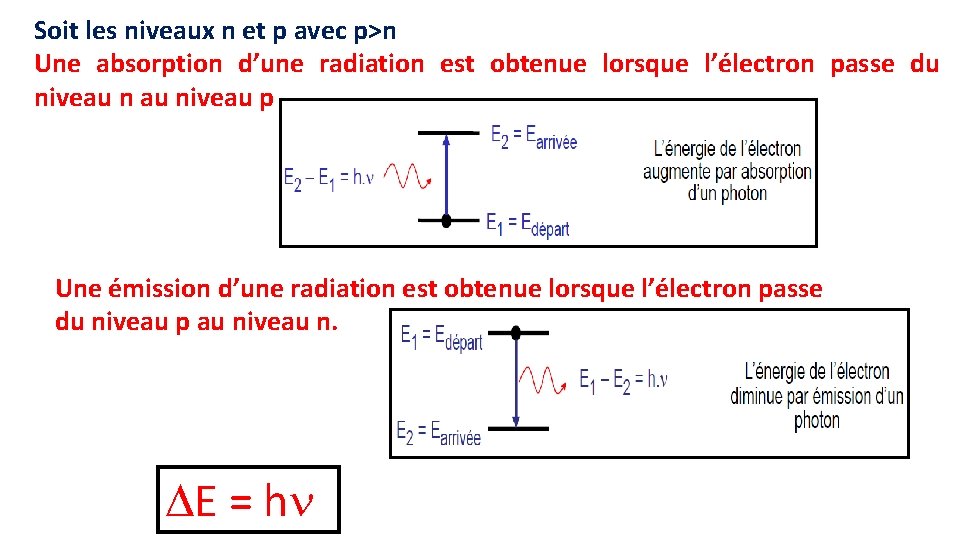
Soit les niveaux n et p avec p>n Une absorption d’une radiation est obtenue lorsque l’électron passe du niveau niveau p Une émission d’une radiation est obtenue lorsque l’électron passe du niveau p au niveau n. E = h

Série 2 Exercice 1 Un atome d'hydrogène initialement à l'état fondamental absorbe une quantité d'énergie de 10, 2 e. V. 1). Dans quel état électronique se trouve-t-il alors ? 2). Calculer la fréquence, la longueur d’onde et le nombre d’onde associés à cette transition 3) Pour passer du 1 er état excité au 3ème état excité, l'électron d'un atome d'hydrogène absorbe un photon de longueur d’onde. Calculer .

m=2


2. b. Calcul de la Longueur d’onde , = C/ Avec c la vitesse de la lumière : C = 3. 108 m/s = 3. 108/ 2, 6 1015 -7 = 1, 217 , 10 m = 121, 7 nm

2. C. Calcul du nombre d’onde : = 1/ 1, 217. 10 -7 = 0, 8217. 107 m-1 = 8217 cm-1


Exercice 2 Calculer les longueurs d'onde des raies visibles observées sur le spectre d’émission de l’Hydrogène. On prendra les 4 raies de Lyman. Donner la variation d'énergie de l'atome d'hydrogène liée à l'émission de la première raie et de la raie limite dans la série de Lyman. On dit que le spectre d'émission de l'atome d'Hydrogène se décompose en plusieurs séries: les séries de Lyman, Balmer, Paschen, Brackett et Pfund. Chaque série est définie par le niveau d'énergie final des transitions électroniques. .


1) Calcul des longueurs d'onde des raies visibles observées sur le spectre d’émission de l’Hydrogène. On prendra les 4 raies de Lyman.


Exercice 4 (Examen session rattrapage 2014) a) Donnez l’expression de la quantification du moment cinétique utilisée dans la théorie de Bohr. b) Si un atome d’hydrogène dans son état fondamental absorbe un photon de longueur d’onde 1 puis émet un photon de longueur d’onde 2, sur quel niveau l’électron se trouve t-il après cette émission ? 1 = 97, 28 nm et 2 = 1879 nm

Postulat du moment cinétique a) Les états de mouvement permis sont ceux pour lesquels le moment cinétique 0 de l’électron est un multiple entier de (h/2 p). 0 = n (h/2 p) = mevern me : masse de l’électron et ve sa vitesse rn : rayon de l’orbite dans laquelle circule l’électron. Le moment cinétique orbital correspond à la rotation d'une particule autour d'un noyau, comme la rotation d'un électron autour d'un noyau dans un atome. On différencie le moment cinétique orbital du moment cinétique intrinsèque, interprétable par la rotation d'une particule élémentaire sur elle-même (on parle de spin de l'électron, par exemple). Tout moment cinétique est quantifié en mécanique, c’est-à-dire que le moment cinétique ne peut prendre que des valeurs discrètes bien précises. C'est une des propriétés fondamentales de la théorie quantique.

Absorption 1 Emission 2


Exercice 5 1) En se basant sur les postulats de la théorie de Bohr pour l’atome d’hydrogène, donner les expressions générales de l’énergie et du rayon des orbites de Bohr. 2) Pour l’hydrogénoïde de l’atome de 4 Be, calculer le photon d’énergie associé à la transition : état fondamental- 2ème état excité, en déduire la longueur d’onde et l’expression de la formule de Ritz généralisée. 3) Calculez la constante de Rhydber RH théorique et comparez cette valeur à celle donnée expérimentalement RH (exp) = 109677 cm-1.

1) L’expression générale de l’énergie est: Les rayons des orbites de Bohr sont calculés à partir de l’expression suivante :

Pour l’hydrogénoïde de l’atome de 4 Be, calcul du photon d’énergie associé à la transition : état fondamental - 2ème état excité: L’hydrogénoïde est Be 3+ Il s’agit de la transition: n=1 n=3 E 1 -3 = E 3 – E 1 absorption donc E 1 -3 > 0 E 3 = -13, 6 Z 2/n 2 = -13, 6 (4)2/32 = - 24, 18 e. V E 1= -13, 6 Z 2/n 2 = -13, 6 (4)2/12 = - 217, 6 e. V E 1 -3 = E 3 – E 1 = 193, 42 e. V (1 e. V= 1, 602. 10 -19 j) E 1 -3 = 3, 099. 10 -17 J

Déduisons la longueur d’onde correspondant à la transition: 1 3 E 1 -3 = h. C/ = h. C/ E 1 -3 (h = 6, 62 10 -34 Js; C = 3 108 ms-1. ) = (6, 62 10 -34 x 3 108 )/3, 099. 10 -17 = 6, 409. 10 -9 m = 6, 409 nm

Déduisons l’expression de la formule de Ritz généralisée.

3) Calcul de la constante de Rhydberg RH théorique et comparaison de cette valeur à celle donnée expérimentalement RH (exp) = 109677 cm-1. avec e = 1, 6 10 -19 C, h = 6, 62 10 -34 Js, C = 3 108 ms-1, me = 9, 109534 10 -31 kg, 0 = 8, 854187 10– 12 C 2 N-1 m-2 on trouve RH(calculée)= 1. 0991668× 107 m-1 = 109917 cm-1 Cette valeur est en accord excellent avec la valeur expérimentale.

Exercice 6 1 Donner la composition (nombre de protons; nombre de neutrons et nombre d’électrons) de l’atome de Bore 115 B. 2 Sachant que l’énergie des niveaux électroniques des hydrogénoïdes est donnée par l’expression en e. V a) Calculez le quantum d’énergie, la fréquence et la longueur d’onde, associés à la transition électronique de l’état fondamentale vers le deuxième état excité. b) Calculez la constante de Rydberg RH’ de l’hydrogénoïde de l’atome de Bore en utilisant la formule de Ritz générale pour les hydrogénoïdes. c) Calculez le potentiel d’ionisation de l’hydrogénoïde de l’atome de Bore. Données e = 1, 6 10 -19 C, h = 6, 62 10 -34 Js, C = 3 108 ms-1, RH = 1, 09677 107 m-1 me = 9, 109534 10 -31 kg, 0 = 8, 854187 10– 12 C 2 N-1 m-2

Solution : 115 B 1) 5 protons, 5électrons, 6 neutrons 2) Transisition : Etat fondamental 2ème état excité : n=1 n=3 a) Calcul du quantum d’énergie : E 1=-13, 6*(5)2/1=-340 e. V E 3=-13, 6*(5)2/(3)2=-37, 8 e. V E= E 3 - E 1=-37, 8 – (-340)=302, 2 e. V E=302, 2 e. V= 4, 84. 10 -17 j Calcul de la fréquence : E =h = E / h = 302, 2 x 1, 6. 10 -19/6, 62. 10 -34 J s =7, 304. 1016 s-1= 730, 4. 1014 s-1

Calcul de la longueur d’onde =c/ =3. 108/730, 4. 1014 = 4, 11. 10 -9 m Calcul de la constante de Rydberg RH’ de l’hydrogénoïde de l’atome de Bore 1/ =Rh’(1/n 2 – 1/m 2) Rh’ = 1/[ x(1/n 2 – 1/m 2)] Rh’ =1/[4, 11. 10 -9 x(1/1 - 1/9)] Rh’ =9/8(4, 11. 10 -9) Rh’ =2, 74. 108 m-1 Calcule du potentiel d’ionisation de l’hydrogénoïde de l’atome de Bore. PI= E - E 1 = 0 - E 1=-(-13, 6*(5)2/1)=+340 e. V

Exercice 7 (Examen session rattrapage 2015) L’électron de l’atome d’hydrogène se trouvant initialement au deuxième état excité émet (émission), par retour à un niveau inférieur, une radiation de longueur d’onde = 1027 Å. Quelle est la transition électronique responsable de cette émission? Calculer la fréquence ( ), le nombre d’onde ( ) et l’énergie du photon accompagnant cette transition ( = 1027 Å). Données : RH = 1, 097373 107 m-1 ; h = 6, 62 10 -34 Js ; C = 3 108 ms-1.

L’électron de l’atome d’hydrogène est sur le : 2ème Etat Excité émission n=3 m? m<n = 1027 Å l’émission d’une radiation de longueur d’onde =1027Å correspond au retour de l’électron vers un état électronique m<n On trouve m=1 (état fondamental), il s’agit de la transition électronique 3 1

Calculer la fréquence ( ), =c/ =(3× 108)/(1027× 10 -10)=2, 92× 1015 Hz Calcul du nombre d’onde ( ) 1/ =1/1027× 10 -10= 9, 74× 106 m-1 Calcul de l’énergie du photon accompagnant cette transition ( = 1027 Å). E = h E =6, 62× 10 -34× 2, 92× 1015= 19, 3× 10 -19 J C’est une émission donc : E<0 E=-19, 3× 10 -19 J

Exercice 6 (Examen Janvier 2014) 1 -Donner la composition (nombre de protons; nombre de neutrons et nombre d’électrons) de l’atome de Bore 511 B. 2 -Sachant que l’énergie des niveaux électroniques des hydrogénoïdes est donnée par l’expression (e. V) a) Calculez le quantum d’énergie, la fréquence et la longueur d’onde, associés à la transition électronique de l’état fondamentale vers le deuxième état excité. b) Calculez la constante de Rydberg RH’ de l’hydrogénoïde de l’atome de Bore en utilisant la formule de Ritz générale pour les hydrogénoïdes. c) Calculez le potentiel d’ionisation de l’hydrogénoïde de l’atome de Bore. Données e = 1, 6 10 -19 C, h = 6, 62 10 -34 Js, C = 3 108 ms-1, RH = 1, 09677 107 m-1 me = 9, 109534 10 -31 kg, 0 = 8, 854187 10– 12 C 2 N-1 m-2

Solution : 11 B. 1) 5 5 protons, 5électrons, 6 neutrons 2) Etat fondamental : n=1, 2ème état excité : n=3 a) Calcul du quantum d’énergie E : E 1=-13, 6*(5)2/1=-340 e. V E 3=-13, 6*(5)2/(3)2=-37, 8 e. V E= E 3 - E 1=-37, 8 – (-340)=302, 2 e. V E=302, 2 e. V= 4, 84. 10 -17 j

Calcul de la fréquence : E =h = E / h = 302, 2 x 1, 6. 10 -19/6, 62 10 -34 J s =7, 304. 1016 s-1= 730, 4. 1014 s-1 Calcul de la longueur d’onde =c/ =3. 108/730, 4. 1014 = 4, 11. 10 -9 m

Calcul de la constante de Rydberg RH’ de l’hydrogénoïde de l’atome de Bore 1/ =Rh’(1/n 2 – 1/m 2) RH’ = 1/[ x(1/n 2 – 1/m 2)] RH’ =1/[4, 11. 10 -9 x(1/1 -1/9)] RH’ =9/8(4, 11. 10 -9) RH’ =2, 74. 108 m-1 Calcul du potentiel d’ionisation de l’hydrogénoïde de l’atome de Bore: EI= E - E 1 = 0 – (-13, 6) (52/12) EI=340 e. V
 Tit for two tats
Tit for two tats Catherine tats
Catherine tats Distance entre deux points formule
Distance entre deux points formule Passive revision
Passive revision Trecho do livro o pequeno principe
Trecho do livro o pequeno principe Entre eu ou entre mim
Entre eu ou entre mim Un deux trois quatre cinq six sept
Un deux trois quatre cinq six sept Démarrage direct un sens de marche
Démarrage direct un sens de marche Poisson affreux
Poisson affreux Les statistiques à deux variables
Les statistiques à deux variables Paires de côtés homologues
Paires de côtés homologues Deux choix possibles
Deux choix possibles J'ai deux pieds pour marcher
J'ai deux pieds pour marcher Infinitif ou subjonctif reliez les deux sequences
Infinitif ou subjonctif reliez les deux sequences Diagonale isométrique
Diagonale isométrique Relation de chasles
Relation de chasles Vecteurs et translation
Vecteurs et translation Poeme un deux trois claque tes doigts
Poeme un deux trois claque tes doigts Quelles sont les deux phases de la bataille de verdun
Quelles sont les deux phases de la bataille de verdun Composée de deux translations
Composée de deux translations Verbe jouer a l'imparfait
Verbe jouer a l'imparfait Part deux french
Part deux french Apprentissage maslow
Apprentissage maslow Droite parallèle à un plan
Droite parallèle à un plan J'ai deux stylos. veux-tu emprunter
J'ai deux stylos. veux-tu emprunter Pronoms objets französisch
Pronoms objets französisch L'homme qui sait deux langues
L'homme qui sait deux langues Histoire de deux amis
Histoire de deux amis 1 seconde en hertz
1 seconde en hertz Mikis theodorakis nous sommes deux
Mikis theodorakis nous sommes deux Sceptre à deux fourches
Sceptre à deux fourches Folie à deux
Folie à deux Tableau 2 dimensions java
Tableau 2 dimensions java