Dpistage des cancers et des tats prcancreux Catherine











































- Slides: 58

Dépistage des cancers et des états précancéreux Catherine Hill Laureen Ribassin-Majed Gustave Roussy catherine. hill@gustaveroussy. fr laureen. majed@gustaveroussy. fr

Prévention secondaire des cancers Dépistage de masse : définition • Examen proposé à la population générale définie seulement en terme de sexe et d’âge, sans symptôme ni facteur de risque particulier (sauf peut-être fumeur pour dépistage du cancer du poumon) • Dès qu’il y a symptôme ou antécédent familial, on sort du cadre du dépistage de masse pour entrer dans le colloque singulier entre patient et médecin

Dépistage des cancers dans la population générale • Potentielle transformation d’une personne bien portante en une personne malade • Ne prévient le cancer que si l’on dépiste un état précancéreux guérissable : col de l’utérus, polype colorectal • Ne prévient pas le cancer du sein, ni celui du poumon

Caractéristiques du dépistage • Dépistage individuel: La population est recrutée lors d’un recours au soin (ex: cancer du col de l’utérus) • Dépistage organisé: Le dépistage est proposé systématiquement à l’ensemble de la population cible. La participation est volontaire (ex: cancer du sein, cancer colorectal)

Dépistages organisés Cancer du sein: les femmes de 50 à 74 ans sont invitées tous les deux ans à faire une mammographie et un examen clinique des seins Colon-rectum: entre 50 et 74 ans, tous les deux ans par test immunologique

Dépistage recommandé Col de l’utérus: pas de programme national de dépistage organisé Dépistage spontané (individuel) par examen cytologique d’un frottis cervico-utérin chez les femmes de 25 à 65 ans, tous les 3 ans après deux examens normaux réalisés à 1 an d’intervalle. Dépistage organisé dans quelques départements (Isère, Bas-Rhin, Haut-Rhin, Martinique)

Dépistages assez mal faits Col de l’utérus, en 2010, 50% des femmes pas ou trop peu souvent dépistées, 10% dépistées comme recommandé, 40% dépistées trop fréquemment. 1 400 décès en 2010 Sein mammographie de 50 à 74 ans tous les 2 ans en 2008 -2009 40% des femmes mal suivies Colon-rectum : plus des 2/3 de la population de 50 à 74 ans n’a jamais eu d’Hemoccult. Source : Haute Autorité de Santé

Prévention et dépistage du cancer du col Dépistage du cancer du sein Dépistage du cancer de la prostate Dépistage du cancer du poumon

Prévention du cancer du col La persistance de l’infection par certains types de papillomavirus (HPV) est la cause des cancers du col de l’utérus. Prévention primaire: vaccination anti-HPV type 16 et 18. Deux vaccins proposés en France aux filles de 11 à 14 ans, et en rattrapage jusqu’à 19 ans. Prévention secondaire: - Examen cytologique sur frottis - Test HPV à l’étude (sur frottis ou urine)

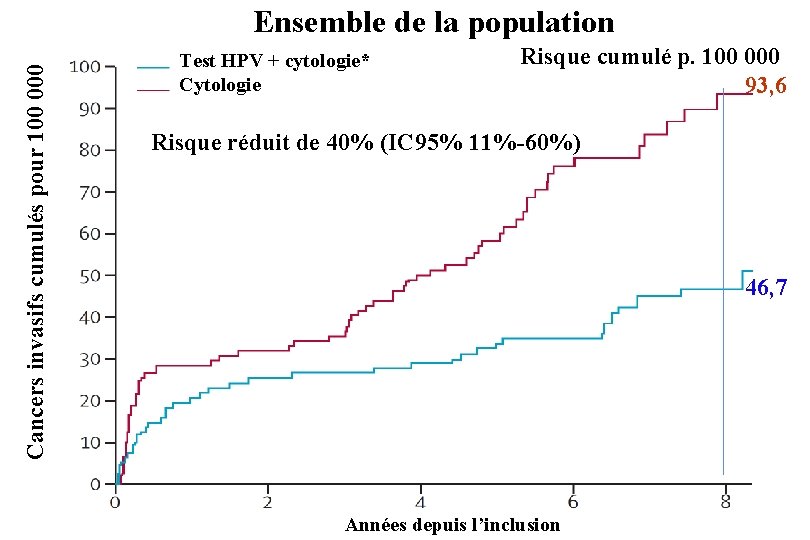
Dépistage du cancer du col 4 essais ont comparés Test HPV + cytologie (chaque test lu à l’aveugle de l’autre) à Cytologie seule Ils ont été réalisés en Suède, Hollande, Italie et Angleterre L’analyse de l’ensemble a été publiée: Ronco G et coll. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet 2014; 383: 524– 32

Cancers invasifs cumulés pour 100 000 Ensemble de la population Test HPV + cytologie* Cytologie Risque cumulé p. 100 000 93, 6 Risque réduit de 40% (IC 95% 11%-60%) 46, 7 Années depuis l’inclusion

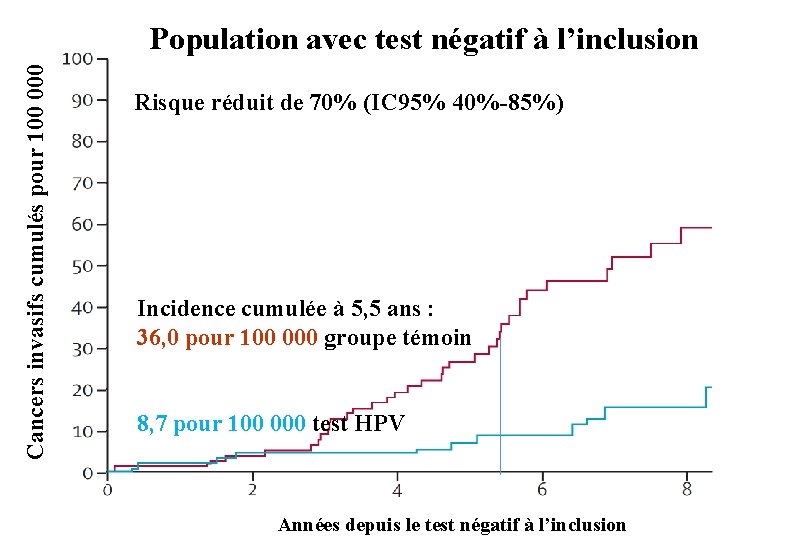
Cancers invasifs cumulés pour 100 000 Population avec test négatif à l’inclusion Risque réduit de 70% (IC 95% 40%-85%) Incidence cumulée à 5, 5 ans : 36, 0 pour 100 000 groupe témoin 8, 7 pour 100 000 test HPV Années depuis le test négatif à l’inclusion

Dépistage du cancer du col : synthèse des essais comparant Test HPV + cytologie à Cytologie Suivi médian 6, 5 ans Cancers invasifs/ Population totale personnes années Test HPV + cytologie 44/650 000 Cytologie 63/561 000 Réduction du risque 40% Population avec test négatif à l’inclusion Test HPV + cytologie 12/590 000 Cytologie 35/525 000 Réduction du risque 70%

Conclusion des auteurs Le dépistage reposant sur le test HPV confère une meilleure protection que la cytologie. Les données suggèrent de commencer le dépistage par un test HPV à 30 ans et d’attendre au moins 5 ans entre deux dépistages (au lieu de faire une cytologie tous les 3 ans après deux examens négatifs à 1 an d’intervalle).

Dépistage du cancer du sein Bilan des avantages et des inconvénients 1. Avantage L’objectif du dépistage est de réduire la mortalité par cancer du sein L’estimation la plus fiable est tirée des essais : dans chaque essai, la population est divisée par tirage au sort en deux groupes comparables, l’un invité et l’autre non invité au dépistage

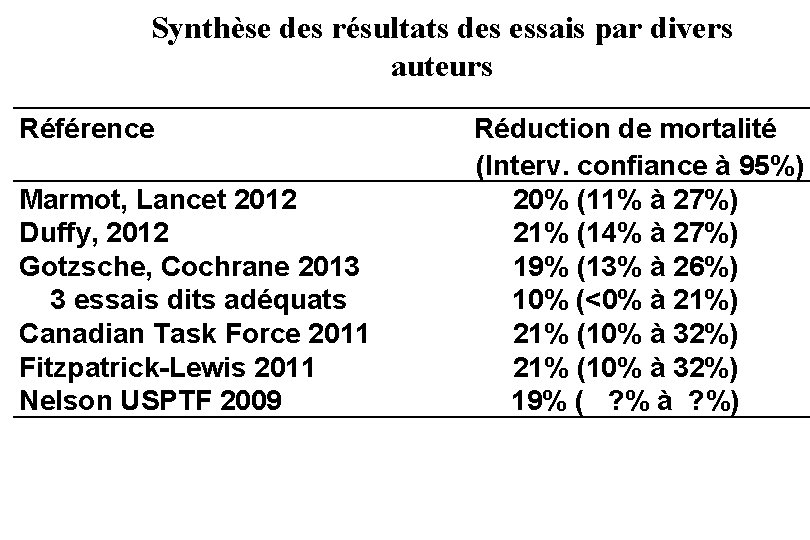
Synthèse des résultats des essais par divers auteurs Référence Marmot, Lancet 2012 Duffy, 2012 Gotzsche, Cochrane 2013 3 essais dits adéquats Canadian Task Force 2011 Fitzpatrick-Lewis 2011 Nelson USPTF 2009 Réduction de mortalité (Interv. confiance à 95%) 20% (11% à 27%) 21% (14% à 27%) 19% (13% à 26%) 10% (<0% à 21%) 21% (10% à 32%) 19% ( ? % à ? %)

Conclusion des résultats des essais La réduction de mortalité est en moyenne de 20% chez les femmes invitées, mais pas de consensus. Réduire de 20% le risque de mourir d’un cancer du sein, c’est relativement bien, mais quelle est la réduction absolue du risque ? On peut la calculer facilement à partir des données des essais, en appliquant la réduction relative du risque observée au risque du groupe témoin.

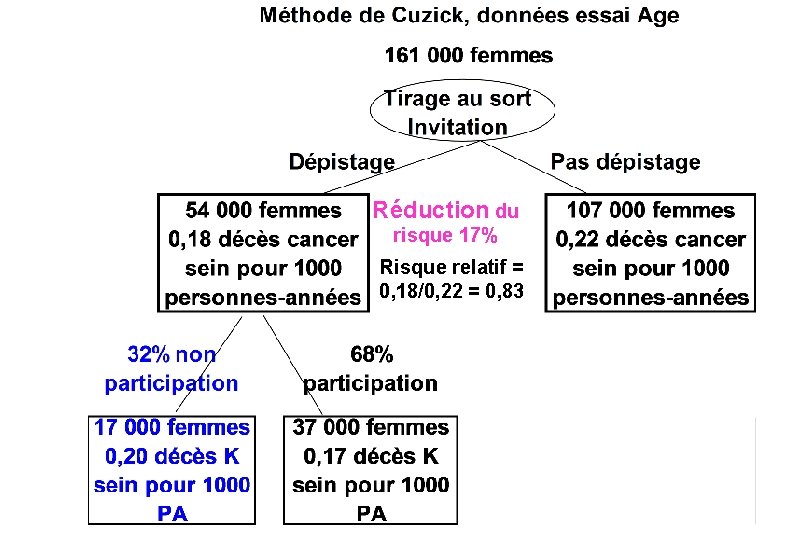
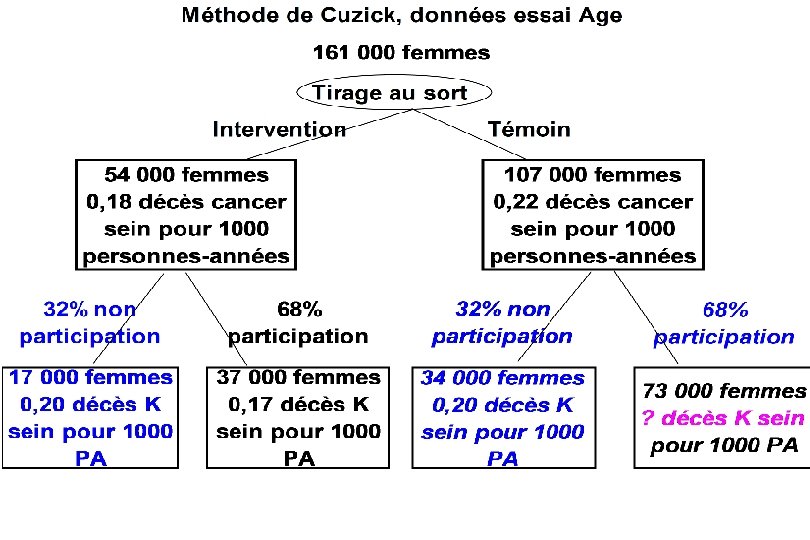
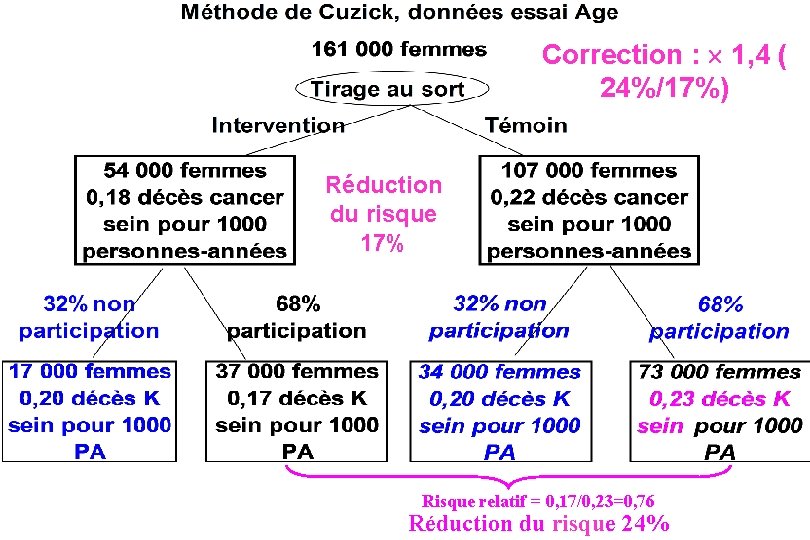
Les essais mesurent le résultat de l’invitation au dépistage et non du dépistage réalisé. Si la compliance n’est pas parfaite, c’est-à-dire s’il y a : § des femmes non dépistées dans le groupe dépistage et § des femmes dépistées dans le groupe témoin, ils en sous estiment le bénéfice (par dilution). On peut estimer l’effet du dépistage réalisé (Cuzick, Statistics in Medicine 1997), prenons l’exemple d’un des essais

Réduction du risque 17% Risque relatif = 0, 18/0, 22 = 0, 83


Correction : 1, 4 ( 24%/17%) Réduction du risque 17% Risque relatif = 0, 17/0, 23=0, 76 Réduction du risque 24%

Bénéfice du dépistage : conclusion Il semble raisonnable de prendre 20% comme estimation de l’effet de l’invitation et 28% comme effet du dépistage réalisé. Les experts ne sont pas d’accord, les estimations vont de 10% pour l’effet de l’invitation dans des essais sélectionnés à 38% ou 48% dans des enquêtes d’observation pour l’effet de la participation

Quand on propose le dépistage du cancer du sein à une femme, ce qui est pertinent c’est la réduction absolue du risque, pas la réduction relative Le risque de mourir d’un cancer du sein est en général très surestimé, aussi bien par les médecins que par la population et par les médias

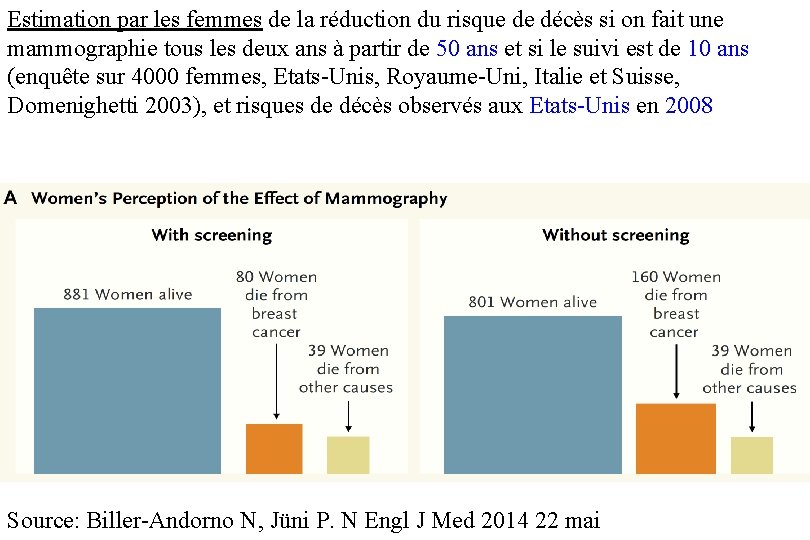
Estimation par les femmes de la réduction du risque de décès si on fait une mammographie tous les deux ans à partir de 50 ans et si le suivi est de 10 ans (enquête sur 4000 femmes, Etats-Unis, Royaume-Uni, Italie et Suisse, Domenighetti 2003), et risques de décès observés aux Etats-Unis en 2008 Source: Biller-Andorno N, Jüni P. N Engl J Med 2014 22 mai

Effet réel du dépistage mammographique sur la mortalité par cancer du sein en 10 ans, calculé à partir des données de mortalité observées en 2008 aux Etats-Unis sous l’hypothèse d’une réduction du risque de 20% de la mortalité par cancer du sein chez 1000 femmes de 50 ans invitées au dépistage. Source: Biller-Andorno N, Jüni P. N Engl J Med 2014 22 mai


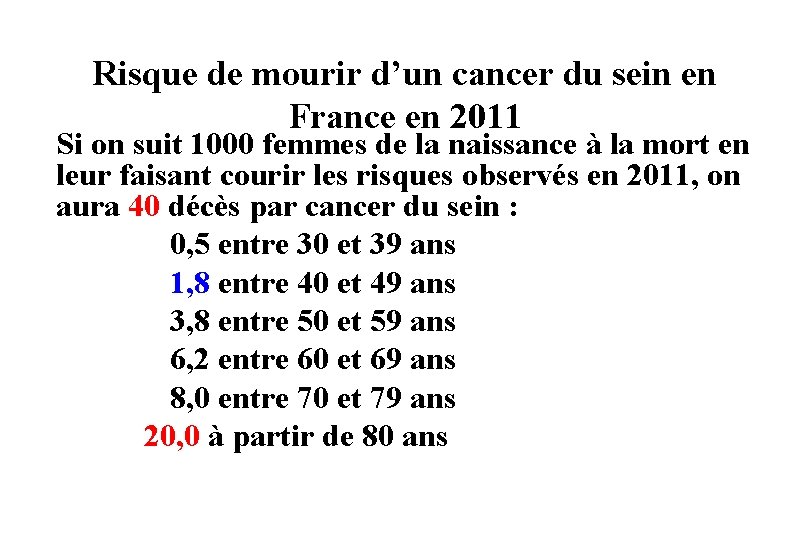
Risque de mourir d’un cancer du sein en France en 2011 Si on suit 1000 femmes de la naissance à la mort en leur faisant courir les risques observés en 2011, on aura 40 décès par cancer du sein : 0, 5 entre 30 et 39 ans 1, 8 entre 40 et 49 ans 3, 8 entre 50 et 59 ans 6, 2 entre 60 et 69 ans 8, 0 entre 70 et 79 ans 20, 0 à partir de 80 ans

Ce risque de mourir d’un cancer du sein observé en France en 2011 est déjà réduit par la pratique répandue du dépistage

Recours à la mammographie dans les deux ans, données 2008 -2009 de l’Echantillon Généraliste des Bénéficiaires de l’Assurance maladie, régime général

Dépistage entre 50 et 74 ans peu de progrès dans la couverture Organisé Autre Total 2008 -2009 45% + 15% = 60% 2012 53% + 10% = 63% 2013 63, 9%? 2014 62, 9% D’après R. Ancelle-Park La lettre du sénologue 2013; 63: 37 Et le quotidien du médecin 2015; 9407: 3

Munis de ces informations, nous pouvons maintenant calculer la réduction absolue du risque apportée par le dépistage Comme exemple, nous allons faire ce calcul dans la classe d’âge 40 à 49 ans, sur la base d’une réduction du risque de 20%. Il faut préciser la durée du suivi. Nous avons pris 10 ans.

La mortalité par cancer du sein entre 40 ans et 49 ans est égale à 1, 8 pour 1000 en 10 ans (0, 18 pour 1000 personnes-années) en France en 2010. Si 36% de ces femmes ont eu un dépistage, et si ce dépistage a réduit le risque de 20%, alors le risque est de 2, 0 pour 1000 en 10 ans chez les femmes non dépistées et de 1, 6 pour 1000 en 10 ans chez les femmes dépistées. Le bénéfice est de 0, 4 pour 1000 femmes en 10 ans (0, 4=2, 0 -1, 6) et il faut dépister 2 500 femmes (1/0, 4 pour 1000) pour éviter 1 décès par cancer du sein en 10 années

L’avantage apporté par le dépistage augmente avec l’âge au premier dépistage, parce que le risque augmente avec l’âge Age Risque de décès % dépistage par cancer du sein en France en 10 ans, France Réduction du risque avec dépistage réalisé Femmes à dépister pour éviter 1 décès en 10 ans 40 1, 8 pour 1000 36 % 28% 1 800 50 3, 8 pour 1000 61% 28% 800 60 6, 2 pour 1000 62% 28% 500 70 8, 0 pour 1000 55% 28% 380 Source INSERM cepi. DC données 2011 Assurance maladie

Principaux inconvénients du dépistage • Surdiagnostic : diagnostic d’un cancer qui ne serait jamais devenu cliniquement détectable du vivant de la femme • Faux positif : dépistage avec mammographie anormale d’où examens complémentaires et beaucoup d’angoisse. Problème non traité faute de temps. • Cancer radio-induit : une mammographie annuelle de 40 à 80 ans augmenterait le risque de décès par cancer du sein de 0, 03% soit 20 à 25 décès pour 100 000 femmes (Hendrick Radiology 2010)

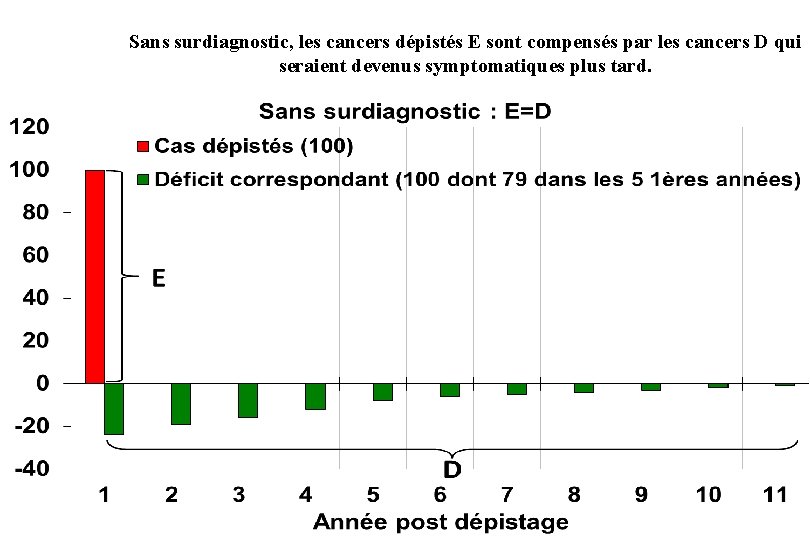
Sans surdiagnostic, les cancers dépistés E sont compensés par les cancers D qui seraient devenus symptomatiques plus tard.

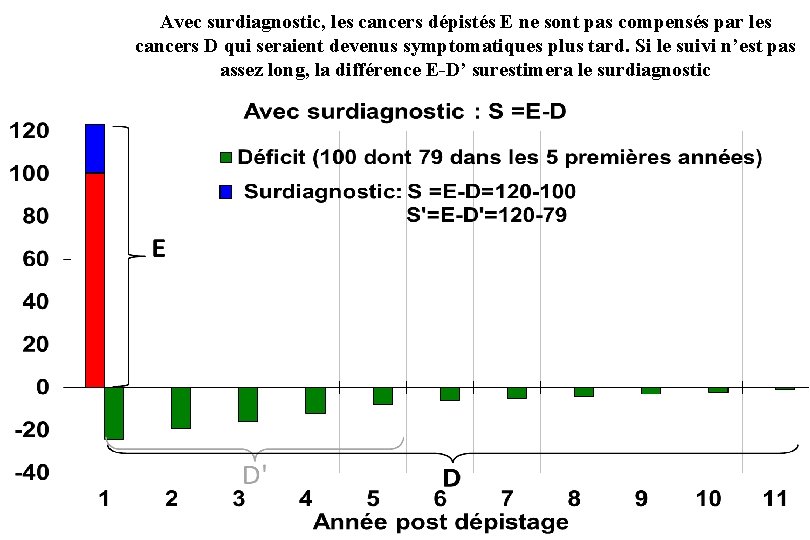
Avec surdiagnostic, les cancers dépistés E ne sont pas compensés par les cancers D qui seraient devenus symptomatiques plus tard. Si le suivi n’est pas assez long, la différence E-D’ surestimera le surdiagnostic

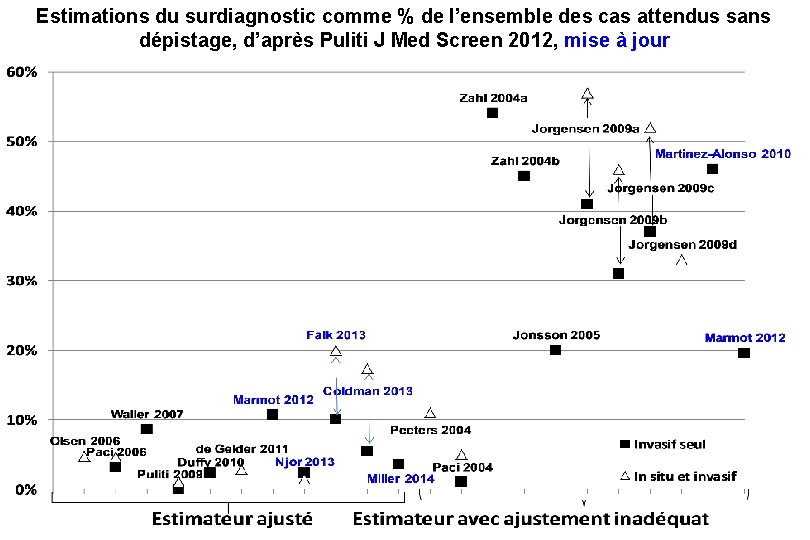
Estimations du surdiagnostic comme % de l’ensemble des cas attendus sans dépistage, d’après Puliti J Med Screen 2012, mise à jour

Conclusions Pas de consensus sur les avantages : réduction du risque 20% pour Marmot (Lancet 2012) 38% à 48% pour un groupe de travail européen (Euroscreen 2012) Pas de consensus sur le surdiagnostic : 19% pour Marmot et 6, 5% pour le groupe de travail européen La réduction relative du risque dépend peu de l’âge, mais la réduction absolue, seule importante, dépend elle beaucoup de l’âge

Risque de décès par cancer de la prostate Si on suit 1 000 hommes de la naissance à la mort, 47 mourront d’un cancer de la prostate, avec les risques observés en 2010, et il y aura : 0 décès entre 0 et 49 ans 6 décès entre 50 et 74 ans et 41 décès à partir de 75 ans Le risque est donc très faible avant 75 ans

1. Risque de décès par cancer de la prostate Si on suit 1 000 hommes de la naissance à la mort, il y aura 6 décès entre 50 et 74 ans i. e. en 24 ans Or 80% d’hommes interrogés par Gigerenzer et coll. (JNCI 2009) pensent qu’en suivant 10 ans 1000 hommes de 50 ans avec un dépistage, on évitera 10 décès, et 41% attendent une réduction d’au moins 100 décès Le risque de décès par cancer de la prostate est donc surestimé d’au moins un facteur 10, et souvent d’un facteur 100

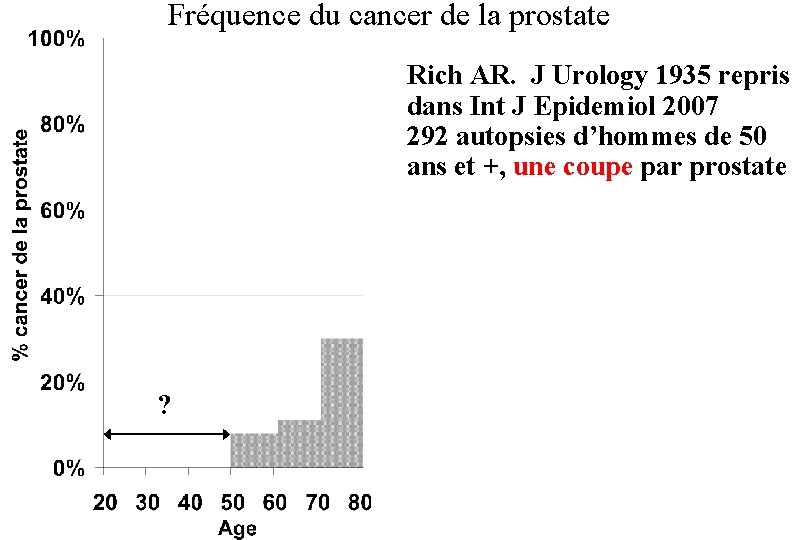
Fréquence du cancer de la prostate Rich AR. J Urology 1935 repris dans Int J Epidemiol 2007 292 autopsies d’hommes de 50 ans et +, une coupe par prostate ?

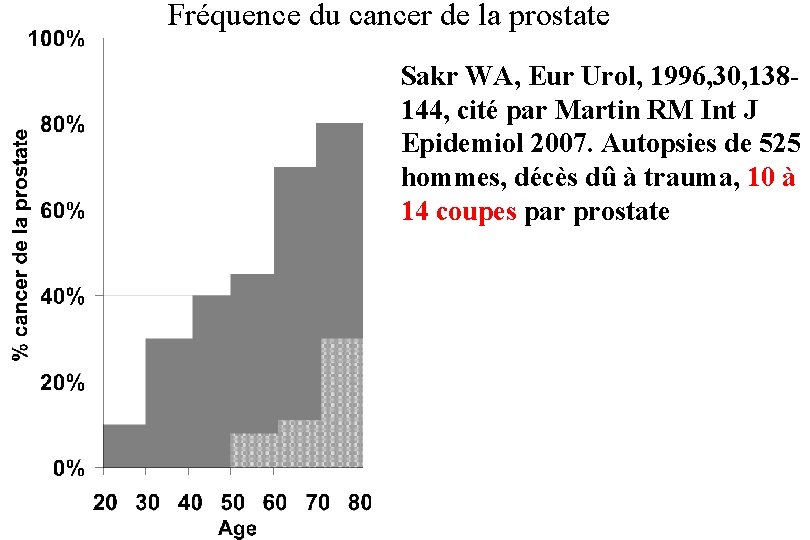
Fréquence du cancer de la prostate Sakr WA, Eur Urol, 1996, 30, 138144, cité par Martin RM Int J Epidemiol 2007. Autopsies de 525 hommes, décès dû à trauma, 10 à 14 coupes par prostate

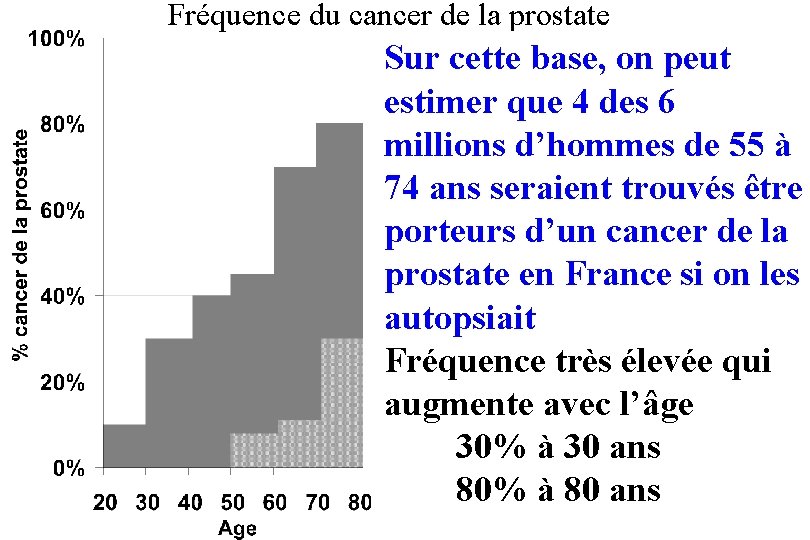
Fréquence du cancer de la prostate Sur cette base, on peut estimer que 4 des 6 millions d’hommes de 55 à 74 ans seraient trouvés être porteurs d’un cancer de la prostate en France si on les autopsiait Fréquence très élevée qui augmente avec l’âge 30% à 30 ans 80% à 80 ans

Surdiagnostic • Maladie semblable à une vraie maladie, mais qui n’aurait jamais ennuyé le patient : – elle n’aurait jamais causé de symptôme – elle serait restée infra clinique jusqu’à ce que la personne meure d’une autre cause • Problèmes : – Le résultat du traitement d’un cas de surdiagnostic ne peut qu’être un succès – Le traitement peut seulement avoir des effets indésirables

Cancer de la prostate L’incidence, c’est à dire la fréquence des nouveaux diagnostics, a augmenté très rapidement jusqu’en 2005. La mortalité diminue depuis 1990 et la baisse est de 4% par an depuis 2003

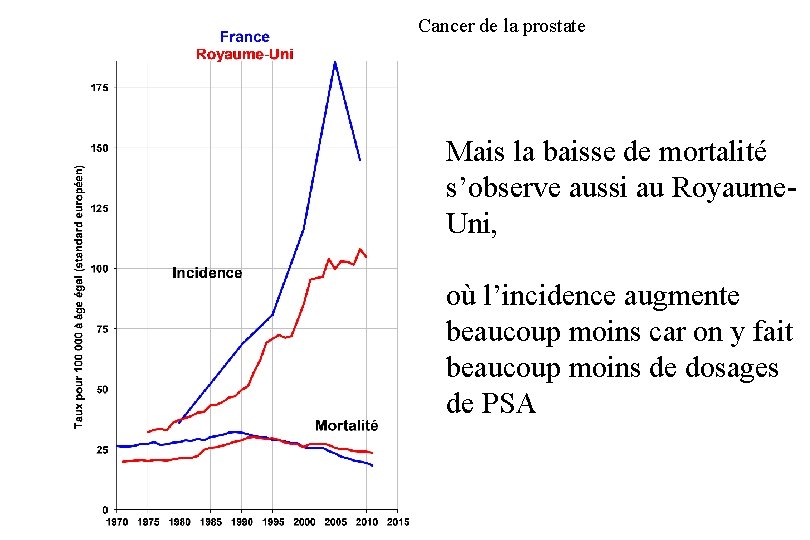
Cancer de la prostate Mais la baisse de mortalité s’observe aussi au Royaume. Uni, où l’incidence augmente beaucoup moins car on y fait beaucoup moins de dosages de PSA

Etendue de l’épidémie due au dépistage A cause du dépistage, on est passé de 10 000 cas par an en 1980 à 21 000 cas en 1990, 39 000 cas en 2000 et 64 000 cas en 2005 53 000 cas en 2009 (L’INVS n’a pas prolongé l’estimation jusqu’en 2012)

Effet du dépistage du cancer de la prostate sur le risque de décès Essai Norrkoping Québec Gr. Dépistage Gr. Témoin Nb décès/Nb total 20/ 1 494 153/ 31 133 97/ Variation du risque & intervalle 95% 7 532 +4% [-36% à +68%] 75/ 15 353 +1% [-34% à +34%] Etats-Unis 92/ 38 343 82/ 38 350 +11% [-17% à +49%] Europe-Suède 250/ 76 915 344/ 93 233 -16% [-30% à -1%] Suède Total 44/ 9 952 78/ 9 952 -44% [-61% à -20%] 559/160 000 676/160 000 -12% [-22% à 0%] Effet du dépistage p=0, 05 Test d’hétérogénéité p=0, 04 Mise à jour -15% après 9 ans -21% après 13 ans -60% -20% Dépistage : Mieux +20% +60% Pire

La réduction du risque de décès due au dépistage Risque • augmenté de 11% dans l’essai américain et • diminué de 16% dans l’essai européen sauf Suède • diminué de 44% dans l’essai suédois Le plus raisonnable est de faire la synthèse de tous les essais d’où une • réduction significative de 12% Choisir l’essai le plus favorable conduit à une réduction très optimiste du risque de 44%

Les effets indésirables des traitements, d’après Gomella 2009 • Prostatectomie : 60 à 90% des patients ont des problèmes d’érection 1 an après, amélioration ultérieure en général 1 à 12% de saignements importants Impuissance 4 à 50% d’incontinence d’effort modérée et/ou 0 à 15% d’incontinence d’effort importante incontinence 2 à 9% de sténose de l’urètre chez 50% des • Curiethérapie, radiothérapie : patients 40% d’impuissance 3 à 5 ans après curie et 80% d’impuissance après radiothérapie Howard 2009 • Hormonothérapie 50 à 100% de problèmes d’érection

Bilan des avantages et des inconvénients du dépistage En supposant que le dépistage réduit le risque de décès de 20%, il conduira à éviter 1 décès pour 1 410 hommes de 50 à 69 ans suivis 10 ans En contrepartie, on aura diagnostiqué et traité 48 cancers qui n’auraient pas entrainé la mort et dont le traitement aura induit l’impuissance ou l’incontinence chez la moitié des patients. D’après Barry N Eng J Med

Conclusion Il est temps de conclure que la balance bénéfice risque est en défaveur du dépistage du cancer de la prostate avant 75 ans ! A moins que l’impuissance et l’incontinence ne vous paraissent des inconvénients négligeables

Dépistage du cancer du poumon Radiologie conventionnelle : inefficace (4 essais) Scanner spiralé à faible dose : un essai américain montre une réduction de la mortalité par cancer du poumon de 20% et une réduction de la mortalité globale de 4%. Cet essai détecte des nodules avec des fréquences de 27%, 28% et 17% dans les examens successifs, dont 96% sont des faux positifs. Plusieurs essais sont en cours dont un essai hollandais NELSON qui gère les nodules différemment d’où 2, 6% d’examens positifs et 64% de faux positifs. Surdiagnostic : 18% Patz et al. JAMA 2014 Cancer radio-induit : Le dépistage par scanner spiralé et les examens diagnostiques en découlant délivrent une dose supérieure à celle des travailleurs de l’industrie nucléaire et des survivants des bombes atomiques. Mc. Cunney & Li. Chest 2014

Conclusion Avancer le diagnostic d’un cancer par dépistage systématique n’est pas nécessairement une bonne idée Il faut améliorer la couverture des dépistages dont l’efficacité est démontrée Il faut éviter de faire des examens qui font plus de mal que de bien

Annexes

Conséquence du dépistage sur la répartition du stade, données hypothétiques 10 000 cas en 1980 : 21 000 cas en 1990 : 39 000 cas en 2000 : 64 000 cas en 2005 : 53 000 cas en 2009 : 5 000 localisés, 5000 métastatiques 16 000 localisés, 5000 métastatiques 34 000 localisés, 5000 métastatiques 59 000 localisés, 5000 métastatiques 48 000 localisés, 5000 métastatiques Les urologues sont rassurés car ils ont l’impression de ne plus voir beaucoup de patients avec des cancers avancés, c’est vrai mais ce n’est pas du tout rassurant


 Catherine tats
Catherine tats Résultat
Résultat Tit for two tats
Tit for two tats Female reproductive cancers
Female reproductive cancers Her2 positive cancers
Her2 positive cancers Catherine peyrot des gachons
Catherine peyrot des gachons Des des des
Des des des Catherine jondreville
Catherine jondreville Catherine belsey books
Catherine belsey books House of capet family tree
House of capet family tree Catherine gordon byron
Catherine gordon byron Catherine paradeise
Catherine paradeise Catherine anquetil
Catherine anquetil Catherine franc
Catherine franc Catherine pelachaud
Catherine pelachaud Catherine wehlburg
Catherine wehlburg Boyaval catherine france
Boyaval catherine france Catherine bradley md
Catherine bradley md Catherine lozupone
Catherine lozupone Catherine gwynne
Catherine gwynne Catherine wishart
Catherine wishart Catherine wehlburg
Catherine wehlburg Catherine pigott
Catherine pigott Catherine clarke psychologist
Catherine clarke psychologist Dr catherine roberts
Dr catherine roberts Catherine of aragon descendants
Catherine of aragon descendants Catherine de medici ballet
Catherine de medici ballet Catherine cress
Catherine cress Catherine maguire infant mental health
Catherine maguire infant mental health Catherine armstrong loughborough
Catherine armstrong loughborough Catherine barba chiaramonti
Catherine barba chiaramonti Catherine earnshaw mental illness
Catherine earnshaw mental illness Who was the absolute monarch of russia
Who was the absolute monarch of russia Catherine cook entrepreneur
Catherine cook entrepreneur Catherine barnard cambridge
Catherine barnard cambridge Catherine recanati
Catherine recanati Src uqam
Src uqam Netherlands royal family tree
Netherlands royal family tree Catherine gater
Catherine gater Catherine bosshart
Catherine bosshart Catherine barruel khodja
Catherine barruel khodja Idealism
Idealism Konrad wolf judith catherine wolf
Konrad wolf judith catherine wolf Dsj organigramme
Dsj organigramme Catherine malaizier
Catherine malaizier Catherine bougault
Catherine bougault Catherine bangeranye
Catherine bangeranye Aprs mutuelle mon compte
Aprs mutuelle mon compte Catherine boudot
Catherine boudot Chapter 29 wuthering heights
Chapter 29 wuthering heights Coulomb élete
Coulomb élete Psychological approach in literature
Psychological approach in literature Catherine riihimaki
Catherine riihimaki Matt bellamy age
Matt bellamy age Catherine matagne
Catherine matagne Catherine carpenter southwestern
Catherine carpenter southwestern Agencywithindatatest
Agencywithindatatest St catherine online ota
St catherine online ota Catherine armstrong loughborough
Catherine armstrong loughborough