Paula Costallat Canto Protenas Componentes fundamentais de todos























- Slides: 30

Paula Costallat Cantão

Proteínas • Componentes fundamentais de todos os seres vivos, inclusive dos vírus; • Formam várias estruturas das células; • Controlam a entrada e saída de substâncias das células pela membrana plasmática; • Conferem sustentação a muitos tecidos do corpo; • Responsáveis pela contração dos músculos e; • Responsáveis pelo transporte de oxigênio no sangue de muitos animais.

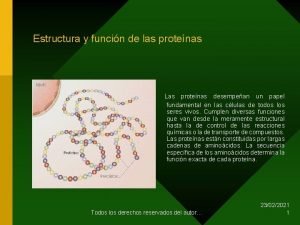
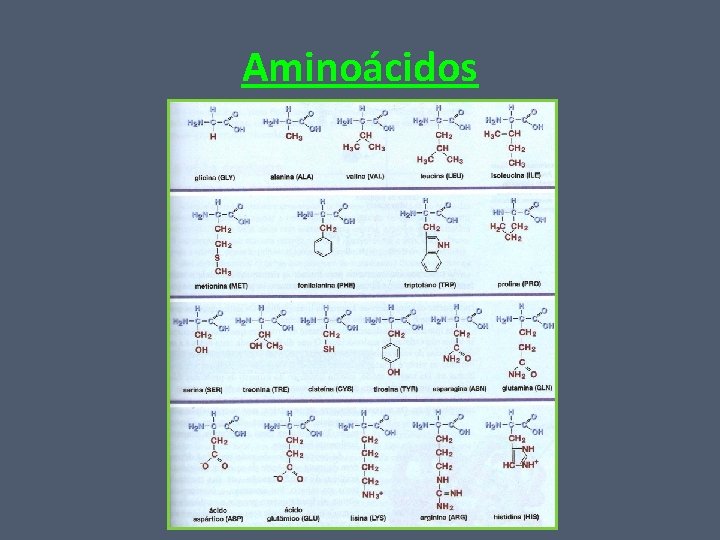
Proteínas Composição Molecular: Moléculas relativamente grandes, formadas pela união sequencial de dezenas ou centenas de moléculas menores, denominadas aminoácidos. É uma sequência de aminoácidos encadeados (cadeia de aminoácidos). Aminoácidos: moléculas orgânicas formadas por átomos de C, H, O e N, unidos de maneira característica. (S)

Aminoácidos Todos os 20 tipos de aminoácidos, diferem quanto ao radical (grupo –R); grupo este que os caracteriza.

Aminoácidos

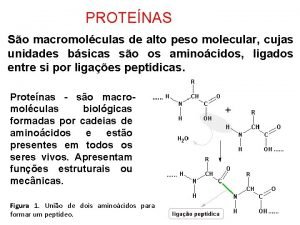
Ligações Peptídicas São ligações entre dois aminoácidos vizinhos, formando uma molécula de proteína (síntese por desidratação). O grupamento Hidroxila do Grupo Carboxila de um dos aminoácidos une-se ao Hidrogênio do Grupo Amina do outro, formando uma molécula de água.

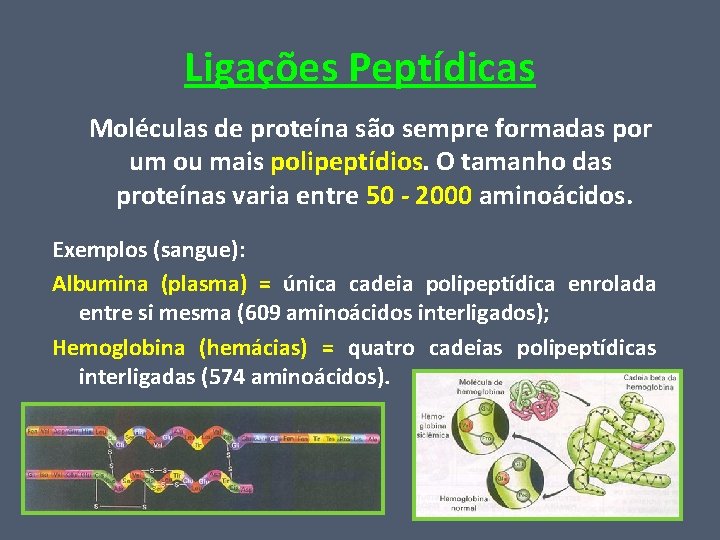
Ligações Peptídicas Peptídios = moléculas resultantes da união de aminoácidos. • Dipeptídio = dois aminoácidos unidos; • Tripeptídio = três aminoácidos unidos; • Tetrapeptídio = quatro aminoácidos unidos; • Oligopeptídio = (oligo = pouco) moléculas formadas por poucos aminoácidos; • Polipeptídio = (poli = muito) moléculas formadas por muitos aminoácidos.

Ligações Peptídicas Moléculas de proteína são sempre formadas por um ou mais polipeptídios. O tamanho das proteínas varia entre 50 - 2000 aminoácidos. Exemplos (sangue): Albumina (plasma) = única cadeia polipeptídica enrolada entre si mesma (609 aminoácidos interligados); Hemoglobina (hemácias) = quatro cadeias polipeptídicas interligadas (574 aminoácidos).


Arquitetura das Proteínas Calcula-se que no corpo humano, existam entre 100 a 200 mil tipos diferentes de proteínas. Diferem umas das outras nos seguintes aspectos: a) Pela quantidade de aminoácidos da cadeia polipeptídica; b) Pelos tipos de aminoácidos presentes na cadeia; c) Pela sequência em que os aminoácidos se dispõem na cadeia polipeptídica.

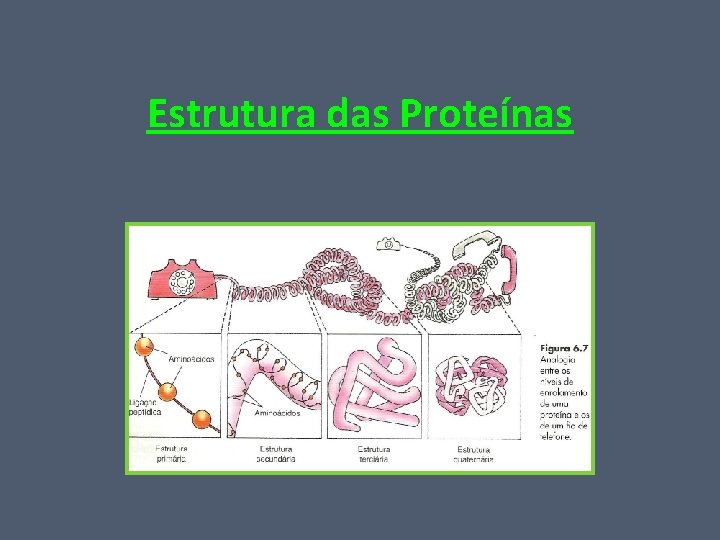
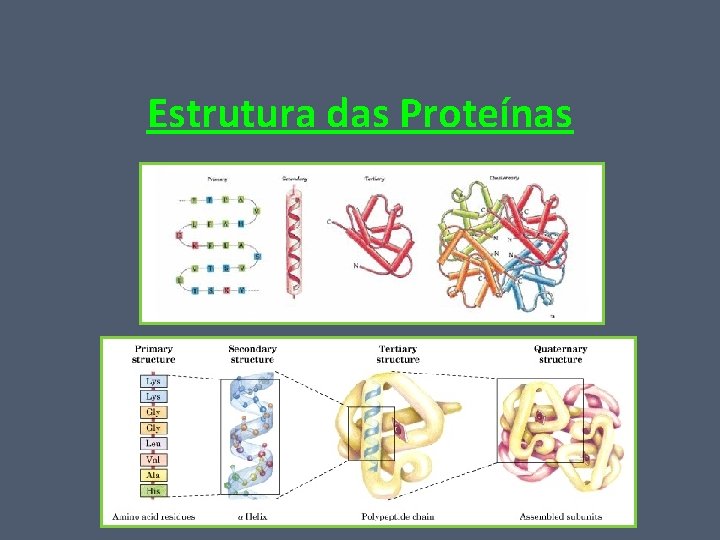
Estrutura das Proteínas Mesmo que a proteína possua exatamente o mesmo número e as mesmas proporções de tipos de aminoácidos, elas podem ser diferentes, dependendo da sequência em que os aminoácidos estão unidos. • • Estrutura primária; Estrutura secundária; Estrutura terciária; Estrutura quaternária.

Estrutura das Proteínas Estrutura primária = tipos de aminoácidos e sua sequência na cadeia polipeptídica. A simples substituição de um aminoácido nessa estrutura pode prejudicar seu funcionamento. Ex: anemia falciforme (moléculas de hemoglobina alteradas, por um único aminoácido)

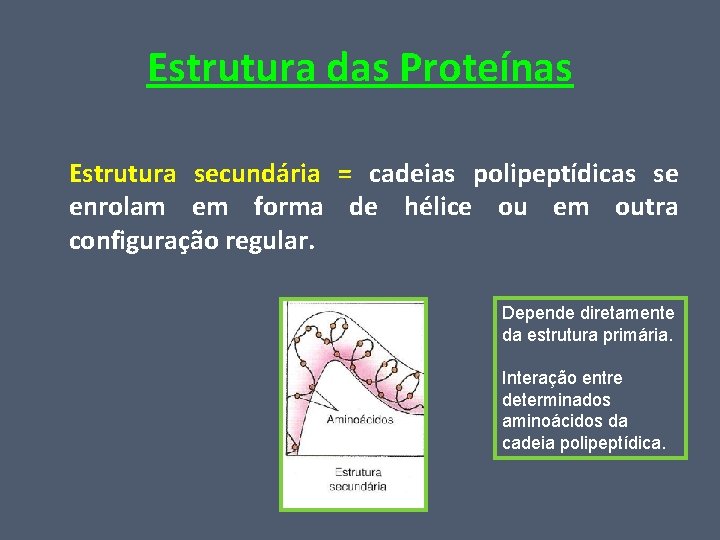
Estrutura das Proteínas Estrutura secundária = cadeias polipeptídicas se enrolam em forma de hélice ou em outra configuração regular. Depende diretamente da estrutura primária. Interação entre determinados aminoácidos da cadeia polipeptídica.

Estrutura das Proteínas Estrutura terciária = segundo nível de enrolamento. Decorre da atração entre diferentes partes da molécula já enrolada em estrutura secundária. Resulta da atração e da repulsão entre os aminoácidos da cadeia polipeptídica e a água circundante.

Estrutura das Proteínas Estrutura quaternária = cadeias polipeptídicas em estruturas terciárias associadas.

Estrutura das Proteínas

Estrutura das Proteínas

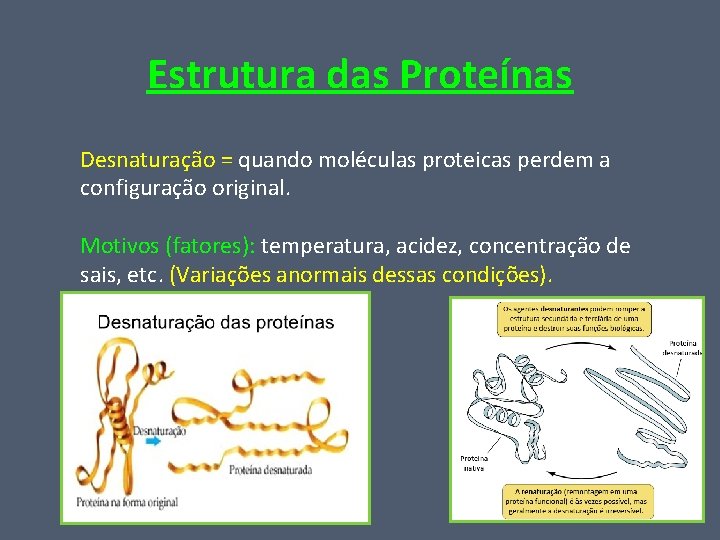
Estrutura das Proteínas Desnaturação = quando moléculas proteicas perdem a configuração original. Motivos (fatores): temperatura, acidez, concentração de sais, etc. (Variações anormais dessas condições).

Estrutura das Proteínas Desnaturação da Albumina

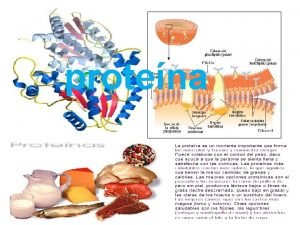
Funções das Proteínas São importantes tanto na estrutura das células quanto no funcionamento. - Ponto de vista estrutural: Formam o Citoesqueleto (esqueleto interno das células, constituído por filamentos protéicos, dando forma e movimento a célula); Fazem parte da estrutura das membranas celulares; Conferem consistência ao citoplasma; -Ponto de vista funcional: Participam de praticamente todas as reações químicas vitais, através de proteínas especiais, denominadas enzimas.

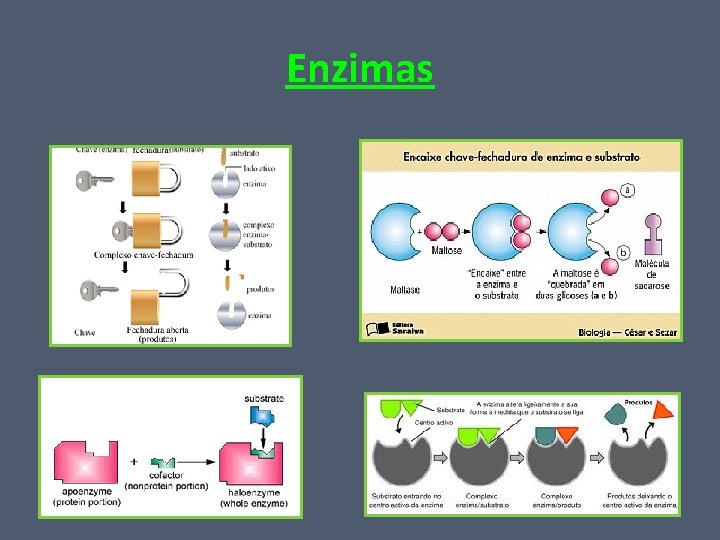
Enzimas São proteínas que atuam como catalisadores biológicos. Catalisador = participa de uma reação química, acelerando-a, porém se desgastar ou se alterar no curso da reação, podendo ser reutilizado. • Catalisam reações de quebra de molécula; • Favorecem a união entre moléculas de substratos; • Atuam modificando certas ligações químicas em uma molécula, transformando-a em outra.

Enzimas Nomenclatura = nome do substrato enzimático + sufixo ase. Exemplos: Protease = enzimas que digerem proteínas; Lipases = enzimas que digerem lipídios; Lactase = enzimas quebram lactose em galactose e glicose; Amilase salivar (ptialina) = enzimas quebram moléculas de amido em maltose ; Sacarase = enzima quebra sacarose em glicose e frutose.

Enzimas São altamente específicas. (Determinada enzima catalisa, em geral, um único tipo de reação. ) Proteína Enzimática: apresenta “encaixes” que se adaptam as moléculas sobre as quais ela atua (substratos enzimáticos). Parte da enzima responsável pelo encaixe com o substrato: CENTRO ATIVO. Grande especificidade: CHAVE – FECHADURA Catalisadores Biológicos: não sofrem alterações moleculares e não são consumidas.

Enzimas

Cofatores e coenzimas Proteínas Simples = enzimas constituídas apenas por cadeias polipeptídicas. Proteínas Conjugadas = enzimas constituídas por: Uma parte proteica (uma ou mais cadeias polipeptídicas) – Apoenzima + Uma parte não-proteica (íons de Cobre, Zinco, . . . ) – Cofator Apoenzima (inativa) + Cofator (inativo) = Holoenzima (ativa) Cofatores de certas enzimas: substâncias orgânicas (Coenzimas). Ex: Vitaminas

Inibição da atividade enzimática Inibição Competitiva: atividades das enzimas inibidas por algumas substâncias. Essas estruturas tem estrutura semelhante à do substrato e competem com ele pela ligação com a enzima. Ligação = é permanente (a molécula de enzima associada ao inibidor deixa de funcionar). Exemplos de inibidores competitivos de ação enzimática: Íon cianeto (CN) = INIBE = Citocromo oxidase (respiração celular) = morte da célula Penicilina = INIBE = Transpeptidase (produção da parede bacteriana) = célula não se reproduz pois não possui a parede da célula.

Fatores que afetam a atividade da enzima Temperatura: cada enzima atua melhor em uma faixa de temperatura característica, chamada temperatura ótima (velocidade da reação catalisada é máxima, sem desnaturação). Maioria das enzimas humanas = 37ºC Bactérias de fontes termais = 80ºC p. H: Grau de acidez do meio, em que a enzima tem seu poder de atuação, chamado de p. H ótimo (no qual sua atividade é máxima). Maioria das enzimas = p. H 7, próximo ao neutro Enzima pepsina (estômago) = p. H 2, fortemente ácido Enzima Tripsina (intestino) = p. H 8, ambiente alcalino



FIM!
 Componentes componentes
Componentes componentes Componentes componentes
Componentes componentes Que es el bolo alimenticio
Que es el bolo alimenticio Componentes componentes
Componentes componentes Chema ruiz el canto del loco
Chema ruiz el canto del loco El software es la parte intangible de la pc
El software es la parte intangible de la pc Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Proteinas conjugadas
Proteinas conjugadas Funciones de las proteinas
Funciones de las proteinas Proteinas como estan formadas
Proteinas como estan formadas Protenas
Protenas Interacciones que estabilizan la estructura terciaria
Interacciones que estabilizan la estructura terciaria Cromoproteinas
Cromoproteinas So
So Estudo das leis fundamentais do pensamento
Estudo das leis fundamentais do pensamento Direitos fundamentais
Direitos fundamentais Formas fundamentais de energia
Formas fundamentais de energia Conceitos centrais de marketing
Conceitos centrais de marketing Conceitos de calor e temperatura
Conceitos de calor e temperatura Teoria dos direitos fundamentais robert alexy
Teoria dos direitos fundamentais robert alexy Cavitação
Cavitação Grandezas fundamentais e derivadas
Grandezas fundamentais e derivadas Teorema do confronto
Teorema do confronto Grandezas fundamentais e derivadas
Grandezas fundamentais e derivadas Somos todos iguais ou somos todos diferentes
Somos todos iguais ou somos todos diferentes Scsa paula beck
Scsa paula beck Paula figari
Paula figari