Purificacin de protenas Parte II Purificacin de protenas

























- Slides: 37

Purificación de proteínas Parte II

Purificación de proteínas Proceso que cuenta con varias etapas cuyo objetivo es lograr la concentración diferencial de una proteína o molécula de interés

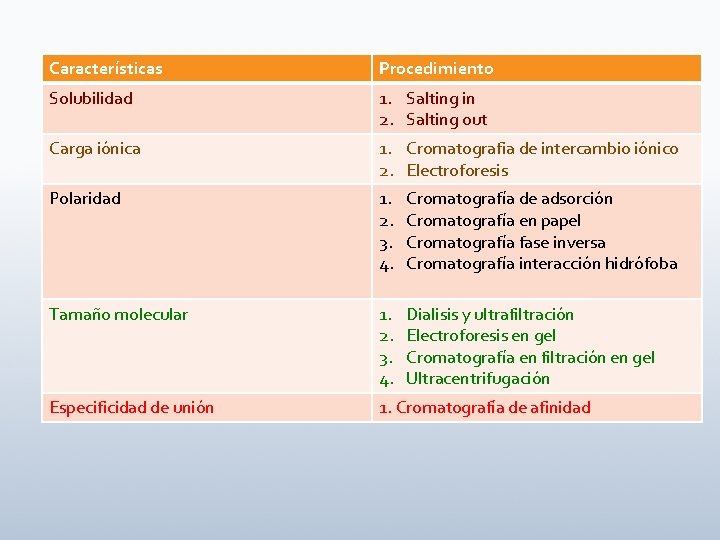
Características Procedimiento Solubilidad 1. Salting in 2. Salting out Carga iónica 1. Cromatografia de intercambio iónico 2. Electroforesis Polaridad 1. 2. 3. 4. Cromatografía de adsorción Cromatografía en papel Cromatografía fase inversa Cromatografía interacción hidrófoba Tamaño molecular 1. 2. 3. 4. Dialisis y ultrafiltración Electroforesis en gel Cromatografía en filtración en gel Ultracentrifugación Especificidad de unión 1. Cromatografía de afinidad

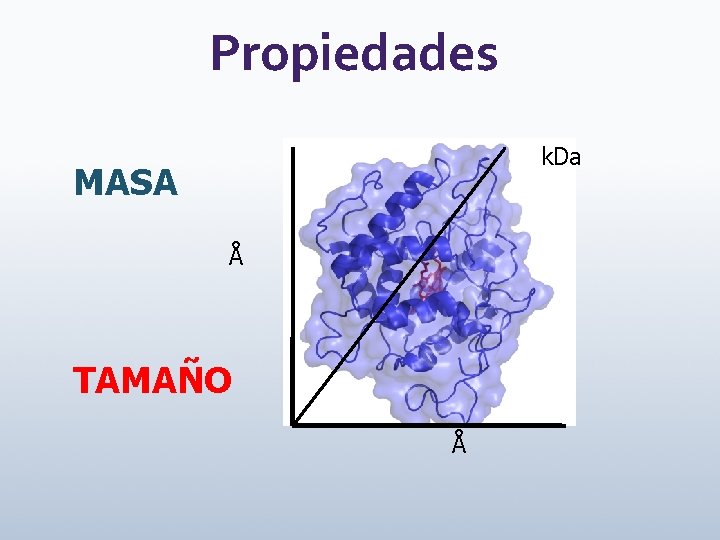
Propiedades k. Da MASA Å TAMAÑO Å

Carga

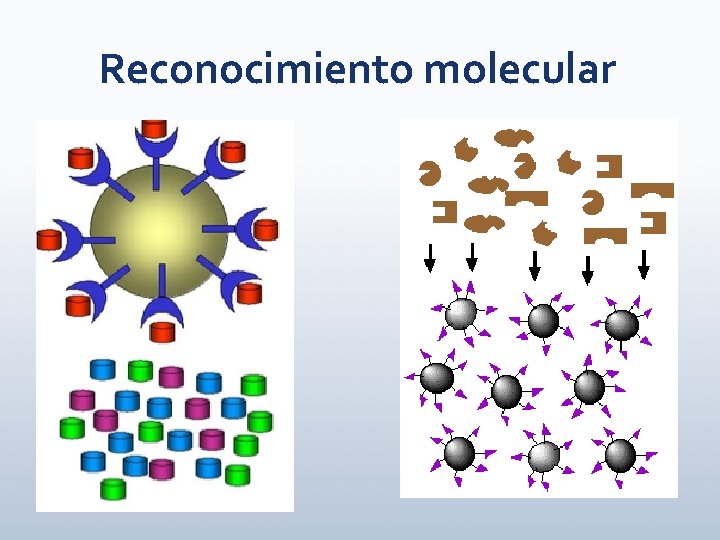
Reconocimiento molecular

Cromatografía Es un conjunto de técnicas basadas en el principio de retención selectiva, cuyo objetivo es separar los distintos componentes de una mezcla, permitiendo identificar dichos componentes. Muestra aplicada Eluyente Volumen de columna Matriz Tapón poroso Eluyente Proteínas separadas

Matriz de la columna. Sustancia que está empapada de solvente y que se empaqueta en la columna. También se denomina fase estacionaria o lecho de la columna. Fase Móvil. Solución Tamponada que se hace pasar a través de la columna. Longitud del dispositivo en el que se empaqueta la columna. Es importante en algunos tipos de cromatografía como la de filtración en gel y poco importante en otras como la cromatografía de afinidad. Volumen de la columna. Volumen total de gel que se empaqueta en una columna cromatográfica. Volumen muerto de la columna. Cantidad de solvente que tiene que atravesar la columna para asegurar que se ha reemplazado completamente.

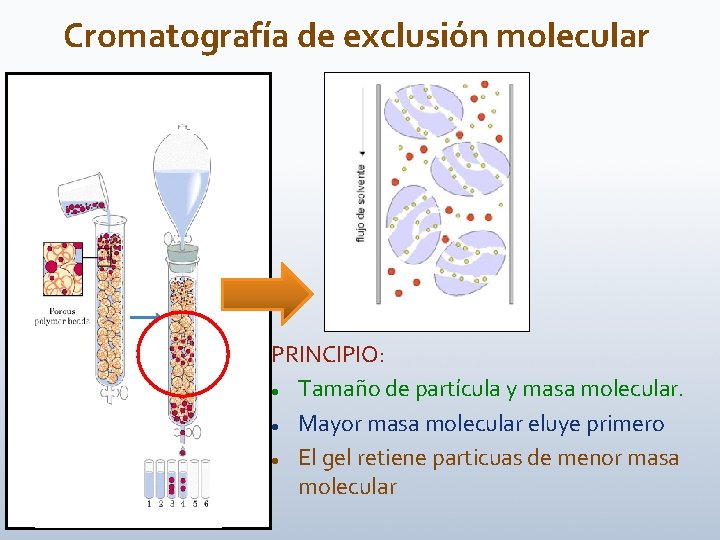
Cromatografía de exclusión molecular PRINCIPIO: Tamaño de partícula y masa molecular. Mayor masa molecular eluye primero El gel retiene particuas de menor masa molecular

TIPOS DE MATRIZ APLICACIONES GRANULOS DE UN MATERIAL ESPONJOSO E HIDRATADO Desalado de proteínas Purificación de proteínas Determinación del peso molecular de las proteínas Dextranos con enlaces cruzados Agarosa Poliacridamida

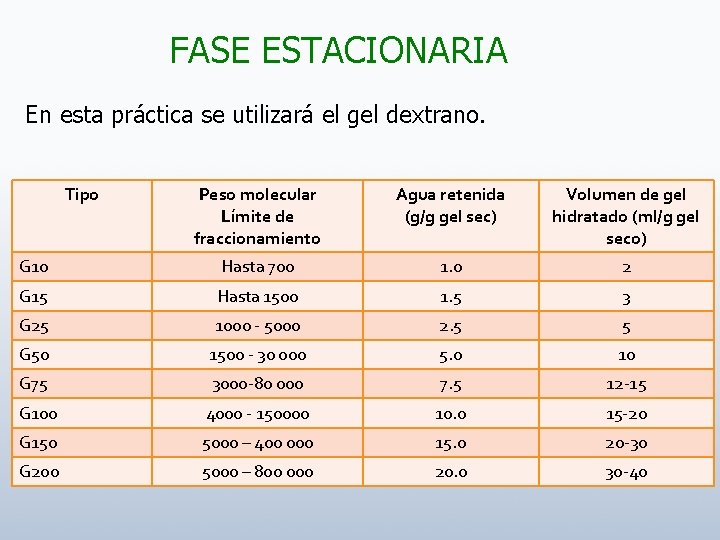
FASE ESTACIONARIA En esta práctica se utilizará el gel dextrano. Tipo Peso molecular Límite de fraccionamiento Agua retenida (g/g gel sec) Volumen de gel hidratado (ml/g gel seco) G 10 Hasta 700 1. 0 2 G 15 Hasta 1500 1. 5 3 G 25 1000 - 5000 2. 5 5 G 50 1500 - 30 000 5. 0 10 G 75 3000 -80 000 7. 5 12 -15 G 100 4000 - 150000 10. 0 15 -20 G 150 5000 – 400 000 15. 0 20 -30 G 200 5000 – 800 000 20. 0 30 -40

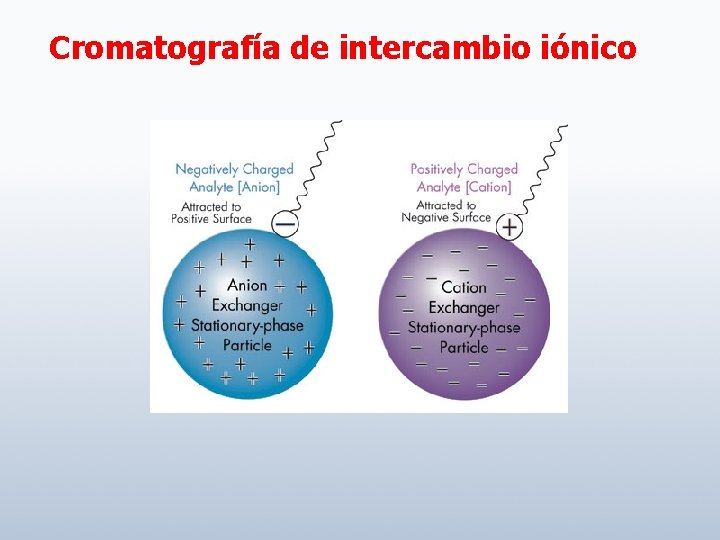
Cromatografía de intercambio iónico

Intercambio catiónico Fase estacionaria cargada negativamente Intercambio aniónico Fase estacionaria cargada positivamente

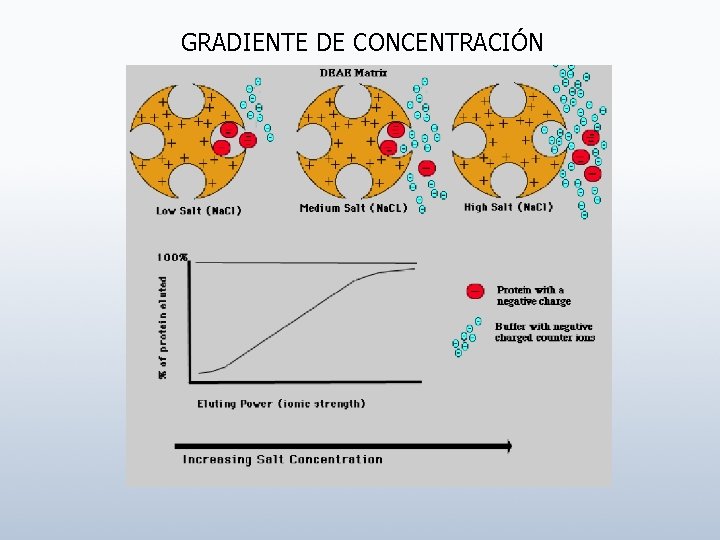
GRADIENTE DE CONCENTRACIÓN

Factores que afectan a la retención 1. Fuerza Iónica 2. p. H 3. Modificadores Orgánicos

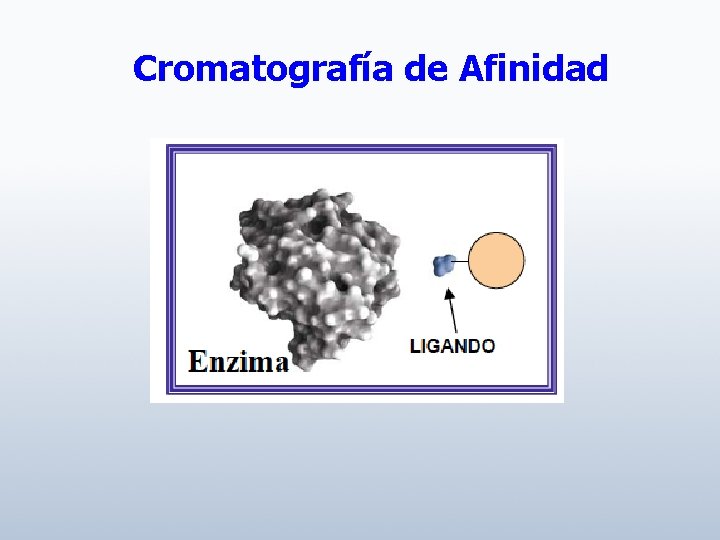
Cromatografía de Afinidad

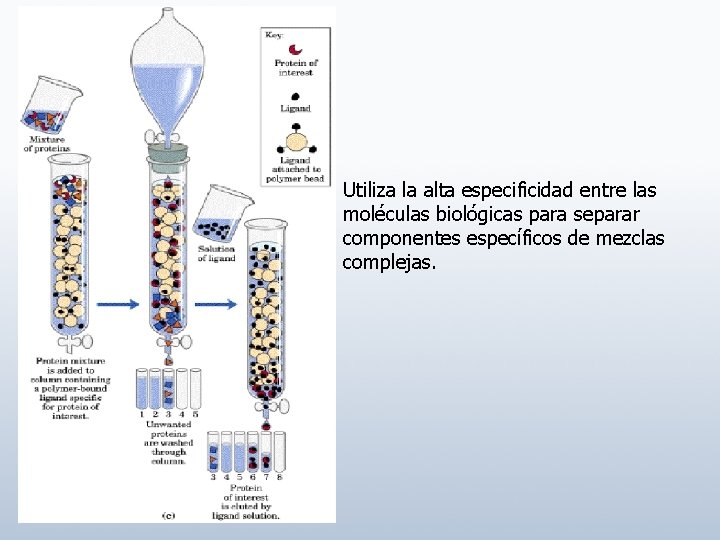
Utiliza la alta especificidad entre las moléculas biológicas para separar componentes específicos de mezclas complejas.


VENTAJAS: No hay restricción por volumen. Especificidad Pureza del producto final DESVENTAJAS: Precio (alto) Condiciones de elución drásticas Ligando específico no disponible o inadecuado

Determinación de la concentración de proteína Métodos espectrofotométricos Ventajas de la técnica Rápida Precisa Versátil Fácil de usar Eficiente en costo

ESPECTROFOTOMETRÍA Son métodos cuantitativos de análisis químico que utilizan la luz para medir la concentración de las sustancias químicas. Espectrofotométria de absorción visible (Colorimetría) Absorción ultravioleta (UV) Infrarroja


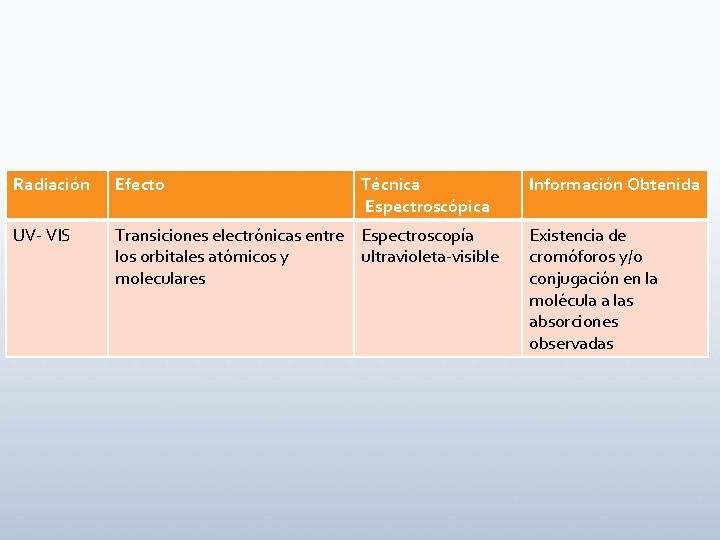
Radiación Efecto Técnica Espectroscópica UV- VIS Transiciones electrónicas entre Espectroscopía los orbitales atómicos y ultravioleta-visible moleculares Información Obtenida Existencia de cromóforos y/o conjugación en la molécula a las absorciones observadas

Tungsteno (visible) Deuterio (UV)

LEY DE LAMBERT Y BEER Establece que la absorbancia es proporcional al número de moléculas absorbentes por las que pasa la luz. A = ε*C*b A = absorbancia C= concentración b=longitud de la celda ε= coeficiente de extinción o absortividad molar?

Coeficiente de extinción o absortividad molar Es una propiedad intrínseca de los compuestos. Es una medida de absorción de luz de las especies químicas a una determinada longitud de onda Unidades ε=M-1 cm-1

DETERMINACIÓN DE LA CONCENTRACIÓN DE PROTEÍNA Los métodos más usuales son: -Absorción en el ultravioleta. -Reacción del Biuret. -Método de Lowry. -Método de Bradford.

Absorción en el ultravioleta • Es un método no destructivo. • El intervalo de concentración que se puede determinar depende del contenido de los aminoácidos Tyr y Trp, y oscila entre 0, 05 y 2 mg/ml. • La presencia de sustancias absorbentes a 280 nm conduce a interferencias.



Método de Biuret Las características más importantes de la reacción son: La reacción del Biuret se aplica, a partir de los tetrapéptidos, a todos los péptidos y proteínas. Su intervalo de determinación es de 1 a 6 mg/ml. No depende de la composición de aminoácidos. Algunos compuestos (NH 4+, Tris, etc. ) dan la reacción. (Proteína en solución alcalina) Complejo proteína-Cu(II) Coloración violeta-púrpura (540 nm)

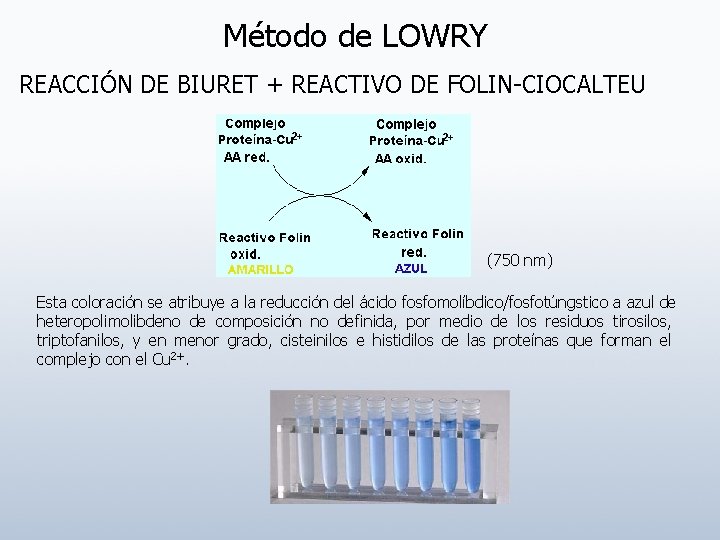
Método de LOWRY REACCIÓN DE BIURET + REACTIVO DE FOLIN-CIOCALTEU (750 nm) Esta coloración se atribuye a la reducción del ácido fosfomolíbdico/fosfotúngstico a azul de heteropolimolibdeno de composición no definida, por medio de los residuos tirosilos, triptofanilos, y en menor grado, cisteinilos e histidilos de las proteínas que forman el complejo con el Cu 2+.

Método de BRADFORD • El rango de determinación de proteína es de 1 -10 mg/ml (ensayo micro) y de 0, 5 -1, 4 mg/ml (ensayo estándar). • La intensidad de absorción depende del contenido de aminoácidos básicos y aromáticos.

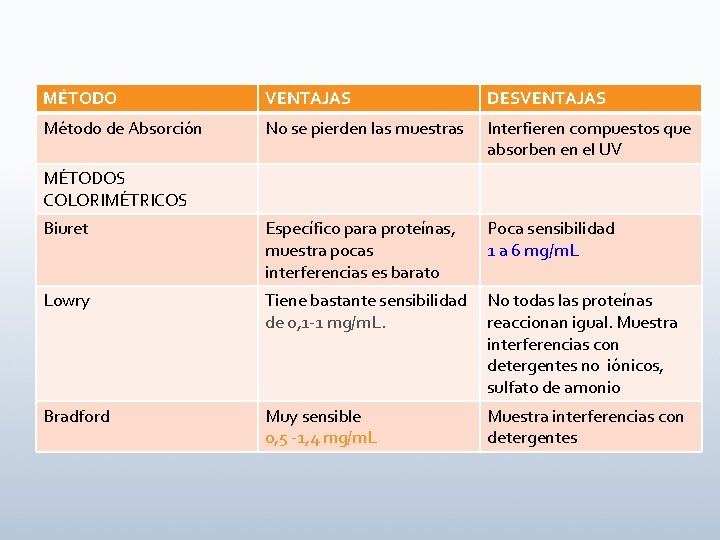
MÉTODO VENTAJAS DESVENTAJAS Método de Absorción No se pierden las muestras Interfieren compuestos que absorben en el UV Biuret Específico para proteínas, muestra pocas interferencias es barato Poca sensibilidad 1 a 6 mg/m. L Lowry Tiene bastante sensibilidad de 0, 1 -1 mg/m. L. No todas las proteínas reaccionan igual. Muestra interferencias con detergentes no iónicos, sulfato de amonio Bradford Muy sensible 0, 5 -1, 4 mg/m. L Muestra interferencias con detergentes MÉTODOS COLORIMÉTRICOS

Curva Patrón Es un marco de referencia que se construye de cantidades conocidas de una sustancia (por ejemplo la albúmina sérica bovina) que se utiliza para determinar la cantidad de proteínas presente en una muestra incógnita. A 280 nm A 595 nm BSA (µg)


 Te invitamos a ser parte
Te invitamos a ser parte Este parte aquele parte
Este parte aquele parte Tabla de parte entera y parte decimal
Tabla de parte entera y parte decimal A missa parte por parte
A missa parte por parte Protenas
Protenas Protenas
Protenas Proteinas monomericas
Proteinas monomericas Protenas
Protenas Protenas
Protenas Funciones de las proteinas
Funciones de las proteinas Proteinas como estan formadas
Proteinas como estan formadas Protenas
Protenas Estructuras de las proteinas primarias
Estructuras de las proteinas primarias Protenas
Protenas Funcion de las cromoproteinas
Funcion de las cromoproteinas Protenas
Protenas Las partes de la mano
Las partes de la mano Una historia
Una historia Mga salitang ginagamit sa magazine
Mga salitang ginagamit sa magazine Fattura immediata ddt
Fattura immediata ddt Ano ang paksang diwa sa talata
Ano ang paksang diwa sa talata Es la parte de la oración que se conjuga
Es la parte de la oración que se conjuga Ejercicios de parte principal
Ejercicios de parte principal Ano ang talumpati
Ano ang talumpati Parte ng talata
Parte ng talata é a parte do planeta em que pisamos
é a parte do planeta em que pisamos L'angolo di deriva è causato dalle forze motrici
L'angolo di deriva è causato dalle forze motrici Componenti della velocità
Componenti della velocità El tronco del cuerpo humano
El tronco del cuerpo humano Andreas ladner parte
Andreas ladner parte Incision subcostal bilateral chevron
Incision subcostal bilateral chevron 2 - na parte b,é possível observar… * 1 ponto
2 - na parte b,é possível observar… * 1 ponto Halimbawa ng taludtod
Halimbawa ng taludtod Lee el siguiente comic y responde
Lee el siguiente comic y responde Lobi e lobuli renali
Lobi e lobuli renali Cos'è la vernalizzazione
Cos'è la vernalizzazione Paano sumulat ng liham para sa kaibigan
Paano sumulat ng liham para sa kaibigan Juicio político argentina
Juicio político argentina