PURIFICACIN DE PROTENAS Ruptura de Clulas Concentracin de



























- Slides: 46

PURIFICACIÓN DE PROTEÍNAS Ruptura de Células Concentración de proteínas Marzo 2019

Planificación inicial Cuál es el uso que se le va a dar a la proteína? El grado de pureza necesario dependerá del uso que se va a dar a la proteína. Para investigación, la escala es reducida y es más importante la pureza que el rendimiento. Para usos terapéuticos la escala es mayor y la pureza requerida es máxima. Para usos industriales, frecuentemente se requiere gran cantidad, bajo costo y pureza menor. Para act. biológica debe estar nativa; para determinar estr. 1° puede estar desnaturalizada. Cuál es la fuente más adecuada? Fuentes naturales donde la proteína de interés es más abundante y estable. Fuentes recombinantes. Elección del organismo productor. Qué sabemos de la proteína? El saber si la proteína es extracelular, intracelular, soluble, insoluble, asociada a membrana o localizada en una organela particular, influirá en la elección del método de extracción. Si se trata de una enzima o un receptor se puede explotar la afinidad por sustrato o ligando. Tamaño y p. I. Estabilidad, sensibilidad a la T, extremos de p. H, proteasas, aire, metales.

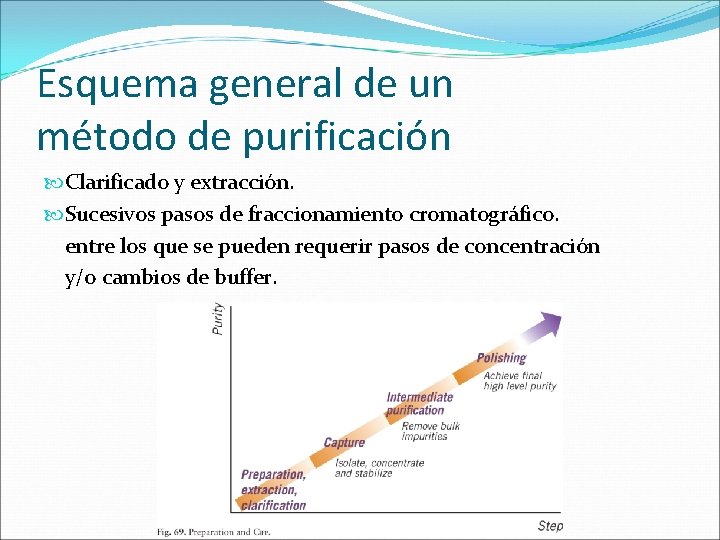
Esquema general de un método de purificación Clarificado y extracción. Sucesivos pasos de fraccionamiento cromatográfico. entre los que se pueden requerir pasos de concentración y/o cambios de buffer.

Clarificado El objetivo principal de la clarificación es separar eficientemente células, debris celulares o partículas coloidales para proporcional a los procesos cromatográficos posteriores un material de partida libre de partículas. Centrifugación Microfiltración

Clarificado por centrifugación Se utiliza la diferencia de densidad entre los componentes de una muestra acelerando la sedimentación que se produciría normalmente. La centrifugación implica la aplicación de una aceleración radial a una suspensión de partículas por un movimiento rotacional.

Centrifugación a escala de lab

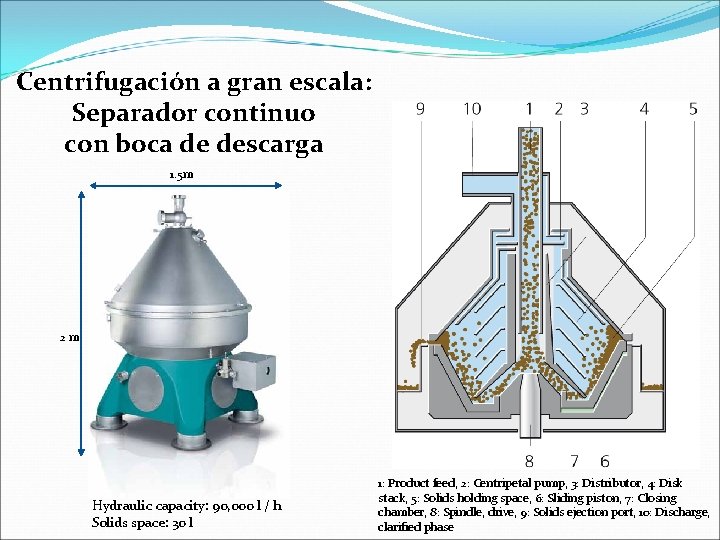
Centrifugación a gran escala: Separador continuo con boca de descarga 1. 5 m 2 m Hydraulic capacity: 90, 000 l / h Solids space: 30 l 1: Product feed, 2: Centripetal pump, 3: Distributor, 4: Disk stack, 5: Solids holding space, 6: Sliding piston, 7: Closing chamber, 8: Spindle, drive, 9: Solids ejection port, 10: Discharge, clarified phase

Clarificado por microfiltración aplicación de una presión a través de un filtro compuesto por una membrana semi-permeable (0. 1 μM-10 μM)

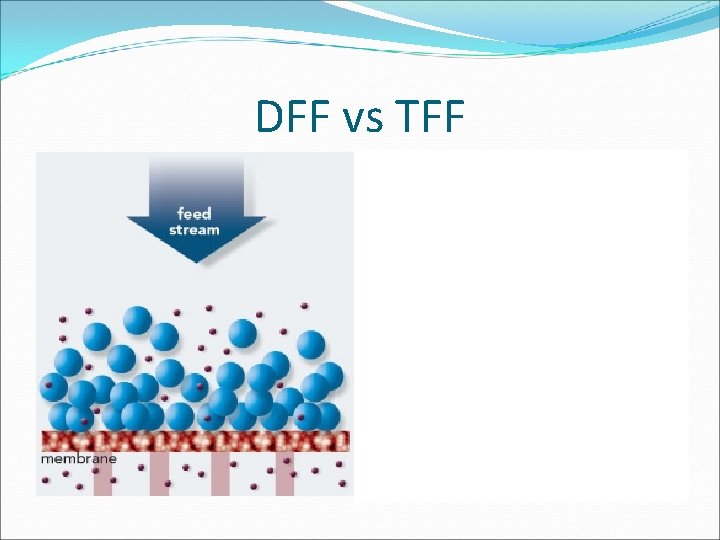
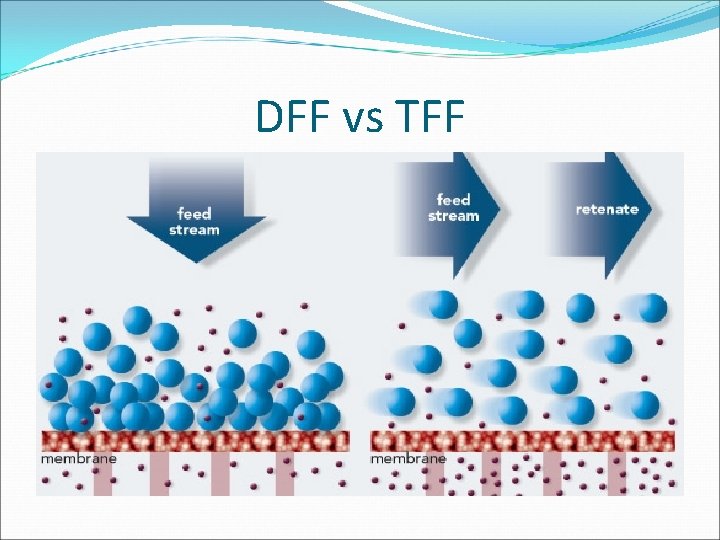
DFF vs TFF

DFF vs TFF

Microfiltración: DFF (direct flow filtration)

Microfiltración: DFF Escala de lab Escala industrial

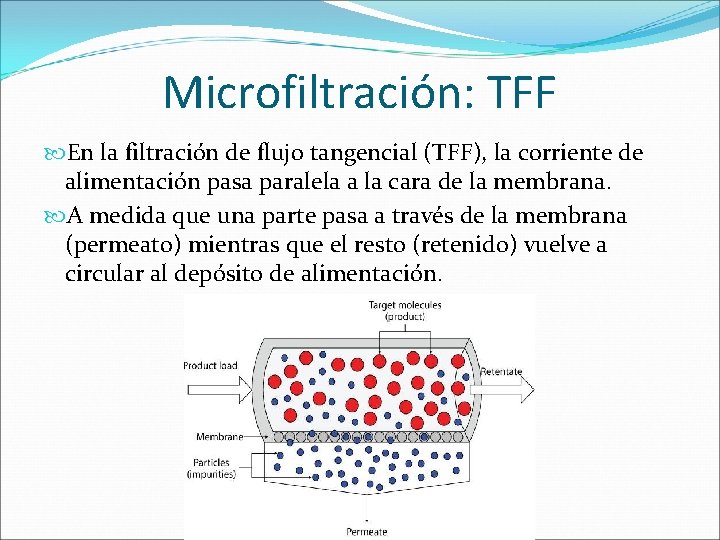
Microfiltración: TFF En la filtración de flujo tangencial (TFF), la corriente de alimentación pasa paralela a la cara de la membrana. A medida que una parte pasa a través de la membrana (permeato) mientras que el resto (retenido) vuelve a circular al depósito de alimentación.

Para estudiar las proteínas, debemos poder obtenerlas de alguna fuente. Una fuente común son las células. Pero. . . ¿cómo extraemos la proteína de interés de una muestra de células?

Extracción Diferencias en la facilidad de la ruptura - Las células animales son muy fáciles de romper, sólo están recubiertas por una membrana plasmática débilmente soportada por un citoesqueleto. - Las vegetales también, pese a tener pared celular, su gran tamaño las hace vulnerables a la ruptura mecánica. - Las células bacterianas son más resistentes, y esta propiedad depende de que sean Gram positivas o Gram negativas. El predominio del peptidoglicano en la pared de las primeras, las hace mucho más sensibles a métodos suaves, como la digestión con lisozima. - Los hongos filamentosos y las levaduras son los más resistentes a la ruptura. Tienen paredes celulares que contienen hasta 80 - 90 % de polisacárido (quitina y glucanos en hongos, manano y glucano en levaduras), además de lípidos y proteínas. Consecuencias de la ruptura - Calor, liberación de proteasas, liberación del ADN celular y aumento de la viscosidad del extracto

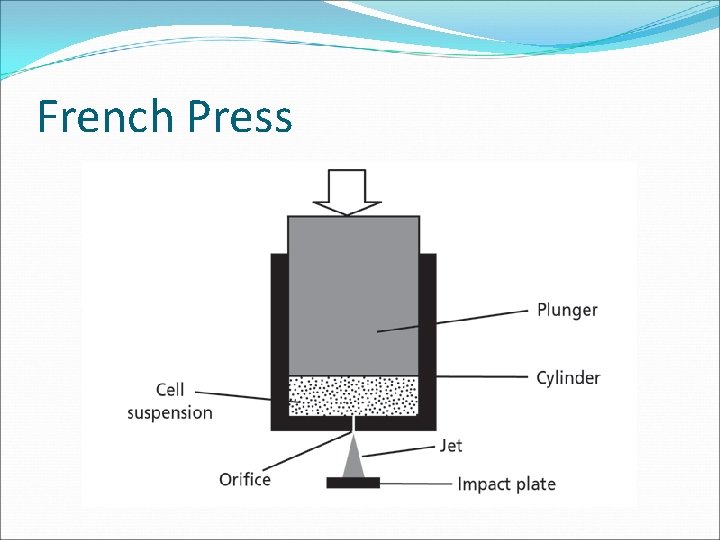
EXTRACCIÓN: MÉTODOS MECÁNICOS Homogeneizadores: - - Mezcladoras y licuadoras para órganos y tejidos (cuchillas rotatorias) - - French Press (extrusión de líquidos) “exprimir” las células a través de un tubo que es mucho menor que ellas. Utilizado para romper bacterias, levaduras. Agitación con abrasivos: - Mortereado con alúmina, carburo de silicio, arena para pequeños vol - Bolitas de vidrio para volúmenes mayores Sonicado: υ>20 k. Hz “cavitación gaseosa” pequeñas burbujas se forman y explotan produciendo una onda de shock local que produce cambios de presión y disrumpe las células. Congelado-Descongelado: formación de cristales que rompen la célula. Utilizado para materiales blandos.

French Press

Sonicador

Sonicador

Sonicador

Sonicador

EXTRACCIÓN: MÉTODOS NO MECÁNICOS Involucran la adición de químicos o enzimas que degradan específicamente los componentes de la pared celular. Muchas veces se utilizan en combinación con métodos mecánicos para asegurar una ruptura completa. La desventaja es que luego tienen que ser removidos de la muestra. Ejemplos: Enzimas líticas Shock osmótico Detergentes y solventes

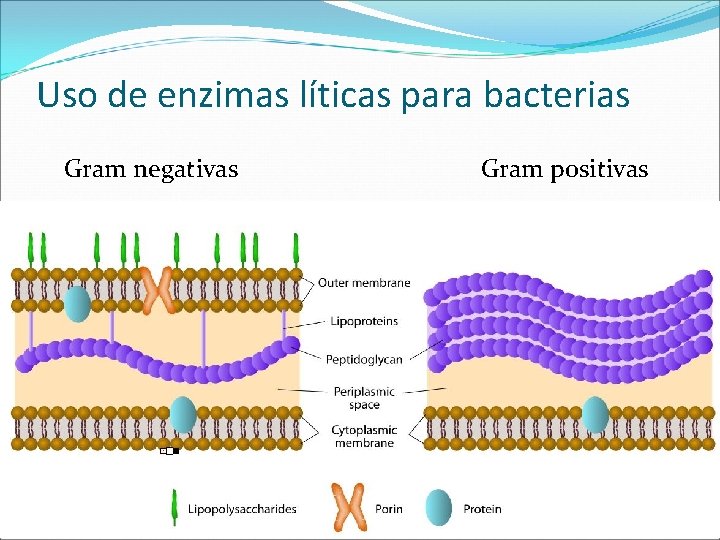
Uso de enzimas líticas para bacterias Gram negativas Gram positivas

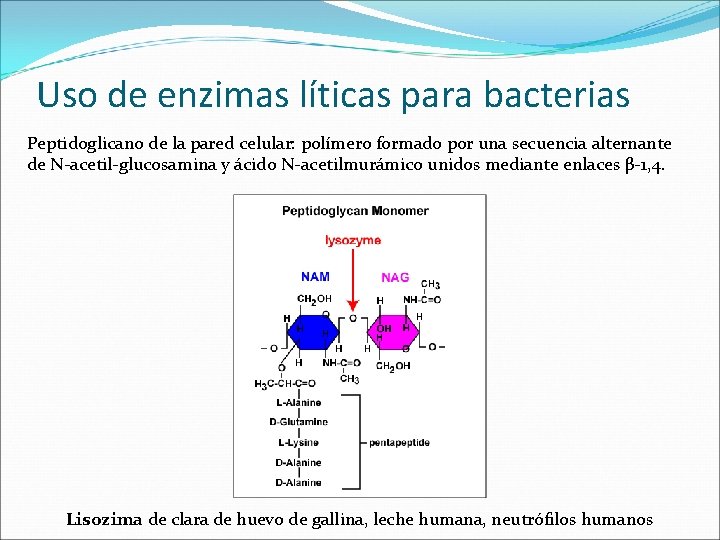
Uso de enzimas líticas para bacterias Peptidoglicano de la pared celular: polímero formado por una secuencia alternante de N-acetil-glucosamina y ácido N-acetilmurámico unidos mediante enlaces β-1, 4. Lisozima de clara de huevo de gallina, leche humana, neutrófilos humanos

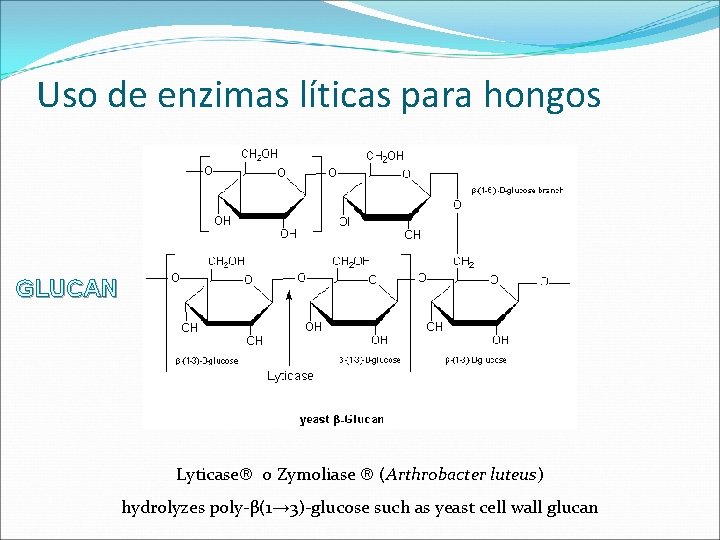
Uso de enzimas líticas para hongos GLUCAN Lyticase o Zymoliase (Arthrobacter luteus) hydrolyzes poly-β(1→ 3)-glucose such as yeast cell wall glucan

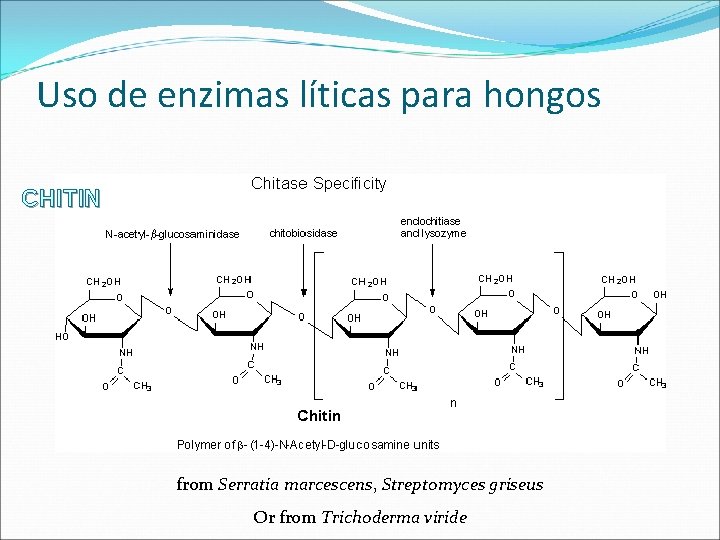
Uso de enzimas líticas para hongos CHITIN from Serratia marcescens, Streptomyces griseus Or from Trichoderma viride

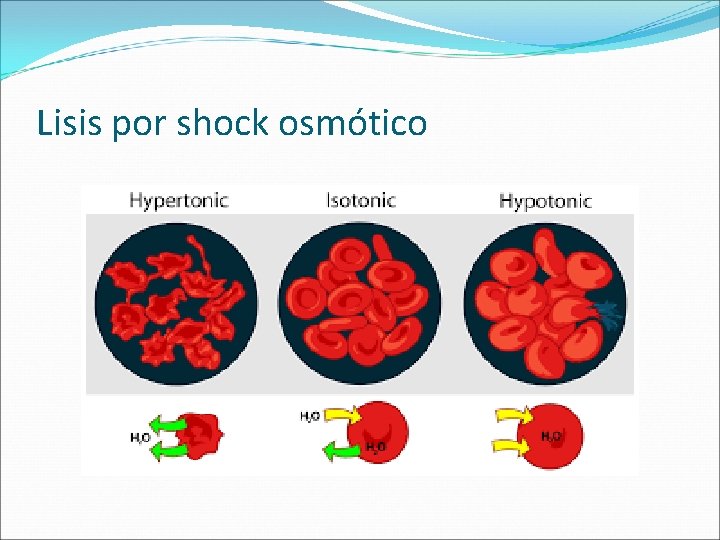
Lisis por shock osmótico

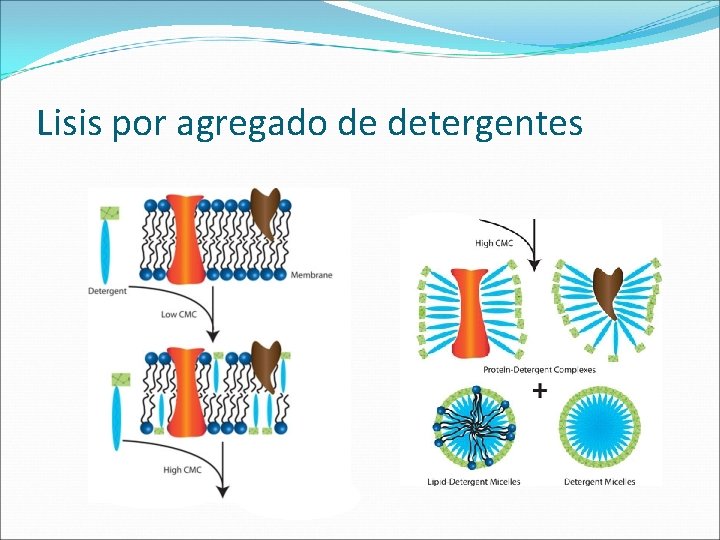
Lisis por agregado de detergentes

Detergentes no iónicos Interrumpe interacciones lípido-lípido, lípidoproteína pero preservan interacciones proteína. Triton X-100, IGEPAL, NP-40


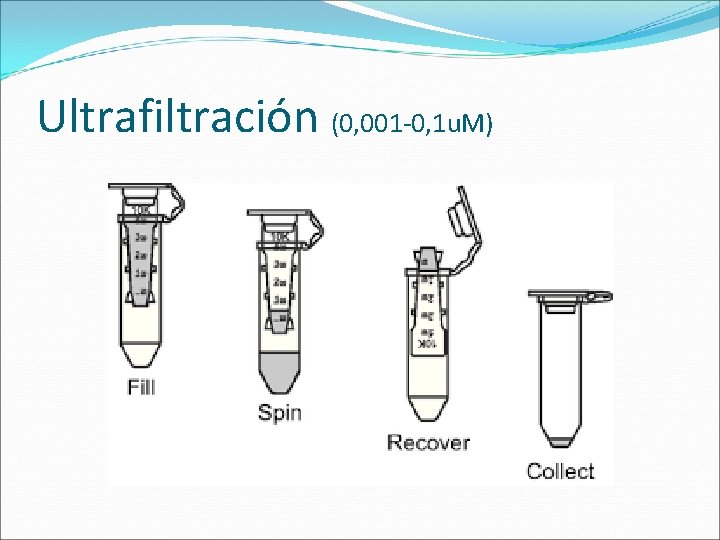
MÉTODOS DE CONCENTRACIÓN Remoción de agua y moléculas pequeñas por: Precipitación y resuspensión en un volumen menor. Remoción a través de una membrana semipermeable: Ultrafiltración. Remoción a través de una membrana semipermeable: Diálisis contra polietilenglicol. Agregado de un polímero seco con poros muy pequeños como para que la proteína penetre (Sephadex G-25).

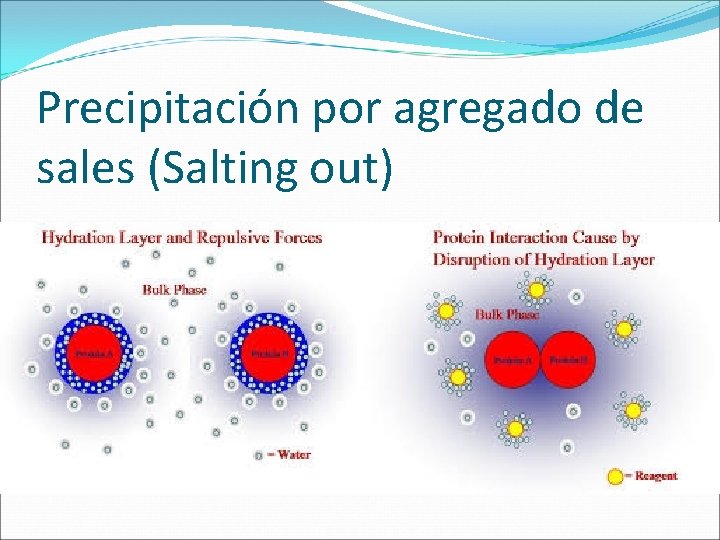
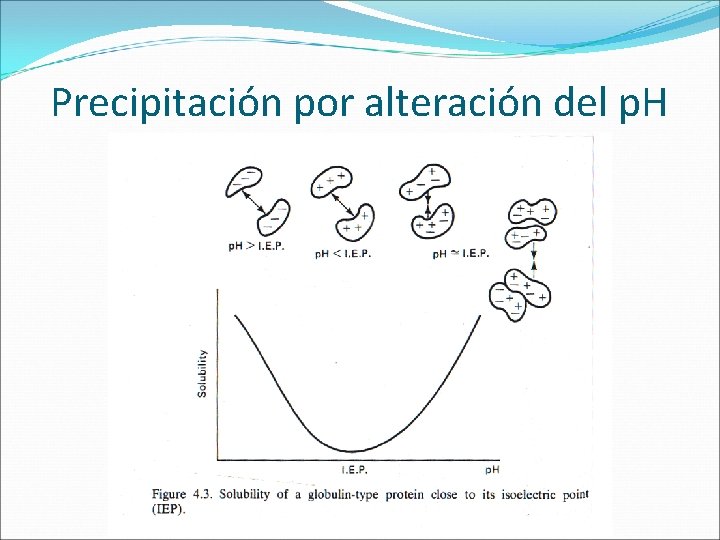
PRECIPITACIÓN La precipitación fue utilizada como método de purificación. Actualmente se utiliza como un paso muy grosero durante las primeras etapas de una purificación. La precipitación se utiliza como método de concentración de proteínas. Efecto de las sales (salting-out) Precipitación por alteración del p. H (mínima solubilidad en el p. I). Precipitación por solventes orgánicos (etanol, acetona), que disminuyen la constante dieléctrica de la solución y por ello su poder de solvatación.

Precipitación por agregado de sales (Salting out)


Precipitación por alteración del p. H

Ultrafiltración (0, 001 -0, 1 u. M)

Diálisis contra polietilenglicol

Sephadex-G 25 resina de filtración en gel preparada por entrecruzamiento de dextrano con epiclorohidrina. Los diferentes tipos de Sephadex difieren en su grado de entrecruzamiento y, por lo tanto, en su rango de fraccionamiento molecular.

Planificación inicial Cómo vamos a ensayarla? Utilizar un método rápido, simple y específico que nos permita evaluar la proteína de interés. Métodos basados en la act enzimática, propiedades inmunológicas o en la act biológica. Gran ayuda para el seguimiento de la purificación: - Nos permite identificar y poolear las fracciones que contienen la proteína de interés. - Combinado con la determinación de proteínas totales nos da una idea del grado de purificación alcanzado. EJEMPLOS: Glucosa 6 P dh, proteasas

Proteínas totales espectrofotometría en el UV (280 nm, Trp; 210 -215 nm, unión peptídica) Métodos colorimétricos - Reacción de Biuret (Cu 2+ alcalino) BCA (Cu 2+ alcalino + ácido bicinconínico) - Bradford (Coomassie Blue)

Espectrofotometría UV Abs 280 nm dada por los aminoácidos con anillos aromáticos (W, F, Y) Rápida y conveniente (no se requieren reactivos ni incubaciones adicionales, no requiere estándar, no se consume la proteína). Relación linear entre abs y cc de proteínas. Sujeta a error presencia de interferencias que abs en la misma longitud de onda. La aplicación más frecuente es para monitorear fracciones de una cromatografía o para una estimación rápida (aunque no precisa). Concentración (mg/ml) = (1. 55 x A 280) - 0. 76 x A 260) Abs 205 nm enlace peptídico Concentración (mg/ml) = (A 205)/31

Biuret Biuret: las sustancias que contienen dos o más enlaces peptídicos forman un complejo color violeta con las sales de cobre en medio alcalino (Abs 550 nm).

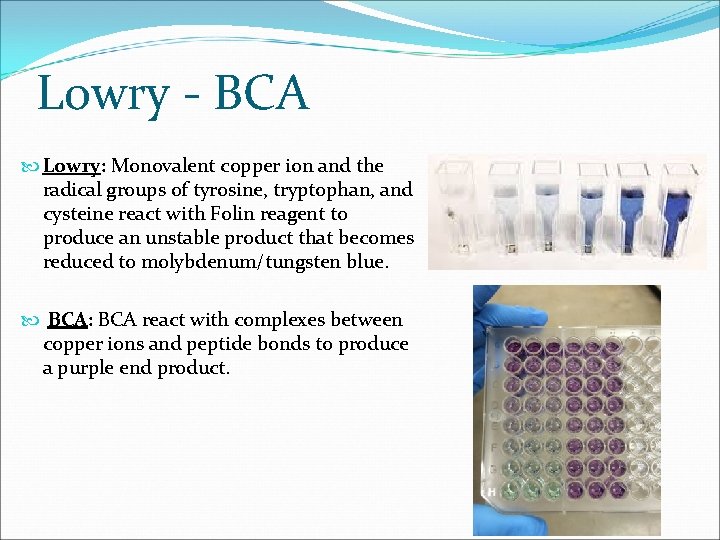
Lowry - BCA Lowry: Monovalent copper ion and the radical groups of tyrosine, tryptophan, and cysteine react with Folin reagent to produce an unstable product that becomes reduced to molybdenum/tungsten blue. BCA: BCA react with complexes between copper ions and peptide bonds to produce a purple end product.

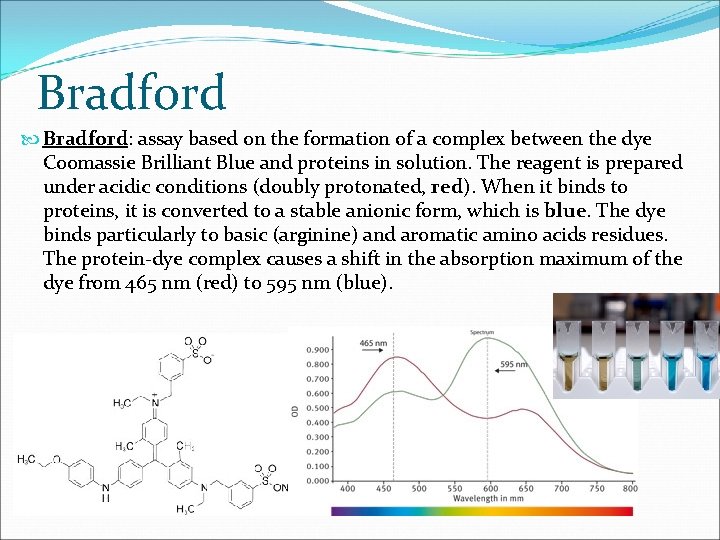
Bradford Bradford: assay based on the formation of a complex between the dye Coomassie Brilliant Blue and proteins in solution. The reagent is prepared under acidic conditions (doubly protonated, red). When it binds to proteins, it is converted to a stable anionic form, which is blue. The dye binds particularly to basic (arginine) and aromatic amino acids residues. The protein-dye complex causes a shift in the absorption maximum of the dye from 465 nm (red) to 595 nm (blue).

Parámetros importantes!! Actividad específica = Proteína de interés / Proteínas totales Grado de purificación = Actividad específica 2/Actividad específica 1 Rendimiento = Proteína de interés 2/ Proteína de interés 1 DESPUÉS INICIAL

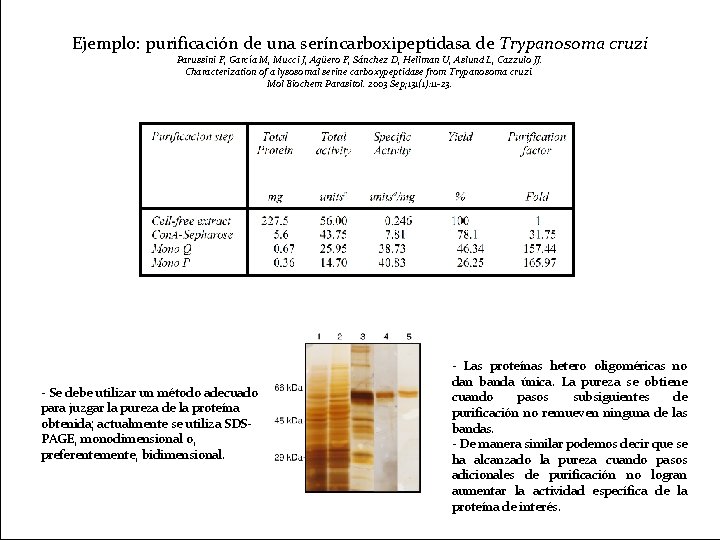
Ejemplo: purificación de una seríncarboxipeptidasa de Trypanosoma cruzi Parussini F, García M, Mucci J, Agüero F, Sánchez D, Hellman U, Aslund L, Cazzulo JJ. Characterization of a lysosomal serine carboxypeptidase from Trypanosoma cruzi. Mol Biochem Parasitol. 2003 Sep; 131(1): 11 -23. - Se debe utilizar un método adecuado para juzgar la pureza de la proteína obtenida; actualmente se utiliza SDSPAGE, monodimensional o, preferentemente, bidimensional. - Las proteínas hetero oligoméricas no dan banda única. La pureza se obtiene cuando pasos subsiguientes de purificación no remueven ninguna de las bandas. - De manera similar podemos decir que se ha alcanzado la pureza cuando pasos adicionales de purificación no logran aumentar la actividad específica de la proteína de interés.
 Estructura cuaternaria de las proteinas
Estructura cuaternaria de las proteinas Protenas
Protenas Protenas
Protenas So
So Protenas
Protenas Protenas
Protenas Protenas
Protenas Classificação das proteínas
Classificação das proteínas Protenas
Protenas Protenas
Protenas Funciones de las proteinas
Funciones de las proteinas Proteinas como estan formadas
Proteinas como estan formadas Ruptura
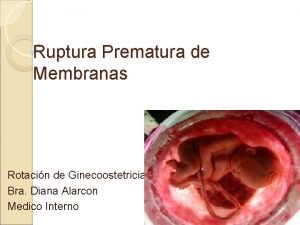
Ruptura Ruptura de uretra
Ruptura de uretra Ruptura perinea
Ruptura perinea Ruptura reunião ens
Ruptura reunião ens Palitoxina
Palitoxina Prolapsul valvei mitrale
Prolapsul valvei mitrale Ruptura generica
Ruptura generica Ruptura
Ruptura Test de nitracina
Test de nitracina Ruptura de parede livre do ve
Ruptura de parede livre do ve Hemoretroperitoneum
Hemoretroperitoneum Ruptura
Ruptura Ruptura del equilibrio literatura
Ruptura del equilibrio literatura Projeto de pesquisa cronograma
Projeto de pesquisa cronograma Ruptura
Ruptura Fmicies
Fmicies Ruptura homolítica ejemplos
Ruptura homolítica ejemplos Nucleofilos
Nucleofilos El pecado ruptura con dios
El pecado ruptura con dios Diagnostico diferencial
Diagnostico diferencial Abogado es diptongo o hiato
Abogado es diptongo o hiato Roprema
Roprema Cloracion del metano
Cloracion del metano Ruptura heterolitica del bromoetano
Ruptura heterolitica del bromoetano