UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO Departamento Acadmico
















- Slides: 25

UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO Departamento Académico de Ciencias QUÍMICA ORGÁNICA Mag. Miguel RAMIREZ GUZMAN

Contenido Reacciones Orgánicas Clasificación Mecanismo de Reacción Tipos de Reactivos Principales Funciones Químicas Orgánicas

Reacciones Orgánicas • Homolítica: El enlace covalente se rompe de manera simétrica Homolítica: (1 electrón para cada átomo). A : B A· + ·B (radicales libres) Ø Suele producirse en presencia de luz UV pues se necesita un aporte de energía elevado. • Heterolítica: El enlace se rompe de manera asimétrica (uno de Heterolítica: los átomos se queda con los dos electrones que compartían) A : B A: – + B+ (iones) § Carbocationes: R 3 C+ Ejemplo: (CH 3)2 CH+ § Carbanión: R 3 C: – Ejemplo: Cl 3 C: –

Ejemplo: Indica la ruptura heterolítica más probable del: a) bromoetano; b) 2 -propanol; c) 2 -cloro-2 -metil-propano. a) CH 3–CH 2 Br CH 3–CH 2+ + Br– b) CH 3–CH 2 OH–CH 3 (CH 3)2–CH+ + OH– c) (CH 3)3–CCl (CH 3)3–C+ + Cl–

Clasificación • Sustitución: Ø un grupo entra y otro sale. Ø CH 3–Cl + H 2 O CH 3–OH + HCl • Adición: a un doble o triple enlace Adición: Ø CH 2=CH 2 + Cl 2 CH 2 Cl–CH 2 Cl • Eliminación: de un grupo de átomos. Eliminación: Ø Se produce un doble enlace Ø CH 3–CH 2 OH CH 2=CH 2 + H 2 O • Redox: (cambia el E. O. del carbono). Redox: Ø CH 3 OH + ½ O 2 HCHO + H 2 O

Número de oxidación del carbono • El número de oxidación de un átomo de carbono varía en -1 por cada enlace que presenta con un átomo de hidrógeno. • El número de oxidación de un átomo de carbono varía en +1 por cada enlace que presenta con un átomo más electronegativo que él. • Los dobles y triples enlaces con un heteroátomo se cuentan dos y tres veces respectivamente. • Los enlaces existentes entre átomos de carbono no se tienen en cuenta al determinar el número de oxidación de los carbonos.

Ejemplo de reacciones de sustitución: n. Nitración (–M): H 2 SO 4 + HNO 3 + H 2 O NO 2 n. Halogenación (+M): Fe. Cl 3 + Cl 2 + HCl n. Alquilación (Friedelf–Crafts) (+I): Al. Cl 3 + Cl. CH 3 + HCl CH 3

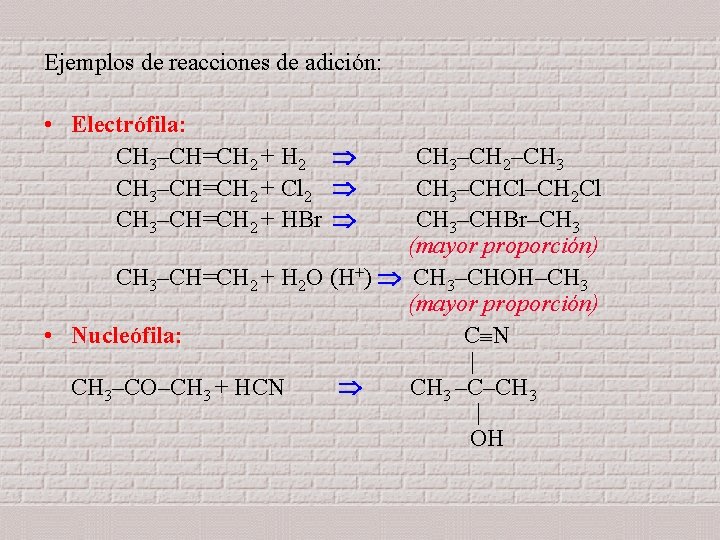
Ejemplos de reacciones de adición: • Electrófila: CH 3–CH=CH 2 + H 2 CH 3–CH=CH 2 + Cl 2 CH 3–CH=CH 2 + HBr CH 3–CH 2–CH 3 CH 3–CHCl–CH 2 Cl CH 3–CHBr–CH 3 (mayor proporción) CH 3–CH=CH 2 + H 2 O (H+) CH 3–CHOH–CH 3 (mayor proporción) • Nucleófila: C N | CH 3–CO–CH 3 + HCN CH 3 –C–CH 3 | OH

Ejemplos de reacciones de eliminación: • Deshidrohalogenación de halogenuros de alquilo. – Se produce en medio básico. CH 3–CH 2–CHBr–CH 3 + Na. OH CH 3–CH=CH–CH 3 • Deshidratación de alcoholes. – Se produce en medio ácido. CH 3–CH 2–CHOH–CH 3 + H 2 SO 4 CH 3–CH=CH–CH 3

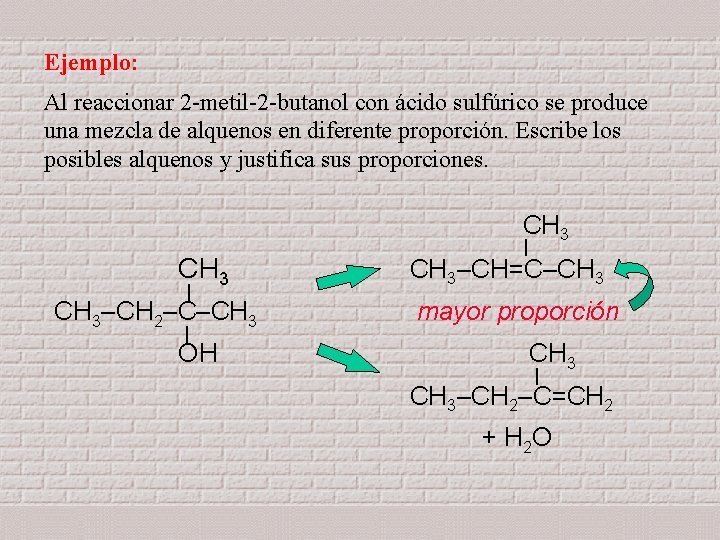
Ejemplo: Al reaccionar 2 -metil-2 -butanol con ácido sulfúrico se produce una mezcla de alquenos en diferente proporción. Escribe los posibles alquenos y justifica sus proporciones. CH 3 | CH 3–CH 2–C–CH 3 | OH | CH 3–CH=C–CH 3 mayor proporción CH 3 | CH 3–CH 2–C=CH 2 + H 2 O

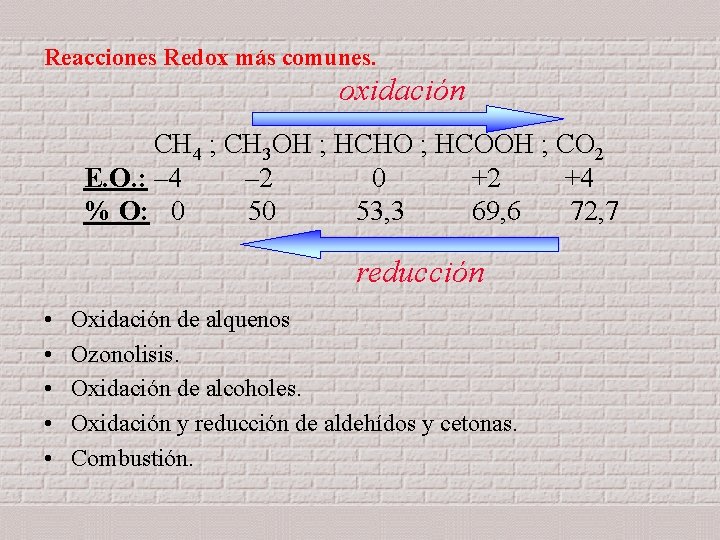
Reacciones Redox más comunes. oxidación CH 4 ; CH 3 OH ; HCHO ; HCOOH ; CO 2 E. O. : – 4 – 2 0 +2 +4 % O: 0 53, 3 69, 6 72, 7 reducción • • • Oxidación de alquenos Ozonolisis. Oxidación de alcoholes. Oxidación y reducción de aldehídos y cetonas. Combustión.

Mecanismo de Reacción Se da en las reacciones de los compuestos orgánicos, por ejemplo, en la halogenación de alcanos (con luz U. V. o en presencia de peróxidos). • Iniciación: Cl 2 + luz ultravioleta 2 Cl · • Propagación: CH 3–CH 3 + Cl · CH 3–CH 2· + HCl • Terminación: CH 3–CH 2 · + Cl · CH 3–CH 2–Cl (2 CH 3–CH 2 · CH 3–CH 2–CH 3)

Tipos de Reactivos • Homolíticos: Radicales libres. Homolíticos: Ø Son especies químicas que tienen átomos con electrones desapareados. Ø Se forman en la reacciones con ruptura homolítica. • Nucleófilos: Tienen uno o más pares de electrones libres (bases Nucleófilos: de Lewis). Ø Atacan a las partes de la molécula con deficiencia de electrones. • Electrófilos: Tienen orbitales externos vacíos (ácidos de Lewis) Electrófilos: Ø Atacan a zonas con alta densidad electrónica (dobles o triples enlaces)

Reactivos nucleófilos y electrófilos Ø Nucleófilos: Ø R–OH Ø R–O– Ø H 2 O Ø R–NH 2 Ø R – C N Ø R–COO– Ø NH 3 Ø OH– Ø halogenuros: Cl–, Br– Ø Electrófilos: Ø H+ Ø NO 2+ Ø NO+ Ø BF 3, Al. Cl 3 Ø cationes metálicos: Na+ Ø R 3 C+ Ø SO 3 Ø CH 3 Cl, CH 3–CH 2 Cl Ø halógenos: Cl 2 , Br 2

Ácidos y bases de Lewis El químico estadounidense Lewis dio una definición acerca del comportamiento de la base, en donde se puede definir como una sustancia que puede donar un par de electrones, y para el ácido como una sustancia que puede aceptar un par de electrones. El ácido debe tener su octeto de electrones incompleto y la base debe tener algún par de electrones solitarios. El amoníaco es una base de Lewis típica y el trifluoruro de boro un ácido de Lewis típico. Los ácidos de Lewis tales como el cloruro de aluminio, el trifluoruro de boro, el cloruro estánnico, el cloruro de zinc y el cloruro de hierro (III) son catalizadores sumamente importantes de ciertas reacciones orgánicas. http: //es. wikipedia. org/w/index. php? title=Especial: Citar&page=%C 3%81 cidos_y_bases_de_Lewis&id=54789491

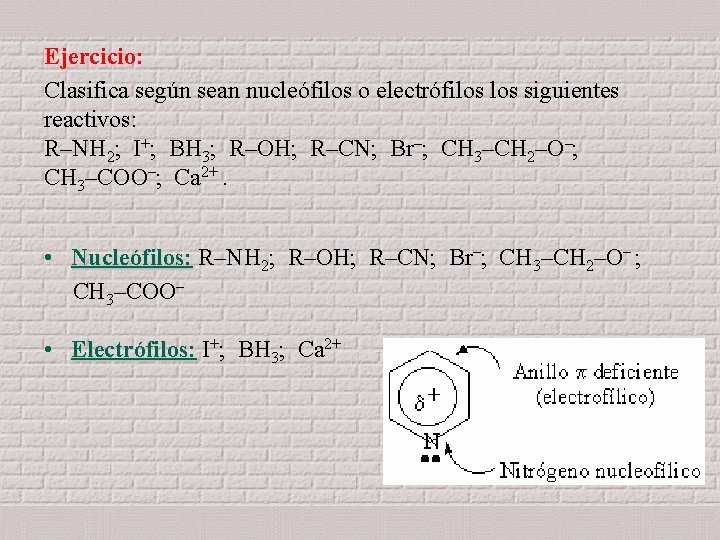
Ejercicio: Clasifica según sean nucleófilos o electrófilos siguientes reactivos: R–NH 2; I+; BH 3; R–OH; R–CN; Br–; CH 3–CH 2–O–; CH 3–COO–; Ca 2+. – – • Nucleófilos: R–NH Nucleófilos: 2; R–OH; R–CN; Br ; CH 3–CH 2–O ; CH 3–COO– • Electrófilos: I Electrófilos: +; BH 3; Ca 2+

Funciones Químicas Orgánicas Concepto de grupo funcional Un grupo funcional es un átomo o grupo de átomos presente en una molécula orgánica que determina las propiedades químicas de dicha molécula Algunas moléculas poseen más de un grupo funcional diferente, otras tienen el mismo grupo funcional repetido varias veces El grupo funcional es el principal responsable de la reactividad química del compuesto, por eso todos los compuestos que poseen un mismo grupo funcional dan origen a las funciones químicas orgánicas y muestran las mismas propiedades.

H H | | H - C - H | | H H etanol HC G. F. H H | | H - C - OH | | H H HC = esqueleto hidrocarbonado G. F. = grupo funcional

Principales Funciones Químicas Orgánicas Existen tres grandes grupos de familias: Ø Compuestos oxigenados Ø Compuestos nitrogenados Ø Derivados halogenados

Compuestos oxigenados Familia Grupo Funcional – CHO Aldehídos Ejemplos H-CHO Metanal. Formaldehído. Formol Se usa para conservar muestras de tejidos orgánicos. CH 3 -CH 2 -CHO Propanal – CO – Cetonas Benzaldehído Es el responsable del aroma de las cerezas CH 3 -CO-CH 3 Propanona. Acetona Es el disolvente más común de los quitaesmaltes CH 3 -CO-CH 2 -CH 3 Butanona Benzaldehído Propanona Acetona Formaldehído Metanal 20 5 -metil-4 -penten-2 -ona

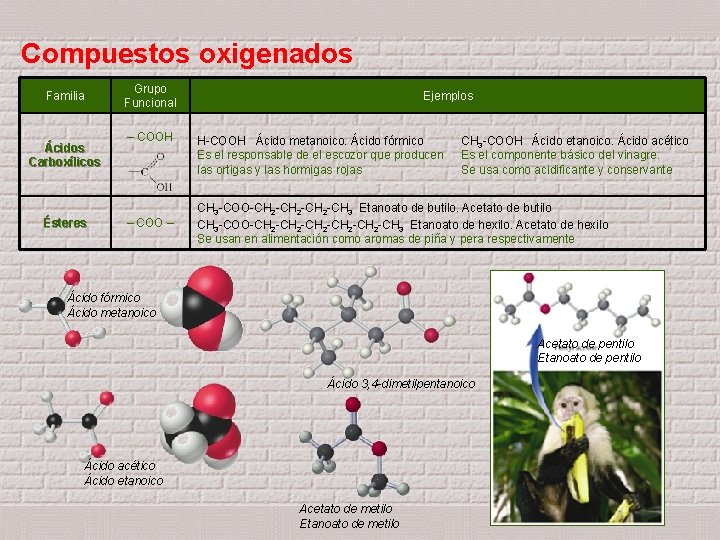
Compuestos oxigenados Familia Ácidos Carboxílicos Ésteres Grupo Funcional – COOH – COO – Ejemplos H-COOH Ácido metanoico. Ácido fórmico Es el responsable de el escozor que producen las ortigas y las hormigas rojas CH 3 -COOH Ácido etanoico. Ácido acético Es el componente básico del vinagre. Se usa como acidificante y conservante CH 3 -COO-CH 2 -CH 3 Etanoato de butilo. Acetato de butilo CH 3 -COO-CH 2 -CH 2 -CH 3 Etanoato de hexilo. Acetato de hexilo Se usan en alimentación como aromas de piña y pera respectivamente Ácido fórmico Ácido metanoico Acetato de pentilo Etanoato de pentilo Ácido 3, 4 -dimetilpentanoico Ácido acético Ácido etanoico Acetato de metilo Etanoato de metilo

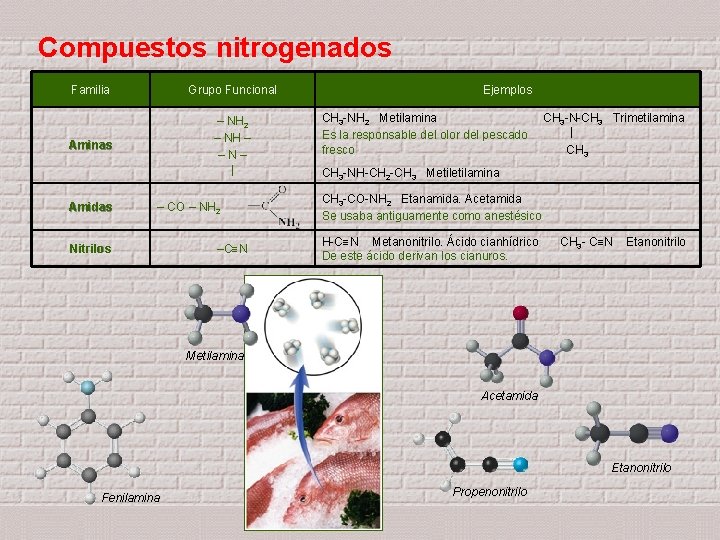
Compuestos nitrogenados Familia Grupo Funcional Aminas – NH 2 – NH – –N– | Amidas – CO – NH 2 Nitrilos –C N Ejemplos CH 3 -NH 2 Metilamina Es la responsable del olor del pescado fresco CH 3 -N-CH 3 Trimetilamina | CH 3 -NH-CH 2 -CH 3 Metilamina CH 3 -CO-NH 2 Etanamida. Acetamida Se usaba antiguamente como anestésico H-C N Metanonitrilo. Ácido cianhídrico De este ácido derivan los cianuros. CH 3 - C N Etanonitrilo Metilamina Acetamida Etanonitrilo Fenilamina Propenonitrilo

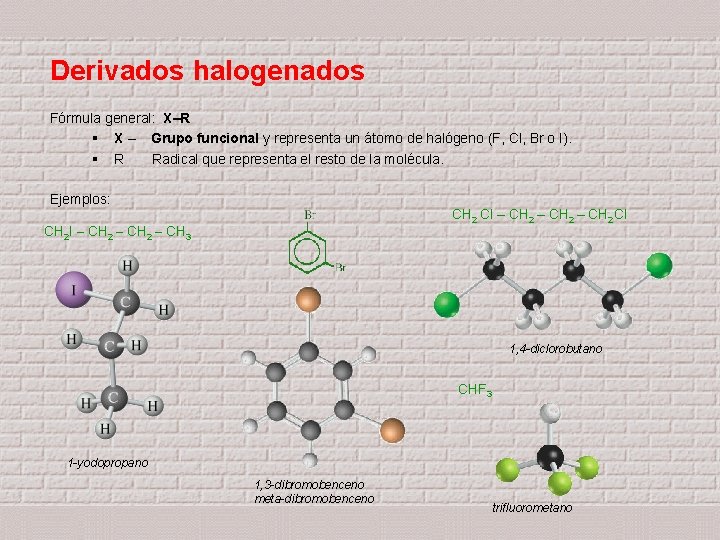
Derivados halogenados Fórmula general: X–R § X – Grupo funcional y representa un átomo de halógeno (F, Cl, Br o I). § R Radical que representa el resto de la molécula. Ejemplos: CH 2 Cl – CH 2 Cl CH 2 I – CH 2 – CH 3 1, 4 -diclorobutano CHF 3 1 -yodopropano 1, 3 -dibromobenceno meta-dibromobenceno trifluorometano

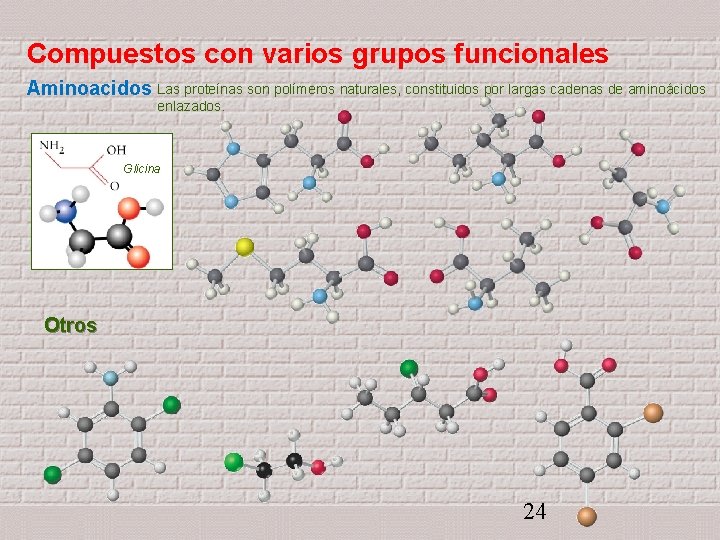
Compuestos con varios grupos funcionales Aminoacidos Las proteínas son polímeros naturales, constituidos por largas cadenas de aminoácidos enlazados. Glicina Otros 24

http: //knol. google. com/k/qu%C 3%ADmica-org%C 3%A 1 nica-i-cap%C 3%ADtulo-iii http: //es. wikibooks. org/wiki/Qu%C 3%ADmica_org%C 3%A 1 nica 25
 Projeto doutorado
Projeto doutorado Universidad utesa
Universidad utesa Beca 18 pucp
Beca 18 pucp Francisco luis espinoza pineda
Francisco luis espinoza pineda Universidad nacional de tumbes segunda especialidad
Universidad nacional de tumbes segunda especialidad Universidad nacional experimental de yaracuy
Universidad nacional experimental de yaracuy Universidad nacional de piura maestrias
Universidad nacional de piura maestrias Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Universidad nacional de cuyo derecho
Universidad nacional de cuyo derecho Facultades de la unge
Facultades de la unge Universidad nacional intercultural de la amazonía
Universidad nacional intercultural de la amazonía Foda de una universidad nacional
Foda de una universidad nacional Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Fisolofica
Fisolofica Universidad nacional de loja
Universidad nacional de loja Centro regional universitario de azuero
Centro regional universitario de azuero Diplomados universidad nacional de trujillo
Diplomados universidad nacional de trujillo Universidad nacional experimental marítima del caribe
Universidad nacional experimental marítima del caribe Universidad nacional
Universidad nacional Universidad nacional de loja
Universidad nacional de loja Universidad nacional de ingenieria
Universidad nacional de ingenieria Francisco de miranda universidad
Francisco de miranda universidad Tesis universidad nacional abierta
Tesis universidad nacional abierta Universidad nacional de azuero
Universidad nacional de azuero Preinscripcion universidad nacional de salta
Preinscripcion universidad nacional de salta Universidad nacional de ingenieria
Universidad nacional de ingenieria

















































