Universidad Nacional Santiago Antnez de Mayolo Departamento Acadmico

















- Slides: 26

Universidad Nacional Santiago Antúnez de Mayolo Departamento Académico de Ciencias Química Orgánica Mag. Miguel RAMIREZ GUZMAN

Contenido Hidrocarburos Saturados Alcanos: Ø Nomenclatura Ø Propiedades físicas Ø Propiedades químicas Ø Reacciones de identificación 2

Hidrocarburos Saturados: Alcanos Hidrocarburos son compuestos químicos más simples que se encuentran formados en exclusiva por átomos de carbono y de hidrógeno. CH 3 -CH 2 -CH 3 CH 2=CH-CH 3 -C≡C-CH 2 -CH 3 CH 2 -CH 2 3

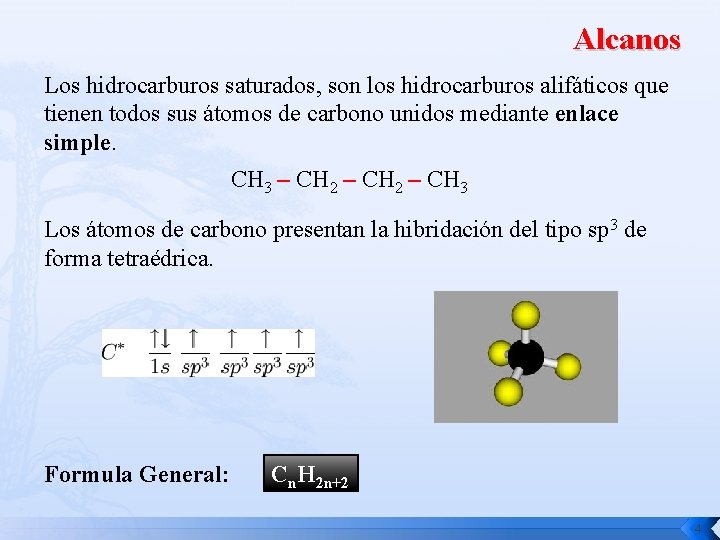
Alcanos Los hidrocarburos saturados, son los hidrocarburos alifáticos que tienen todos sus átomos de carbono unidos mediante enlace simple. CH 3 – CH 2 – CH 3 Los átomos de carbono presentan la hibridación del tipo sp 3 de forma tetraédrica. Formula General: Cn. H 2 n+2 4

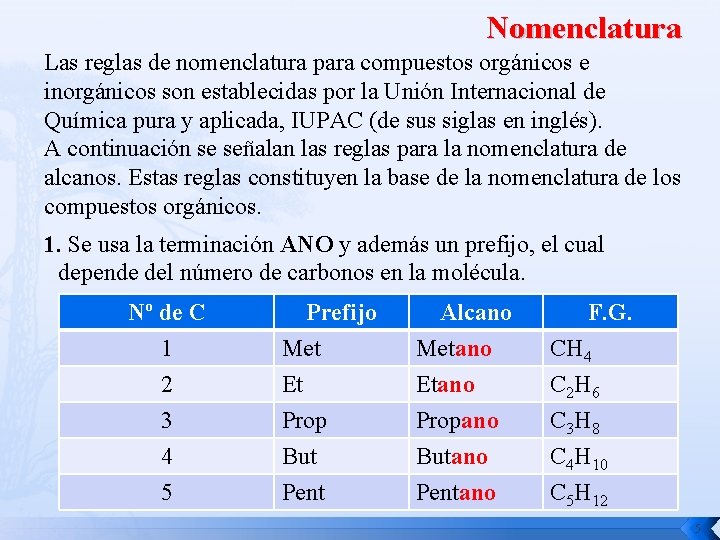
Nomenclatura Las reglas de nomenclatura para compuestos orgánicos e inorgánicos son establecidas por la Unión Internacional de Química pura y aplicada, IUPAC (de sus siglas en inglés). A continuación se señalan las reglas para la nomenclatura de alcanos. Estas reglas constituyen la base de la nomenclatura de los compuestos orgánicos. 1. Se usa la terminación ANO y además un prefijo, el cual depende del número de carbonos en la molécula. Nº de C 1 2 3 4 5 Prefijo Met Et Prop Alcano Metano Etano Propano F. G. CH 4 C 2 H 6 C 3 H 8 But Pent Butano Pentano C 4 H 10 C 5 H 12 5

Nº de C 6 7 8 9 10 11 12 15 19 20 Prefijo Hex Hept Oct Alcano Hexano Heptano Octano F. G. C 6 H 14 C 7 H 16 Non Dec Undec Dodec Pentadec Nonadec Eicos Nonano Decano Undecano Dodecano Pentadecano Nonadecano Eicosano C 9 H 20 C 8 H 18 C 10 H 22 C 11 H 24 C 12 H 26 C 15 H 32 C 19 H 40 C 20 H 42 6

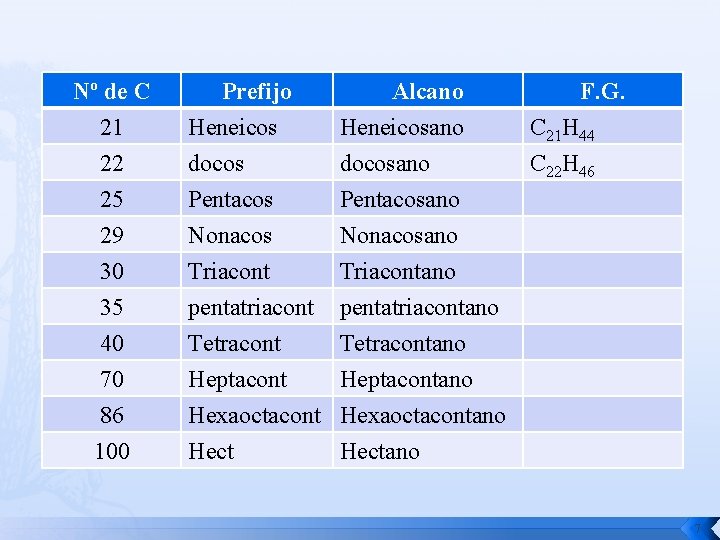
Nº de C 21 22 25 29 30 35 40 70 86 100 Prefijo Heneicos docos Pentacos Alcano Heneicosano docosano Pentacosano Nonacos Triacont pentatriacont Tetracont Heptacont Hexaoctacont Hect Nonacosano Triacontano pentatriacontano Tetracontano Heptacontano Hexaoctacontano Hectano F. G. C 21 H 44 C 22 H 46 7

Radicales alquilo Cuando alguno de los alcanos pierde un átomo de hidrógeno se forma un radical alquilo. Estos radicales aparecen como ramificaciones sustituyendo átomos de hidrógeno en las cadenas. 8

Las líneas rojas indican el enlace con el cual el radical se une a la cadena principal. Esto es muy importante, el radical no puede unirse por cualquiera de sus carbonos, sólo por el que tiene el enlace libre. 2. El nombre base del compuesto, es la cadena continua más larga de átomos de carbono. 3. La numeración se inicia por el extremo más cercano a una ramificación. Para nombrarlo, se escribe el número de carbono en la que se encuentra la ramificación o grupo alquilo, seguido del nombre del grupo alquilo unido al nombre de la cadena más larga (alcano). 5 4 3 2 1 CH 3 -CH 2 -CH-CH 3 2 -metilpentano 9

4. En caso de encontrar dos ramificaciones a la misma distancia, se empieza a numerar por el extremo más cercano a la ramificación de menor orden alfabético. 5. Si se encuentran dos ramificaciones del mismo nombre a la misma distancia de cada uno de los extremos, se busca una tercera ramificación y se numera la cadena por el extremo más cercano a ella. 1 2 3 4 5 6 7 8 CH 3 -CH-CH 2 -CH-CH 3 CH 2 -CH 3 4 -etil-2, 7 -dimetiloctano 10

6. Si se encuentran dos o más cadenas con el mismo número de átomos de carbono, se selecciona la que contiene mas radicales alquilo. 7. Cuando en un compuestos hay dos o más ramificaciones iguales, no se repite el nombre, se le añade un prefijo numeral. Los prefijos numerales son: Número 2 3 4 Prefijo di tri tetra Número 5 6 7 Prefijo penta hexa hepta 11

8. Se escriben las ramificaciones en orden alfabético y el nombre del alcano que corresponda a la cadena principal, como una sola palabra junto con el último radical. Al ordenar alfabéticamente, los prefijos numerales y los prefijos n-, sec- y ter- no se toman en cuenta. 9. Por convención, los números y las palabras se separan mediante un guión, y los números entre si, se separan por comas. La comprensión y el uso adecuado de las reglas señaladas facilitan la escritura de nombres y fórmulas de compuestos orgánicos. 12

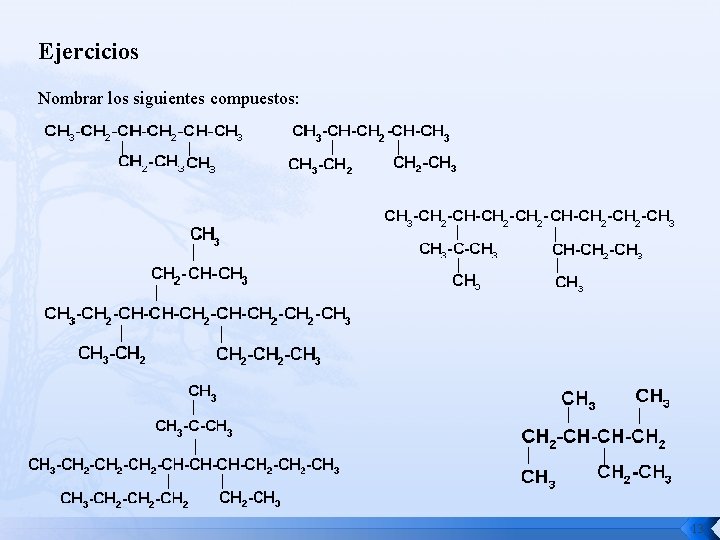
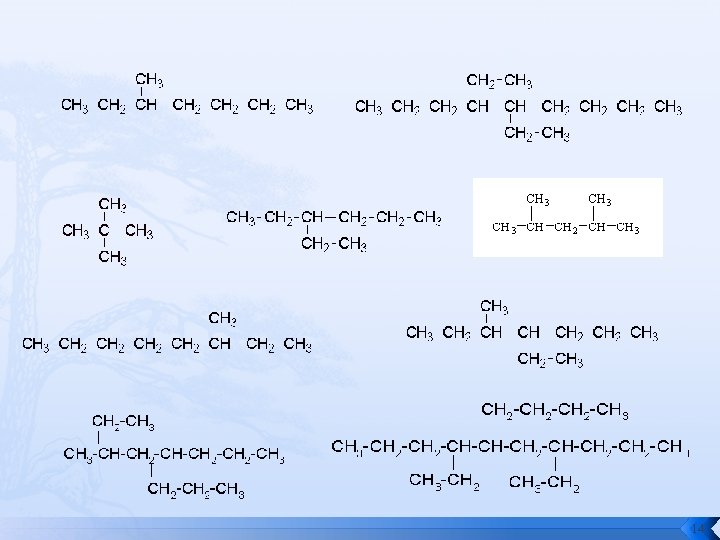
Ejercicios Nombrar los siguientes compuestos: 13

14

Dar la estructura de los siguientes alcanos: 2, 4, 5 -trimetilheptano 3 -metil-5 -propilnonano 5 -butil-4, 5 -dietildecano 5 -etil-5 -butil-2 -metil-4 -propilnonano 5 -butil-4, 6 -dipropildecano 3 -etil-5 -metil-4 -propilheptano 5 -butil-5 -propildecano 6 -etil-6 -propil-3, 3 -dimetildecano 3 -metil-4 -propiloctano 15

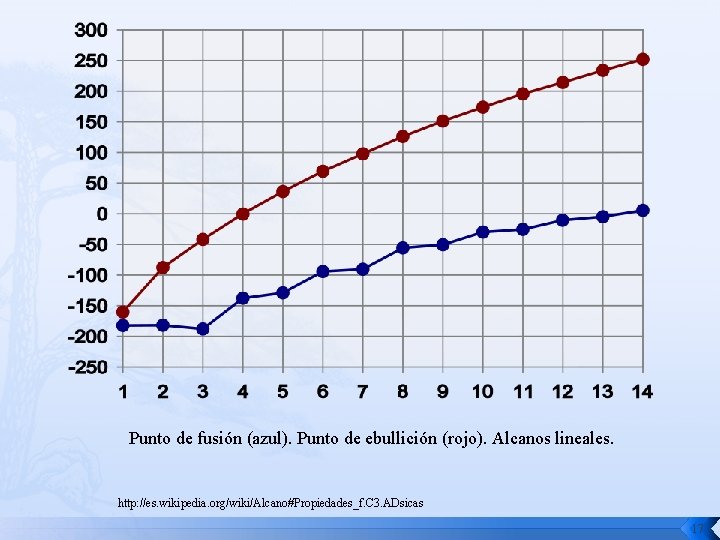
Propiedades físicas Ø El estado físico de los 4 primeros alcanos: metano, propano y butano es gaseoso. Del pentano al hexadecano (16 átomos de carbono) son líquidos y a partir de heptadecano (17 átomos de carbono) son sólidos. Ø El punto de fusión, de ebullición y la densidad aumentan conforme aumenta el número de átomos de carbono. Ø La densidad de los alcanos permanece inferior a la del agua. Ø No forman enlaces de hidrógeno y son insolubles en solventes polares como el agua. Ø Pueden emplearse como disolventes para sustancias poco polares como grasas, aceites y ceras. Ø El gas de uso doméstico es una mezcla de alcanos, principalmente propano. Ø El gas de los encendedores es butano. 16

Punto de fusión (azul). Punto de ebullición (rojo). Alcanos lineales. http: //es. wikipedia. org/wiki/Alcano#Propiedades_f. C 3. ADsicas 17

Ø Un alcano de cadena lineal tendrá un mayor punto de ebullición que un alcano de cadena ramificada, Ø Los alcanos son malos conductores de la electricidad y no se polarizan sustancialmente por un campo eléctrico. Ø Su solubilidad en solventes no polares es relativamente buena 18

Propiedades químicas Ø El principal uso de los alcanos es como combustibles debido a la gran cantidad de calor que se libera en esta reacción. Ejemplo: Ø En general, los alcanos muestran una reactividad relativamente baja, porque sus enlaces de carbono son relativamente estables y no pueden ser fácilmente rotos Ø Solo reaccionan muy pobremente con sustancias iónicas o polares. Ø Son prácticamente inertes a los ácidos y bases. Ø La reacción con el oxígeno conduce a la combustión sin humo; con los halógenos, a la reacción de sustitución. 19

Obtención o Síntesis El petróleo como fuente de alcanos. El petróleo es una mezcla compleja de hidrocarburos, la mayoría de los cuales son alcanos y cicloalcanos, y constituye el resultado final de la descomposición de la materia animal y vegetal sepultada bajo la corteza terrestre durante períodos muy largos. El gas natural Es una mezcla de hidrocarburos gaseosos y consta básicamente de etano y metano junto con pequeñas cantidades de propano. Hidrogenación de alquenos. El catalizador puede ser Pt, Pd, Ni 20

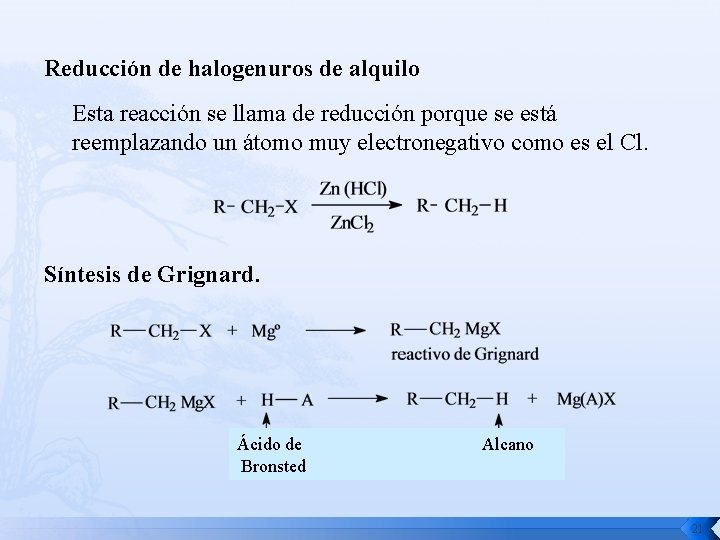
Reducción de halogenuros de alquilo Esta reacción se llama de reducción porque se está reemplazando un átomo muy electronegativo como es el Cl. Síntesis de Grignard. Ácido de Bronsted Alcano 21

Síntesis de Wurtz. Este método sirve para sintetizar alcanos simétricos, es decir, solo debe usarse un halogenuro de alquilo en cada reacción. Método de Clemmensen. Este método reduce el compuesto carbonílico con Zinc amalgamado, obtenido al tratar previamente el Zn metálico con una disolución acuosa de una sal de mercurio. 22

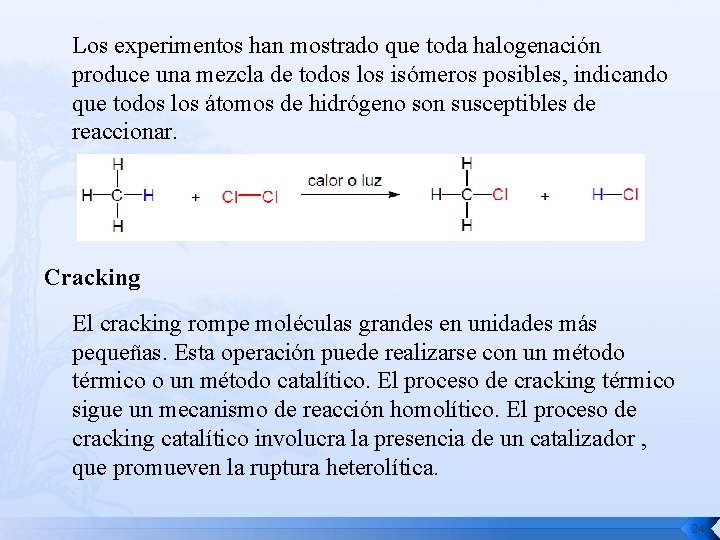
Reacciones químicas Reacción de combustión Cn. H 2 n+2 + (1, 5 n+0, 5)O 2 → (n+1)H 2 O + n. CO 2 En ausencia de oxígeno suficiente, puede formarse monóxido de carbono o inclusive negro de humo, como se muestra a continuación Cn. H(2 n+2) + ½ n. O 2 → (n+1)H 2 + n. CO Reacción de halogenación Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno. 23

Los experimentos han mostrado que toda halogenación produce una mezcla de todos los isómeros posibles, indicando que todos los átomos de hidrógeno son susceptibles de reaccionar. Cracking El cracking rompe moléculas grandes en unidades más pequeñas. Esta operación puede realizarse con un método térmico o un método catalítico. El proceso de cracking térmico sigue un mecanismo de reacción homolítico. El proceso de cracking catalítico involucra la presencia de un catalizador , que promueven la ruptura heterolítica. 24

Lectura Gasolina e índices de octano: http: //genesis. uag. mx/edmedia/material/quimicaii/pdf/Gasindices octano. pdf 25

Para practicar y leer: http: //www. uhu. es/quimiorg/nomenclatura. html http: //www. infonegocio. com/csanvima/alumnos/organica/ejercici osalcanos. htm http: //web. usal. es/~frena/Moberly. QFS/documents/tema 5. pdf http: //objetos. univalle. edu. co/files/Alcanos_y_cicloalcanos. pdf http: //www. alonsoformula. com/organica/alcanos. htm 26
 Projeto doutorado
Projeto doutorado Universidad utesa
Universidad utesa Diplomados universidad nacional de trujillo
Diplomados universidad nacional de trujillo Umc velero
Umc velero Centro regional universitario de azuero
Centro regional universitario de azuero Universidad nacional
Universidad nacional Tenerios
Tenerios Bases legales del marco teorico
Bases legales del marco teorico Universidad nacional de ingenieria
Universidad nacional de ingenieria Tesis universidad nacional abierta
Tesis universidad nacional abierta Fomularo
Fomularo Centro universitario de azuero
Centro universitario de azuero Himno de la universidad nacional mayor de san marcos
Himno de la universidad nacional mayor de san marcos Universidad nacional de ingenieria
Universidad nacional de ingenieria Universidad nacional experimental de la seguridad sigla
Universidad nacional experimental de la seguridad sigla Competencias abet
Competencias abet Universidad nacional banner
Universidad nacional banner Angel maria camponeschi
Angel maria camponeschi Pucp beca 18
Pucp beca 18 Francisco luis espinoza pineda
Francisco luis espinoza pineda Universidad nacional de tumbes segunda especialidad
Universidad nacional de tumbes segunda especialidad Universidad nacional experimental de yaracuy
Universidad nacional experimental de yaracuy Universidad nacional de piura maestrias
Universidad nacional de piura maestrias Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Universidad nacional de cuyo derecho
Universidad nacional de cuyo derecho Escudo de la universidad nacional de guinea ecuatorial
Escudo de la universidad nacional de guinea ecuatorial Universidad nacional intercultural de la amazonía
Universidad nacional intercultural de la amazonía


















































