UNIVERSIDAD NACIONAL SANTIAGO ANTNEZ DE MAYOLO DEPARTAMENTO ACADMICO






















- Slides: 36

UNIVERSIDAD NACIONAL “SANTIAGO ANTÚNEZ DE MAYOLO” DEPARTAMENTO ACADÉMICO CIENCIAS M. RAMÍREZ G. Mag. Miguel RAMÍREZ 1

Teoría Cinética Molecular • Ofrece un modelo para explicar las propiedades de los gases, sólidos y líquidos en términos del movimiento de las partículas y de las fuerzas de atracción que existen entre éstas. • Las partículas del gas están en constante movimiento aleatorio. • Las partículas del gas no se repelen ni se atraen entre sí. M. RAMÍREZ G. 2

Teoría Cinética Molecular • Las partículas del gas son mucho más pequeñas que las distancias que existen entre ellas. • No se pierde energía cinética cuando las partículas del gas chocan entre sí o con las paredes de su recipiente. • Todos los gases tienen la misma energía cinética promedio a una temperatura dada. M. RAMÍREZ G. 3

Principales Propiedades de los Gases Expansibilidad. - Ocupan todo el volumen disponible. Fluidez. - Adoptan la forma del recipiente que los contiene. Compresibilidad. - Disminuyen sus dimensiones fácilmente por efecto de una pequeña presión. M. RAMÍREZ G. 4

Principales Propiedades de los Gases Elasticidad. - Recuperan sus dimensiones originales, cuando cesa la fuerza deformadora. Difusibilidad. - Atraviesan materiales porosos a grandes velocidades. M. RAMÍREZ G. 5

Variables que determinan el comportamiento de los gases • Número de partículas del gas presente (n) • Temperatura del gas (T) • Presión del gas (P) • Volumen de la muestra del gas (V) M. RAMÍREZ G. 6

Presión y Temperatura Cuando se trabaja con gases, las variables de estado se tienen que operar en estados absolutos. La presión tiene que ser absoluta: Pabs = Patm + Pman M. RAMÍREZ G. 7

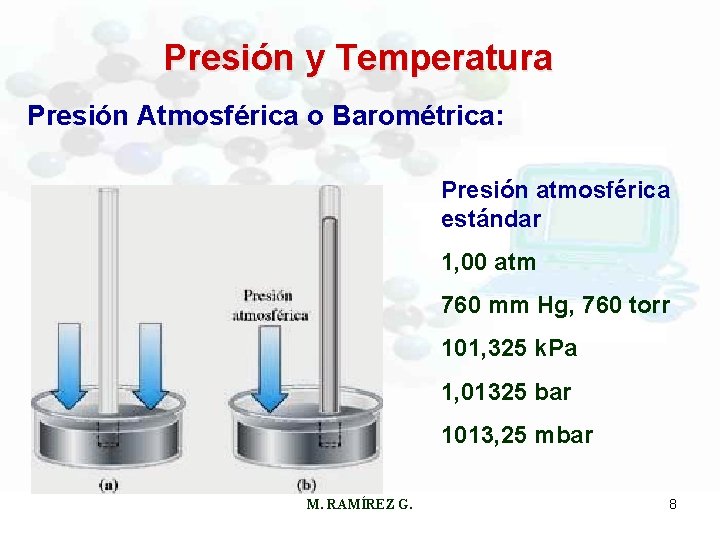
Presión y Temperatura Presión Atmosférica o Barométrica: Presión atmosférica estándar 1, 00 atm 760 mm Hg, 760 torr 101, 325 k. Pa 1, 01325 bar 1013, 25 mbar M. RAMÍREZ G. 8

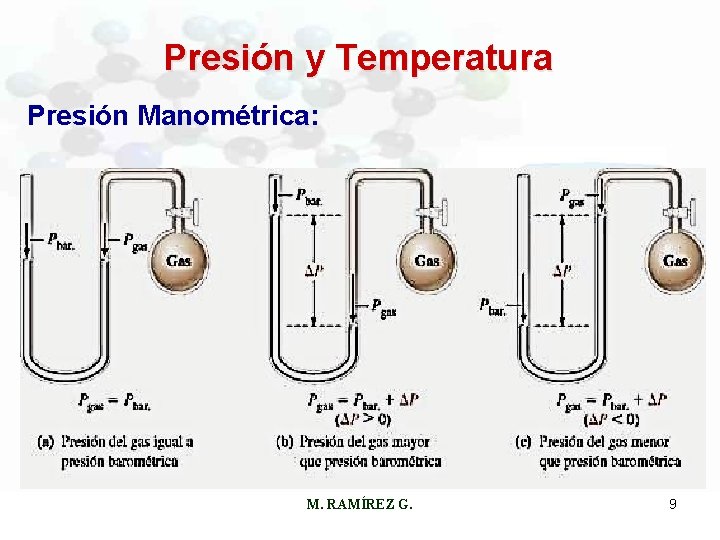
Presión y Temperatura Presión Manométrica: M. RAMÍREZ G. 9

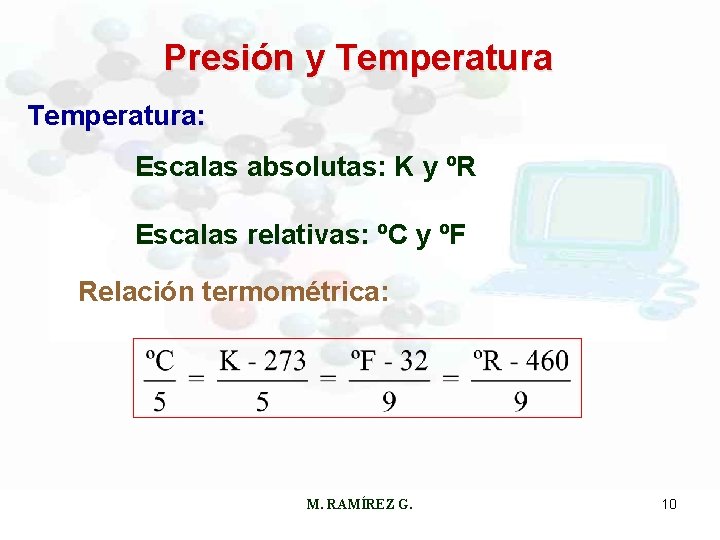
Presión y Temperatura: Escalas absolutas: K y ºR Escalas relativas: ºC y ºF Relación termométrica: M. RAMÍREZ G. 10

Presión y Temperatura Ejemplo: La presión en el interior de un balón de gas es 2500 mm Hg. ¿Cuál es la presión absoluta? La relación de Presión absoluta es: Pabs = Patm + Pman Pabs = 760 mm Hg + 2500 mm Hg Pabs = 3260 mm Hg M. RAMÍREZ G. 11

Presión y Temperatura Ejemplo: La temperatura de un gas se encuentra a 27ºC, ¿cuál será la temperatura en Kelvin? Usando la relación de ºC y K: ºC = K -273 Despejando K: K = ºC + 273 Reemplazando valores: TK = 27 + 273 TK = 300 K M. RAMÍREZ G. 12

Leyes de los Gases Ley de Boyle Ley de Charles Ley de Avogadro Ley de Gases Ideales Ley de Graham M. RAMÍREZ G. 13

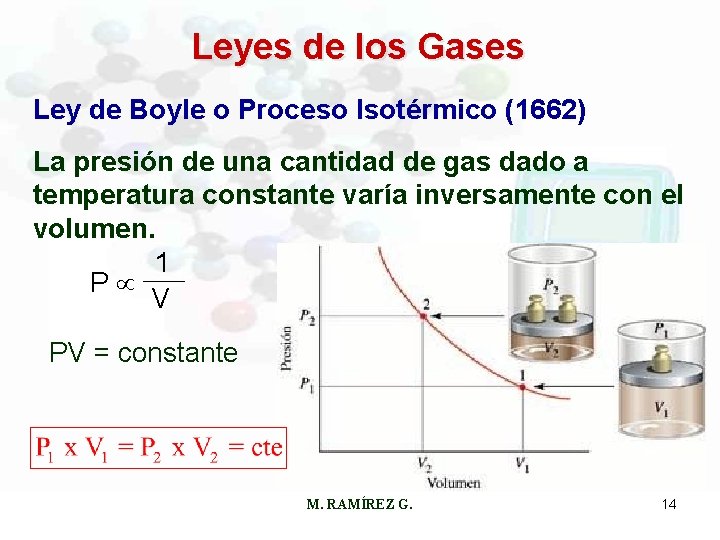
Leyes de los Gases Ley de Boyle o Proceso Isotérmico (1662) La presión de una cantidad de gas dado a temperatura constante varía inversamente con el volumen. 1 P V PV = constante M. RAMÍREZ G. 14

Leyes de los Gases Ejemplo: Relación entre el volumen y la presión de un gas. Ley de Boyle. P 1 V 1 = P 2 V 2 P 1 V 1 = 694 L V 2 = P 2 M. RAMÍREZ G. Vdepósito = 644 L 15

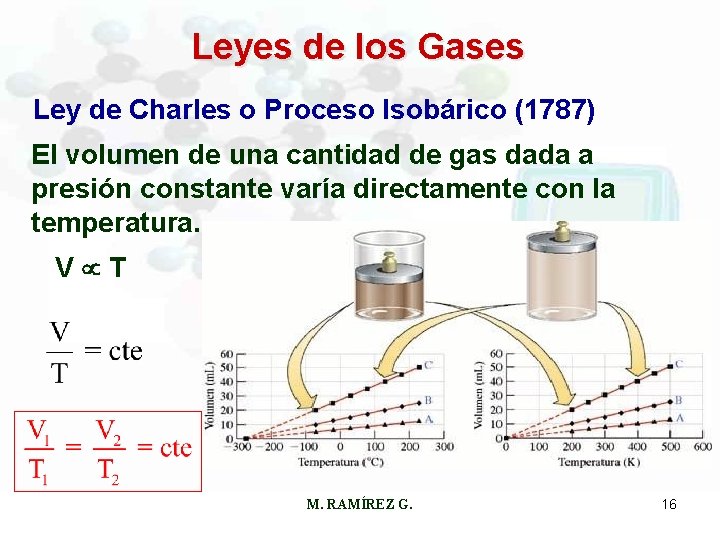
Leyes de los Gases Ley de Charles o Proceso Isobárico (1787) El volumen de una cantidad de gas dada a presión constante varía directamente con la temperatura. V T M. RAMÍREZ G. 16

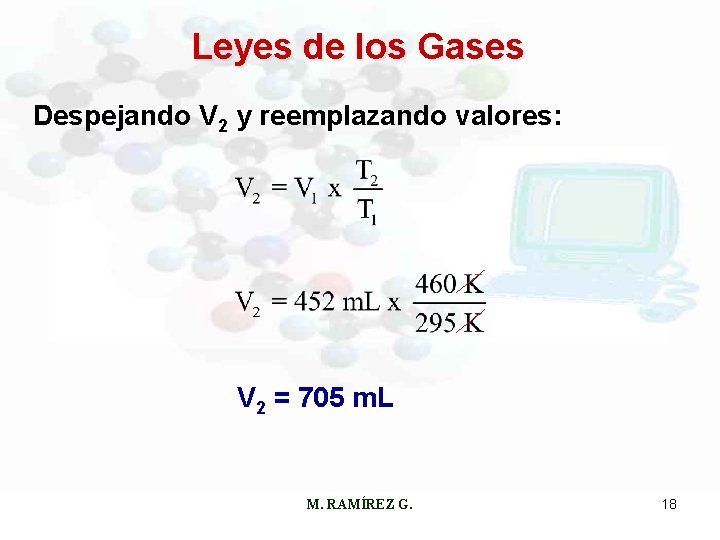
Leyes de los Gases Ejemplo: El argón es un gas inerte usado en los tubos luminosos. En un experimento, 452 m. L de gas se calientan de 22ºC a 187ºC a presión constante. ¿Cuál es el volumen final? Usando la ecuación: Condiciones iniciales: Condiciones finales: V 1 = 452 m. L V 2 = ? ? T 1 = (22 + 273)K = 295 K T 2 = (187 + 273)K = 460 K M. RAMÍREZ G. 17

Leyes de los Gases Despejando V 2 y reemplazando valores: V 2 = 705 m. L M. RAMÍREZ G. 18

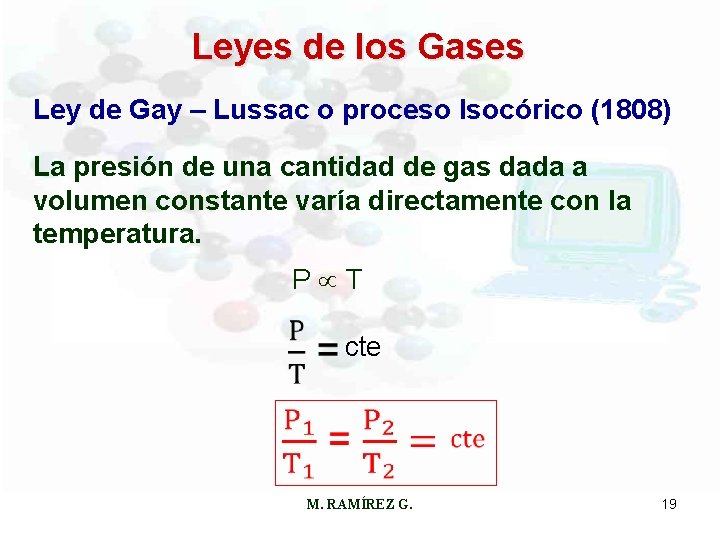
Leyes de los Gases Ley de Gay – Lussac o proceso Isocórico (1808) La presión de una cantidad de gas dada a volumen constante varía directamente con la temperatura. P T cte M. RAMÍREZ G. 19

Leyes de los Gases Ejemplo: Cierto volumen de un gas se encuentra a una presión de 970 mm Hg cuando su temperatura es de 25°C. ¿A qué temperatura deberá estar para que su presión sea 760 mm Hg? Usando la ecuación: M. RAMÍREZ G. 20

Leyes de los Gases Condiciones iniciales: Condiciones finales: T 1 = (25 + 273)K = 298 K T 2 = ? ? P 1 = 970 mm Hg P 2 = 760 mm Hg Despejando T 2 y reemplazando valores: T 2 = 233, 5 K M. RAMÍREZ G. 21

Leyes de los Gases Ley de Avogadro (1811) El volumen de una cantidad de gas dada a temperatura y presión constante varía directamente con el número de partículas. V n M. RAMÍREZ G. 22

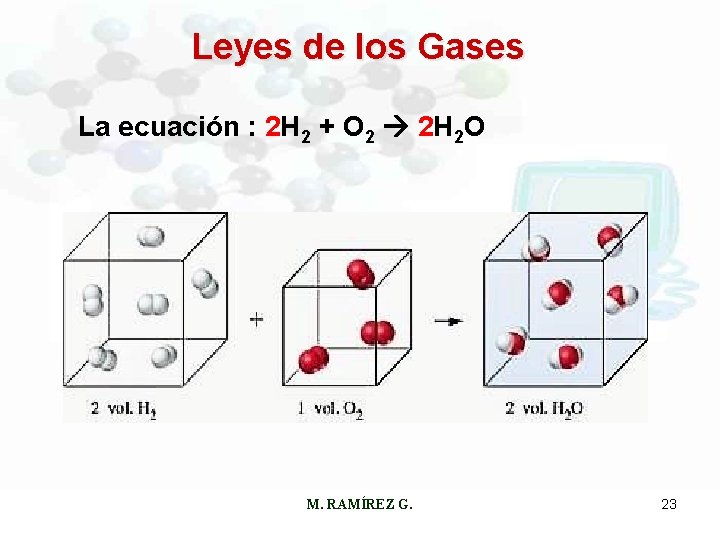
Leyes de los Gases La ecuación : 2 H 2 + O 2 2 H 2 O M. RAMÍREZ G. 23

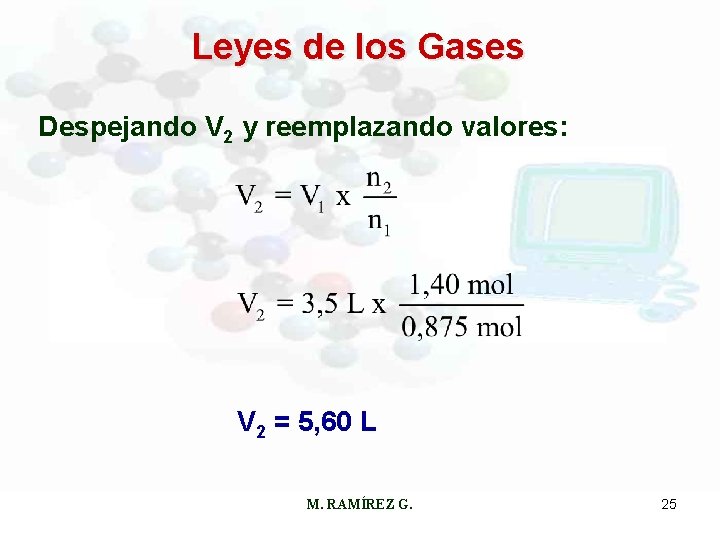
Leyes de los Gases Ejemplo: Sabemos que 3, 50 L de un gas contienen 0, 875 mol. Si aumentamos la cantidad de gas hasta 1, 40 mol, ¿cuál será el nuevo volumen del gas? (a temperatura y presión constantes) De acuerdo a la ecuación: M. RAMÍREZ G. 24

Leyes de los Gases Despejando V 2 y reemplazando valores: V 2 = 5, 60 L M. RAMÍREZ G. 25

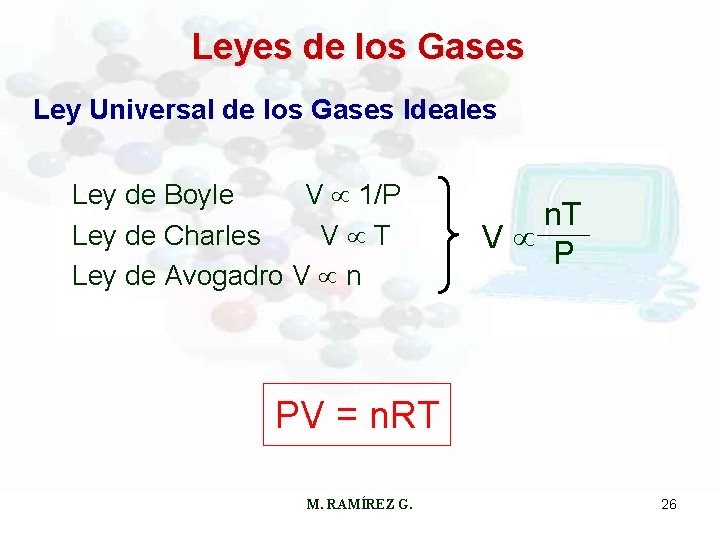
Leyes de los Gases Ley Universal de los Gases Ideales Ley de Boyle V 1/P Ley de Charles V T Ley de Avogadro V n n. T V P PV = n. RT M. RAMÍREZ G. 26

Leyes de los Gases A condiciones normales (CN) una mol de cualquier gas ocupa un volumen constante: P = 1 atm T = 0ºC = 273 K Vm = 22, 4 L/mol M. RAMÍREZ G. 27

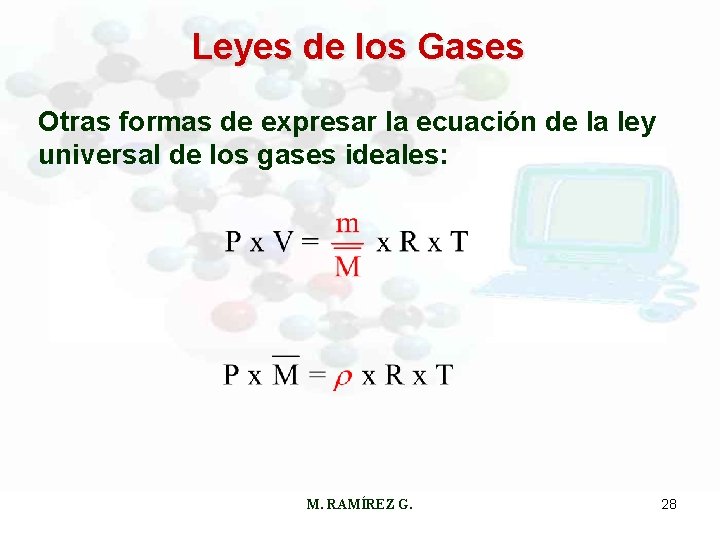
Leyes de los Gases Otras formas de expresar la ecuación de la ley universal de los gases ideales: M. RAMÍREZ G. 28

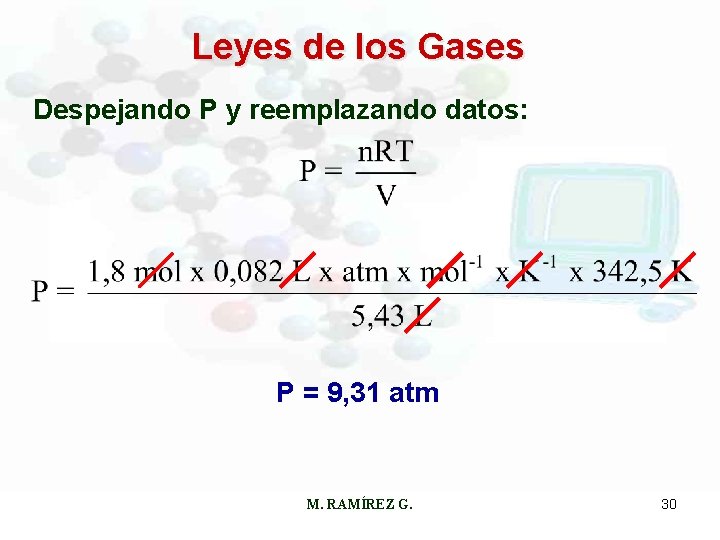
Leyes de los Gases Ejercicio: El hexafluoruro de azufre (SF 6) es un gas incoloro, inodoro y muy reactivo. Calcúlese la presión en atmósferas ejercida por 1, 8 moles del gas en un recipiente de 5, 43 L a 69, 5ºC. De la ecuación universal: PV = n. RT Acondicionando de datos: n = 1, 8 moles V = 5, 43 L T = (69, 5 + 273)K = 342, 5 K M. RAMÍREZ G. 29

Leyes de los Gases Despejando P y reemplazando datos: P = 9, 31 atm M. RAMÍREZ G. 30

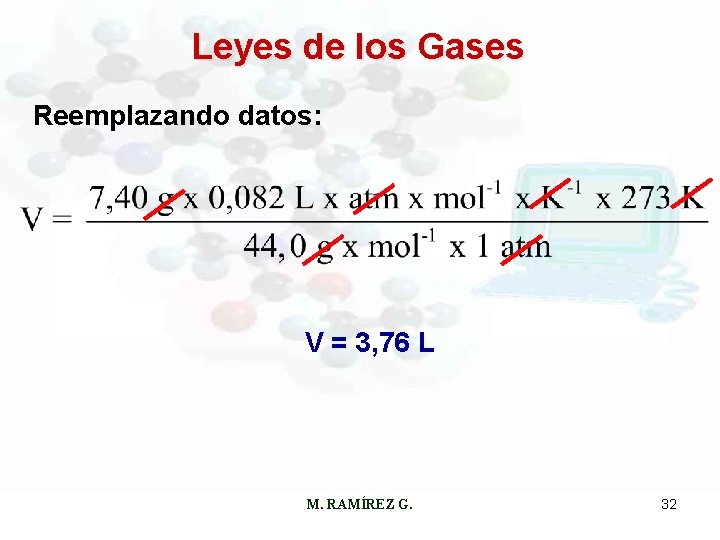
Leyes de los Gases Ejemplo: Calcúlese el volumen en litros ocupado por 7, 40 g de CO 2 a CN. Acondicionando la formula y los datos: m = 7, 40 g P = 1 atm M. RAMÍREZ G. T = 273 K 31

Leyes de los Gases Reemplazando datos: V = 3, 76 L M. RAMÍREZ G. 32

Leyes de los Gases Ley de Graham (1662) La velocidad de la difusión o efusión de un gas varía inversamente con la raíz cuadrada de su masa molecular. M. RAMÍREZ G. 33

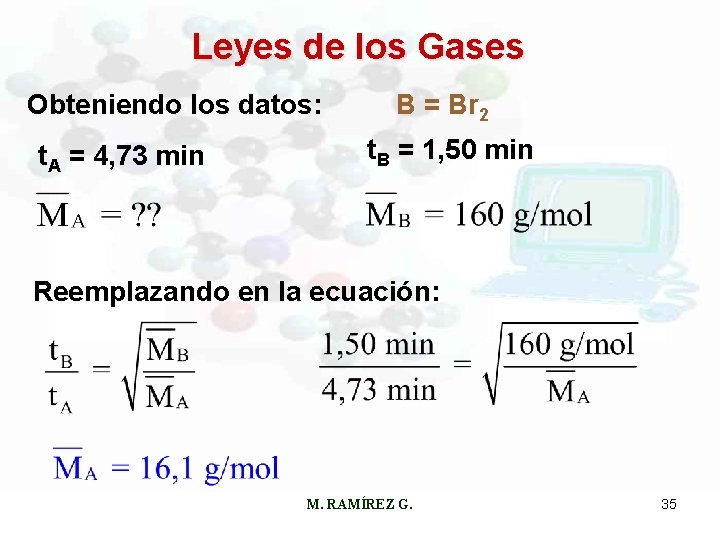
Leyes de los Gases Ejemplo: Un gas inflamable constituido sólo de carbono e hidrógeno es generado por ciertos cultivos de bacterias anaeróbicas en tierras pantanosas y áreas de drenaje. Se encontró que una muestra pura de este gas afluye a través de cierta barrera porosa en 1, 50 min. En condiciones idénticas de temperatura y presión, un volumen igual de bromo gaseoso afluye en 4, 73 min a través de la misma barrera. Calcúlese la masa molar del gas desconocido. M. RAMÍREZ G. 34

Leyes de los Gases Obteniendo los datos: t. A = 4, 73 min B = Br 2 t. B = 1, 50 min Reemplazando en la ecuación: M. RAMÍREZ G. 35

Bibliografía • Petrucci. Harwood Química General. Editorial Prentice Hall. 8ª edición México • Raymond Chang Química. Editorial Mc Graw Hill. 4ª edición. México M. RAMÍREZ G. 36
 Projeto doutorado
Projeto doutorado Universidad tecnologica de santiago
Universidad tecnologica de santiago David hume teoría del conocimiento
David hume teoría del conocimiento Universidad nacional experimental de la seguridad sigla
Universidad nacional experimental de la seguridad sigla Universidad nacional de loja
Universidad nacional de loja Universidad nacional banner
Universidad nacional banner Universidad nacional de azuero
Universidad nacional de azuero Umc velero
Umc velero Universidad nacional
Universidad nacional Francisco luis espinoza pineda
Francisco luis espinoza pineda Universidad nacional experimental de yaracuy
Universidad nacional experimental de yaracuy Universidad nacional experimental francisco de miranda
Universidad nacional experimental francisco de miranda Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Tesis universidad nacional abierta
Tesis universidad nacional abierta Universidad nacional de guinea ecuatorial
Universidad nacional de guinea ecuatorial Centro regional universitario de azuero
Centro regional universitario de azuero Universidad nacional de ingenieria
Universidad nacional de ingenieria Foda de una universidad nacional
Foda de una universidad nacional Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Competencias abet
Competencias abet Artes plasticas universidad nacional
Artes plasticas universidad nacional Universidad de trujillo diplomados
Universidad de trujillo diplomados Pucp beca 18
Pucp beca 18 Universidad nacional de tumbes segunda especialidad
Universidad nacional de tumbes segunda especialidad Universidad nacional de loja
Universidad nacional de loja Universidad nacional de piura maestrias
Universidad nacional de piura maestrias Universidad nacional de ingenieria
Universidad nacional de ingenieria Universidad nacional de cuyo derecho
Universidad nacional de cuyo derecho Universidad nacional intercultural de la amazonía
Universidad nacional intercultural de la amazonía Siu preinscripción unsa
Siu preinscripción unsa Himno de la universidad nacional mayor de san marcos
Himno de la universidad nacional mayor de san marcos Acadmico
Acadmico Google acadmico
Google acadmico Vvvv
Vvvv 学术搜索(https //scholar.google.com/)
学术搜索(https //scholar.google.com/) Acadmico
Acadmico Acadmico
Acadmico




























































