MINISTRIO DA EDUCAO SECRETARIA DE EDUCAO PROFISSIONAL E

















- Slides: 29

MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS LAGES 4. Geometria Molecular Prof. Marcel Piovezan marcel. piovezan@ifsc. edu. br Curso Superior de Tecnologia em Processos Química Geral e Experimental I Fase 1

GEOMETRIA MOLECULAR DEPENDE: Disposição espacial dos núcleos dos átomos. Repulsão dos pares eletrônicos das ligações ou pares livres dos átomos. Obs. Toda molécula formada por dois átomos é sempre linear.

Nuvens Eletrônicas Quando se tratar de moléculas com três ou mais átomos, considera-se uma nuvem eletrônica para os casos: Ligação covalente simples Ligação covalente dupla Ligação covalente tripla Par de elétrons não ligante

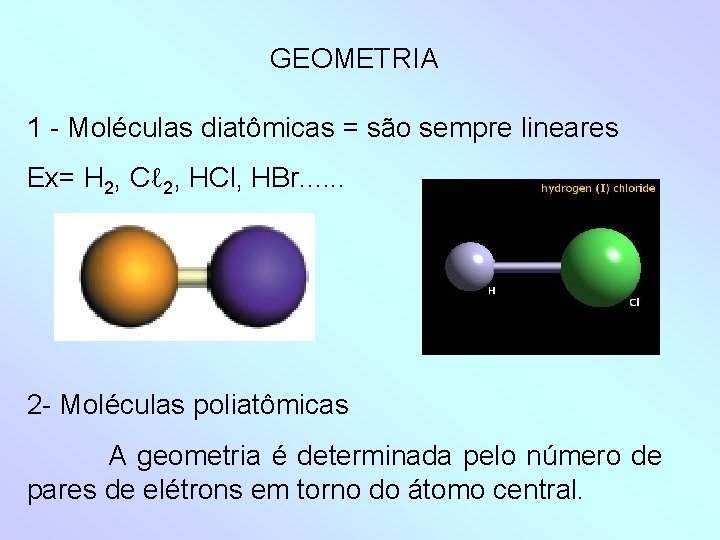
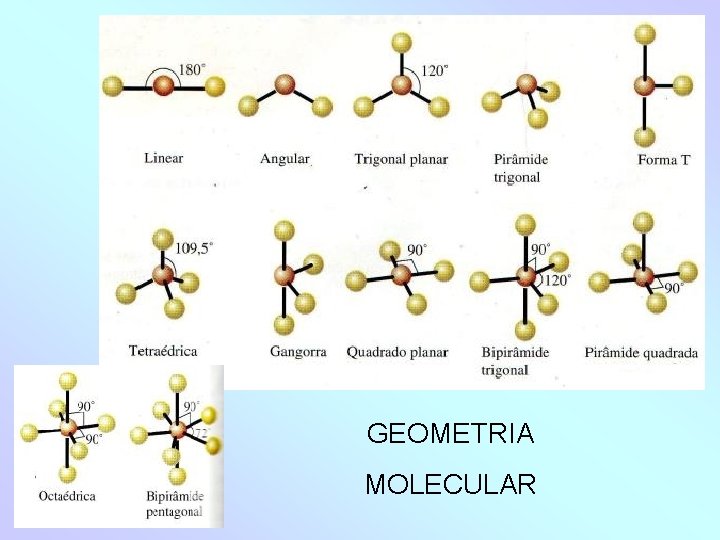
GEOMETRIA 1 - Moléculas diatômicas = são sempre lineares Ex= H 2, Cℓ 2, HCl, HBr. . . 2 - Moléculas poliatômicas A geometria é determinada pelo número de pares de elétrons em torno do átomo central.

Dois pares ligantes – Linear (1800) Ex= CO 2, CS 2. . : Ö = C = Ö: Três pares Todos ligantes – Trigonal plana (1200) Ex = SO 3, BF 3.

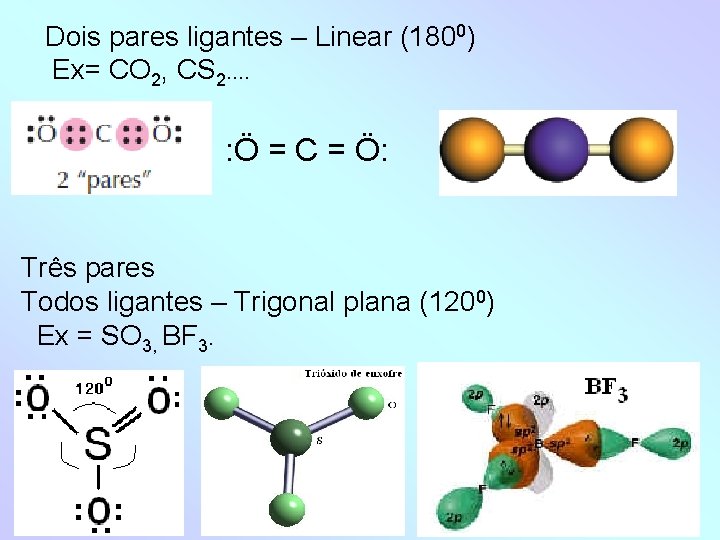
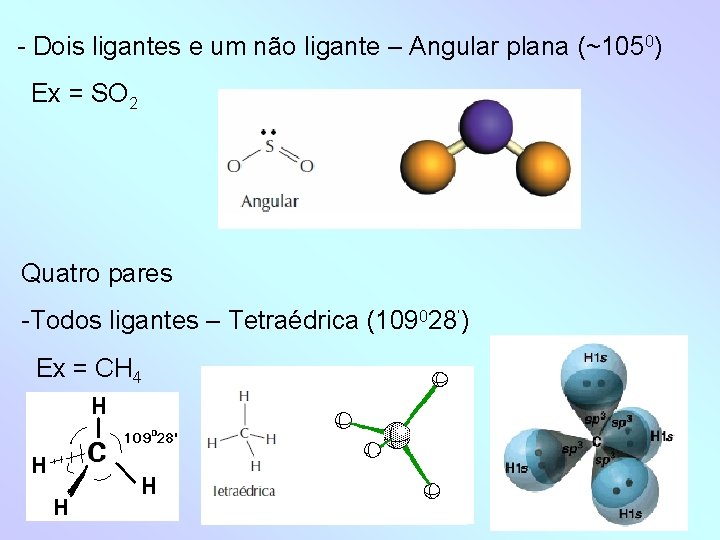
- Dois ligantes e um não ligante – Angular plana (~1050) Ex = SO 2 Quatro pares -Todos ligantes – Tetraédrica (109028’) Ex = CH 4

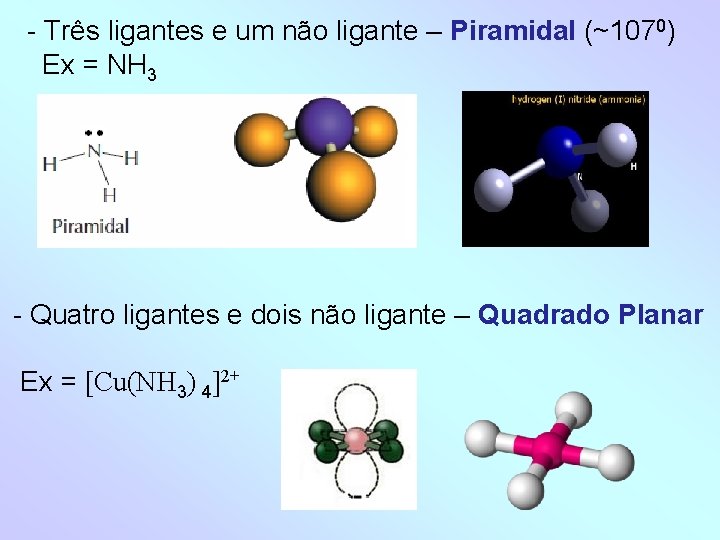
- Três ligantes e um não ligante – Piramidal (~1070) Ex = NH 3 - Quatro ligantes e dois não ligante – Quadrado Planar Ex = [Cu(NH 3) 4]2+

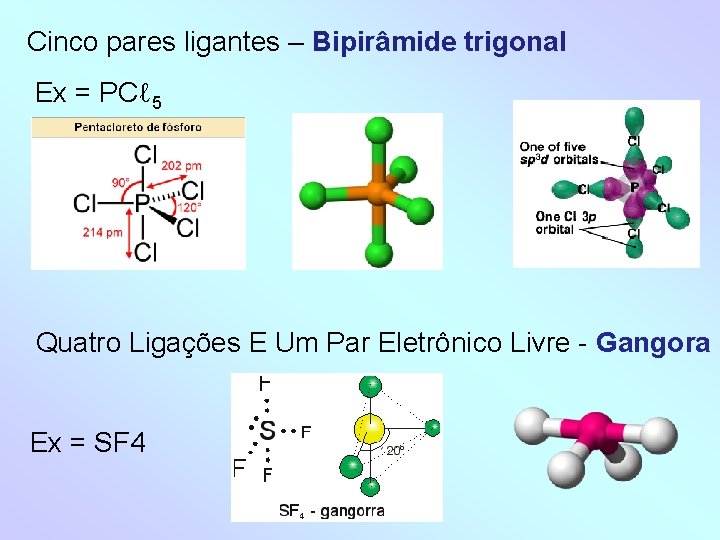
Cinco pares ligantes – Bipirâmide trigonal Ex = PCℓ 5 Quatro Ligações E Um Par Eletrônico Livre - Gangora Ex = SF 4

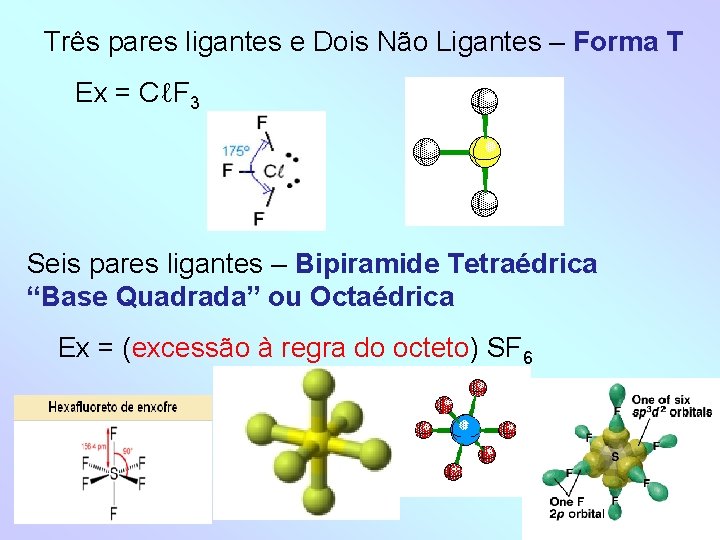
Três pares ligantes e Dois Não Ligantes – Forma T Ex = CℓF 3 Seis pares ligantes – Bipiramide Tetraédrica “Base Quadrada” ou Octaédrica Ex = (excessão à regra do octeto) SF 6

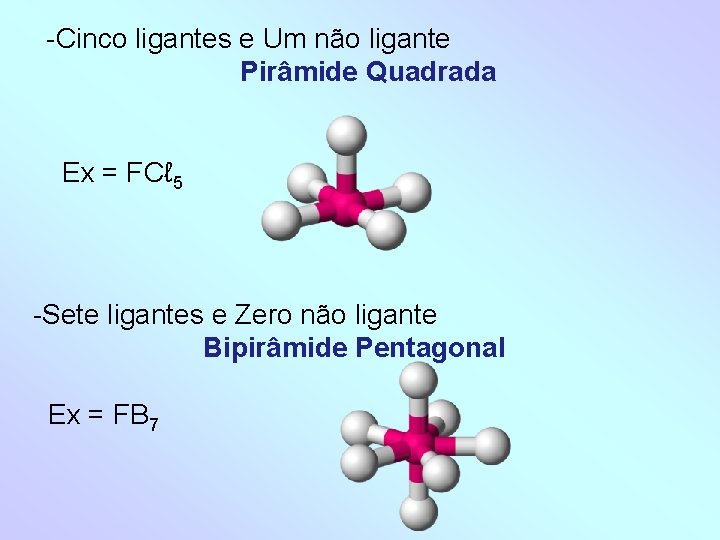
-Cinco ligantes e Um não ligante Pirâmide Quadrada Ex = FCℓ 5 -Sete ligantes e Zero não ligante Bipirâmide Pentagonal Ex = FB 7

GEOMETRIA MOLECULAR

Exercícios de fixação: Mostre as ligações (estrutura de Lewis) e Determine a forma geométrica das espécies químicas abaixo: • SCℓ 2 • BF 3 • HI • O 3 • PH 3 • CO 2 • P 4 • Si. H 4 NH 3 NH 4+

POLARIDADE DAS LIGAÇÕES Definição: acúmulo de cargas elétricas em regiões distintas da ligação – pólos. Ligações iônicas: são fortemente polarizadas, cada íon define um pólo da ligação. + _

Polaridade das Ligações covalentes: é função da diferença de eletronegatividade entre os átomos da ligação. Classificação: - Apolar: formadas por átomos de eletronegatividades iguais, a nuvem não se deforma. - Polar: formadas por átomos de eletronegatividade diferentes, a nuvem se deforma.

Polaridade das Ligações Ligação covalente apolar: H 2 H H Ligação covalente polar: + HCl H Cl -

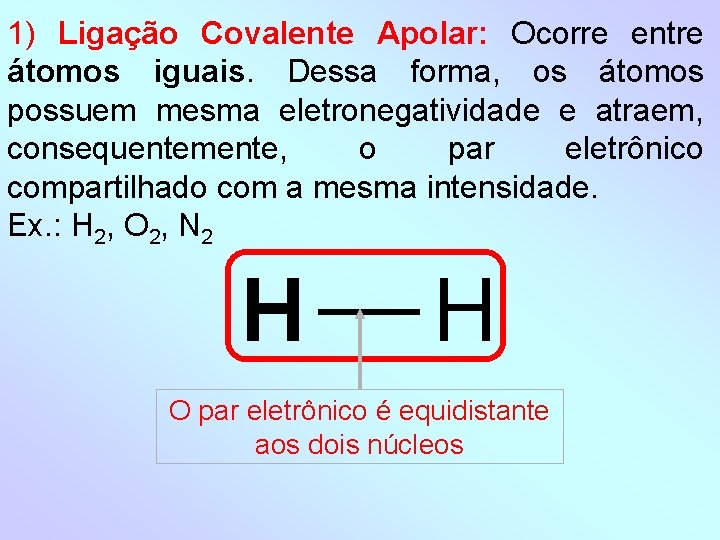
1) Ligação Covalente Apolar: Ocorre entre átomos iguais. Dessa forma, os átomos possuem mesma eletronegatividade e atraem, consequentemente, o par eletrônico compartilhado com a mesma intensidade. Ex. : H 2, O 2, N 2 H H O par eletrônico é equidistante aos dois núcleos

2) Ligação Covalente Polar: Ocorre entre átomos diferentes. Dessa forma, o átomo que possui maior eletronegatividade atrai o par eletrônico compartilhado com maior intensidade. Ex. : HCl. O par eletrônico fica mais próximo do cloro pois este átomo atrai mais fortemente os elétrons da ligação covalente (porque é mais eletronegativo). + A ligação forma um dipolo elétrico H - Cl

Obs. Quanto maior a diferença de eletronegatividade entre os átomos maior a polarização. F O N = Cl Br I = S = C P = H metais A cada ligação covalente polar corresponde um dipolo elétrico. Serão tantos dipolos, quantas forem as ligações polares.

As ligações polares e os dipolos formados serão tanto maiores, quanto maior for a diferença de eletronegatividade entre os átomos ligantes. Ex: H-F > H-Cl > H-Br > H-I H 2 O > H 2 S Representação do dipolo = vetor momento dipolar

POLARIDADE DAS MOLÉCULAS Definição: acúmulo de cargas elétricas em regiões distintas da molécula, sua força depende da polaridade das ligações e da geometria molecular. Momento dipolar: é o vetor que orienta a polaridade da ligação, pólo positivo para o negativo. Ex: H Cl Momento dipolar resultante ( r): vetor que define a polaridade da molécula, soma dos vetores.

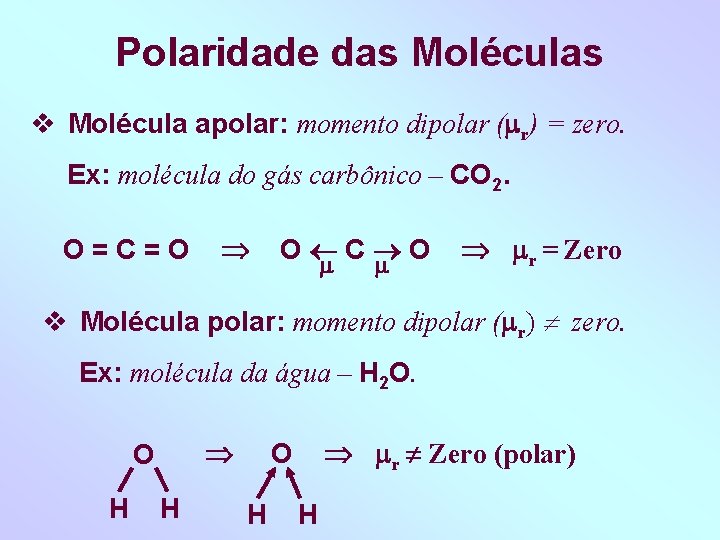
Polaridade das Moléculas Molécula apolar: momento dipolar ( r) = zero. Ex: molécula do gás carbônico – CO 2. O=C=O O C O r = Zero Molécula polar: momento dipolar ( r) zero. Ex: molécula da água – H 2 O. O H H r Zero (polar) O H H

Exercícios de fixação: 1. Os tipos de ligações dos compostos Li. F, SCl 2 e Cl 2 são, respectivamente: a) covalente apolar, covalente polar e iônica. b) iônica, covalente apolar e covalente apolar. c) covalente polar, iônica e covalente apolar. d) covalente apolar, iônica e covalente polar. e) iônica, covalente polar, covalente apolar. 2. Dadas as moléculas O 2, PCl 3, Be. H 2, C 5 H 10 e CHCl 3 o número de moléculas polares é: a) 1 b) 2 c) 3 d) 4 e) 5 3. Dos solventes abaixo, o mais indicado para dissolver enxofre (S 8) é: a) H 2 O(água) d) CS 2 (dissulfeto de carbono) b) C 2 H 5 OH (álcool etílico) c) HCCl 3 (clorofórmio) e) C 3 H 8 O 3 (glicerina)

LIGAÇÕES INTERMOLECULARES DEFINIÇÃO: ligações entre as moléculas de substâncias no estado sólido ou líquido. Tipos de ligações intermoleculares: 1) Ligação Dipolo – Dipolo: ocorrem entre as moléculas polares. 2) Ligação de Hidrogênio: ocorrem entre moléculas fortemente polarizadas, quando o H se encontra ligado aos átomos de F, O e N. 3) Ligação Dipolo Induzido – Dipolo Induzido: ocorrem entre as moléculas apolares 4) Ligação Dipolo – Dipolo Induzido: ocorrem entre as moléculas polares e moléculas apolares

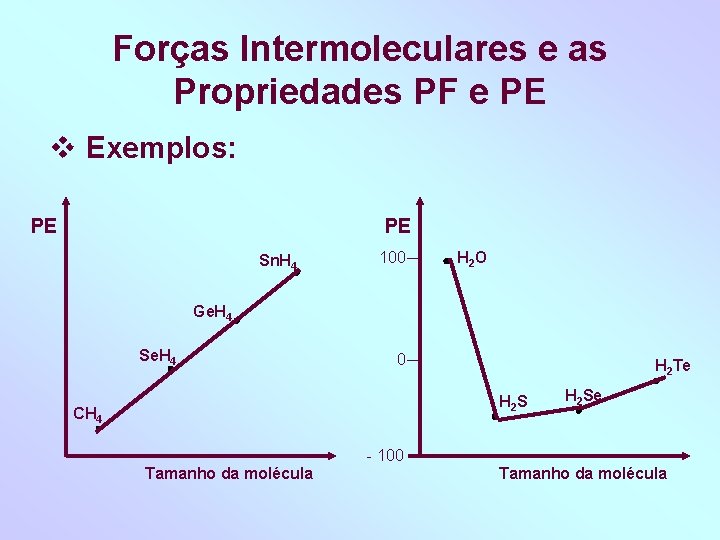
Forças Intermoleculares e as Propriedades PF e PE Dois fatores influem nos PF e PE: 1) Ligações intermolecular: quanto maior a intensidade das forças de ligação, maiores os PF e PE da substância. Ordem crescente da intensidade de interação: Dipolo induzido < dipolo – dipolo < ligação de H 2) O tamanho das moléculas: quanto maior o tamanho das moléculas, maiores o PF e PE da substância.

Forças Intermoleculares e as Propriedades PF e PE Exemplos: PE PE Sn. H 4 100 H 2 O Ge. H 4 Se. H 4 0 H 2 Te H 2 S CH 4 H 2 Se - 100 Tamanho da molécula

Exercícios de fixação: 1. Considere as seguintes substâncias químicas: H 2, CH 4, HCl, H 2 S e H 2 O. Qual delas apresenta moléculas associados por pontes de hidrogênio? a) H 2 b) CH 4 c) HCl d) H 2 S e) H 2 O 2. Dentre os cloretos a seguir, o mais volátil, provavelmente é: a) CCl 4 b) Si. Cl 4 c) Ge. Cl 4 d) Sn. Cl 4 e) Pb. Cl 4

4. O ferro sólido e o cloreto de sódio fundido conduzem corrente elétrica. O que há no ferro e no sal que explicam tal comportamento? 5. Quando H recebe um elétron e se transforma em ânion, podemos dizer que o hidrogênio passa a ser hélio? Por quê? 6. O número de massa (A) do 27 Al se altera quando ele se transforma em Al 3+? Por quê? 7. Um elemento metálico forma um sulfeto de fórmula M 2 S 3. A fórmula de seu cloreto será: 8. Sabendo que o elemento E pertence ao subgrupo 2 A e que o elemento D pertence ao subgrupo 7 A, escreva a fórmula do composto constituído por E e D e a natureza da ligação entre eles. 9. Átomos neutros representados por 73 X ao se unirem a átomos de flúor formam o composto iônico de fórmula: 10. Sejam os elementos X com 53 elétrons e Y com 38 elétrons. Depois de fazermos a sua distribuição eletrônica, podemos afirmar que o composto mais provável formado pelo elementos é:

11. Qual o número de ligações coordenadas nas moléculas de H 2 SO 4, H 3 PO 4 e SO 2, respectivamente? 12. Quais ligações são apresentadas pelo cloreto de amônio (NH 4 Cl) possui: 13. Dadas as moléculas: Quais são polares: • HCl H 2 O NH 3 BF 3 CH 4 14. Qual o tipo de interação que se manifesta entre as moléculas de: NH 3? CH 4?

15. Comparando-se as temperaturas de ebulição dos compostos HF, HCl, HBr, HI, nota-se que a do HF é muito elevada em relação aos demais. Como poderíamos explicar esse fato? 16. A congelação da água na superfície dos lagos em países frios ocorre pela: a) ruptura de ligações intermoleculares. b) Ruptura de ligações intramoleculares. c) Formação de ligações intermoleculares. d) Formação de ligações intramoleculares. e) Formação de ligação inter e intramoleculares. 17. O dióxido de carbono solidificado, as moléculas de CO 2 serão unidas por ligações:
 Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio do trabalho
Ministrio do trabalho Ministrio da fazenda
Ministrio da fazenda Escola profissional de cuba
Escola profissional de cuba Conhecimento profissional
Conhecimento profissional Psicologia aplicada e ética profissional
Psicologia aplicada e ética profissional Planejamento de carreira e sucesso profissional estácio
Planejamento de carreira e sucesso profissional estácio Curtigrama
Curtigrama Responsabilidade profissional enfermagem
Responsabilidade profissional enfermagem Perfil profissional professor
Perfil profissional professor Etica profissional
Etica profissional Escola profissional de vouzela
Escola profissional de vouzela Separação de misturas
Separação de misturas Psicologia aplicada e ética profissional
Psicologia aplicada e ética profissional Saberes docentes e formação profissional ppt
Saberes docentes e formação profissional ppt Identidade profissional do professor
Identidade profissional do professor Secretaria de meio ambiente da bahia
Secretaria de meio ambiente da bahia Hoja diaria de consulta externa 2020
Hoja diaria de consulta externa 2020 Cagr ufsc aluno
Cagr ufsc aluno Secretaria de avaliação e gestão da informação
Secretaria de avaliação e gestão da informação Objetivo general de una secretaria
Objetivo general de una secretaria Plano da secretaria da economia criativa
Plano da secretaria da economia criativa Secretaria do estado de santa catarina
Secretaria do estado de santa catarina Secretaria de avaliação e gestão da informação
Secretaria de avaliação e gestão da informação Lenguaje de secretaria
Lenguaje de secretaria Bip
Bip C
C




















































