MINISTRIO DA EDUCAO SECRETARIA DE EDUCAO PROFISSIONAL E















- Slides: 21

MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS Florianópolis Teorias Ácido-Base Prof. Marcel Piovezan marcel. piovezan@ifsc. edu. br Curso Técnico Integrado em Química Unidade Curricular: Química Geral Fase 1

TEORIA DE ARRHENIUS Desenvolveu a Teoria da Dissociação Iônica. Em 1881 começou a realizar inúmeras experiências relacionadas à passagem de corrente elétrica através de soluções aquosas Químico Sueco Baseado nos resultados observados, ele chegou à teoria de que a condutividade elétrica estava relacionada à presença de íons nas soluções.

Para ARRHENIUS: Ácido era toda a substância que contendo hidrogênio, se “ioniza” em solução produzindo íons H+ ou H 3 O+ ou

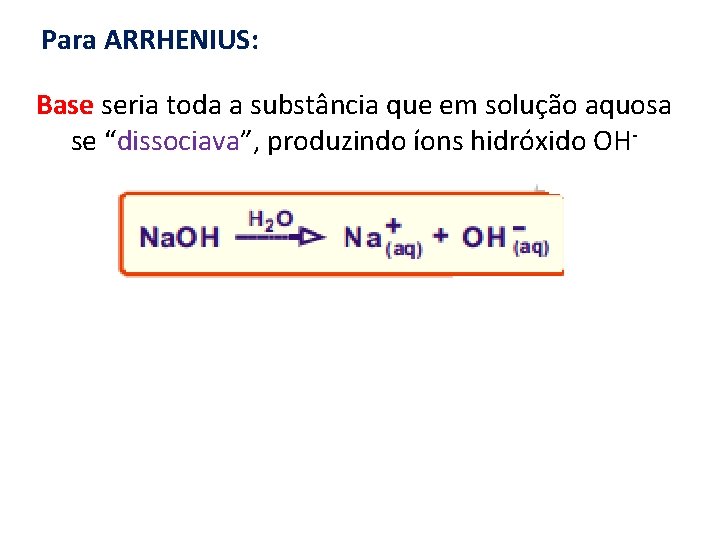
Para ARRHENIUS: Base seria toda a substância que em solução aquosa se “dissociava”, produzindo íons hidróxido OH-

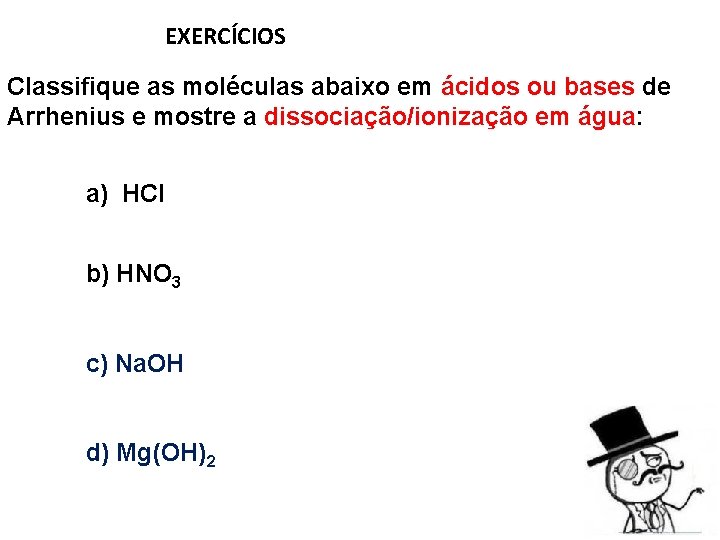
EXERCÍCIOS Classifique as moléculas abaixo em ácidos ou bases de Arrhenius e mostre a dissociação/ionização em água: a) HCl b) HNO 3 c) Na. OH d) Mg(OH)2

Para ARRHENIUS: Esta teoria estava incompleta, pois não explicava o comportamento básico da amônia em água NH 3(aq)+ H 2 O(l) NH 4+(aq) + OH–(aq) Surgindo uma segunda teoria que explicaria esse comportamento

TEORIA DE BRONSTED-LOWRY BRONSTED Químico Dinamarquês LOWRY Químico Britânico Estudaram simultaneamente o comportamento de diversos ácidos e bases

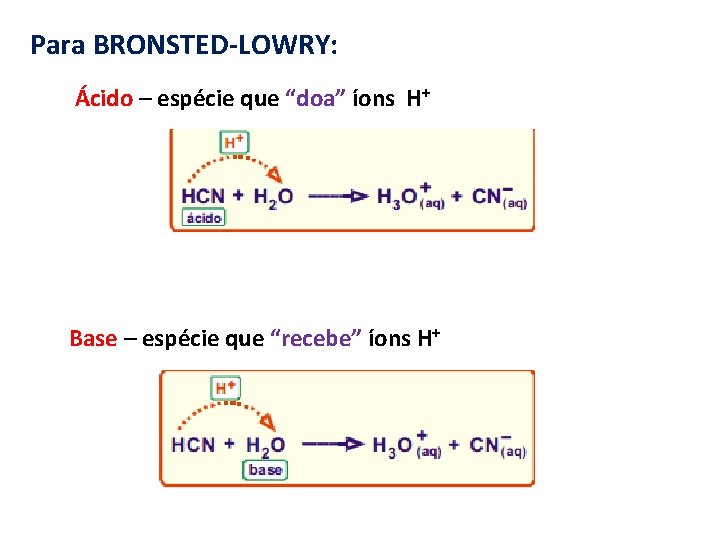
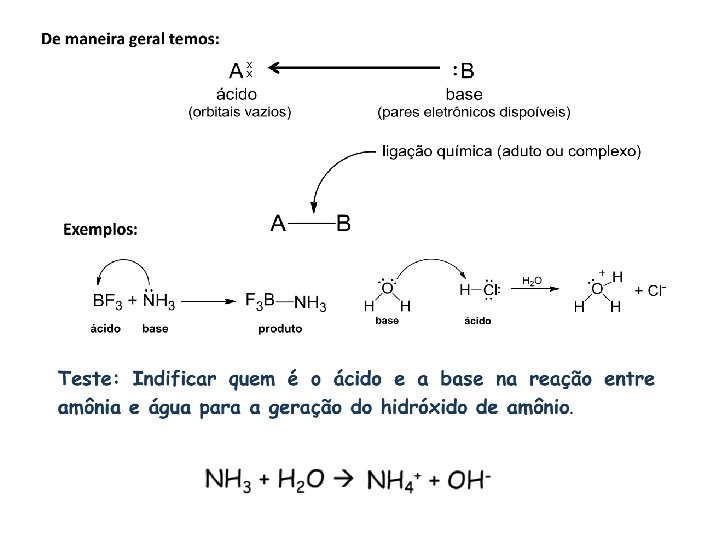
Para BRONSTED-LOWRY: Ácido – espécie que “doa” íons H+ Base – espécie que “recebe” íons H+

Essas reações são reversíveis, de modo que, no sentido inverso teremos: Segundo a teoria , há a formação de pares ácido base conjugados

Exemplo Ionização da Amônia NH 3(aq)+ H 2 O(l) NH 4+(aq) + OH–(aq)

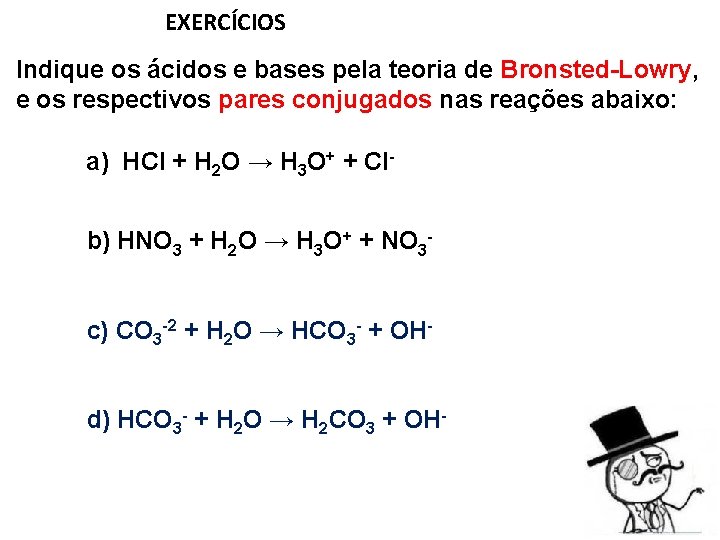
EXERCÍCIOS Indique os ácidos e bases pela teoria de Bronsted-Lowry, e os respectivos pares conjugados nas reações abaixo: a) HCl + H 2 O → H 3 O+ + Clb) HNO 3 + H 2 O → H 3 O+ + NO 3 c) CO 3 -2 + H 2 O → HCO 3 - + OHd) HCO 3 - + H 2 O → H 2 CO 3 + OH-

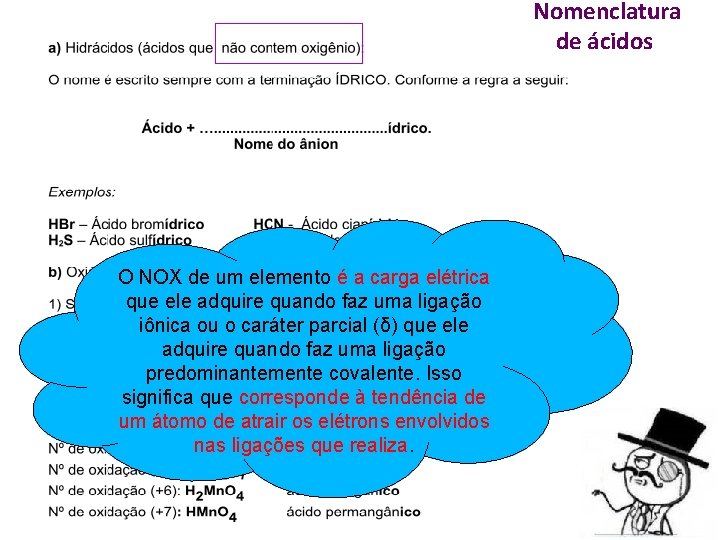
Nomenclatura de ácidos O NOX de um elemento é a carga elétrica que ele adquire quando faz uma ligação iônica ou o caráter parcial (δ) que ele adquire quando faz uma ligação predominantemente covalente. Isso significa que corresponde à tendência de um átomo de atrair os elétrons envolvidos nas ligações que realiza.

Nomenclatura

Nomenclatura de bases

Exercícios Nomeie os seguintes ácidos e bases CO 2 + OH- HCO 3 -






 Ministrio do trabalho
Ministrio do trabalho Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Maurice tardif
Maurice tardif Identidade profissional do professor
Identidade profissional do professor Escola profissional de cuba
Escola profissional de cuba Psicologia aplicada e ética profissional
Psicologia aplicada e ética profissional Conhecimento profissional
Conhecimento profissional Planejamento de carreira e sucesso profissional estácio
Planejamento de carreira e sucesso profissional estácio Curtigrama
Curtigrama Responsabilidade profissional enfermagem
Responsabilidade profissional enfermagem Perfil profissional professor
Perfil profissional professor Etica profissional
Etica profissional Imagem de destilação fracionada
Imagem de destilação fracionada Putas perto de mim
Putas perto de mim Psicologia aplicada a ética profissional
Psicologia aplicada a ética profissional Secretaria general
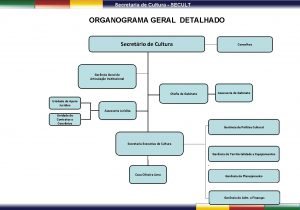
Secretaria general Organograma secretaria municipal de cultura
Organograma secretaria municipal de cultura Greelec
Greelec