MINISTRIO DA EDUCAO SECRETARIA DE EDUCAO PROFISSIONAL E


























- Slides: 36

MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS LAGES Soluções e Expressão das concentrações Prof. Marcel Piovezan marcel. piovezan@ifsc. edu. br Curso Técnico concomitante em Análises Química Unidade Curricular: Química Analítica Módulo 2

BRIAN SYTNYK/ MASTERFILE/OTHER-IMAGES Introdução às expressões de concentração das soluções aquosas X SAIR

Os conceitos de solução, solvente e soluto HIGHRES PRESS STOCK/CID Solução: mistura homogênea (soluto + solvente) Soluto: dissolvido pelo solvente Solvente: substância utilizada para dissolver outra Grande parte das soluções é líquida, mas, como vemos aqui, existem soluções sólidas, como o ouro, e gasosas, como o ar atmosférico. 1 Introdução às expressões de concentração das soluções aquosas X SAIR

"Solutos diferentes apresentam solubilidades diferentes“ - Solução diluída - quantidade grande de solvente em relação ao soluto Ex: 2 g de Na. Cl em 100 m. L de H 2 O a 18ºC - Solução concentrada - quantidade grande de soluto em relação ao solvente Ex: 30 g de Na. Cl em 100 m. L de H 2 O a 18ºC X SAIR

- Solução saturada - contém a máxima quantidade de sal que se dissolve em 100 m. L de H 2 O a uma determinada temperatura. Ex: 36 g de Na. Cl em 100 m. L de H 2 O a 18 ºC -Solução supersaturada - apresenta uma maior quantidade de soluto do que o solvente consegue dissolver. Essa solução apresenta corpo de chão, corpo de fundo ou precipitado. Ex: 40 g de Na. Cl em 100 m. L de H 2 O a 18ºC X SAIR

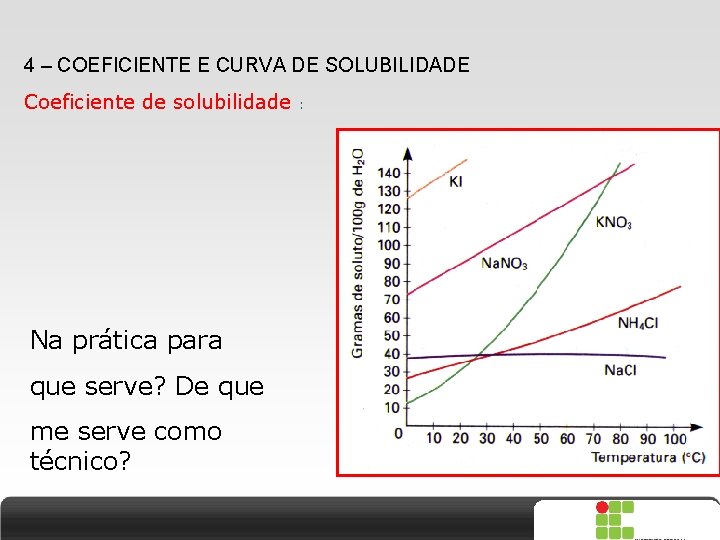
4 – COEFICIENTE E CURVA DE SOLUBILIDADE Coeficiente de solubilidade : Na prática para que serve? De que me serve como técnico? X SAIR

O preparo de uma solução aquosa em laboratório THE NEXT/CID Solução aquosa de Na. OH O soluto é transferido para o frasco e, em seguida, adiciona-se um pouco de água destilada e agita-se até que todo o sólido se dissolva. Massa do soluto = 80 g M(Na. OH) = 40 g • mol– 1 Finalmente, acrescenta- se água com auxílio de uma pisseta até atingir a marca de 1. 000 m. L. 1 Introdução às expressões de concentração das soluções aquosas Massa do soluto = 80 g Volume da solução = 1 L X SAIR

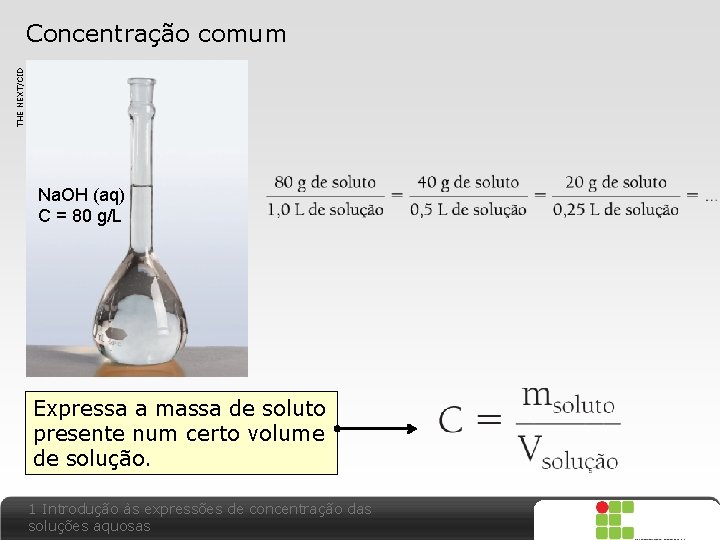
Concentração comum THE NEXT/CID Relação entre massa de soluto e volume de sua solução Na. OH (aq) C = 80 g/L A solução preparada contém 80 g de soluto dissolvidos em 1, 0 L de solução. 1 Introdução às expressões de concentração das soluções aquosas X SAIR

THE NEXT/CID Concentração comum Na. OH (aq) C = 80 g/L Expressa a massa de soluto presente num certo volume de solução. 1 Introdução às expressões de concentração das soluções aquosas X SAIR

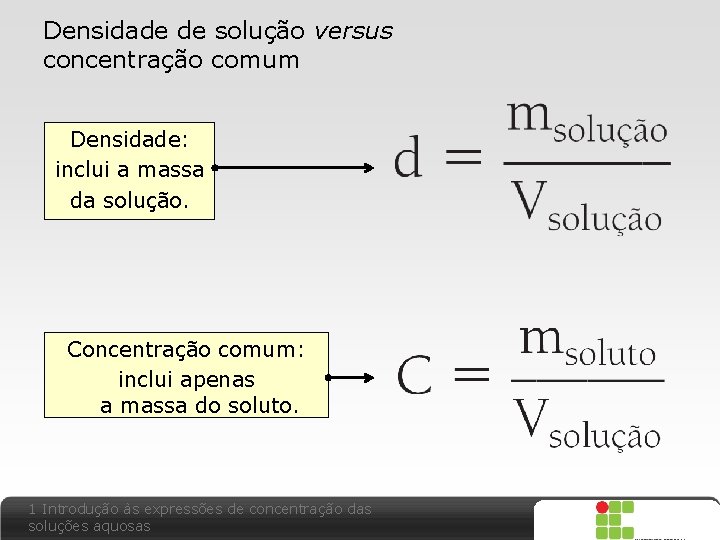
Densidade de solução versus concentração comum Densidade: inclui a massa da solução. Concentração comum: inclui apenas a massa do soluto. 1 Introdução às expressões de concentração das soluções aquosas X SAIR

BRIAN SYTNYK/ MASTERFILE/OTHER-IMAGES Concentração em quantidade de matéria e outras expressões de concentração X SAIR

Concentração em quantidade de matéria e outras expressões de concentração THE NEXT/CID Concentração em quantidade de matéria X SAIR

Relembrando. . . Mol É a quantidade de uma espécie química que contém 6, 02 x 1023 partículas (átomos, moléculas, íons, elétrons, etc). Massa Molar (M ou MM) A massa em g de 1 mol da espécie química. Massa molar atômica Peso atômico Ex: 1 mol de H = 1, 0079 g de H, 1 mol de Fe = 55, 847 g de Fe Massa molar molecular Ex: 1 mol de CO 2 = 44, 01 g de CO 2 1 mol de H 2 O = 18, 0158 g de H 2 O X SAIR

Concentração da solução Concentração Molar (Molaridade) Concentração da solução expressa em mols do soluto por litros do solvente. Solução 1 molar = 1 mol da substância / 1 L de solução ou 1 molar = 1 mmol da substância / 1 m. L de solução X SAIR

Densidade = massa da substância / volume Unidades: (g/m. L) ou (g/cm 3) ou (kg/L) Expressões de resultados analíticos: Relação m/m Amostras sólidas % analito = massa (g) analito x 100 massa (g) amostra Relação m/v % analito = massa (g) analito Amostras líquidas x 100 volume (m. L) amostra Relação v/v % analito = volume (m. L) analito x 100 volume (m. L) amostra X SAIR

Título em massa Expressa a relação entre a massa de soluto e a massa de solução. 2 Concentração em quantidade de matéria e outras expressões de concentração X SAIR

Título em volume Expressa a relação entre o volume de soluto e o volume de solução. 2 Concentração em quantidade de matéria e outras expressões de concentração X SAIR

Porcentagem em massa e em volume Quando o título em massa é expresso em porcentagem, tem-se a porcentagem em massa do soluto na solução. 2 Concentração em quantidade de matéria e outras expressões de concentração X SAIR

Porcentagem em volume Quando o título em volume é expresso em porcentagem, tem-se a porcentagem em volume do soluto na solução. 2 Concentração em quantidade de matéria e outras expressões de concentração X SAIR

Exercícios 1. Calcular a massa em gramas em 1 mol de Ca. SO 4. 7 H 2 O (Ca = 40, 08; S = 32, 06; O = 15, 99; H = 1, 01) R: 262, 14 g/mol 2. Calcular o número de mols em 500 mg de Na 2 CO 3. (Na = 22, 990; C = 12, 011) R: 0, 0047 mol ou 4, 7 x 10 -3 mol 3. Quantos miligramas estão contidos em 0, 250 mmol de Fe 2 O 3? (Fe = 55, 847) R: 39, 923 mg 4. Calcule a concentração , em g/L da solução obtida ao dissolver cloreto de sódio em 50 cm 3 de água? R: 80 g/L 4 g de 5. O soro fisiológico contém 0, 900 g de Na. Cl, em 100 m. L de solução aquosa. Calcule a concentração do sal expressa em mol L -1 ? R: 0, 15 mol L-1 X SAIR

Vamos exercitar mais. . X SAIR

1. Um técnico de análises químicas precisa preparar uma solução de concentração 0, 1 mol/L de Na. OH em um balão volumétrico de 50 m. L a) Qual a massa molar da base (g/mol) M = 0, 1 mol/L b) Qual a massa a ser pesada da base em gramas e em miligramas para preparar essa solução. V = 50 m. L ou 0, 05 L c) Será necessário preparar mais volume de solução (500 m. L), quanto de base devo pesar para obter a mesma concentração de 0, 1 mol/L Na. OH X SAIR

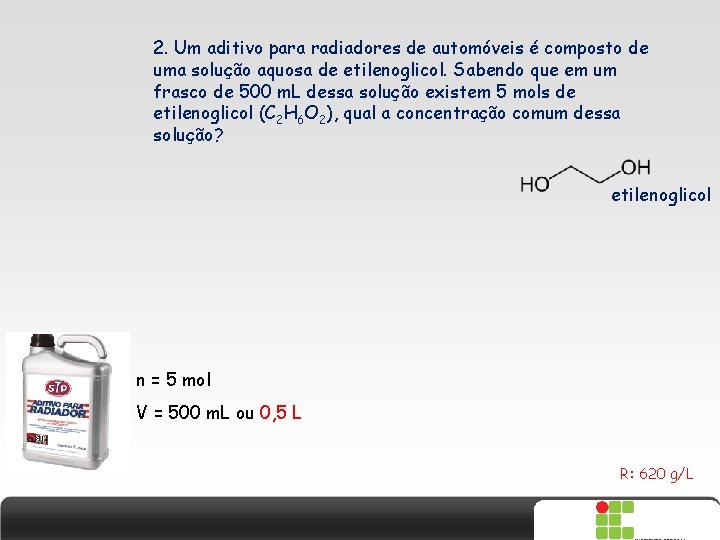
2. Um aditivo para radiadores de automóveis é composto de uma solução aquosa de etilenoglicol. Sabendo que em um frasco de 500 m. L dessa solução existem 5 mols de etilenoglicol (C 2 H 6 O 2), qual a concentração comum dessa solução? etilenoglicol n = 5 mol V = 500 m. L ou 0, 5 L R: 620 g/L X SAIR

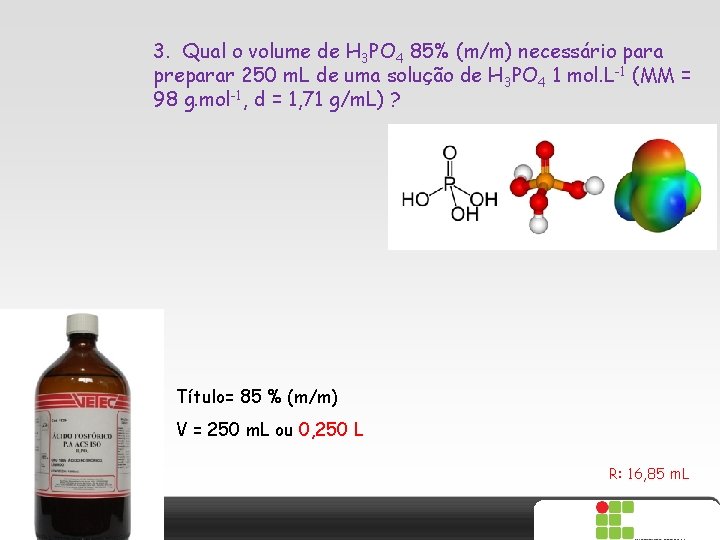
3. Qual o volume de H 3 PO 4 85% (m/m) necessário para preparar 250 m. L de uma solução de H 3 PO 4 1 mol. L-1 (MM = 98 g. mol-1, d = 1, 71 g/m. L) ? Título= 85 % (m/m) V = 250 m. L ou 0, 250 L R: 16, 85 m. L X SAIR

4. Qual a massa de iodeto de potássio para preparar 2 L de uma solução de KI 10% (m/v)? R: 0, 2 kg ou 200 g X SAIR

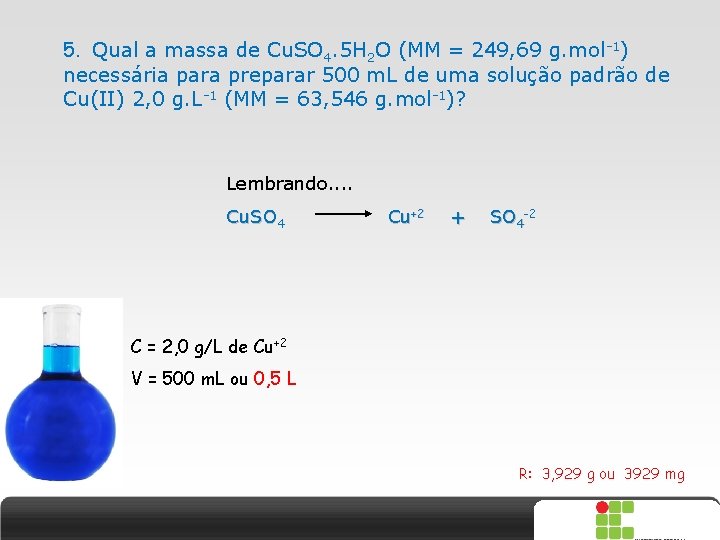
5. Qual a massa de Cu. SO 4. 5 H 2 O (MM = 249, 69 g. mol-1) necessária para preparar 500 m. L de uma solução padrão de Cu(II) 2, 0 g. L-1 (MM = 63, 546 g. mol-1)? Lembrando. . Cu. SO 4 Cu+2 + SO 4 -2 C = 2, 0 g/L de Cu+2 V = 500 m. L ou 0, 5 L R: 3, 929 g ou 3929 mg X SAIR

6. Uma solução de ácido Nítrico tem concentração igual a 126 g/L e densidade igual a 1, 008 g/m. L. Quai as frações molares do soluto e do solvente nessa solução? C = 126 g/L d = 1, 008 g/m. L R: XHNO 3 = 0, 035 ou 3, 5 % XH 2 O = 0, 965 ou 96, 5 % X SAIR

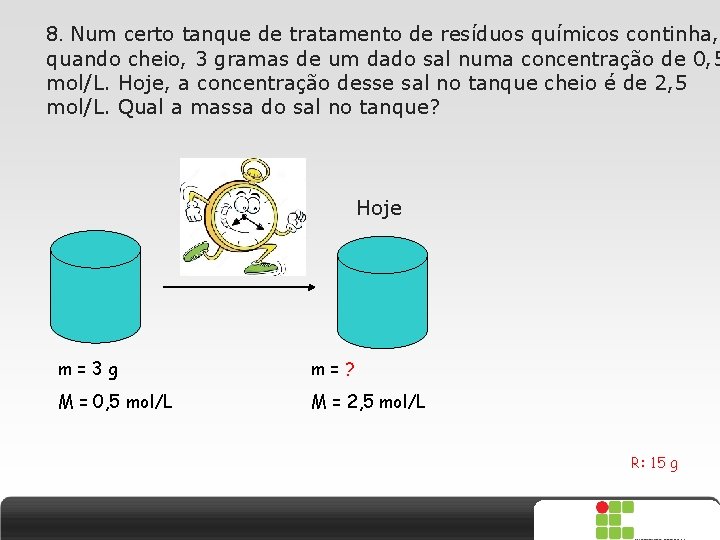
8. Num certo tanque de tratamento de resíduos químicos continha, quando cheio, 3 gramas de um dado sal numa concentração de 0, 5 mol/L. Hoje, a concentração desse sal no tanque cheio é de 2, 5 mol/L. Qual a massa do sal no tanque? Hoje m=3 g m=? M = 0, 5 mol/L M = 2, 5 mol/L R: 15 g X SAIR

9. O soro fisiológico utilizado para limpar lentes de contato é uma solução aquosa de Na. Cl 0, 9 %. Se, em um frasco contendo 100 m. L desse soro, forem adicionados 10, 8 g de Na. Cl, qual será a concentração molar da solução preparada? m = 10, 8 g de Na. Cl M=? Título = 0, 9 % (m/m) V = 100 m. L ou 0, 1 L R: massa final = 10, 8 g M = 1, 85 mol/L X SAIR

Diluição e mistura de soluções X SAIR BRIAN SYTNYK/ MASTERFILE/OTHER-IMAGES

Diluição de soluções Adição de solvente a uma solução I II O pó dissolvido em água. Muito concentrado Acrescenta-se mais água: diluição. Menos concentrado ou mais diluído Diluição de pó em solvente água 3 Diluição e mistura de soluções X SAIR

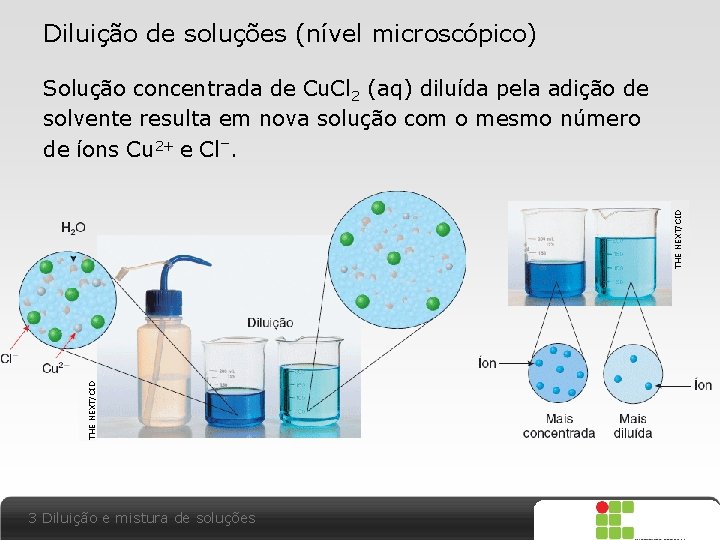
Diluição de soluções (nível microscópico) THE NEXT/CID Solução concentrada de Cu. Cl 2 (aq) diluída pela adição de solvente resulta em nova solução com o mesmo número de íons Cu 2+ e Cl–. 3 Diluição e mistura de soluções X SAIR

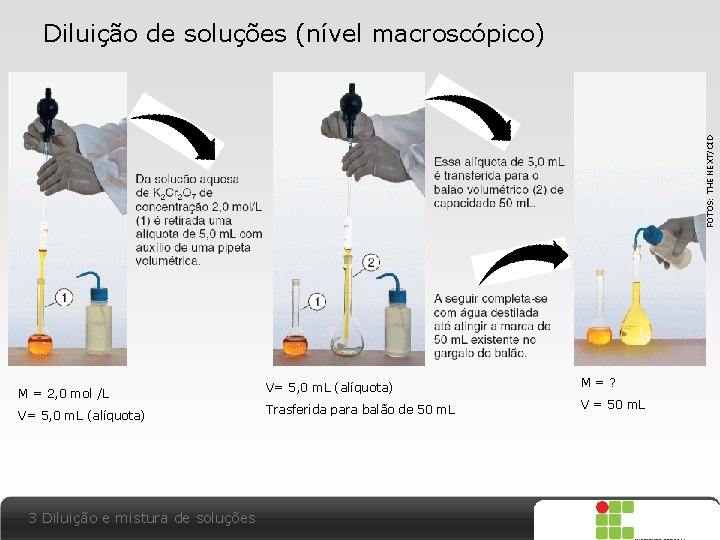
FOTOS: THE NEXT/CID Diluição de soluções (nível macroscópico) M = 2, 0 mol /L V= 5, 0 m. L (alíquota) M=? V= 5, 0 m. L (alíquota) Trasferida para balão de 50 m. L V = 50 m. L 3 Diluição e mistura de soluções X SAIR

Cálculos envolvendo diluição A quantidade de soluto permanece a mesma. 3 Diluição e mistura de soluções X SAIR

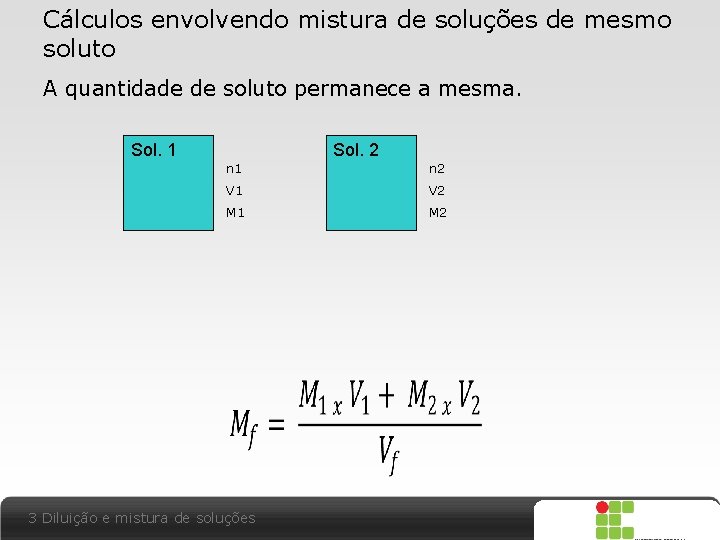
Cálculos envolvendo mistura de soluções de mesmo soluto A quantidade de soluto permanece a mesma. Sol. 1 Sol. 2 n 1 n 2 V 1 V 2 M 1 M 2 3 Diluição e mistura de soluções X SAIR

Cálculos envolvendo mistura de soluções de mesmo soluto 1) Diluição é uma operação muito utilizada no nosso dia-a-dia, quando, por exemplo, preparamos um refresco a partir do suco concentrado. Considere 100 m. L de determinado suco em que a concentração do soluto seja de 0, 4 mol/L. Qual o volume em m. L de água, que deverá ser acrescentado para que a concentração do soluto caia para 0, 04 mol/L? 1) Um volume de 200 m. L de uma solução aquosa de glicose (C 5 H 12 O 6) de concentração igual a 60 g/L foi misturada a 300 m. L de uma solução de glicose de concentração igual a 120 g/L. Determine a concetração em g/L da solução final. 1) Uma solução aquosa 2 mol/L de Na. Cl de volume 50 m. L foi misturada a 100 m. L de uma solução aquosa de Na. Cl 0, 5 mol/L. Calcule a nova concentração da solução. 3 Diluição e mistura de soluções X SAIR
 Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio do trabalho
Ministrio do trabalho Ministrio da fazenda
Ministrio da fazenda Escola profissional de cuba
Escola profissional de cuba Conhecimento profissional
Conhecimento profissional Psicologia aplicada e ética profissional
Psicologia aplicada e ética profissional Planejamento de carreira e sucesso profissional estácio
Planejamento de carreira e sucesso profissional estácio Curtigrama profissional
Curtigrama profissional Responsabilidade profissional enfermagem
Responsabilidade profissional enfermagem Ppgea ufrrj
Ppgea ufrrj Etica profissional
Etica profissional Escola profissional de vouzela
Escola profissional de vouzela O que é destilação fracionada
O que é destilação fracionada Psicologia aplicada e ética profissional
Psicologia aplicada e ética profissional Maurice tardif
Maurice tardif Identidade profissional do professor
Identidade profissional do professor Secretaria de meio ambiente da bahia
Secretaria de meio ambiente da bahia Hoja diaria de consulta externa 2020
Hoja diaria de consulta externa 2020 Cagr ufsc aluno
Cagr ufsc aluno Secretaria de avaliação e gestão da informação
Secretaria de avaliação e gestão da informação Objetivo general de una secretaria
Objetivo general de una secretaria Plano da secretaria da economia criativa
Plano da secretaria da economia criativa Secretaria do estado de santa catarina
Secretaria do estado de santa catarina Secretaria de avaliação e gestão da informação
Secretaria de avaliação e gestão da informação Lenguaje de secretaria
Lenguaje de secretaria Mensagem de secretaria eletronica
Mensagem de secretaria eletronica Sad jose c paz formularios
Sad jose c paz formularios Secretaria upf poblenou
Secretaria upf poblenou Secretaria de salud departamental del valle
Secretaria de salud departamental del valle Sntt
Sntt Secretaria da saude são paulo
Secretaria da saude são paulo Secretaria nacional de portos e transportes aquaviários
Secretaria nacional de portos e transportes aquaviários Impuestos guarne
Impuestos guarne Secretaria regional da agricultura e florestas
Secretaria regional da agricultura e florestas



























































