MINISTRIO DA EDUCAO SECRETARIA DE EDUCAO PROFISSIONAL E







- Slides: 11

MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DE SANTA CATARINA CAMPUS LAGES Modelos Atômicos e o Átomo Prof. Marcel Piovezan marcel. piovezan@ifsc. edu. br Unidade Curricular: Química Geral e experimental I Fase: 1

Modelo de Demócrito e Leucipo toda a matéria era formada por pequenos corpos indivisíveis. Chamaram estes corpos de átomo, que em Demócrito e Leucipo, sugeriram que grego a significa não e tomos significa divisível. - 500 e 1500 d. c, surgiram entre os árabes e europeus, os alquimistas. Seus trabalhos eram obter o elixir da longa vida, imortalidade, pedra filosofal, capaz de tornar qualquer metal em ouro - No século XVIII, nasce a ideia de química como Ciência, com os estudos das Leis Ponderais, Lavoisier e Proust.

Modelo de Dalton - Bolinha maciça e indivisível. Baseado nas Leis Ponderais de Proust e Lavoisier. Postulou. . . I) Todas as substâncias são constituídas de átomos, que não podem ser criados e nem destruídos. II) Cada substância é constituída de um único tipo de átomo. Substância simples ou elementos são formados de “átomos simples”, que são indivisíveis. Substâncias compostas são formadas por “átomos compostos”, capazes de se decompor, em “átomos simples”. III) Todos os átomos de uma mesma substância são idênticos na forma, no tamanho, na massa e nas demais propriedades. A massa de um ”átomo composto” é igual à soma das massas de todos os “átomos simples” componentes. IV) Os “átomos compostos” são formados por um pequeno número de “átomos simples”.

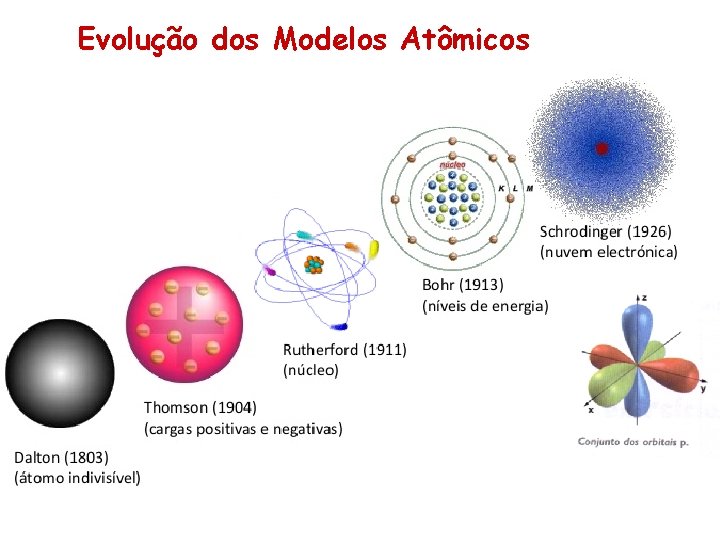
Modelos Atômicos O que é? Os modelos atômicos são teoria baseadas na experimentação feita por cientistas para explicar como é o átomo. Os modelos NÃO existem na natureza. São apenas explicações para mostrar o porquê de um fenômeno. Muitos cientistas desenvolveram suas teorias. Com o passar dos tempos, os modelos foram evoluindo até chegar ao modelo atual. E qual é em 2017?

Evolução dos Modelos Atômicos

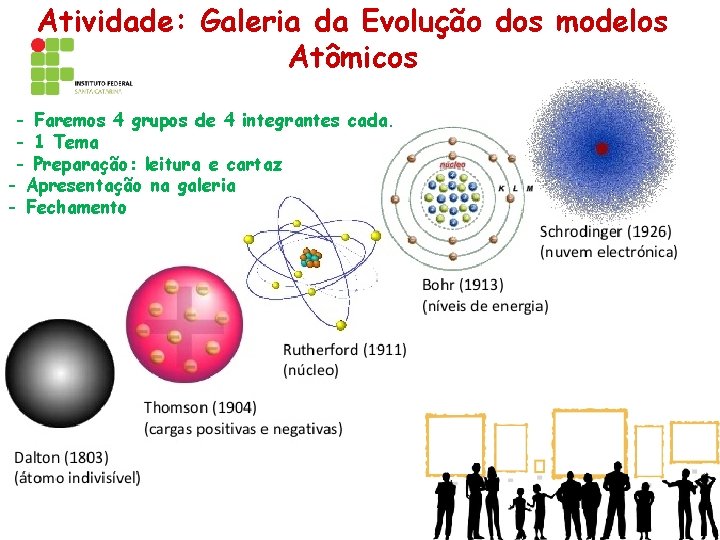
Atividade: Galeria da Evolução dos modelos Atômicos - Faremos 4 grupos de 4 integrantes cada. - 1 Tema - Preparação: leitura e cartaz - Apresentação na galeria - Fechamento

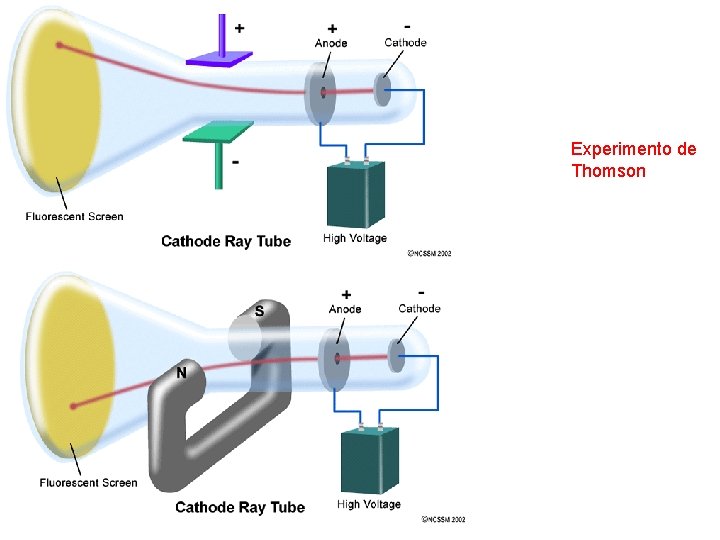
Experimento de Thomson

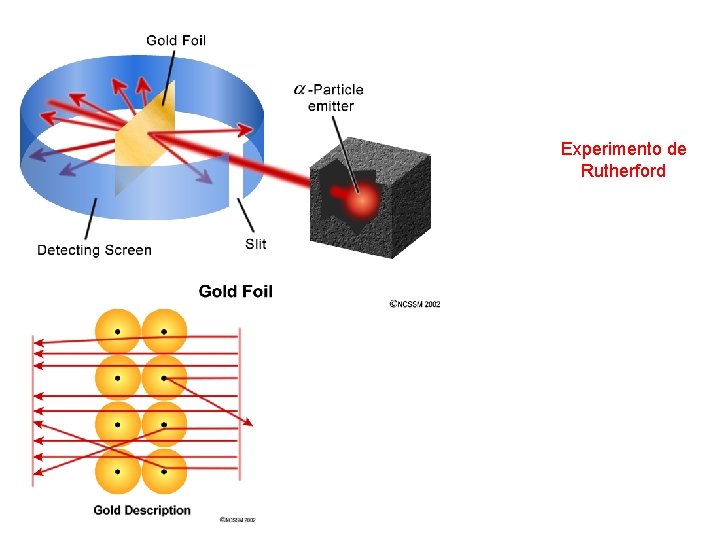
Experimento de Rutherford

EXERCÍCIOS DE FIXAÇÃO 1. Descreva o modelo atômico de Dalton. 2. Descreva o modelo atômico de Thomson. 3. Descreva o modelo atômico de Rutherford. 4. Descreva o modelo atômico de Bohr. 5. Onde estão dispostos os Prótons, Nêutrons e Elétrons? 6. Quando podemos dizer que um átomo “A” qualquer e um átomo “B” qualquer são átomos do mesmo elemento químico? 7. Utilizando uma tabela periódica identifique o nome: 6 elementos com letras iniciais A; 1 elemento com letra inicial I; 5 elementos com letras iniciais B; 4 elementos com letras iniciais F; 3 elementos com letras iniciais M; 2 elementos com letras iniciais Z;

8) O que é um átomo eletricamente neutro? Quando um átomo deixa de ser eletricamente neutro ? 9) O que significa a expressão A = Z + N ? 10) O número atômico de um átomo de nitrogênio é 7 e seu número de massa é 14. Determine o número de prótons, de nêutrons e de elétrons desse átomo. 11) Calcule o número de prótons, de elétrons e de nêutrons do átomo que apresenta: Z = 20 e A = 41. 12) O que são Isótopos, Isótonos e Isóbaros ? 13) Quando 1 ou mais elétrons são removidos de um átomo a partícula resultante é um íon positivo. Explique.

EXERCÍCIOS DE RACIOCÍNIO 13) Três átomos neutros T, Y e R, apresentam, respectivamente, números de massa pares e consecutivos. O número de nêutrons de T é igual ao número de nêutrons de Y, cujo número de prótons é 17/32 vezes o número de massa de R, que tem 16 elétrons e um número de massa igual ao dobro de prótons. Qual é o número de massa e quantos prótons, nêutrons e elétrons tem o átomo T? 14) Os átomos X e Y são isótonos. Se o número atômico de X é igual a 52 e o número de nêutrons de Y é igual a 76, qual é o número de massa de X? 15) São dados três átomos genéricos A, B e C. O átomo A tem número atômico 70 e número de massa 160. O átomo C tem 94 nêutrons, sendo isótopo de A. O átomo B é isóbaro de C e isótono de A. Qual é o número de elétrons do átomo B? 16) São dadas as seguintes informações relativas aos átomos A, B e C: I) A é isóbaro de B e isótono de C. II) B tem número atômico 56, número de massa 137 e é isótopo de C. III) O número de massa de C é 138. Qual é o número atômico de A?
 Ministrio do trabalho
Ministrio do trabalho Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Ministrio da fazenda
Ministrio da fazenda Maurice tardif
Maurice tardif Identidade profissional do professor
Identidade profissional do professor Escola profissional de cuba
Escola profissional de cuba Conhecimento profissional
Conhecimento profissional Psicologia aplicada e ética profissional
Psicologia aplicada e ética profissional Planejamento de carreira e sucesso profissional estácio
Planejamento de carreira e sucesso profissional estácio





















