Metodi gravimetrici di analisi I metodi gravimetrici si



















- Slides: 26

Metodi gravimetrici di analisi

I metodi gravimetrici si basano sulla misura della massa con bilancia analitica, strumento che fornisce dei dati accurati e precisi. Sono essenzialmente di due tipi: • metodi di precipitazione: l’analita viene trasformato in un precipitato scarsamente solubile. Il precipitato viene quindi filtrato e liberato col lavaggio dalle impurità; • metodi di volatilizzazione: l’analita o i suoi prodotti di decomposizione vengono volatilizzati ad una temperatura appropriata.

Metodi di precipitazione Le reazioni utilizzate nell’analisi gravimetrica sono quelle che portano alla formazione di sali scarsamente solubili. In chimica per solubilità si intende la quantità massima di soluto che può sciogliersi in un dato solvente ed è funzione della struttura chimica dei due composti e della temperatura. DIPENDENZA DELLA SOLUBILITA’ DEL SOLVENTE La dipendenza della solubilità di una sostanza dalla natura chimica del solvente può essere riassunta con la regola che il simile scioglie il simile. Infatti, quando un soluto si scioglie in un solvente, le molecole o gli ioni che lo costituiscono vengono circondati dalle molecole di solvente con le quali interagiscono e si definiscono solvatate, o nel caso in cui il solvente sia l’acqua idratate. Si stabiliscono cioè forze attrattive tra soluto e solvente. DIPENDENZA DELLA SOLUBILITA’ DALLA TEMPERATURA • Liquidi non polari come il benzene o il tricloroetilene sono solventi migliori per molecole non polari. • Se si considerano soluti cui siano coinvolti legami a idrogeno, solventi adatti sono quelli che possono garantire la realizzazione di legami a idrogeno con il solvente. Ad esempio il saccarosio si scioglie in acqua ma non in benzene. • I composti ionici sono poco solubili in solventi apolari. Invece la loro solubilità in acqua varia enormemente da caso. PRINCIPIO DI LE CHATELIER Fonte: www. wikipedia. it

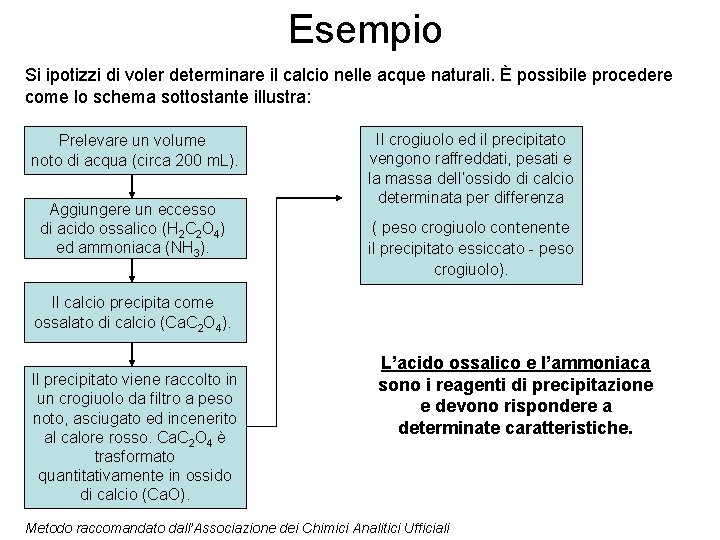
Esempio Si ipotizzi di voler determinare il calcio nelle acque naturali. È possibile procedere come lo schema sottostante illustra: Prelevare un volume noto di acqua (circa 200 m. L). Aggiungere un eccesso di acido ossalico (H 2 C 2 O 4) ed ammoniaca (NH 3). Il crogiuolo ed il precipitato vengono raffreddati, pesati e la massa dell’ossido di calcio determinata per differenza ( peso crogiuolo contenente il precipitato essiccato - peso crogiuolo). Il calcio precipita come ossalato di calcio (Ca. C 2 O 4). Il precipitato viene raccolto in un crogiuolo da filtro a peso noto, asciugato ed incenerito al calore rosso. Ca. C 2 O 4 è trasformato quantitativamente in ossido di calcio (Ca. O). L’acido ossalico e l’ammoniaca sono i reagenti di precipitazione e devono rispondere a determinate caratteristiche. Metodo raccomandato dall’Associazione dei Chimici Analitici Ufficiali

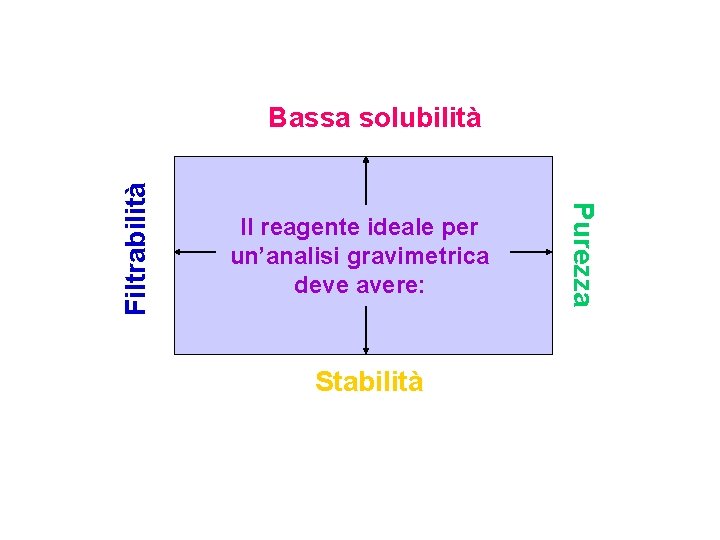
Caratteristiche dei reagenti di precipitazione Idealmente, un agente di precipitazione gravimetrica dovrebbe reagire specificamente con un analita. Inoltre dovrebbe: q essere esente da contaminanti e facilmente filtrabile; q avere una solubilità sufficientemente bassa così da non consentire la perdita del precipitato durante le operazioni di lavaggio; q chimicamente stabile; q di composizione nota dopo essiccamento o, eventualmente, calcinazione. Non sempre tutte queste condizioni sono verificate

Il reagente ideale per un’analisi gravimetrica deve avere: Stabilità Purezza Filtrabilità Bassa solubilità

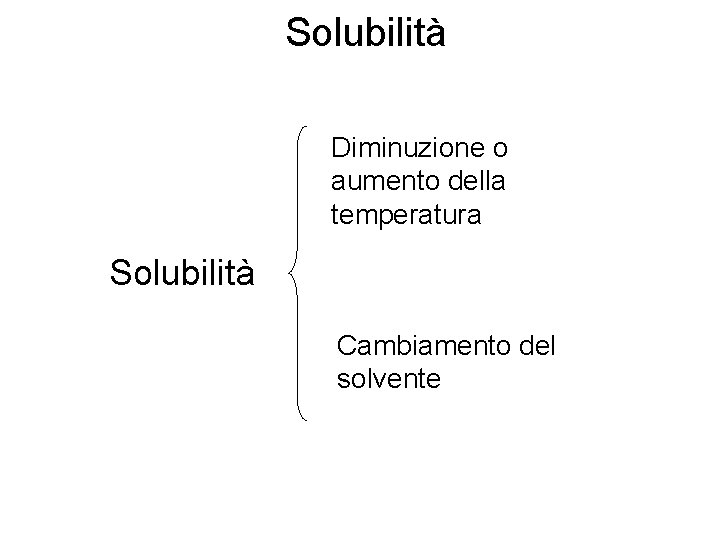
Solubilità Diminuzione o aumento della temperatura Solubilità Cambiamento del solvente

Filtrabilità Cristalli (>0, 10 mm) La filtrabilità è esattamente proporzionale alla dimensione delle particelle. Infatti, i precipitati costituiti da particelle grandi sono in genere preferibili in un’analisi gravimetrica perché più puri, facili da filtrare e da lavare dalle impurità. La dimensione delle particelle varia a seconda dell’esperimento, ad un estremo ci sono le sospensioni colloidali le quali non mostrano alcuna tendenza a depositarsi e quindi non sono facilmente filtrabili. All’altro estremo ci sono le particelle di una sospensione cristallina che tendono, invece, a depositarsi spontaneamente. Colloidi (10 -7 – 10 -4 cm)

PRECIPITATO SOLUZIONE VERA SOLUZIONE COLLOIDALE (effetto Tyndall) Fonte immagini: www. galenotech. org

La dimensione delle particelle è influenzata da diverse variabili sperimentali, quali: • solubilità del precipitato; • temperatura; • concentrazione dei reagenti. L’effetto di tutte queste variabili può essere spiegato ammettendo che la dimensione sia correlata ad una sola proprietà detta supersaturazione relativa. Supersaturazione relativa = Q–S S Dove: Q: concentrazione molare (moli/L) dopo l’aggiunta dei solventi; S: solubilità

In pratica la supersaturazione influenza uno dei meccanismi di precipitazione, che sono la nucleazione e la crescita della particella. Fonte: www. wikipedia. it La nucleazione è il primo stadio della precipitazione e consiste nella formazione di microcristalli stabili, capaci di accrescimento spontaneo, cioè di nuclei di cristallizzazione. Un’ulteriore precipitazione comporta una competizione tra una nucleazione aggiuntiva ed una crescita sui nuclei esistenti (crescita della particella). Se predomina la nucleazione si formerà una soluzione colloidale; se invece predomina la crescita si otterrà un cristallo facilmente filtrabile. Una bassa supersaturazione favorisce l’accrescimento dei microcristalli già formati piuttosto che la formazione di nuovi nuclei. Inoltre favoriscono la formazione di precipitati cristallini le temperature elevate per aumentare la solubilità del precipitato (S), la diluizione delle soluzioni (Q), e la lenta addizione di un agente di precipitazione con un energetico mescolamento.

Purezza Mediante la coprecipitiazione i composti altrimenti solubili vengono rimossi dalla soluzione durante la formazione del precipitato. Esistono quattro tipi di coprecipitazione: • adsorbimento di superficie: avviene uno scambio tra i controioni interferenti adsorbiti sulla superficie del precipitato e gli ioni del liquido di lavaggio; • formazione di cristalli misti: uno degli ioni del reticolo cristallino viene sostituito da uno ione di un altro elemento. Questa tecnica è poco utilizzata; • occlusione meccanica: quando un cristallo si sta rapidamente accrescendo durante la formazione del precipitato, ioni estranei nello strato di controioni possono restare intrappolati (occlusi); • inclusione meccanica: i cristalli rimangono molto ravvicinati durante lo sviluppo. I diversi cristalli si sviluppano assieme e così facendo intrappolano una parte della soluzione in una minuscola sacca.

Stabilità Il reagente di precipitazione deve rimanere a composizione nota dopo che il precipitato viene asciugato e incenerito.

Fasi successive alla precipitazione Dopo la precipitazione, il precipitato necessita del lavaggio, dell’essiccamento e della calcinazione. La scelta di un opportuno liquido di lavaggio è determinata al fine di ridurre il pericolo di adsorbimenti, occlusioni ed inclusioni. Normalmente per effettuare il lavaggi si usano soluzioni di sali di ammonio che, qualora presenti nel precipitato come contaminanti, possono essere eliminati con gli step successivi perché volatili. Successivamente al lavaggio avviene l’essiccamento, cioè un trattamento a 100150°C, in modo che possano essere allontanate le ultime tracce di umidità dal precipitato e che nel successivo stadio di calcinazione, qualora necessario, non si perdano frazioni di precipitato a causa di microesplosioni dovute alla vaporizzazione dell’acqua occlusa. La calcinazione avviene in muffola a temperature massime dell’ordine di 475525°C.

Calcolo dei risultati dei dati gravimetrici = 0, 04045 g Ca/100 m. L

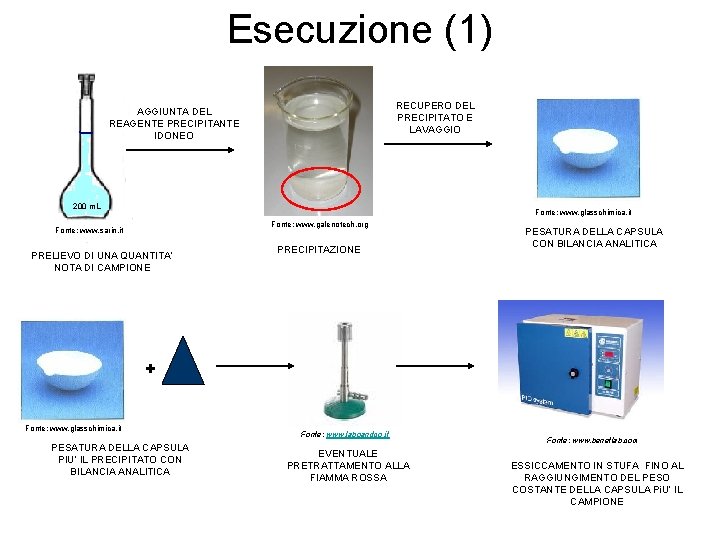
Esecuzione (1) RECUPERO DEL PRECIPITATO E LAVAGGIO AGGIUNTA DEL REAGENTE PRECIPITANTE IDONEO 200 m. L Fonte: www. glasschimica. it Fonte: www. galenotech. org Fonte: www. sarin. it PRELIEVO DI UNA QUANTITA’ NOTA DI CAMPIONE PRECIPITAZIONE PESATURA DELLA CAPSULA CON BILANCIA ANALITICA + Fonte: www. glasschimica. it PESATURA DELLA CAPSULA PIU’ IL PRECIPITATO CON BILANCIA ANALITICA Fonte: www. laboandco. it EVENTUALE PRETRATTAMENTO ALLA FIAMMA ROSSA Fonte: www. benetlab. com ESSICCAMENTO IN STUFA FINO AL RAGGIUNGIMENTO DEL PESO COSTANTE DELLA CAPSULA Pi. U’ IL CAMPIONE

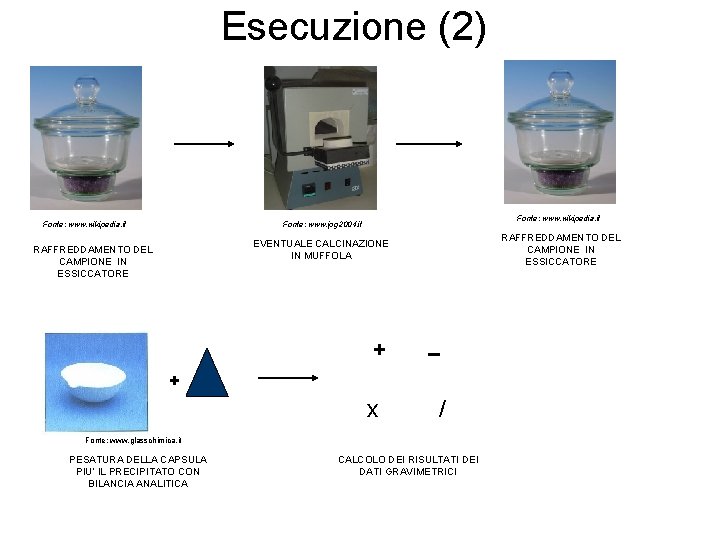
Esecuzione (2) Fonte: www. wikipedia. it Fonte: www. ipg 2004. it RAFFREDDAMENTO DEL CAMPIONE IN ESSICCATORE EVENTUALE CALCINAZIONE IN MUFFOLA RAFFREDDAMENTO DEL CAMPIONE IN ESSICCATORE + − + x / Fonte: www. glasschimica. it PESATURA DELLA CAPSULA PIU’ IL PRECIPITATO CON BILANCIA ANALITICA CALCOLO DEI RISULTATI DEI DATI GRAVIMETRICI

Analisi gravimetriche rappresentative

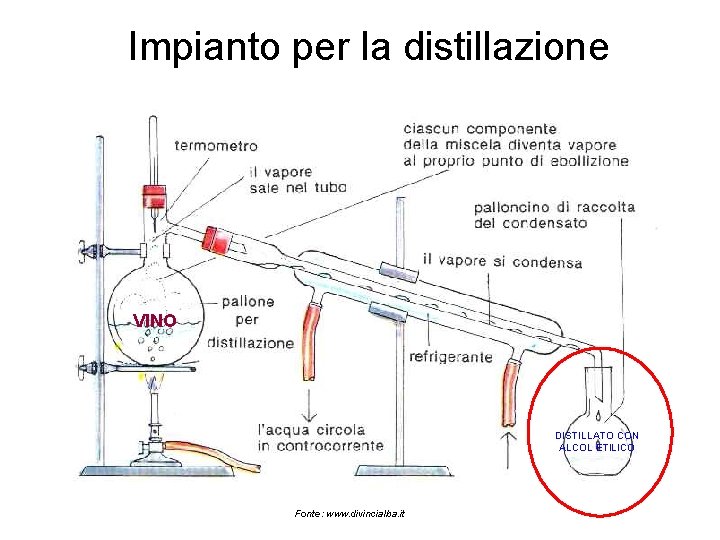
Metodi di volatilizzazione Il metodo gravimetrico più comune basato sulla volatilizzazione è quello dell’etanolo nel vino. Infatti, la determinazione della gradazione alcolica è effettuata previa distillazione del vino e successiva determinazione del peso specifico (con bilancia idrostatica) della soluzione idroalcolica ottenuta. Apposite tabelle (di Reichard) permettono di risalire alla gradazione alcolica. Maggiore è il tenore alcolico del vino, più basso sarà il peso specifico del distillato. Questo metodo è ufficiale ed è utilizzato per determinare il tenore alcolico di birra e acquaviti. È da sottolineare che in genere, il risultato è leggermente superiore all’effettivo titolo alcolometrico volumico in quanto, assieme all’etanolo distillano altri alcoli e sostanze volatili.

Impianto per la distillazione VINO DISTILLATO CON ALCOL ETILICO Fonte: www. divincialba. it

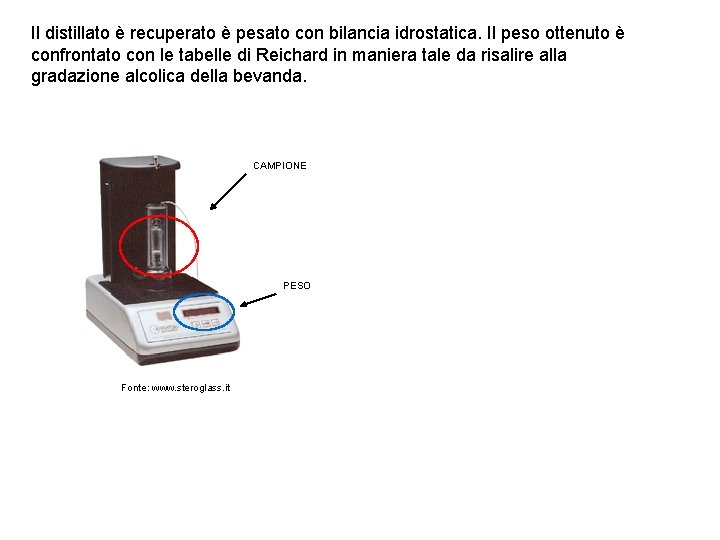
Il distillato è recuperato è pesato con bilancia idrostatica. Il peso ottenuto è confrontato con le tabelle di Reichard in maniera tale da risalire alla gradazione alcolica della bevanda. CAMPIONE PESO Fonte: www. steroglass. it

H 2 O L’acqua è il composto più diffuso in natura, rappresenta il componente principale di tutti i sistemi biologici e degli alimenti fatta eccezione per alcuni prodotti come i cereali e derivati, i semi delle leguminose e lo zucchero.

Acqua in alcuni alimenti Alimento Acqua (%) Farina di frumento 14, 2 Luccio 79, 0 Piselli secchi 13, 0 Ricotta vaccina 75, 7 Piselli freschi crudi 79, 4 Scamorza 44, 9 Albicocche fresche 86, 3 Parmigiano 30, 4 Carne bovina 71, 6 Olio extravergine di oliva 0, 0 Mitili 82, 1 Vino 89, 8

Determinazione dell’acqua negli alimenti solidi 1. Portare “a bolla” la bilancia analitica (tutte le operazioni elencate vanno effettuate con questo tipo di bilancia) ed assicurarsi che il piatto sia pulito; 2. stabilizzare la capsula di porcellana in stufa per un paio di ore, lasciarla raffreddare in essiccatore e pesarla di tanto in tanto fino a che non raggiunge un peso costante. Annotare il peso esatto; 3. intanto pesare circa 5 g. di campione solido e sminuzzarlo con un blender. Annotare il peso esatto; 4. quando la capsula è arrivata a peso costante, inserire all’interno il campione solido ed annotare il peso esatto; 5. portare in stufa la capsula, settata a temperature differenti a seconda del campione analizzato ed essiccare fino a che il peso non diventa stabile. Ricordarsi che ogni volta che si intende pesare il campione, esso va dapprima raffreddato in essiccatore in maniera tale da ridurre al minimo l’assorbimento di umidità dall’ambiente esterno. N. B. la capsula ed il campione vanno maneggiati con pinze o tamponi per le dita per evitare che prendano umidità.

Calcolo dei risultati Si ipotizzi di aver pesato circa 5, 2352 g di pesca, e che il crogiuolo vuoto stabilizzato pesi 25, 6000 gr. Al termine dell’essiccazione il peso del crogiuolo più il campione era di 26, 3825 gr. Calcolare l’umidità assoluta ed il contenuto umido del campione. Peso iniziale = 25, 6000 g + 5, 2352 g = 30, 8352 g Peso acqua contenuta in 5 g di campione = 30, 8352 g – 26, 3825 g = 4, 4527 g Umidità assoluta 1 = 4, 4527 x 100 5, 2352 = 85, 05 g / 100 g di alimento Peso sostanza secca contenuta in 5 g di campione = 5, 2352 g – 4, 4526 g = 0, 7826 g Contenuto umido 2 = 4, 4527 g / 0, 7826 g = 5, 67 1. umidità assoluta (g H 2 O/100 g di alimento) = quantità di acqua presente nell’ alimento 2. contenuto umido (g. H 2 O/g. SS) = quantità di acqua (g H 2 O) presente nell’alimento riferita all’unità di sostanza secca (g. SS)

Bibliografia e sitografia • Douglas A. Skoog, Donald M. West F. James Holler; Chimica analitica una introduzione; edizioni Edi. Ses • www. wikipedia. it • http: //www. fdf. unict. it/arearis/Upload/Doc_21/Gravimetria. pdf • http: //www. good-weighing-practice. com
 Metodi gravimetrici
Metodi gravimetrici Huquq fanidan ochiq dars ishlanmasi
Huquq fanidan ochiq dars ishlanmasi Pentola di koch
Pentola di koch Legge di lambert beer
Legge di lambert beer Metodi e tecniche del servizio sociale slide
Metodi e tecniche del servizio sociale slide Ko'phadni ko'phadga ko'paytirish
Ko'phadni ko'phadga ko'paytirish Curva riscaldamento miscuglio
Curva riscaldamento miscuglio Tushunchalar tahlili
Tushunchalar tahlili Talim vositalari
Talim vositalari Baliq skeleti metodi
Baliq skeleti metodi Holat fellari
Holat fellari Biologiya fanlar sistemasi
Biologiya fanlar sistemasi Shina topologiyasi
Shina topologiyasi Ta'lim metodlari va usullari
Ta'lim metodlari va usullari Loyihalash metodi
Loyihalash metodi Faoliyatni tashkil etish metodlari
Faoliyatni tashkil etish metodlari Metodi sotirov
Metodi sotirov Disegno di ricerca longitudinale
Disegno di ricerca longitudinale Huquqiy tarbiyaning maqsad va vazifalari
Huquqiy tarbiyaning maqsad va vazifalari Fenomeni collettivi esempi
Fenomeni collettivi esempi Metodi di separazione dei miscugli esempi
Metodi di separazione dei miscugli esempi Schema bilancio consolidato
Schema bilancio consolidato Akvarium metodi haqida
Akvarium metodi haqida Ditaktika nima
Ditaktika nima Radiatsion gigiyena
Radiatsion gigiyena Foydalanilgan adabiyotlar tarix
Foydalanilgan adabiyotlar tarix Yozuv darsi dars ishlanmasi
Yozuv darsi dars ishlanmasi