METODI DI ANALISI CHIMICHE SU MOSTO E VINO





















- Slides: 24

METODI DI ANALISI CHIMICHE SU MOSTO E VINO LABORATORIO DI ENOLOGIA

DETERMINAZIONE DELLA ACIDITA TOTALE DI UN VINO • Misura la quantità di acidi liberi presenti nel mosto o nel vino. Gli acidi misurati sono i seguenti: tartarico, malico, citrico, lattico, succinico, acetico, e altri acidi minori. • Corrisponde alla somma degli acidi titolabili quando si neutralizza perfettamente il mosto o il vino mediante aggiunta di una soluzione alcalina a concentrazione nota. • Le titolazioni di acidi deboli eseguite con basi forti, come nel caso dei mosti e dei vini, presentano il punto di equivalenza spostato verso valori alcalini (p. H≅9). In queste condizioni però, si possono avere interferenze da parte di altri composti, in particolare da parte dei polifenoli, che si comportano da acidi debolissimi. Per queste ragioni è stato scelto come punto di equivalenza convenzionale il p. H=7. • La CO 2 e l’SO 2, combinata e libera, non sono comprese nell’acidità totale.

DETERMINAZIONE DELLA ACIDITA TOTALE DI UN VINO • Prima della vendemmia: - il dosaggio dell’acidità totale, associato a quello degli zuccheri, permette di controllare l’evoluzione della maturazione dell’uva. • Sul mosto e sul vino permette di: - prevedere le possibili correzioni da fare (disacidificazione, acidificazione) - di favorire o di impedire la fermentazione malolattica • Durante la maturazione del vino l’acidità diminuisce sotto l’effetto di: - fermentazione malolattica - precipitazioni tartariche (dipende dal titolo alcolimetrico; dalla temperatura)

MATERIALE OCCORENTE • Buretta graduata da 50 ml; • Imbuto per buretta; • Beuta da 250 ml; • Pipetta graduata o tarata da 10 ml e relativo propipetta; • Becher da 100 ml da utilizzare per il processo di decarbonizzazione; • Pinza d’acciaio; • Becher da 100 ml contenente la soluzione titolante: Na. OH 0, 1 Molare;

MATERIALE OCCORENTE • Becher da 50 ml utilizzato per lo scarto di Na. OH durante le fasi di avvinamento e azzeramento della buretta; • Becher da 100 ml utilizzato per versare il campione da prelevare mediante pipetta; • Spruzzetta contenente acqua distillata; • Carta Assorbente; • Cartina tornasole;

REAGENTI • Diversi campioni di vino assegnati ad ogni gruppo. I campioni si troveranno in matracci tarati da 100 ml e saranno numerati con numerazione progressiva. • Soluzione titolante a concentrazione nota di Na. OH 0, 1 Molare • Indicatore: soluzione alcoolica al 4% di Blu di Bromotimolo

PREPARAZIONE DELLA BURETTA • Preparazione della Buretta: - Verificare l’integrità della buretta - Verificare la tenuta del rubinetto, e nello stesso tempo il non eccessivo attrito della sua rotazione. Nel caso possiamo intervenire chiudendo o aprendo leggermente il dado del rubinetto - Avvinare prima dell’esecuzione dell’esperienza con soluzione titolante che deve essere poi scartata; - Dopo avere riempito la buretta, verificare l’assenza di bolle d’aria, che possono rimanere soprattutto all’interno della punta. Se ve ne fossero aprire e chiudere velocemente il rubinetto per rimuoverle.

PREPARAZIONE DELLA BURETTA - Riempire la buretta con la soluzione titolante superando leggermente la tacca di taratura dello zero - Azzerare la buretta avendo cura che si formi esattamente un menisco che appoggi sulla tacca di taratura dello 0. - Durante la titolazione, eseguire le aggiunte con una velocità non superiore a 0. 3 -0. 4 m. L/sec (ovvero 1 m. L ogni 3 sec), come visto per le pipette. - Se si forma una goccia pendente sulla punta della buretta, è necessario farla cadere nella beuta e recuperarla lavando le pareti con dell’acqua distillata.

PREPARAZIONE DEL CAMPIONE: LA DECARBONIZZAZIONE • Prima di procedere con l’analisi volumetrica il campione deve essere sottoposto ad opportuno trattamento per l’eliminazione della CO 2 presente in esso • L’eliminazione può avvenire mediante diversi metodi: - Mediante filtrazione a vuoto del campione; - Mediante riscaldamento del campione fino a 70°/80°C. Metodica utilizzata nel caso di analisi di vini in fermentazione, spumanti o frizzanti. - Mediante riscaldamento del campione in becher su fiamma ossidante del bunsen per 3 o 4 secondi

LA DECARBONIZZAZIONE • Versare nel becher all’incirca 25 -30 ml del campione; • Come da immagine utilizzare le pinze d’acciaio per tenere il becher e posizionarlo sulla fiamma ossidante del bunsen per 3 -4 secondi; • Togliere il becher dalla fiamma e appoggiarlo delicatamente sul bancone;

PREPARAZIONE DEL CAMPIONE IN BEUTA • Dopo aver atteso qualche secondo che il campione si sia raffreddato prelevare con una pipetta 10 ml di campione e versarli nella beuta da 250 ml • Alcuni consigli per il corretto uso delle pipette: - Mantenere la pipetta ad una pendenza di circa 45 gradi o poco più, tenendo con una mano la propipetta e con l’altra mano la parte terminale della pipetta o il contenitore dove si sta erogando. - Nel caso si utilizzino pipette tarate non toccare la parte centrale rigonfiata della pipetta per non scaldare il vetro e quindi variare il suo volume nominale.

PREPARAZIONE DEL CAMPIONE IN BEUTA - Aspirare la soluzione da erogare, fino a superare di poco la tacca di taratura. Far scendere il livello toccando con la punta la parete di un becher di scarto, fino a quando il menisco è tangente la tacca. - Spostare la punta della pipetta sul recipiente dove si deve erogare la soluzione appena prelevata e tenendo la punta sempre appoggiata alla parete, erogare. La velocità di erogazione non deve superare 0. 30. 4 m. L/sec (ovvero 1 m. L ogni 3 sec), poiché in caso contrario si formerebbe sulle pareti un velo di soluzione che viaggia più lentamente del resto del liquido, e che quindi non verrebbe erogato. - Il volume rimasto in punta al termine dell’erogazione non va espulso soffiando

LA TITOLAZIONE • Immergere con l’aiuto di una pinzetta una striscia di cartina tornasole nella beuta. Estrarre la cartina tornasole adagiarla su un pezzo di carta assorbente e annotare il valore registrato. • Aggiungere nella beuta 3 -4 gocce dell’indicatore soluzione alcoolica al 4% di blu di bromotimolo. Il vino presente nella beuta assumerà una colorazione : arancione carico;

LA TITOLAZIONE • Durante la titolazione, eseguire le aggiunte con una velocità non superiore a 0. 3 -0. 4 m. L/sec (ovvero 1 m. L ogni 3 sec), come visto per le pipette. • Quando il campione all’interno della beuta ha assunto la colorazione rosso - viola chiudere il rubinetto e misurare il p. H con un altro pezzo di cartina tornasole utilizzando la stessa procedura prima illustrata. • Aggiungere a questo punto l’Na. OH goccia a goccia fino ad ottenere un colore azzurro-violaceo. Anche in questo caso andiamo a misurare e annotare il p. H rilevato con la cartina tornasole.

RACCOLTA DATI • Raccogliamo in una tabella come la seguente i valori registrati durante le varie prove Numero Titolazione 1 Titolazione 2 Titolazione 3 Titolazione 4 ml di Na. OH 0, 1 Molare consumati

REAZIONI E CALCOLI • Effettuare la media dei volumi di Na. OH utilizzati. Nel caso sia presente un valore che si discosta eccessivamente dagli altri non considerarlo nel calcolo della media. • A questo punto occorre prendere in considerazione sia la reazione alla base della titolazione sia la modalità con cui viene espresso il valore. • Il valore dell’acidità totale può essere espresso in uno dei seguenti modi: • meq/l di acido solforico o acido tartarico. • g/l di acido solforico o acido tartarico.

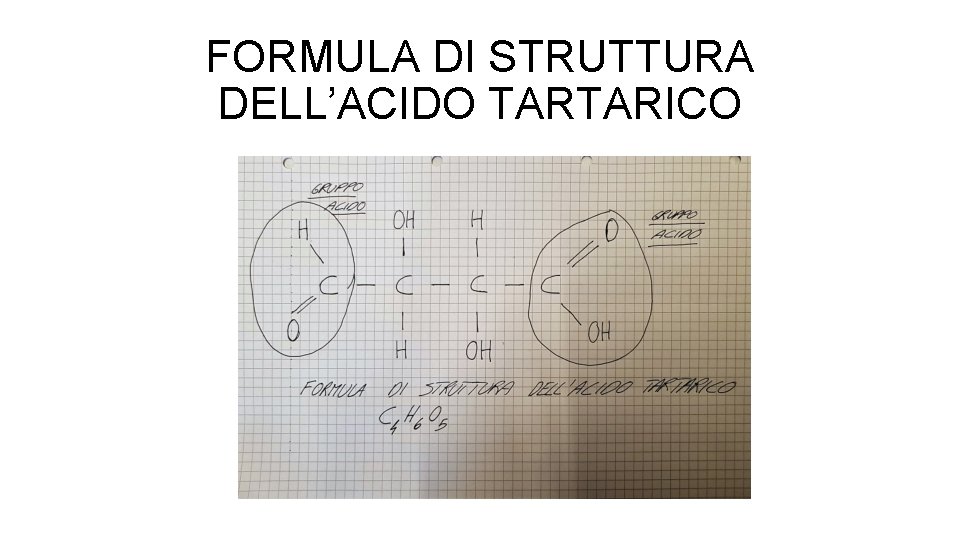
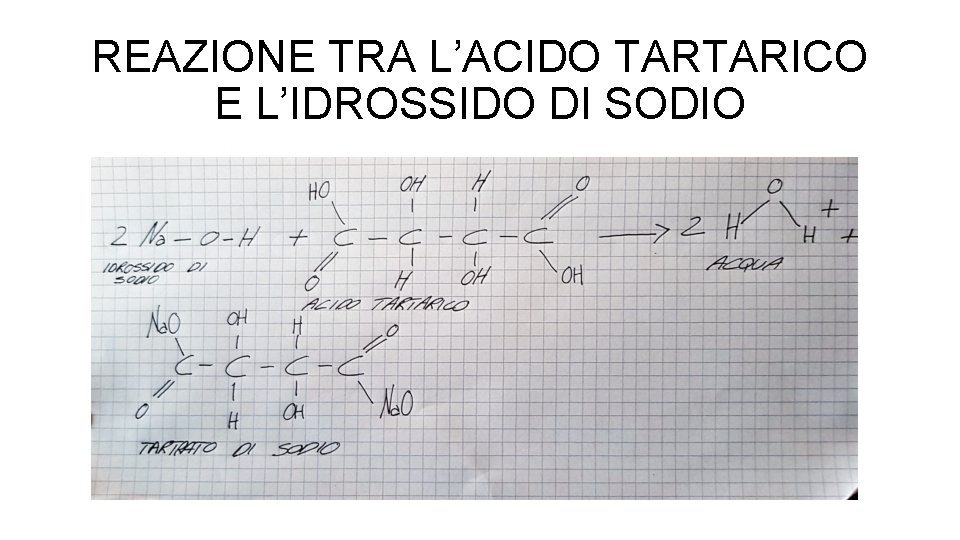
REAZIONI E CALCOLI • Il nostro valore verrà espresso come g/l di acido tartarico • La reazione che è alla base della titolazione è la seguente: 2 Na. OH + C 4 H 6 O 6 C 4 H 4 O 6 Na 2 + 2 H 2 O • Per cui: • Per neutralizzare una mole di acido tartarico (C 4 H 6 O 6) ci vogliono due moli di Idrossido di Sodio (Na. OH). • I prodotti della reazione sono una mole di tartrato di sodio (C 4 H 4 O 6 Na 2) e due moli di acqua (H 2 O)

FORMULA DI STRUTTURA DELL’ACIDO TARTARICO

REAZIONE TRA L’ACIDO TARTARICO E L’IDROSSIDO DI SODIO

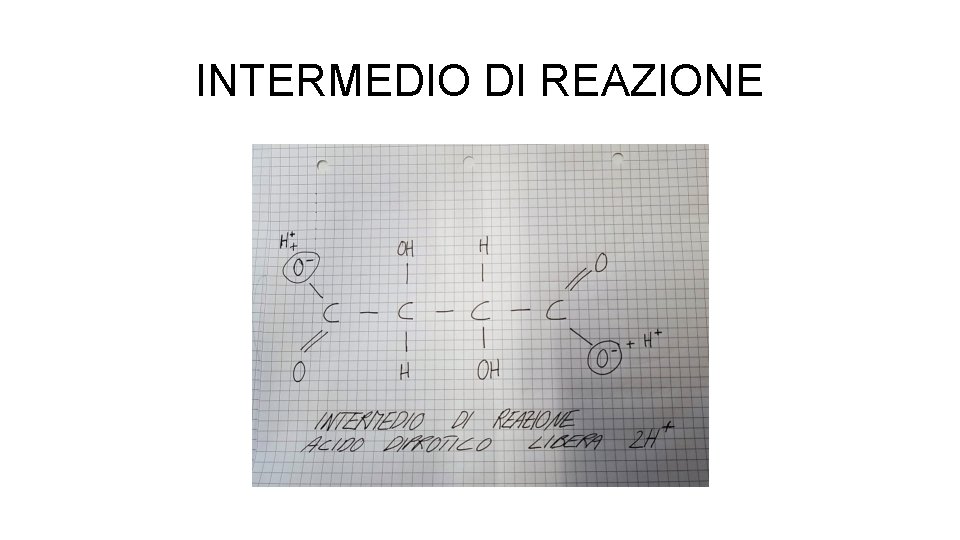
INTERMEDIO DI REAZIONE

CALCOLI •

CALCOLI •

INTERPRETAZIONE DEL RISULTATO • E’ fondamentale definire dei valori medi di acidità totale e di p. H nei vini prima di introdurre termini quali “basso”, “elevato”, “sostenuto” ecc. • Possiamo affermare che l’acidità media di un vino può essere compresa tra 4, 5 – 8 g/l di acido tartarico ed il p. H può essere compreso tra 3 e 4. • Più alto è il valore di acidità, più basso è il p. H , più l’acidità è bassa più il p. H è alto. • Il p. H gioca un ruolo fondamentale in enologia anche ai fini della selezione microbica durante la fermentazione alcolica in quanto intorno al valore 3 si adattano e lavorano meglio i lieviti, mentre intorno al 4 sono anzitutto i batteri che trovano un ambiente favorevole al proprio sviluppo. • ; .

INTERPRETAZIONE DEL RISULTATO • Per quanto riguarda i vini rossi va aggiunto che ben sopportano acidità più basse e p. H più alti in quanto i composti fenolici in essi contenuti ne accentuano il gusto acido e contribuiscono ancor più alla loro tenuta nel tempo. Ovviamente, per il loro reale potenziale evolutivo contribuiscono alla causa anche l’alcol ed i polifenoli totali. • Per i vini bianchi la tendenza attuale è quella di preservare l’acido malico per garantire al vino una maggiore freschezza e giovinezza, mentre per i vini rossi nella maggior parte dei casi viene fatta svolgere ad opera dei batteri lattici la cosiddetta fermentazione malolattica, che altro non è che la trasformazione dell’acido malico in acido lattico: per ogni grammo di malico si generano 0, 67 circa di lattico, quindi assistiamo ad un calo del contenuto di acidità e soprattutto al cambiamento della qualità sensoriale, in quanto l’acido lattico è un acido che potremmo definire più “dolce” o “morbido”.
 Analisi chimiche vino
Analisi chimiche vino Reazioni chimiche esempi
Reazioni chimiche esempi Trasformazioni fisiche e chimiche zanichelli
Trasformazioni fisiche e chimiche zanichelli Reazione chimica esempi
Reazione chimica esempi Dalle trasformazioni chimiche alla teoria atomica
Dalle trasformazioni chimiche alla teoria atomica Mappe concettuali reazioni chimiche
Mappe concettuali reazioni chimiche Le reazioni chimiche zanichelli capitolo 14
Le reazioni chimiche zanichelli capitolo 14 Capitolo 16 zanichelli chimica
Capitolo 16 zanichelli chimica Reazioni di sintesi
Reazioni di sintesi Le leggi ponderali zanichelli
Le leggi ponderali zanichelli Dalla materia all'atomo soluzioni capitolo 3
Dalla materia all'atomo soluzioni capitolo 3 Industrie chimiche forestali
Industrie chimiche forestali Trabalenguas de vino
Trabalenguas de vino Cadena de valor del vino
Cadena de valor del vino El hijo del hombre come y bebe
El hijo del hombre come y bebe Cuando vino el cumplimiento del tiempo dios envio a su hijo
Cuando vino el cumplimiento del tiempo dios envio a su hijo Calcolo montegradi vino
Calcolo montegradi vino Zipz wine vs copa de vino
Zipz wine vs copa de vino Mvve
Mvve San juan 1-11
San juan 1-11 Drz ma blizsie sam den co den
Drz ma blizsie sam den co den Vino malvasia griego
Vino malvasia griego Estratto secco del vino
Estratto secco del vino Con el vino de jerez y el vinillo de rioja
Con el vino de jerez y el vinillo de rioja Jesus vino a dividir
Jesus vino a dividir