Metodi di dosaggio di proteine Studentessa Federica Esposito

























- Slides: 47

Metodi di dosaggio di proteine Studentessa: Federica Esposito matr 574/424 Anno accademico: 2008/09

Per poter quantizzare la proteina di interesse è necessario disporre di un opportuno saggio che : • consenta di seguire la proteina durante i vari passaggi di purificazione • sia eseguibile rapidamente su molti campioni • sia eseguibile su piccola quantità della proteina desiderata • indichi in maniera affidabile la quantità della proteina

Spettrofotometria

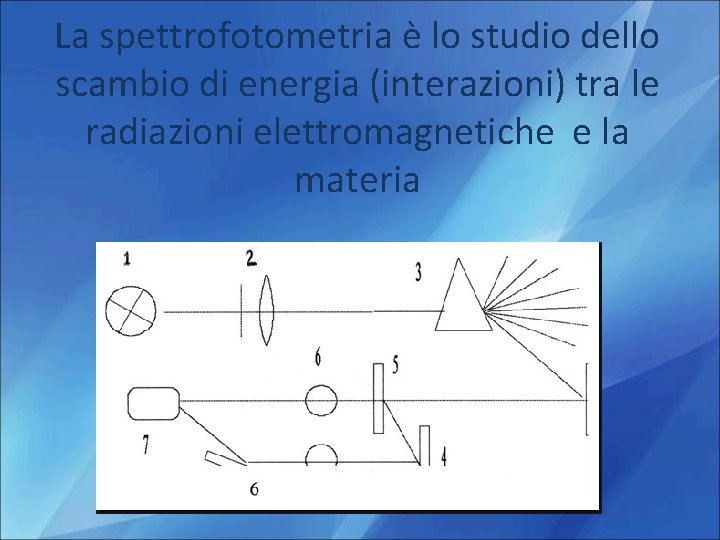
La spettrofotometria è lo studio dello scambio di energia (interazioni) tra le radiazioni elettromagnetiche e la materia

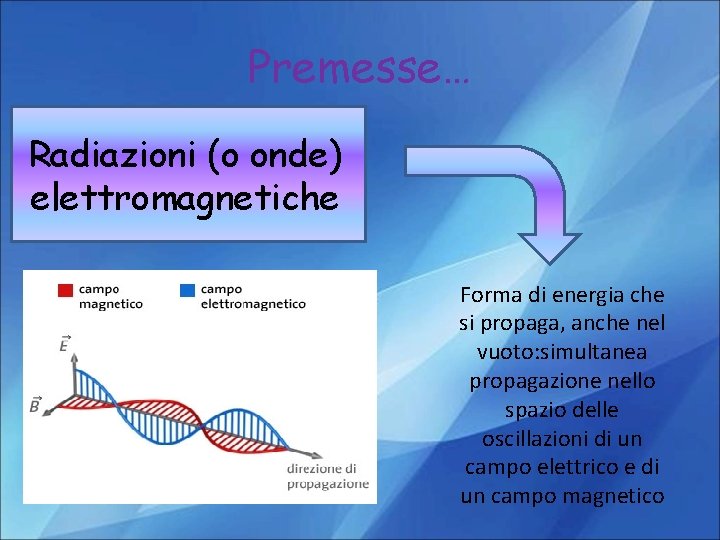
Premesse… Radiazioni (o onde) elettromagnetiche Forma di energia che si propaga, anche nel vuoto: simultanea propagazione nello spazio delle oscillazioni di un campo elettrico e di un campo magnetico

Ogni radiazione è caratterizzata dai seguenti parametri: Frequenza: V - Numero di vibrazioni nell’unità di tempo - Si misura in sec-1, chiamati Hertz (Hz) Periodo: T - tempo occorrente per compiere una oscillazione completa - è l’inverso della frequenza (T=1/V) e si misura in sec Si legge ‘’ni’’ Lunghezza d’onda: l - distanza tra 2 punti adiacenti in fase (ad Si legge ‘’ lambda’’ esempio tra 2 massimi consecutivi - si misura in m, micron, nanometri, ampere

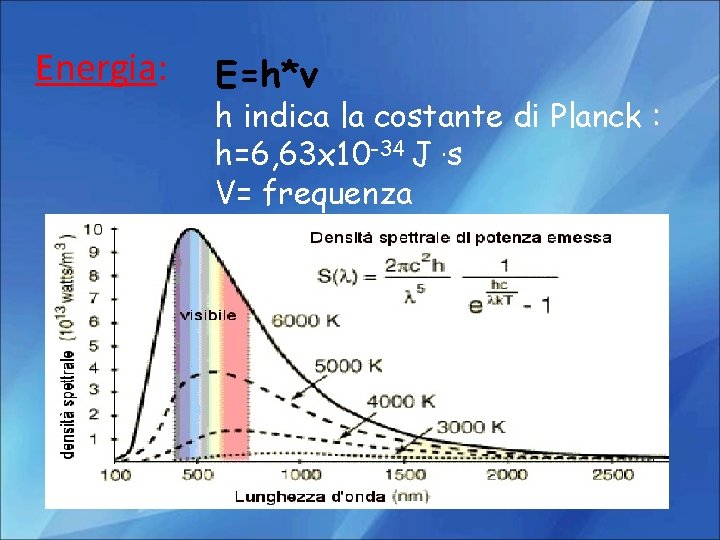
Energia: E=h*v h indica la costante di Planck : h=6, 63 x 10 -34 J. s V= frequenza

Diversi tipi di radiazioni (differiscono tra di loro per la lunghezza d’onda)

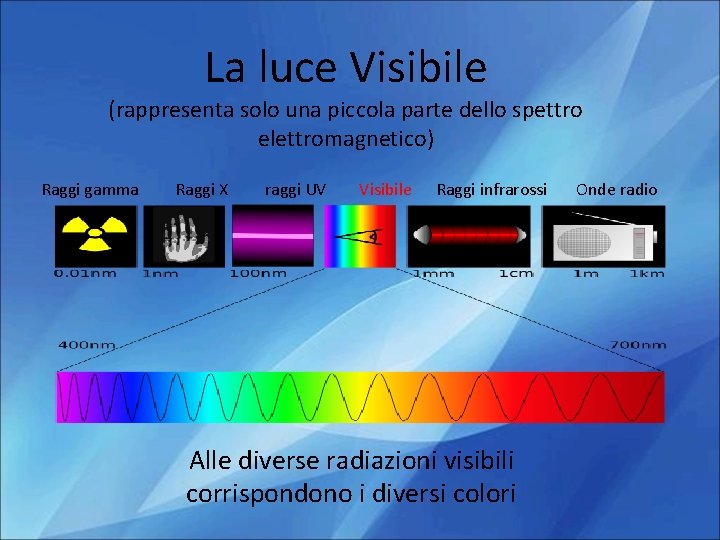
La luce Visibile (rappresenta solo una piccola parte dello spettro elettromagnetico) Raggi gamma Raggi X raggi UV Visibile Raggi infrarossi Alle diverse radiazioni visibili corrispondono i diversi colori Onde radio

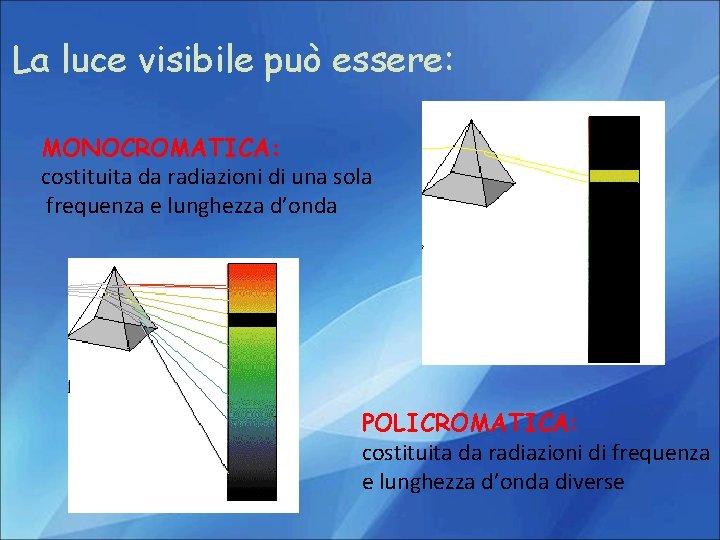
La luce visibile può essere: MONOCROMATICA: costituita da radiazioni di una sola frequenza e lunghezza d’onda POLICROMATICA: costituita da radiazioni di frequenza e lunghezza d’onda diverse

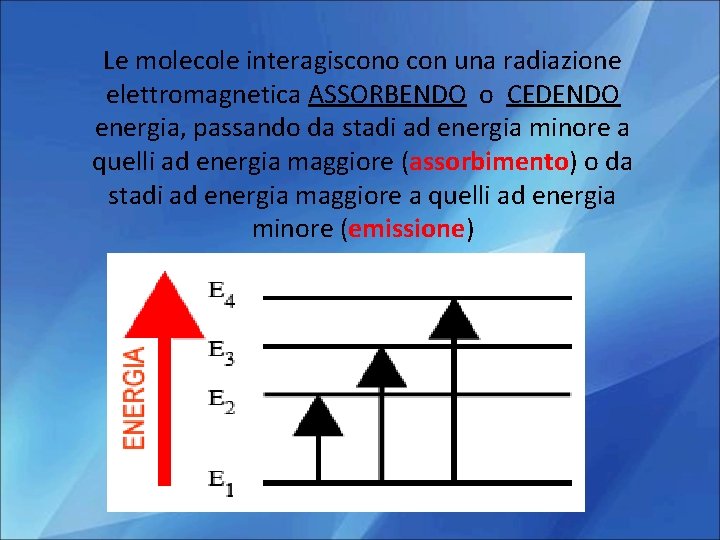
Le molecole interagiscono con una radiazione elettromagnetica ASSORBENDO o CEDENDO energia, passando da stadi ad energia minore a quelli ad energia maggiore (assorbimento) o da stadi ad energia maggiore a quelli ad energia minore (emissione)

Dall’energia assorbita od emessa sotto forma di radiazione si possono ricavare informazioni strutturale e/o analitiche Informazioni qualitative Natura della sostanza in esame Informazioni quantitative Quantità della sostanza in esame

Le determinazioni quantitative sono basate sul fatto che, quando una radiazione attraversa una soluzione, viene assorbita più o meno intensamente a seconda della concentrazione Lo strumento utilizzato per misurare l’assorbimento è lo spettofotometro

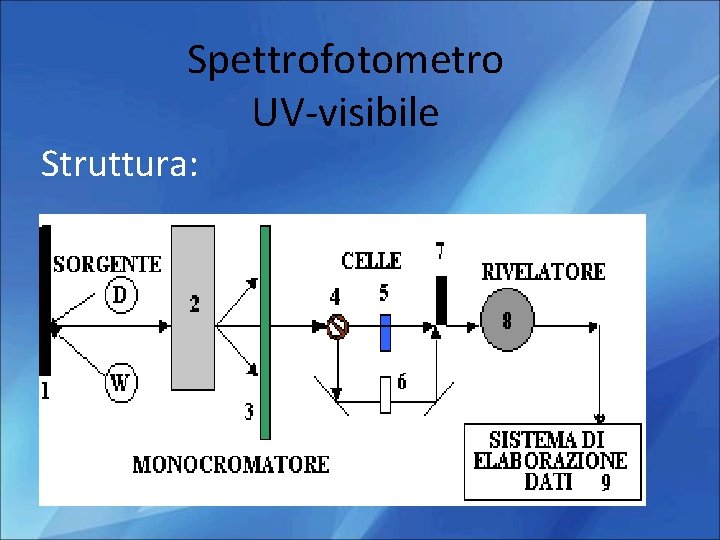
Spettrofotometro UV-visibile Struttura:

1. Sorgenti Deve emettere radiazioni policromatiche, contenenti cioè tutte le lunghezze d’onde del campo richiesto Per la regione del visibile si utilizzano lampade ad incadescenza Per la regione UV si utilizzano lampade a scarica di gas

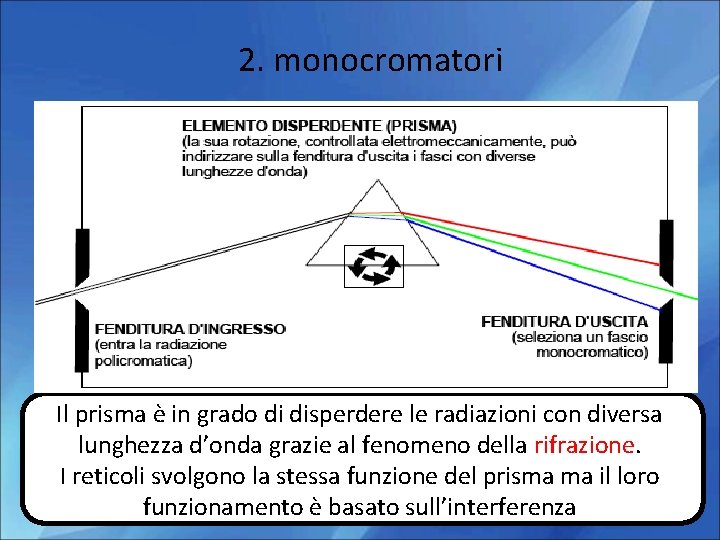
2. monocromatori Ne esistono due tipi: Basati su un Basati su Elemento disperdente( prisma o filtri (ottici o reticolo) interferenziali) Che fanno incidere il fascio policromatico sull’elemento che bloccano una disperdente in gradocon di deviare le Il prisma è inluce grado le radiazioni diversa parte della e di disperdere diverse radiazioni conrifrazione. i diversi angoli: la lunghezza d’onda grazie al fenomeno della lasciano passare solo radiazionedel uscente sarà quella che I reticoli svolgono la stessa funzione prisma ma il loro la parte desiderata passa attraverso la fenditura di uscita funzionamento è basato sull’interferenza

Trasparente alla radiazione impiegata Preciso cammino ottico 3. Celle Visibile - Vetro - Quarzo - Alcuni materiali plastici UV - Quarzo

4. Rivelatori Dispositivi capaci di produrre un segnale elettrico che dipende dall’energia delle radiazioni che lo investono. 5. Elaborazione e presentazione dati Il segnale proveniente dal rivelatore viene Amplificato e trasmesso a Indicatore Eventuale registratore su carta Eventuale sistema computerizzato di elaborazione dati

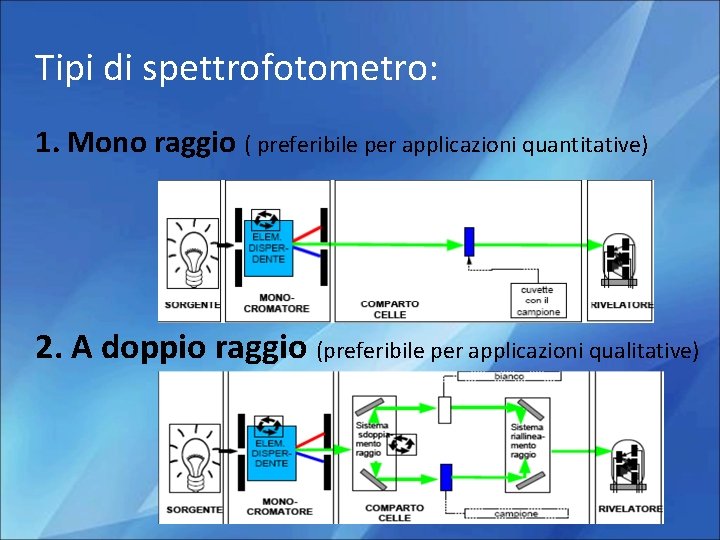
Tipi di spettrofotometro: 1. Mono raggio ( preferibile per applicazioni quantitative) 2. A doppio raggio (preferibile per applicazioni qualitative)

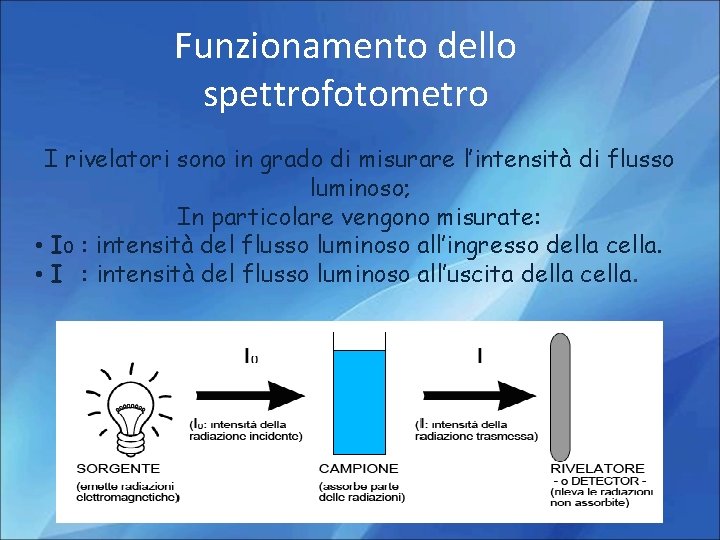
Funzionamento dello spettrofotometro I rivelatori sono in grado di misurare l’intensità di flusso luminoso; In particolare vengono misurate: • I 0 : intensità del flusso luminoso all’ingresso della cella. • I : intensità del flusso luminoso all’uscita della cella.

Dalla misura dei flussi I 0 e I gli strumenti forniscono direttamente i valori di : 1. Trasmittanza T= I/Io 2. Assorbanza A= -log T Utilizzata nelle analisi quantitative poiché risulta direttamente proporzionale alla concentrazione A= εxbx. C

Determinazione della concentrazione della sostanza in esame Metodo diretto Metodo indiretto

1°: Metodo diretto Legge dell’assorbimento (legge di Lambert-Beer) Prendendo in considerazione una cella, contenente una sostanza in soluzione, attraversata da un raggio di luce monocromatica, si dimostra che: A= εxbx. C

A= εxlx. C l = cammino ottico C = concentrazione ε = coefficiente di assorbimento molare o coefficiente di estinzione molare rappresenta l'assorbanza di una soluzione a concentrazione molare unitaria ad una data lunghezza d'onda, attraverso una cella di lunghezza ottica unitaria. Da notare che indica il valore di assorbanza del composto in esame quando l=1 cm e C = 1 e il suo valore dipende : -- Lunghezza d’onda -- Dalla natura del solvente -- Dal PH -- Dalla specie chimica che assorbe

ε = coefficiente di assorbimento molare o coefficiente di estinzione molare può essere: 1. NOTO 2. NON NOTO ε% = assorbimento di una soluzione ad una determinata %

Calcolando l’assorbanza con lo spettrofotometro e , applicando la formula inversa della legge di Lambert-Beer, si calcola la CONCENTRAZIONE della soluzione in esame A= εxbx. C C=A/ (εxb)

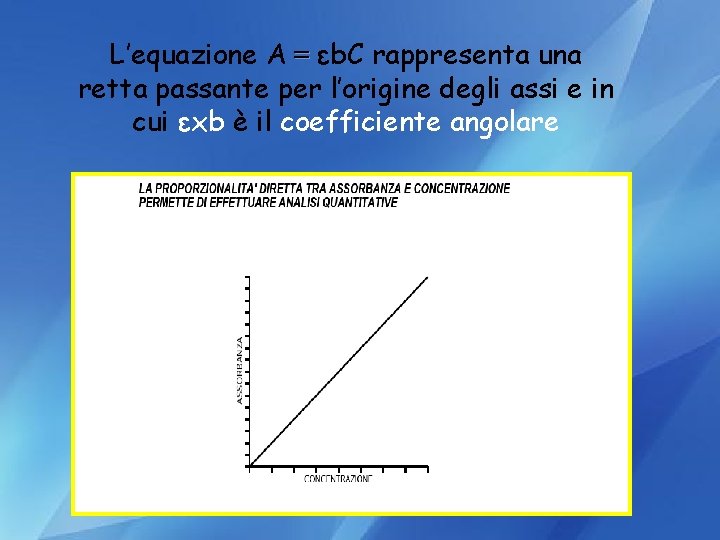
L’equazione A = εb. C rappresenta una retta passante per l’origine degli assi e in cui εxb è il coefficiente angolare

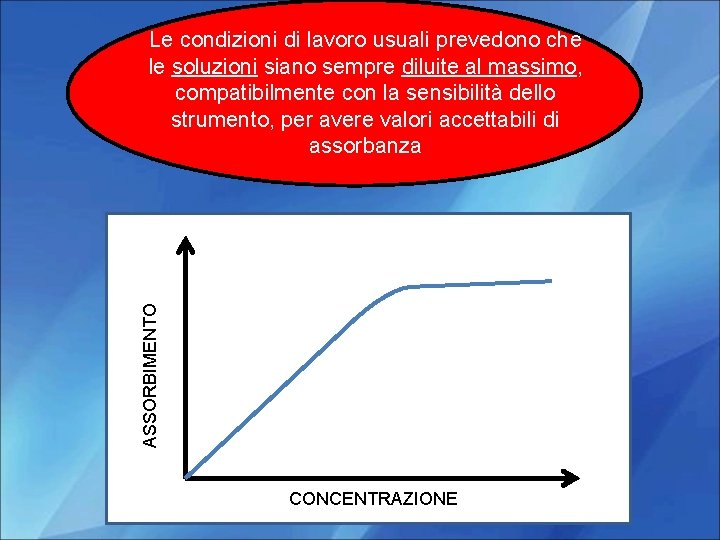
ASSORBIMENTO Le condizioni di lavoro usuali prevedono che Al crescere della concentrazione del soluto le soluzioni siano sempre diluite al massimo, si verificano deviazioni notevoli compatibilmente con la sensibilità dello strumento, con perconseguente avere valori accettabili di scarsa attendibilità del dato analitico assorbanza CONCENTRAZIONE

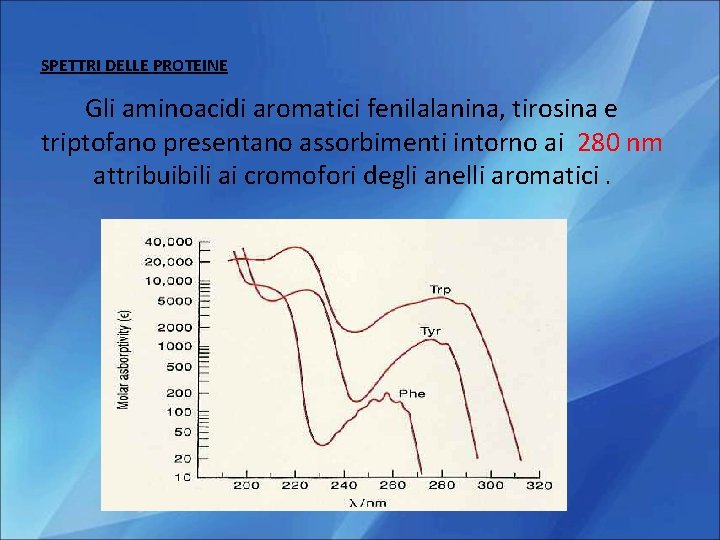
SPETTRI DELLE PROTEINE Gli aminoacidi aromatici fenilalanina, tirosina e triptofano presentano assorbimenti intorno ai 280 nm attribuibili ai cromofori degli anelli aromatici.

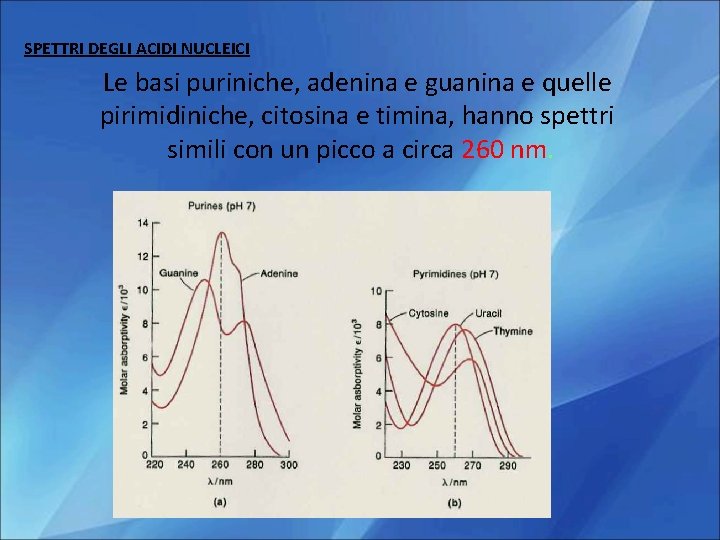
SPETTRI DEGLI ACIDI NUCLEICI Le basi puriniche, adenina e guanina e quelle pirimidiniche, citosina e timina, hanno spettri simili con un picco a circa 260 nm.

2°: Metodo indiretto Colorimetria

La colorimetria è in biochimica tra le applicazioni più importanti dello spettrofotometro. Viene utilizzata per la determinazione quantitativa delle proteine.

Premesse… Numerose sostanze possono reagire quantitativamente con un'altra sostanza a formare un complesso colorato detto comoforo. Proteina + Colorante L’ assorbimento è proporzionale alla quantità di colorante legato COMPLESSO COLORATO

Metodo di Bradford Metodo del Biureto Determinazione della concentrazione della sostanza in esame Metodo di Lowry Metodo BCA

Metodo di Bradford Colorante utilizzato: Comassie Brillant blue

Il legame del colorante Coomassie Brilliant Blue G 250 alle proteine determina uno spostamento del massimo di assorbimento del colorante da 465 nm (rosso) a 595 nm (blu) in soluzioni acide (Bradford, 1976)

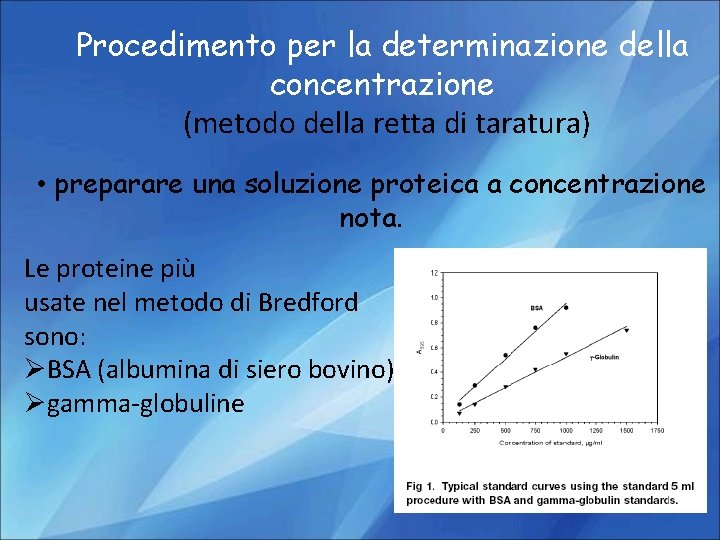
Procedimento per la determinazione della concentrazione (metodo della retta di taratura) • preparare una soluzione proteica a concentrazione nota. Le proteine più usate nel metodo di Bredford sono: ØBSA (albumina di siero bovino) Øgamma-globuline

• dalla soluzione preparata prelevare soluzioni di diversi ml, a concentrazioni note e crescenti. 1 X mg/ml 1 mg/ml 2 2 mg/ml 3 4 mg/ml 4 8 mg/ml 5 16 mg/ml

• ad ogni soluzione aggiungere acqua e reattivo (500 μl del reagente colorante di Bradford) • Agitare ed attendere 5 min

• misurare l’assorbanza.

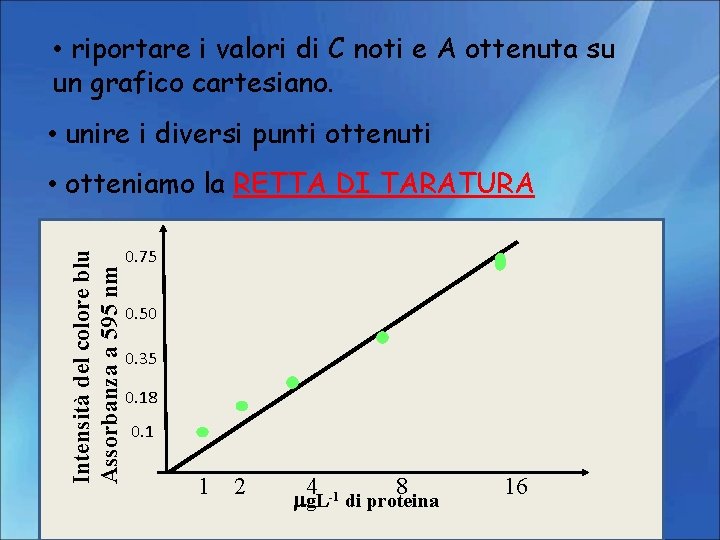
• riportare i valori di C noti e A ottenuta su un grafico cartesiano. • unire i diversi punti ottenuti Intensità del colore blu Assorbanza a 595 nm • otteniamo la RETTA DI TARATURA 0. 75 0. 50 0. 35 0. 18 0. 1 1 2 4 8 mg. L-1 di proteina 16

• Prendo il campione di cui voglio calcolare la concentrazione, aggiungo acqua e reattivo, ne misuro l’assorbimento. Intensità del colore blu Assorbanza a 595 nm • riportiamo il valore dell’ Ax ottenuto, sul grafico Ax Per interpolazione otteniamo il valore di Cx 0. 50 0. 35 0. 18 0. 1 1 2 4 mg. L-1 8 di proteina 16

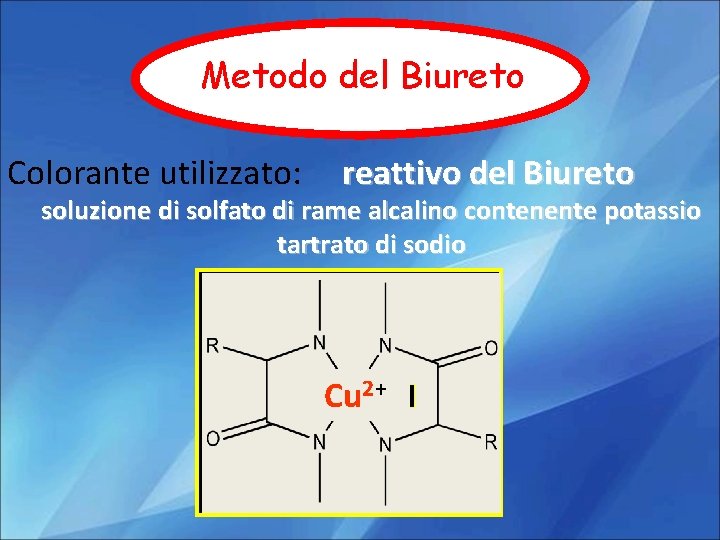
Metodo del Biureto Colorante utilizzato: reattivo del Biureto soluzione di solfato di rame alcalino contenente potassio tartrato di sodio Cu 2+

• In condizioni alcaline gli ioni rameici Cu 2+ formano un complesso di coordinazione con quattro gruppi –NH presenti in altrettanti legami peptidici • Il complesso che si forma assorbe luce nel visibile, con un picco a 550 nm

Metodo del Lowry Colorante utilizzato: Reattivo di Folin • Il complesso che si forma assorbe luce nel visibile, con un picco a 750 nm • Molto sensibile: è possibile determinare concentrazioni fino a 10 µg/ml

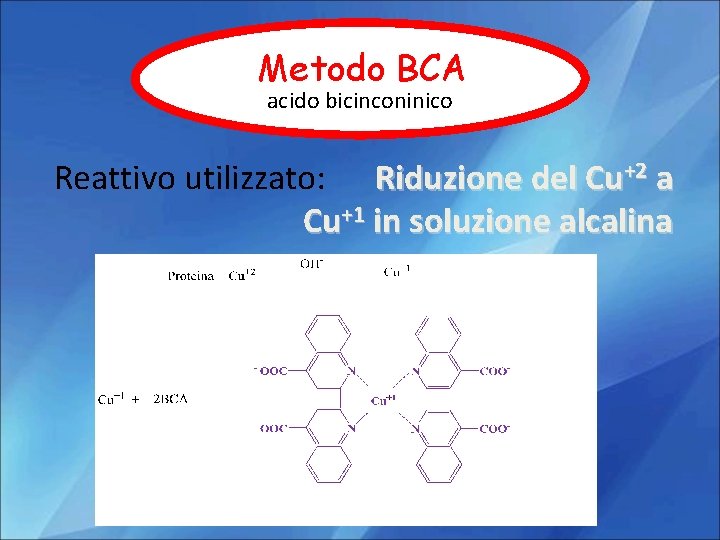
Metodo BCA acido bicinconinico Reattivo utilizzato: Riduzione del Cu+2 a Cu+1 in soluzione alcalina

Due molecole di BCA chelano uno ione rameoso (Cu+1) Tale evento determina la formazione di un intenso colore violetto con un massimo di assorbimento a 562 nm
 Fp7-space
Fp7-space Calciparina dosaggio profilattico
Calciparina dosaggio profilattico Materiali leganti
Materiali leganti Radical killer life 120
Radical killer life 120 Marilena esposito
Marilena esposito Nb handy greenville sc
Nb handy greenville sc Magali esposito la pampa
Magali esposito la pampa Federica antonelli
Federica antonelli Federica gigliotti
Federica gigliotti Federica spano età
Federica spano età Maria federica burattini
Maria federica burattini Federica leonetti
Federica leonetti Federica zanaboni
Federica zanaboni Federica caboni unica
Federica caboni unica Federica aielli
Federica aielli Federica capellino
Federica capellino Federica aielli
Federica aielli Federica burattini
Federica burattini Federica cimini
Federica cimini Federica oradini
Federica oradini Federica
Federica Federica martinelli
Federica martinelli Federica legger
Federica legger Proteine del latte
Proteine del latte Herbalife doc
Herbalife doc Pozitif nitrojen dengesi
Pozitif nitrojen dengesi Proteine ici
Proteine ici Proteine dna
Proteine dna Denaturazione proteine
Denaturazione proteine Struttura terziaria proteine
Struttura terziaria proteine Proteine definitie
Proteine definitie Funzione delle proteine
Funzione delle proteine Mhc proteine
Mhc proteine Valin
Valin Proteine del latte
Proteine del latte Vindecarea prediabetului
Vindecarea prediabetului Proteine intrinseche
Proteine intrinseche Amminoacid
Amminoacid Struttura nativa
Struttura nativa Permeabilità intestinale
Permeabilità intestinale Biureto proteine esperimento
Biureto proteine esperimento Gli enzimi sono proteine globulari
Gli enzimi sono proteine globulari Ciaperonine
Ciaperonine Le proteine sono formate da
Le proteine sono formate da Proteina sr
Proteina sr Proteine intrinseche
Proteine intrinseche Membrana plasmatica doppio strato fosfolipidico
Membrana plasmatica doppio strato fosfolipidico Amminoacidi classificazione
Amminoacidi classificazione