MAVANSKA SREDNJA KOLA AMINOKISELINE I GRAENJE PEPTIDNE VEZE

















- Slides: 35

MAČVANSKA SREDNJA ŠKOLA AMINOKISELINE I GRAĐENJE PEPTIDNE VEZE KLARA KAKUČKA, prof. hemije

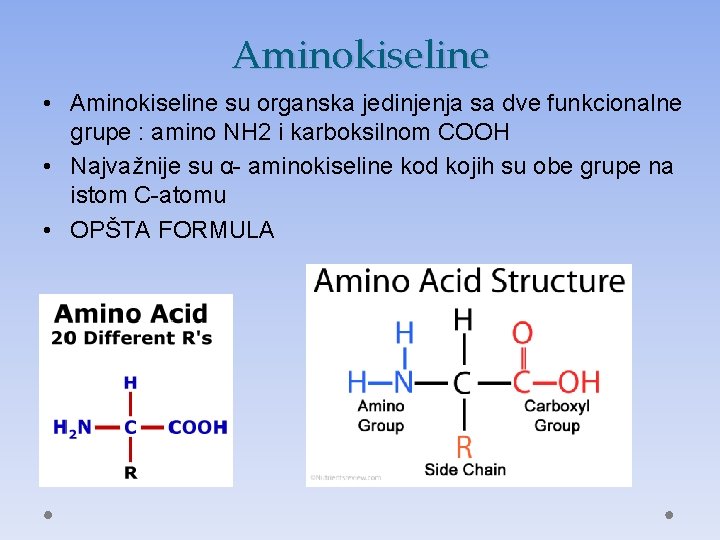
Aminokiseline • Aminokiseline su organska jedinjenja sa dve funkcionalne grupe : amino NH 2 i karboksilnom COOH • Najvažnije su α- aminokiseline kod kojih su obe grupe na istom C-atomu • OPŠTA FORMULA

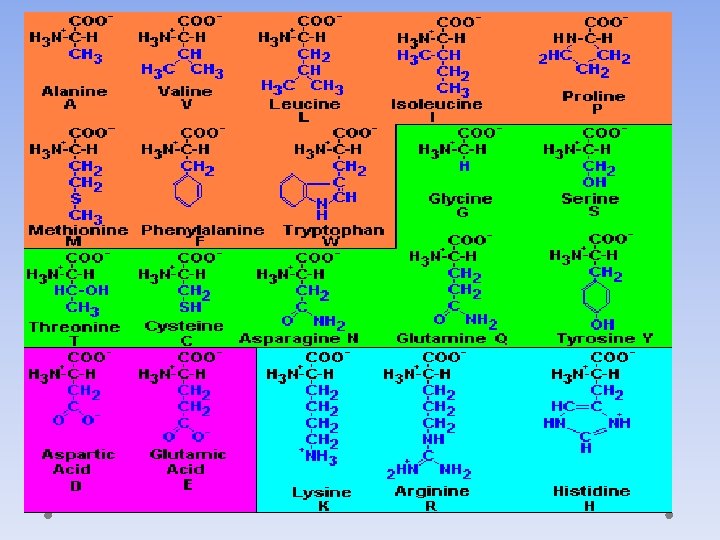
Aminokiseline • Ulaze u sastav protena • Hidrolizom proteina dobija se svega 20 αaminokiselina • Klasifikacija aminokiselina prema: • Polarnosti • Funkcionalnim grupama u bočnom nizu • Biosintezi ( esencijalne i neesencijalne)


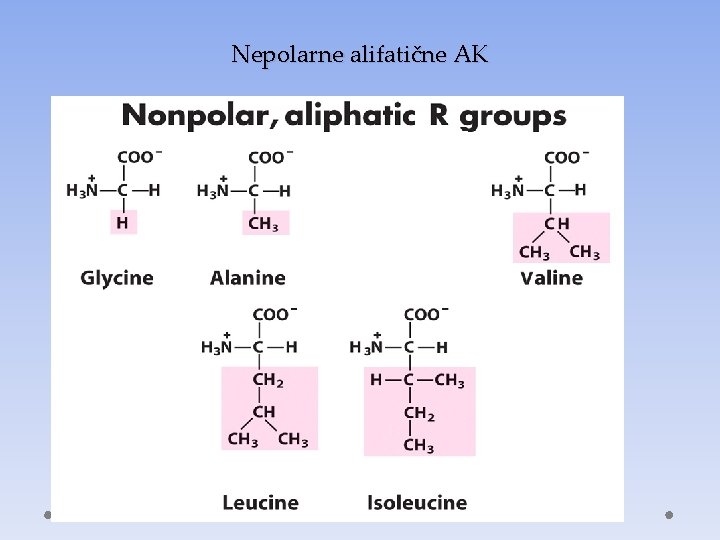
Nepolarne alifatične AK

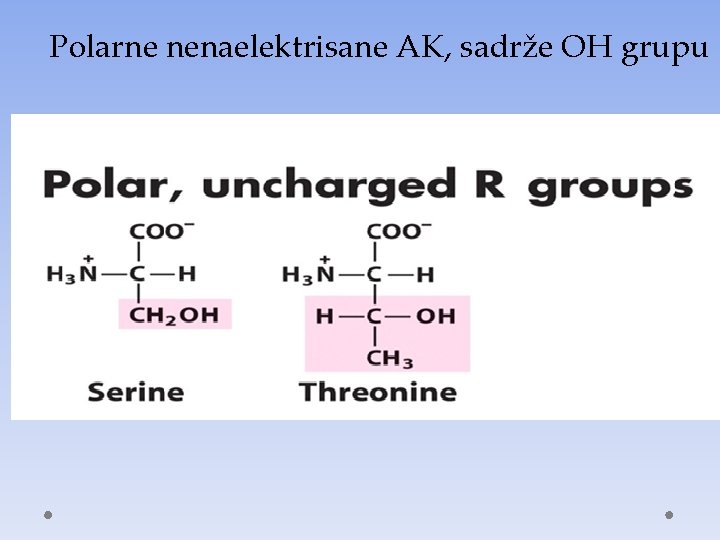
Polarne nenaelektrisane AK, sadrže OH grupu

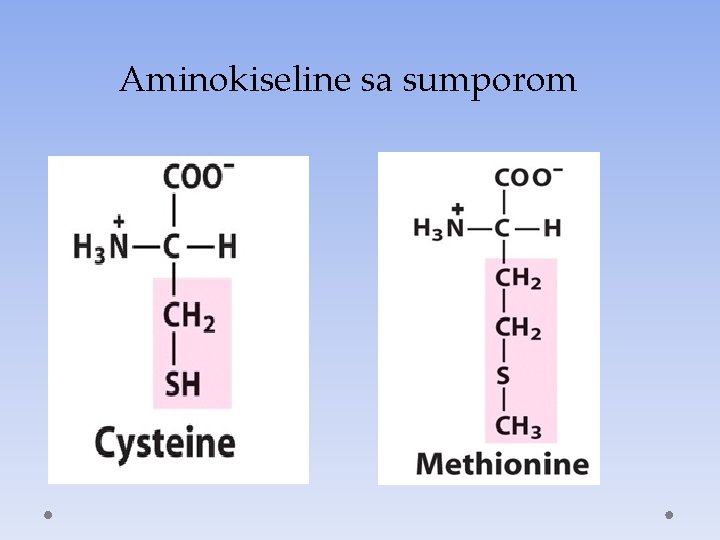
Aminokiseline sa sumporom

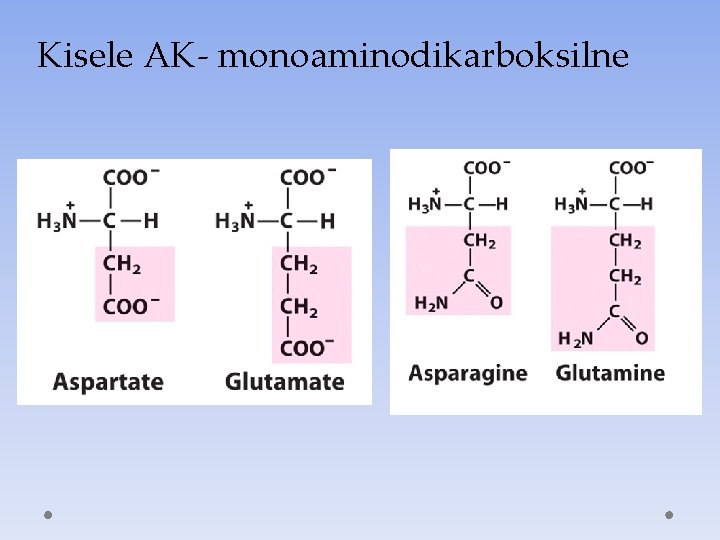
Kisele AK- monoaminodikarboksilne

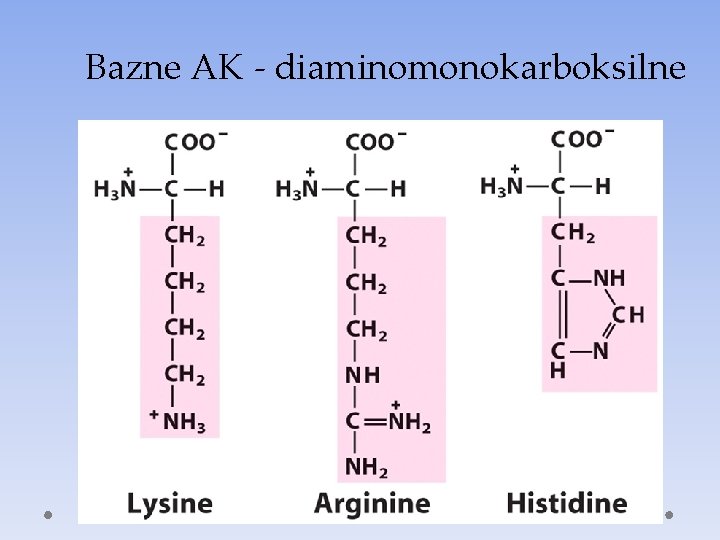
Bazne AK - diaminomonokarboksilne

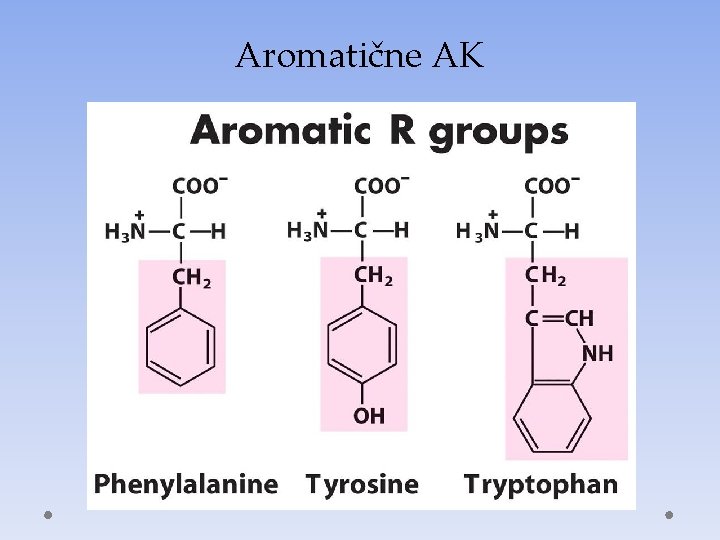
Aromatične AK

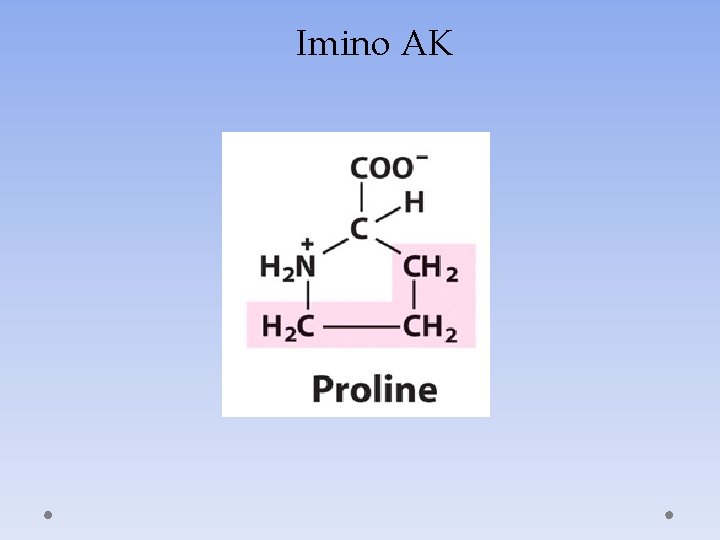
Imino AK

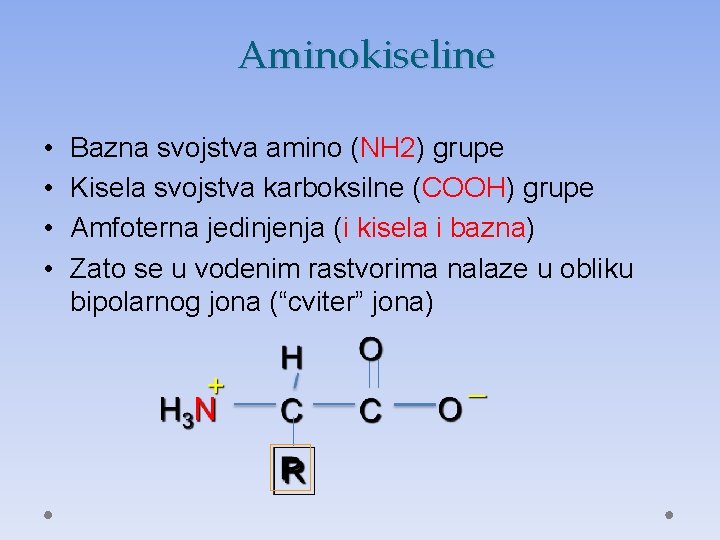
Aminokiseline • • Bazna svojstva amino (NH 2) grupe Kisela svojstva karboksilne (COOH) grupe Amfoterna jedinjenja (i kisela i bazna) Zato se u vodenim rastvorima nalaze u obliku bipolarnog jona (“cviter” jona)


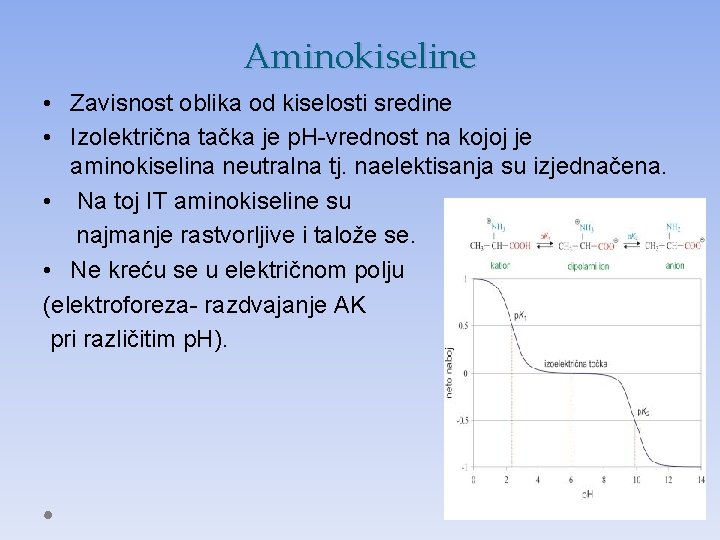
Aminokiseline • Zavisnost oblika od kiselosti sredine • Izolektrična tačka je p. H-vrednost na kojoj je aminokiselina neutralna tj. naelektisanja su izjednačena. • Na toj IT aminokiseline su najmanje rastvorljive i talože se. • Ne kreću se u električnom polju (elektroforeza- razdvajanje AK pri različitim p. H).

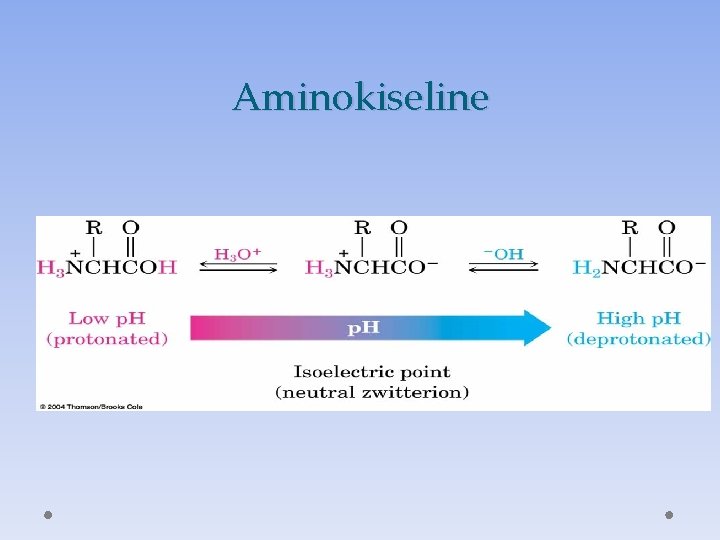
Oblik jona u zavisnosti od p. H

Aminokiseline


Aminokiseline-Podela prema biosintezi: • Neesencijalne – mogućnost biosinteze • Alanin • Cistein • Asparaginska kiselina • Glutaminska kiselina • Glicin • Norleucin • Serin • Tirozin • Esencijalne – nemogućnost biosinteze • Arginin • Histidin • Izoleucin • Lizin • Metioni • Fenilalanin • Treonin • Triptofan • Valin

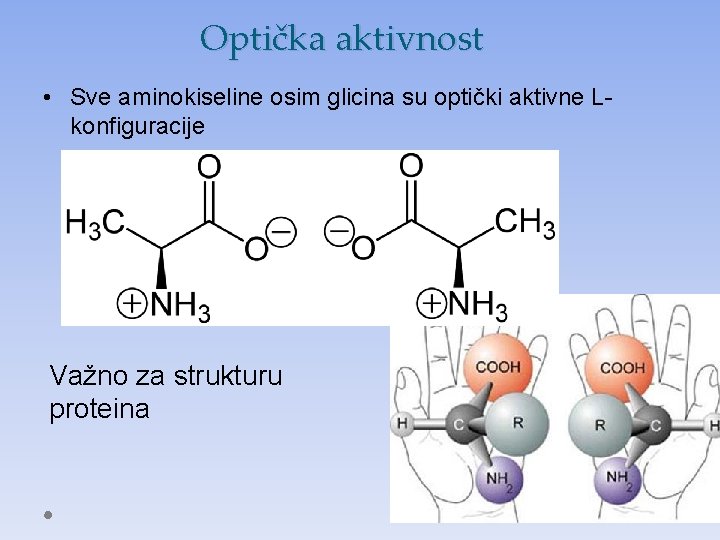
Optička aktivnost • Sve aminokiseline osim glicina su optički aktivne Lkonfiguracije Važno za strukturu proteina

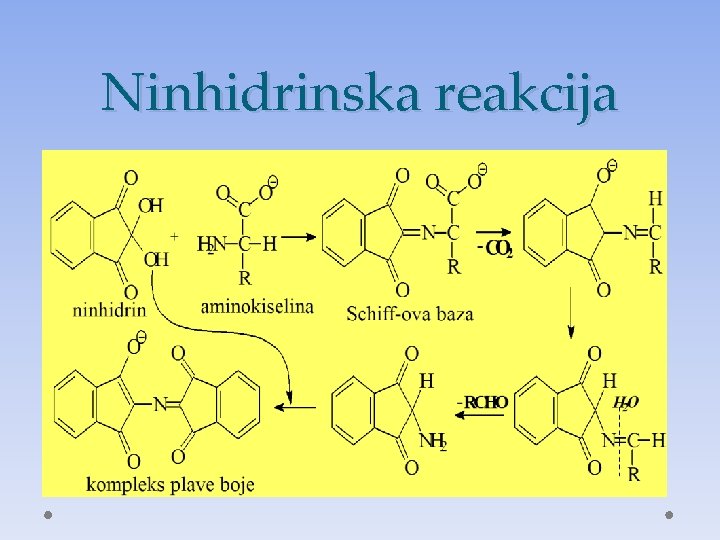
Hemijske osobine AK • Imaju svojstva i kiselina i baza ali i karakteristična samo za AK • Dokazna reakcija sa ninhidrinom- plavo obojenje • Građenje dipeptida i polipeptida

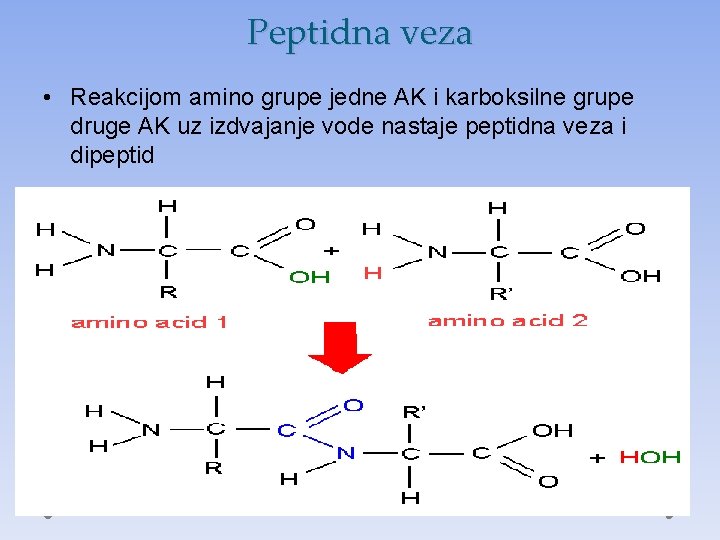
Peptidna veza • Reakcijom amino grupe jedne AK i karboksilne grupe druge AK uz izdvajanje vode nastaje peptidna veza i dipeptid


Peptidna veza • Na svakom molekulu ostaje po jedna slobodna amino grupa na N-kraju i karboksilna na drugom C- kraju koji mogu da reaguju sa novom AK, i grade polipeptide (do 100 AK) i proteine (preko 100 AK)

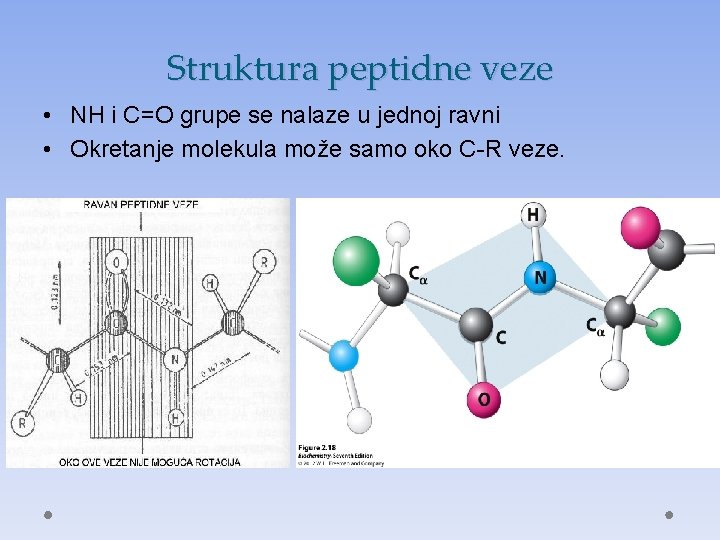
Struktura peptidne veze • NH i C=O grupe se nalaze u jednoj ravni • Okretanje molekula može samo oko C-R veze.

Taložne reakcije proteina • Biuretska reakcija • Ninhidrinska reakcija • Ksantoproteinska reakcija

Biuretska reakcija

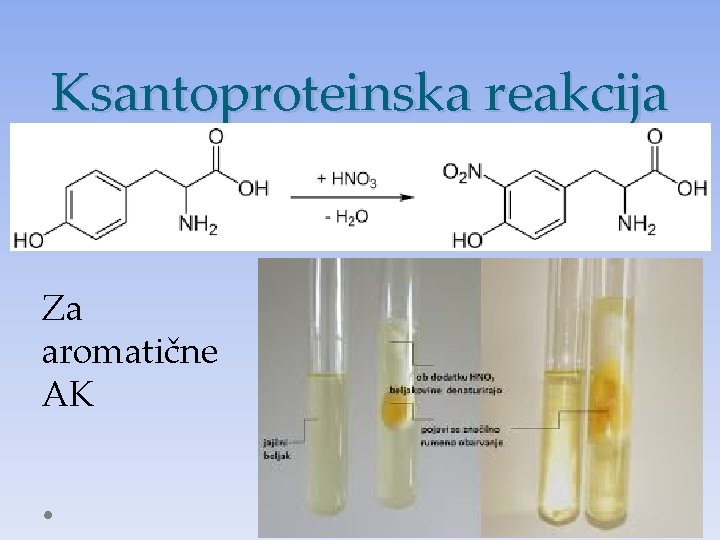
Ksantoproteinska reakcija Za aromatične AK

Ninhidrinska reakcija

Izdvajanje i prečišćavanje proteina • Cilj ovih metoda je izdvojiti protein od ostalih u smesi ili tkivu. • Postupak je težak jer su proteini osjetljivi i lako se denaturišu. • Postupci se temelje na tri fizičko-hemijska svojstva, te su i metode razvijene prema tim parametrima: razdvajanje prema veličini molekula razdvajanje prema naelektrisanju molekula razdvajanje prema specifičnim vezama ( afinitetna hromatografija) • Razdvajanje proteina prema njihovoj izoelektričnoj tački. Pomoću amfolita stvori se p. H-gradijent, pa se aminokiselina zaustavljaju na područjima njihove izoelektrične tačke, i od toga mesta se više pomeraju jer električno polje ne djeluje na njih jer postanu neutralne.

Razdvajanje • • RAZDVAJANJE PREMA RASTVORLJIVOSTI Proteini se talože neutralnim solima. Primer je aluminij sulfat. Rastvorljivost je najmanja pri izoelektričnoj tački. • RAZDVAJANJE ADSORPCIJOM • Neki nerastvorni neorganska ili organska jedinjenja mogu adsorbovati proteine kao npr. hidroksilapatit, koji se koristi i u hromatografij. • • • RAZDVAJANJE PREMA NAELEKTRISANJU Aminokiseline u vodenom rastvoru su polivalentne. Negativno naelektrisanje daju karboksilne grupe bočnih lanaca glutaminske i asparaginske kiseline i terminalna –COOH grupa, Pozitivno naelektrisanje daje –NH 2 grupa bočnih lanaca asp, liz i his i teminalna –NH 2 grupa. Niski p. H sprečava disocijaciju –COOH, a kod visokog p. H aminogrupa je neutralna. •

ELEKTROFOKUSIRANJE • Pri određenom p. H aminokiseline imaju i različito naelektrisanje. • U električnom polju one putuju različitom brzinom. • Molekuli sa više negativnih naelektrisanja putuju prema anodi. • Elektroforeza se vrši na nosačima, koji osim celuloznog acetata, mogu biti poliakriamidni gelovi. Njihovom različitom polimerizacijom se postiže i različita veličina pora, pa se prema tome mogu stvoriti i molekulska sita, koja razdvajaju proteine prema njihovoj veličini molekula. • U medicini se analizira serum elektroforezom na nosaču koji može biti papir, celulozni acetat, skrobni ili poliakrilamidni gel. Iz dobivenog elektrograma se iščitaju udeo pojedinih vrsta proteina seruma.

HROMATOGRAFIJA NA JONSKIM IZMENJIVAČIMA • Kao izmjenjivač se ne koriste sintetske smole jer mogu denaturisati protein. Kao adsorbens se koriste preparati celuloze u koje se mogu umetnuti naelektrisani elementi. Hromatografija se provodi na koloni, a u eluentu se UV-adsorpcijom dokazuju sastavnice. • • ODVAJANJE PREMA VELIČINI MOLEKULA Proteini su često različitih veličina. Za njihovo razdvajanje koristi se ultracentifuga, SDS-elektroforeza i hromatografija ekskluzijom. Preparativno odvajanje se vrši u gradijentu gustine centrifugiranjem. Rrastvor cesijum-hlorida ima različitu gustinu, pa proteini putuju do onoga mesta u kojem lebde tj. do mesta gdje je gustina ekvivalentna njihovoj. • • SDS-ELEKTROFOREZA Pomoću natrij-dodecilsulfata ( SDS ) proteini se denaturišu, Dodecilsulfat se veže na njih i oni poprimaju negativno naelektrisanje proporcionalno njihovoj dužini.

GEL FILTRACIJA • Stacionarna faza je polisaharidni gel koji deluje kao molekulsko sito. Sadrži malene šupljine u koje mogu ući molekuli. • Molekulska Petera proteina se može odrediti centrifugom. Proteini čija je gustina veća od gustine rastvora mogu se taložiti. Zemljina sila teže nije dovoljna, nego je potrebno stvoriti centripetalnu silu. Sedimentacija proteina se može meriti optičkim metodama. Tako se odredi konstanta sedimentacije u meri svedberg ( 1 S = 〖 10〗^(-13)s ). Relativna molekulska Petera se može izračunati iz konstante sedimentacije ako se zna konstanta difuzije i gustina proteina. Jednostavnija metoda određivanja molekulske Petere je hromatografija na molekulskim sitima.

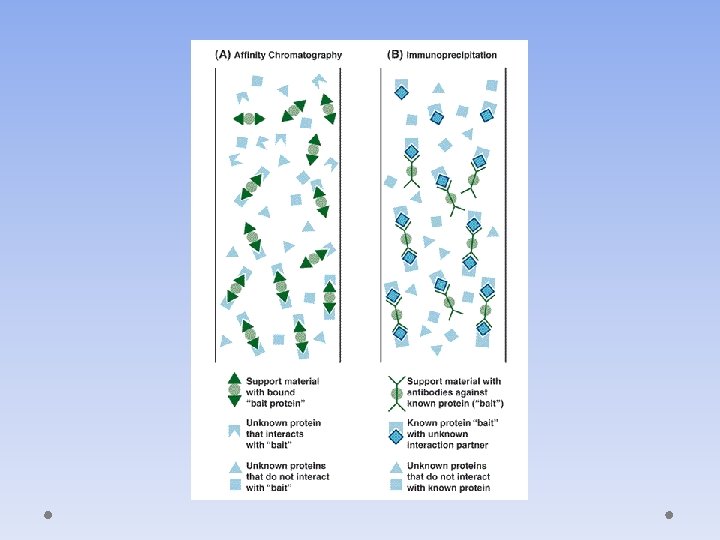
AFINITETNA HROMATOGRAFIJA • Zasniva se na principu da se proteini vežu na određene manje molekule i razdvajanje se vrši na temelju njihove povezanosti ( afinitetu ) s manjim molekulima. • Na slici se vidi kako se određeni protein veže za molekulu ˝bait˝, dok drugi ne i na temelju toga će se razdvojiti u hromatografiji.

 Ninhidrinska reakcija
Ninhidrinska reakcija Aminokiseline podela
Aminokiseline podela Opsta formula aminokiselina
Opsta formula aminokiselina Cviter jon
Cviter jon Jednako ubrzano pravolinijsko kretanje
Jednako ubrzano pravolinijsko kretanje Drvene konstrukcije spojevi
Drvene konstrukcije spojevi Lokomotorni sustav čovjeka
Lokomotorni sustav čovjeka Klauzijus klapejronova jednacina
Klauzijus klapejronova jednacina Defekt mase formula
Defekt mase formula Sloj veze
Sloj veze Redna veza
Redna veza Kovalentna veza primeri
Kovalentna veza primeri Intramolekulske veze
Intramolekulske veze Polihidroksilni alkoholi
Polihidroksilni alkoholi Defekt na masa
Defekt na masa Energija veze
Energija veze Panteli kola
Panteli kola Moja kola
Moja kola Sağ kürek kemiğinden kola vuran ağrı
Sağ kürek kemiğinden kola vuran ağrı Komutacija kola
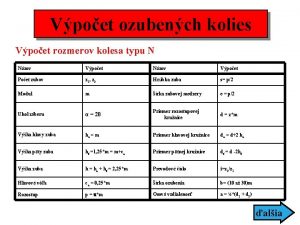
Komutacija kola Vypocet ozubeneho kolesa
Vypocet ozubeneho kolesa Cmos invertor
Cmos invertor Imena nebeskih tijela
Imena nebeskih tijela Erno kola
Erno kola Foda de inca kola
Foda de inca kola Wonder
Wonder Odklon kola
Odklon kola Skloňování slova kola
Skloňování slova kola Omov zakon
Omov zakon Obwod kola
Obwod kola Obsah
Obsah Auto kola
Auto kola Moja kola
Moja kola Beyce kola
Beyce kola Logicka kola zadaci
Logicka kola zadaci Marijan biruš
Marijan biruš