Meumolekulske veze ta su meumolekulske veze Meumolekulske veze


















- Slides: 24


Međumolekulske veze

Šta su međumolekulske veze? • Međumolekulske veze (sekundarne veze) su interakcije koje se javljaju između svih vrsta molekula, i polarnih i nepolarnih.

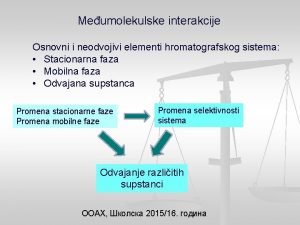
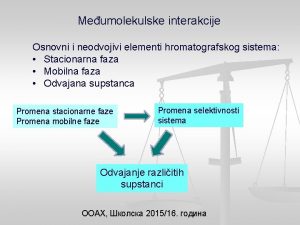
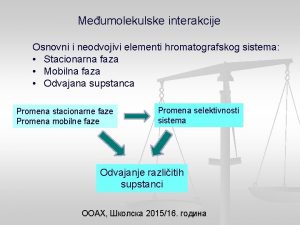
Vrste međumolekulskih veza: • van der Valsove privlačne sile; • vodonična veza; • međumolekulske veze u biološkim sistemima.

Van der Valsove sile su privlačne sile koje se javljaju između nepolarnih i polarnih molekula. Veoma su slabe, slabije od kovalentne veze u proseku 10 do 100 puta. Najpoznatije vrste van der Valsovih sila su: • sile tipa dipol – dipol; • sile tipa dipol - indukovani dipol; • sile tipa indukovani dipol - indukovani dipol.

Dobile su naziv po Johannes Diderik van der Waals-u holandskom fizičaru, dobitniku Nobelove nagrade za fiziku 1910. godine. Johannes Diderik van der Waals (1837 -1923)

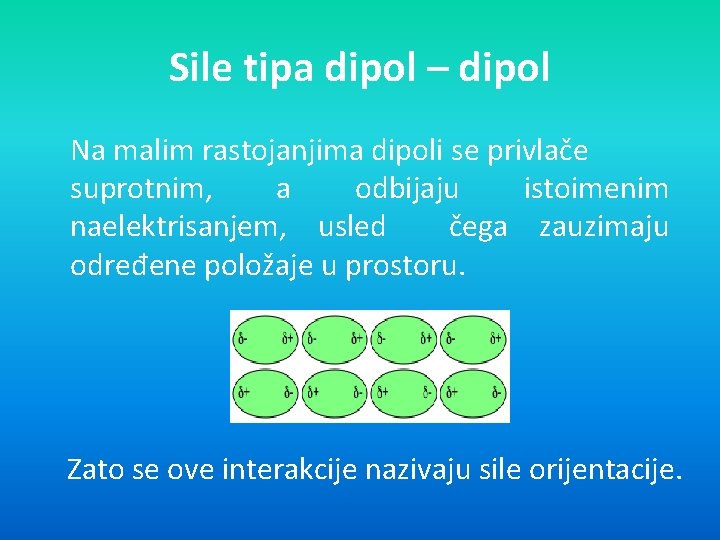
Sile tipa dipol – dipol Šta su dipoli? Dipolni molekuli poseduje spoljašnje elektrostatičko polje, mnogo slabije od elektrostatičkog polja jona, ali dovoljno jako da dođe do njihovog međusobnog privlačenja.

Sile tipa dipol – dipol Na malim rastojanjima dipoli se privlače suprotnim, a odbijaju istoimenim naelektrisanjem, usled čega zauzimaju određene položaje u prostoru. Zato se ove interakcije nazivaju sile orijentacije.

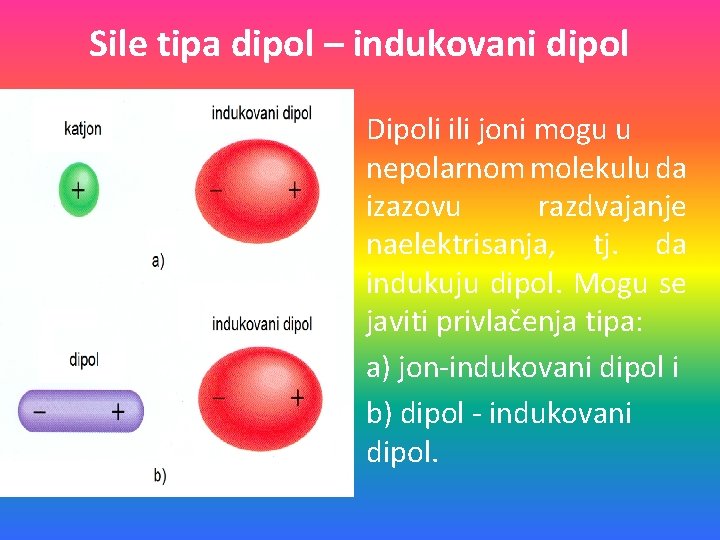
Sile tipa dipol – indukovani dipol Dipoli ili joni mogu u nepolarnom molekulu da izazovu razdvajanje naelektrisanja, tj. da indukuju dipol. Mogu se javiti privlačenja tipa: a) jon-indukovani dipol i b) dipol - indukovani dipol.

Sile tipa indukovani dipol – indukovani dipol Ove sile se javljaju između nepolarnih molekula pa čak i između atoma plemenitih gasova. Nepolarni molekuli: H 2, N 2, O 2, F 2 itd.

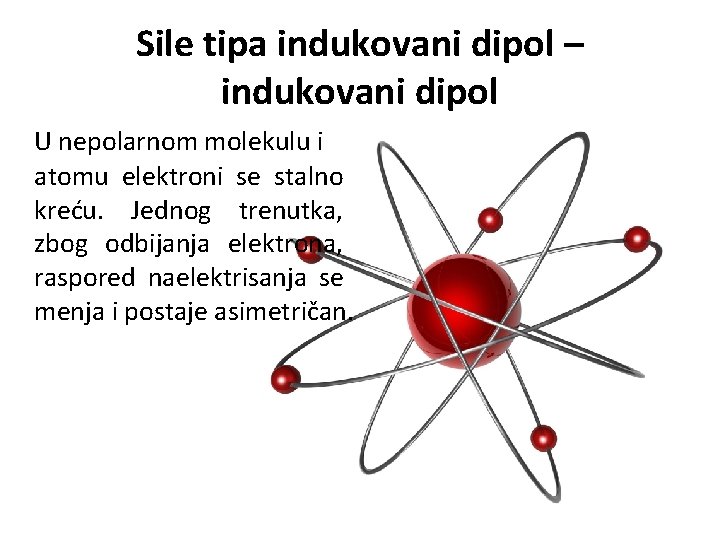
Sile tipa indukovani dipol – indukovani dipol U nepolarnom molekulu i atomu elektroni se stalno kreću. Jednog trenutka, zbog odbijanja elektrona, raspored naelektrisanja se menja i postaje asimetričan.

Sile tipa indukovani dipol – indukovani dipol • U molekulu ili atomu nastaje trenutno indukovani dipol koji u drugom molekulu ili atomu izaziva polarizaciju, tj. stvara drugi indukovani dipol. • Između indukovanih dipola javljaju se slabe sile privlačenja, tzv. ili sile disperzije.

Da li sekundarne veze utiču na osobine molekula? Utiču na: • fizička svojstva molekula (npr. na povećanje tački topljenja i ključanja) i njihovu organizaciju u prostoru.

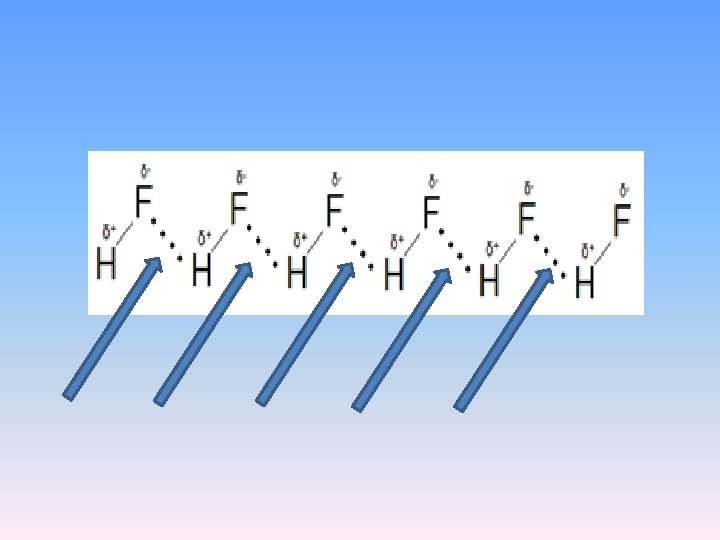
Vodonična veza • Vodonična veza je međumolekulska sila koja nastaje između dva molekula, od kojih jedan, kao delimično pozitivan pol, ima atom vodonika, a drugi, kao delimično negativan pol, atom velike elektronegativnosti (npr. F, N, O). • Vodonična veza je specijalni vid dipol-dipol interakcije.


Vodonična veza se javlja kod mnogih neorganskih molekula: vode, amonijaka, fluorovodonika, itd; i organskih (alkohola, fenola, amina, organskih kiselina, baza nukleinskih kiselina, proteina itd).

Vodonična veza između molekula vode

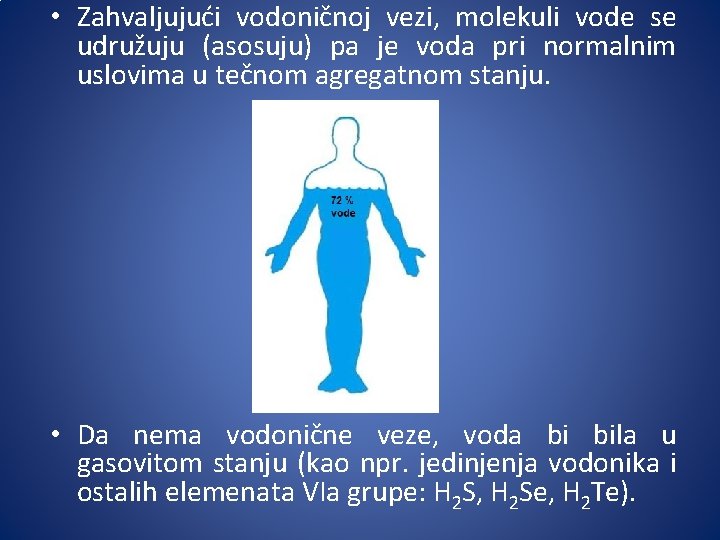
• Zahvaljujući vodoničnoj vezi, molekuli vode se udružuju (asosuju) pa je voda pri normalnim uslovima u tečnom agregatnom stanju. • Da nema vodonične veze, voda bi bila u gasovitom stanju (kao npr. jedinjenja vodonika i ostalih elemenata VIa grupe: H 2 S, H 2 Se, H 2 Te).

Zašto led pliva po vodi?

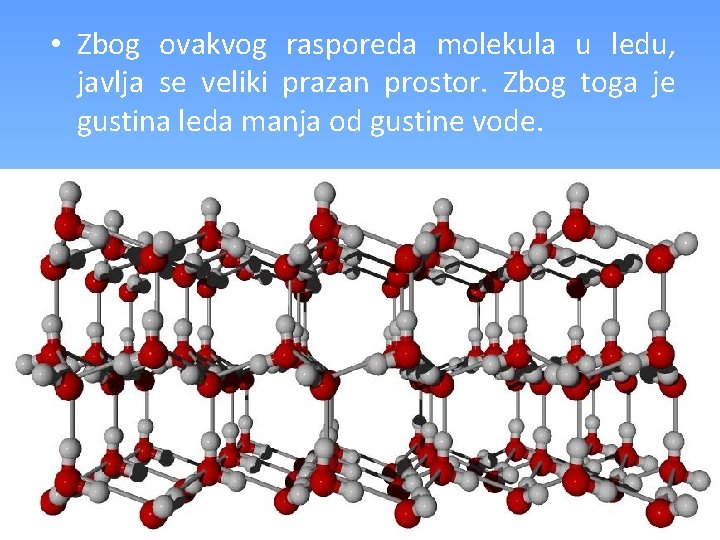
Vodonična veza u ledu • Molekul vode može da nagradi 4 vodonične veze (2 preko slobodnih elektronskih parova na Vodonične veze kiseoniku i 2 preko dva atoma vodonika). • Veze imaju tetraedarski raspored u prostoru.

• Zbog ovakvog rasporeda molekula u ledu, javlja se veliki prazan prostor. Zbog toga je gustina leda manja od gustine vode.

• Zahvaljujući tome, moguć je život u vodi za vreme zimskih meseci i niskih temperatura.

Stvaranje tetraedaskih veza između molekula vode objašnjava pojavu fenomena koji se naziva anomalija vode. Pri hlađenju voda smanjuje svoju zapreminu (kao i sve ostale supstance) ali samo do +4 o. C. Hlađenjem ispod ove temperature, voda uvećava svoju zapreminu i naglo se širi na O o. C kada prelazi u čvrsto stanje-led.

Vodonična veza se javlja u biomolekulima (npr. proteinima, nukleinskim kiselinama) i omogućava vršenje njihove biološke funkcije.