MAVANSKA SREDNJA KOLA Hemijske veze JONSKA I KOVALENTNA


































- Slides: 45

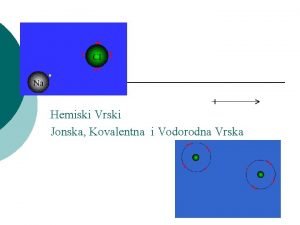
MAČVANSKA SREDNJA ŠKOLA Hemijske veze JONSKA I KOVALENTNA VEZA Klara Kakučka, prof. hemije

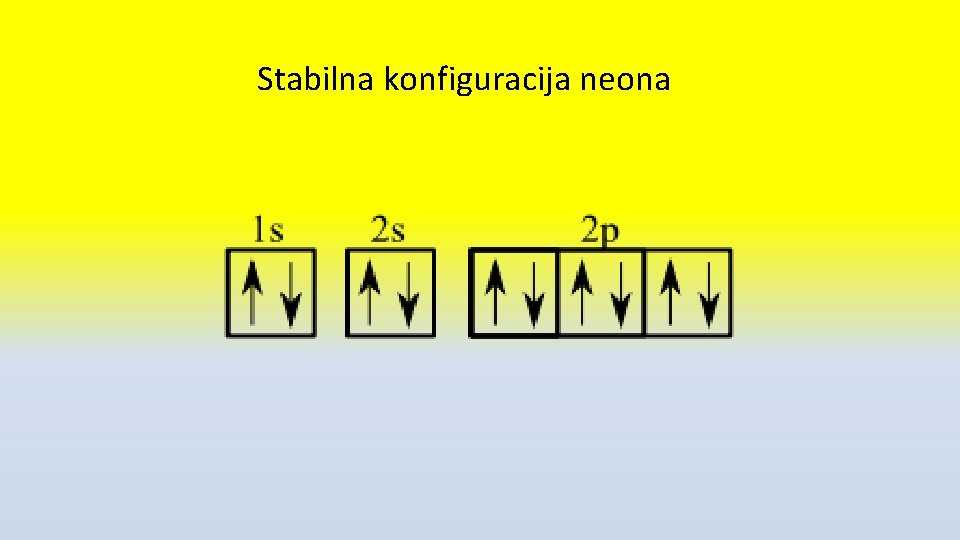
Stabilna konfiguracija • Stabilna elektronska konfiguracija je osam elektrona na poslednjem energetskom nivou –OKTET • Ređe DUBLET- 2 e • Stabilna jer su svi elektroni spareni – niža energija • Stabilnu konfiguraciju imaju plenmeniti gasovi , • Zato su inertni (nereaktivni), jednoatomni gasovi (ostali dvoatomni O 2, N 2, H 2) • Svi ostali elementi imaju manje od 8 e- n a poslednjem energetskom nivou i teže da postignu stabilnu konfiguraciju.


Stabilna konfiguracija neona

Energija jonizacije • Energija jonizacije (Ej) je količina energije koju treba dovesti atomu da otpusti najslabije vezani elektron • Metali 1 i 2. grupe PSE imaju najnižu Ej i lako otpuštaju e • Nemetali imaju veliku Ej i ne otpuštaju e • U periodi raste Ej s leva na desno, od metala ka nemetalima


Afinitet prema elektronu Ae • Afinitet prema elektronu je količina energije koja se oslobodi kada atom primi e- do stabilne konfiguracije • Elementi 16 i 17 g. imaju veliki Ae • U periodi raste Ae sleva od metala na desno do nemetala • Nemetali lako primaju e-

Hemijske veze su sile koje drže atome na okupu u molekulu. Zašto se atomi povezuju u molekule? Da bi postigli stabilnu konfiguraciju najbližeg plemenitog gasa. Atomi otpuštaju, primaju ili dele elektrone u cilju postizanja elektronske konfiguracije plemenitih gasova • U formiranju hemijskih veza učestvuju valencioni elektroni • •


Hemijske veze • Postoje dva krajnja oblika spajanja i povezivanja atoma: • • JONSKA VEZA–potpuni prenos elektrona sa jednog atoma na drugi • KOVALENTNA VEZA – elektroni se dele između atoma • VEĆINA VEZA MEĐU ATOMIMA JE NEGDE IZMEĐU

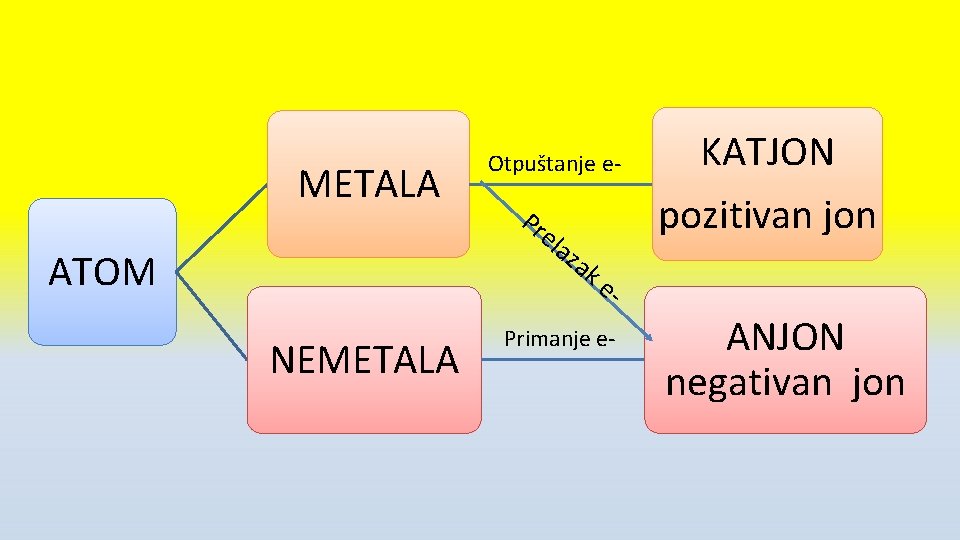
Jonska veza • Jonska veza nastaje između: metala i nemetala • Metala 1. i 2. grupe PSE i • Nemetala 16. i 17 gr PSE

Metali • • Metali otpuštaju e- i postaju pozitivni joni KATJONI Katjoni su onoliko puta pozitivni koliko su e- otpustili Na pr : Na: 11 e- : 1 s 2, 2 p 6 3 s 1 -1 e- Na+ : 1 s 2, 2 p 6 [ Ne] +1 e[ Ne]

Nemetali • • Nemetali primaju e- i postaju negativni joni ANJONI Anjoni su onoliko puta negativni koliko su e- primili Na pr: Cl 17 e-: 1 s 2, 2 p 6, 3 s 2, 3 p 5 + 1 е- Cl- 1 s 2, 2 p 6, 3 s 2, 3 p 6 [Ar] -1 e[Ar]

Jonska veza • Sudarom metala i nemetala dolazi do prelaska e- sa metala na nemetal • Oba postižu stabilnu konfiguraciju plemenitog gasa • Na: 11 e- : 1 s 2, 2 p 6 3 s 1 -1 e- Na+ • Cl 17 e-: 1 s 2, 2 p 6, 3 s 2, 3 p 5 + 1 е- Cl-


Jonska veza • Broj otpuštenih elektrona mora biti jednak broju primljenih elektrona • Mg : 1 s 2, 2 p 6, 3 s 2 treba da otpusti dva elektrona Mg 2+ • F može da primi samo jedan e- F 1 • Zato je Mg. F 2

Kristalna rešetka • Kada nastanu joni, dolazi do : • 1. elektrostatičkog privlačenja suprotno naelektrisanih jona • 2. elektrostatičkog odbijanja isto naelektrisanih jona i gradi se kristalna rešetka • Energija kristalne rešetke je niža od energija pojedinih atoma


Kristalna rešetka • Nema molekula Na. Cl, već koristimo termin formulska jedinica. • U Na. Cl svaki jon okružen je sa šest jona suprotnog naelektrisanja! • Katjoni su uvek manji od neutralnih atoma • Anjoni su uvek veći od neutralnih atoma

METALA Otpuštanje e- Pr ela ATOM NEMETALA za k KATJON pozitivan jon e- Primanje e- ANJON negativan jon

Svojstva jedinjenja sa jonskom vezom Kristalne strukture Nisu usmerene u prostoru – šire se u svim pravcima Visoke temperature topljenja i ključanja Dobro se rastvaraju u polarnim rastvaračima (voda) a slabo u nepolarnim • Provode električnu struju i u rastvorima i rastopima • •

Kovalentna veza NEMETAL + NEMETAL Atomi iste vrste- molekul elemenata H 2, O 2, P 4, S 8 Atomi različite vrste – molekul jedinjenja H 2 O, SO 3, CO 2 Pomoću zajedničkih elektronskih parova Da bi nagradili elektronske parove atomi moraju da imaju - nesparene elektrone suprotnih spinova - orbirale se preklapaju • • •

σiπ • U zavisnosti od vrsta orbitala i načina preklapanja kovalentne veze se dele na σ iπ • σ nastaje čeonim preklapanjem (duž ose koja spaja jezgra) • Može biti preklapanjem s i s; s i p, p i p orbitala



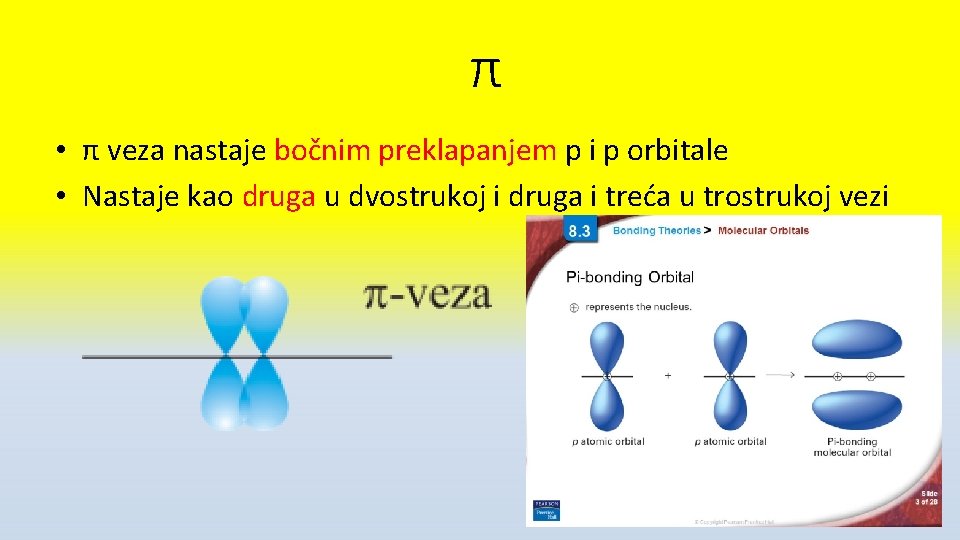
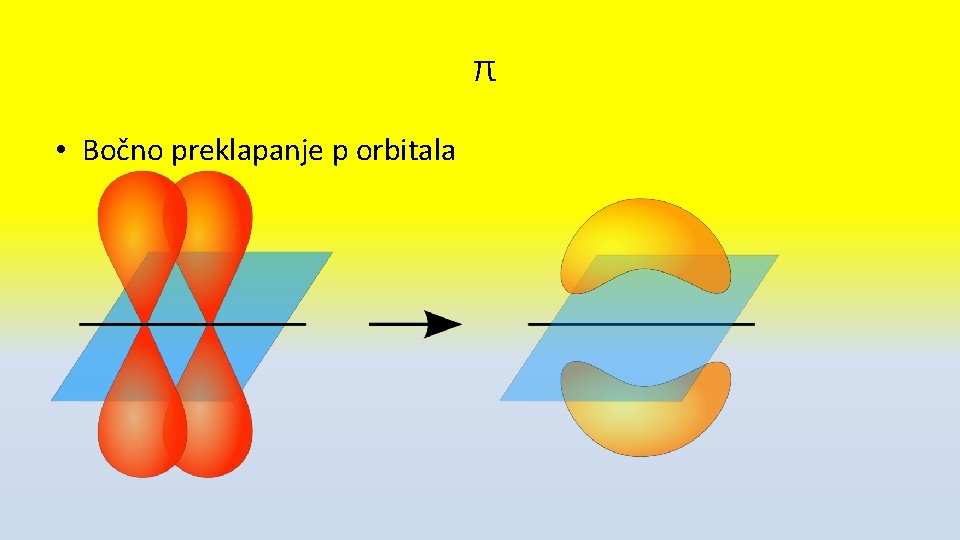
π • π veza nastaje bočnim preklapanjem p i p orbitale • Nastaje kao druga u dvostrukoj i druga i treća u trostrukoj vezi

π • Bočno preklapanje p orbitala



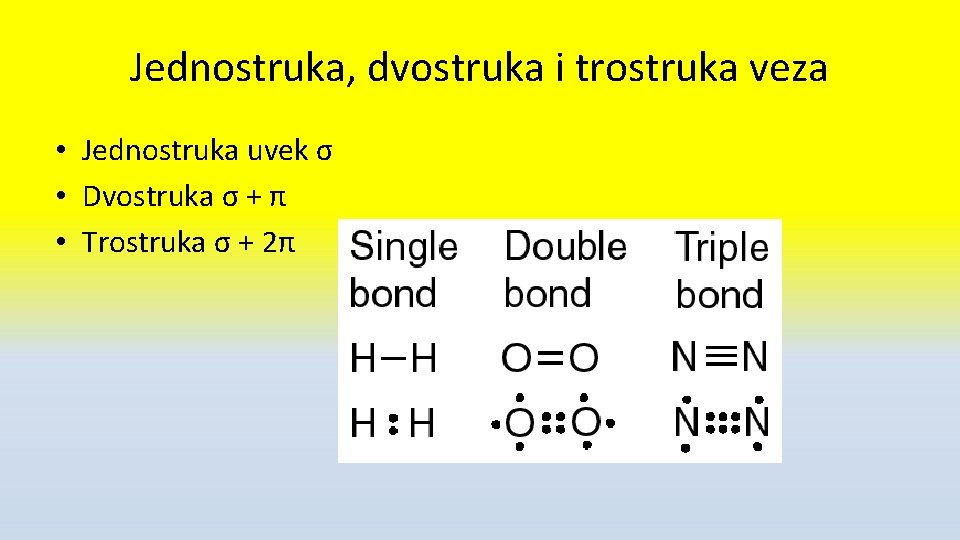
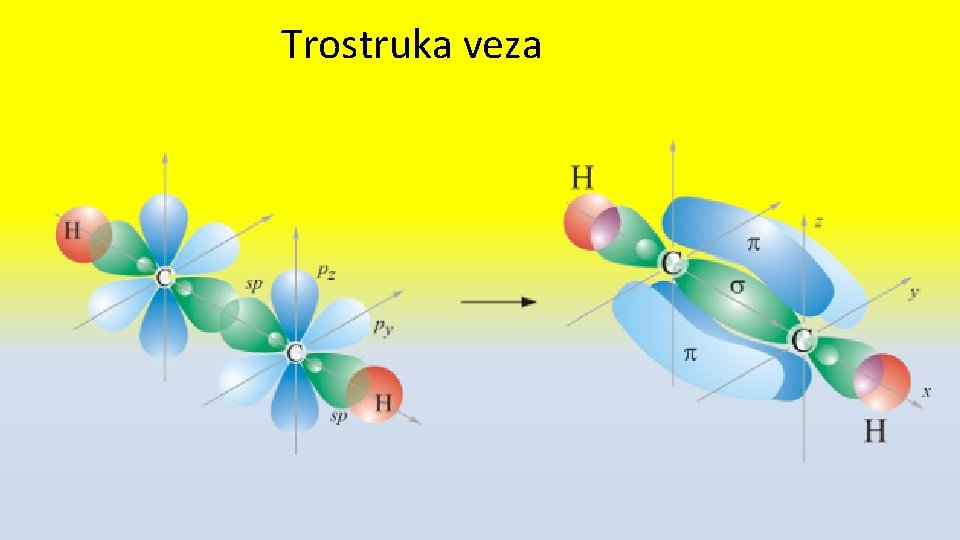
Jednostruka, dvostruka i trostruka veza • Jednostruka uvek σ • Dvostruka σ + π • Trostruka σ + 2π

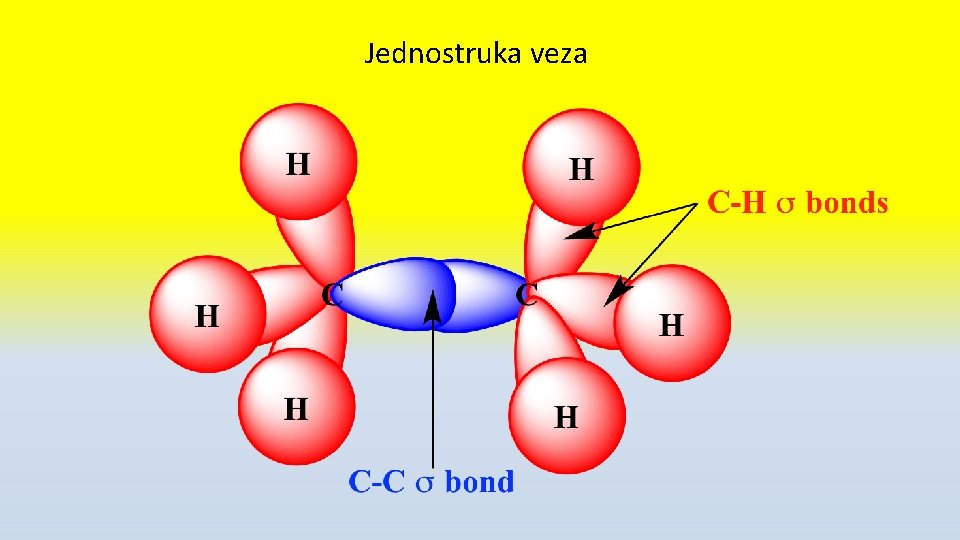
Jednostruka veza


Trostruka veza

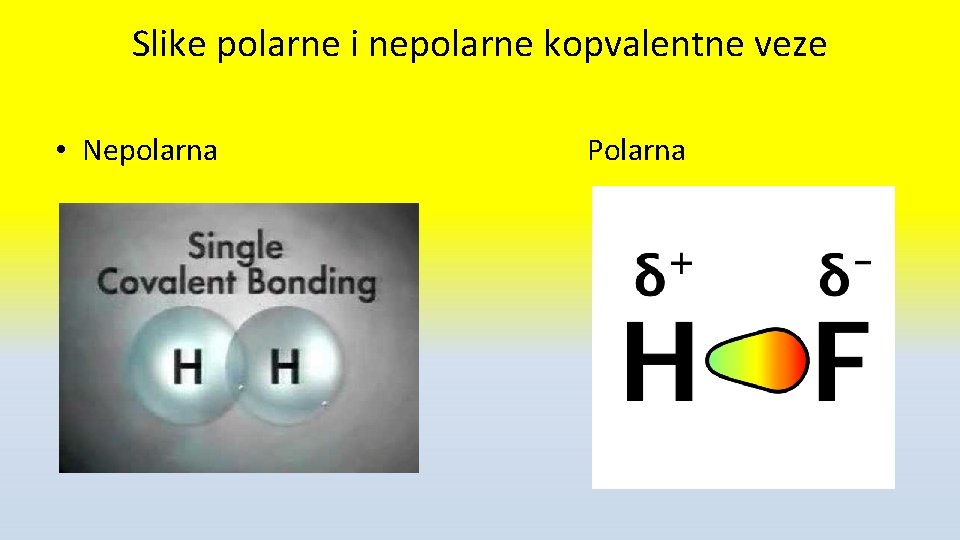
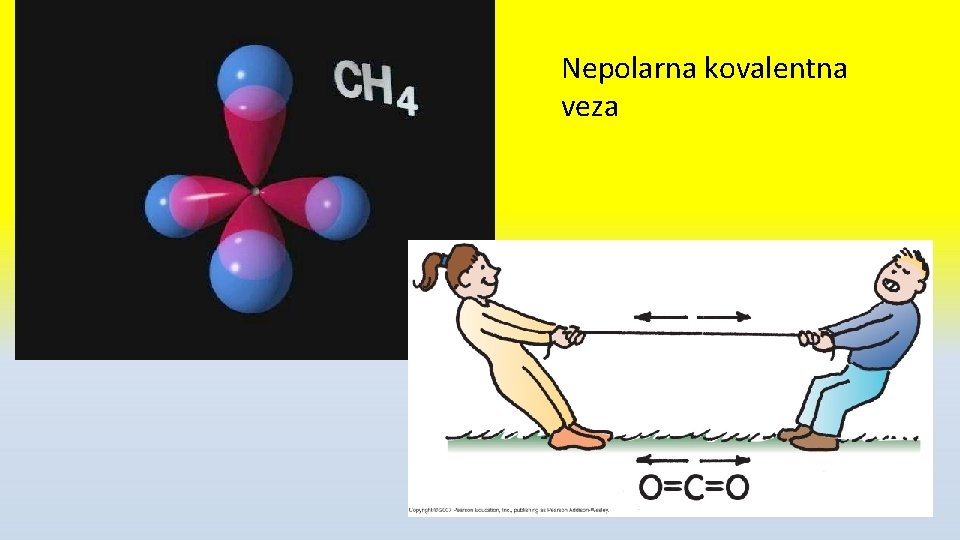
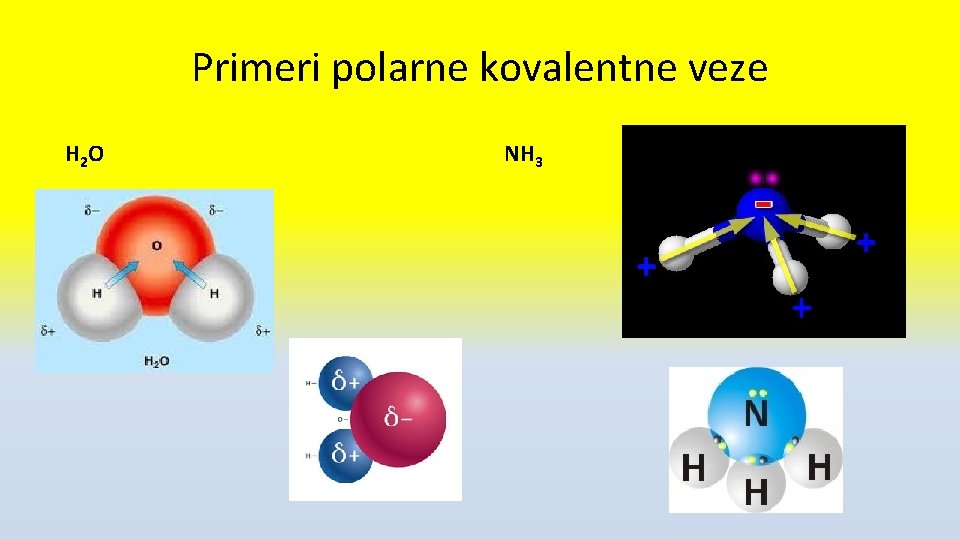
Polarna i nepolarna kovalentna veza • Elektronegativnost je sposobnost atoma elementa da privlači zajednički elektronski par • F ima najveću (4, 00) a Cs najmanju (0, 7) • Ako zajednički e- par grade atomi iste ili sličnih elektronegativnosti veza je NEPOLARNA kovalentna • Ako zajednički e- par grade atomi različite EN veza je POLARNA kovalentna sa delimično negativnim (δ -)naelektrisanjem na elektronegativnijem atomu i δ+ na drugom





Slike polarne i nepolarne kopvalentne veze • Nepolarna Polarna

Nepolarna kovalentna veza

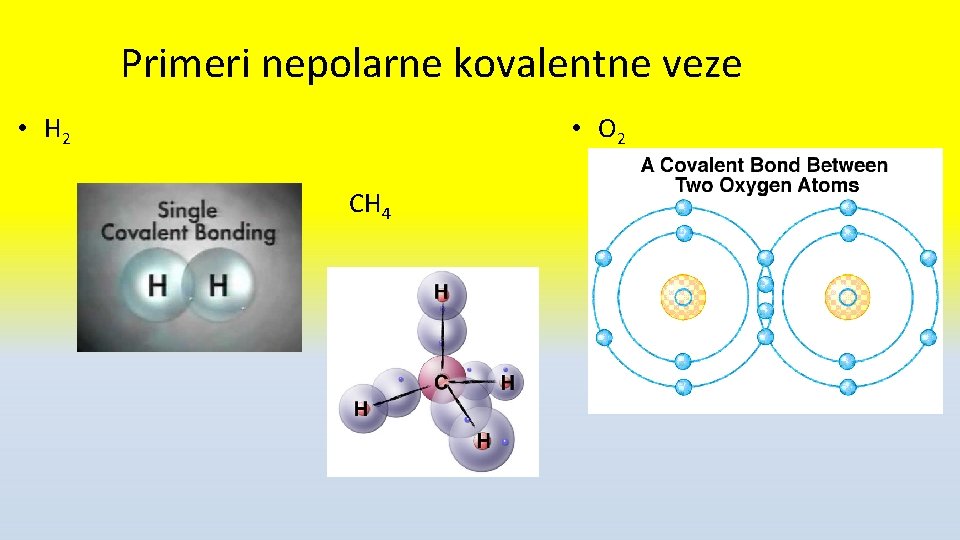
Primeri nepolarne kovalentne veze • H 2 • O 2 CH 4

Primeri polarne kovalentne veze H 2 O NH 3



HVALA NA PAŽNJI
 Jonska veza srednja skola
Jonska veza srednja skola Kovalentna vrska
Kovalentna vrska Polarna kovalentna väzba
Polarna kovalentna väzba Luisove formule
Luisove formule Luisovi simboli hemija
Luisovi simboli hemija Hemijske osobine metala
Hemijske osobine metala Osobine vode
Osobine vode Hemijska kinetika
Hemijska kinetika Hemijske osobine metala
Hemijske osobine metala Fizicke osobine vode
Fizicke osobine vode Termohemijske jednacine
Termohemijske jednacine Polihidroksilni fenoli
Polihidroksilni fenoli Antikatalitički proces
Antikatalitički proces Fizicke osobine alkana
Fizicke osobine alkana Uticaj koncentracije na brzinu hemijske reakcije
Uticaj koncentracije na brzinu hemijske reakcije Defekt mase i energija veze
Defekt mase i energija veze Polihidroksilni alkoholi
Polihidroksilni alkoholi Ksantoproteinska reakcija
Ksantoproteinska reakcija Energija veze
Energija veze E sfera veze između slajdova
E sfera veze između slajdova Defekt na masa
Defekt na masa Ne ne ne
Ne ne ne Intermolekulske veze
Intermolekulske veze Drvene konstrukcije spojevi
Drvene konstrukcije spojevi Sloj veze
Sloj veze Redna i paralelna veza otpora zadaci
Redna i paralelna veza otpora zadaci Intramolekulske veze
Intramolekulske veze Obsah a obvod trojuholníka
Obsah a obvod trojuholníka Fazorski dijagram napona i struja
Fazorski dijagram napona i struja Meyan kökü kola
Meyan kökü kola Lokacija teretnih kola
Lokacija teretnih kola Magnetizam elektrotehnika
Magnetizam elektrotehnika Skloňování slova kola
Skloňování slova kola Karolina kola
Karolina kola Kola reg
Kola reg Moja kola
Moja kola Oka kola
Oka kola M. intercostales intimi
M. intercostales intimi Agencija za strukovno obrazovanje
Agencija za strukovno obrazovanje Ggl pada generator bangkit tergantung arus penguatan dan
Ggl pada generator bangkit tergantung arus penguatan dan Výpočet ozubeného kola
Výpočet ozubeného kola Vyska na stranu trojuholnika vzorec
Vyska na stranu trojuholnika vzorec Erno kola
Erno kola Panteli kola
Panteli kola Wonder
Wonder Sağ kürek kemiğinden kola vuran ağrı
Sağ kürek kemiğinden kola vuran ağrı