Grupo 15 Familia del Nitrgeno Acevedo Domnguez Naray





























![Configuración Electrónica [Kr] 4 d 10 5 s 2 5 p 3 Número atómico Configuración Electrónica [Kr] 4 d 10 5 s 2 5 p 3 Número atómico](https://slidetodoc.com/presentation_image/119246d1af0369eb86a53a38940b67ce/image-39.jpg)













- Slides: 56

Grupo 15: Familia del Nitrógeno Acevedo Domínguez Naray Alejandra Alvarado Salinas Guillermo Samuel García Aragón Cynthia León Zárate María José López Guadarrama Alejandro Villanueva Estrada Estefanía

Generalidades del Grupo 15 (Familia VA) • Configuración electrónica que termina en n. S 2 n. P 3. ó n. S 2 nd 10 n. P 3. (Arsénico) • 5 electrones en su capa de valencia. • Los números de oxidación suelen ser o 5 o 3. • Tienden a formar 3 o 5 enlaces cuando son el átomo central de una molécula. • El carácter metálico aumenta con el aumento del número atómico. • EL punto de ebullición y de fusión aumenta a medida que aumenta el número atómico. Si el carácter metálico aumenta ¿Qué propiedad disminuye?

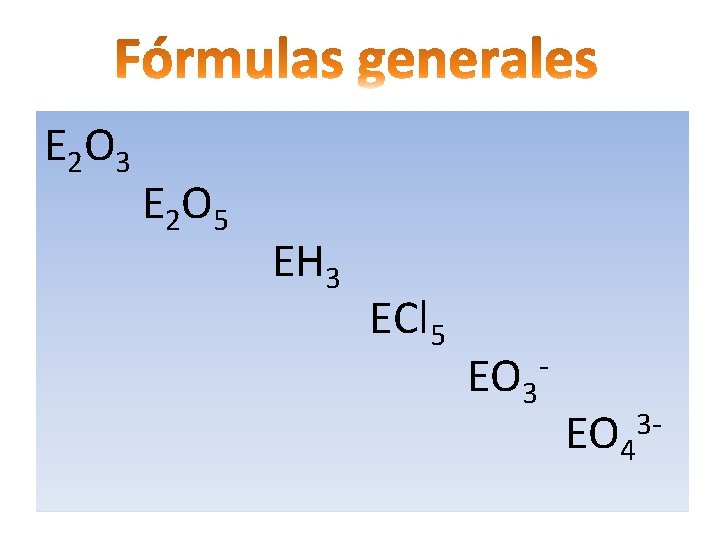
E 2 O 3 E 2 O 5 EH 3 ECl 5 EO 3 - EO 4 3 -

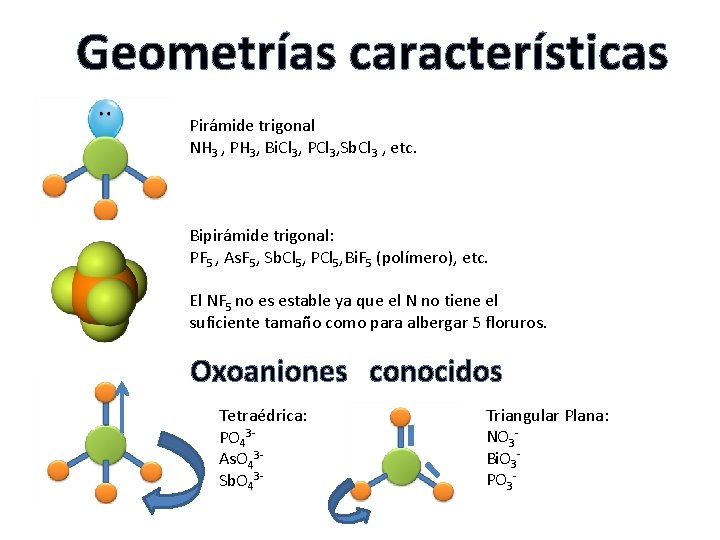
Geometrías características Pirámide trigonal NH 3 , PH 3, Bi. Cl 3, PCl 3, Sb. Cl 3 , etc. Bipirámide trigonal: PF 5 , As. F 5, Sb. Cl 5, PCl 5, Bi. F 5 (polímero), etc. El NF 5 no es estable ya que el N no tiene el suficiente tamaño como para albergar 5 floruros. Oxoaniones conocidos Tetraédrica: PO 43 As. O 43 Sb. O 43 - Triangular Plana: NO 3 Bi. O 3 PO 3 -

Mnemotecnia para Aprenderse el grupo 15

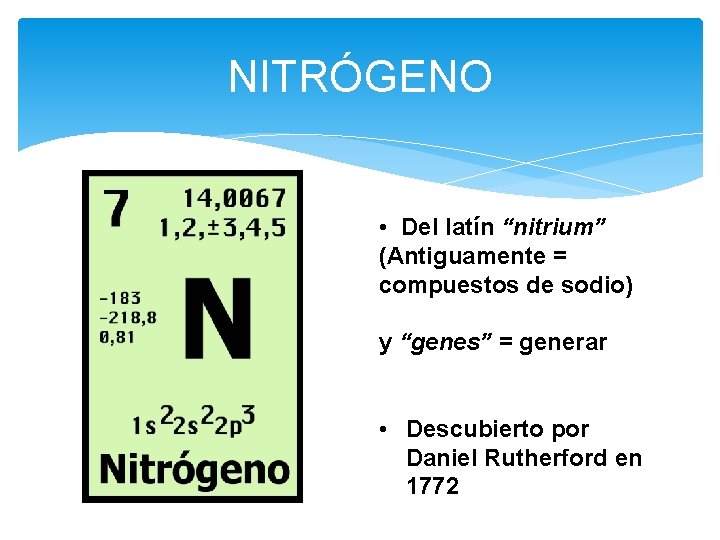
NITRÓGENO • Del latín “nitrium” (Antiguamente = compuestos de sodio) y “genes” = generar • Descubierto por Daniel Rutherford en 1772

Características Gas diatómico (N 2). Compone el 78 % del aire en la atmósfera Consta de 6 isótopos: 14 15 - Estables N y N - Radiactivos 12 N, 13 N, 16 N y 17 N

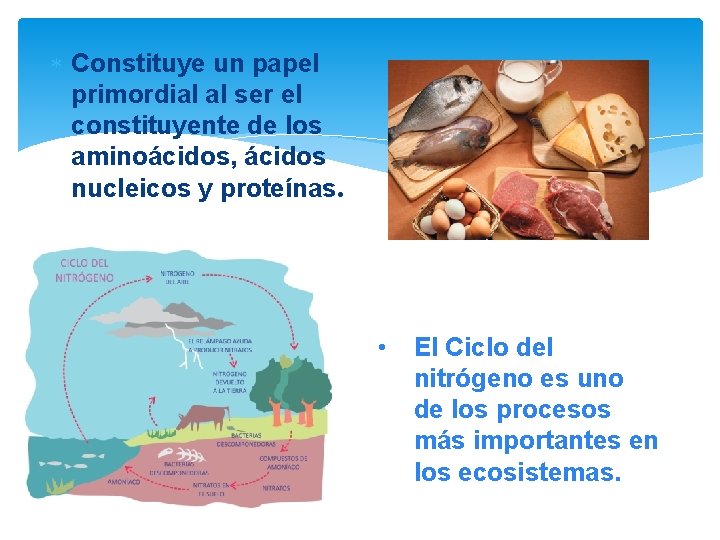
Constituye un papel primordial al ser el constituyente de los aminoácidos, ácidos nucleicos y proteínas. • El Ciclo del nitrógeno es uno de los procesos más importantes en los ecosistemas.

Nitruros Compuestos binarios Clasificación: salinos, covalentes e intersticiales. Su formación puede darse a partir de N 2 o NH 3, o por descomposición térmica de una amida: 6 Li (s) + N 2 → 2 Li 3 N(s) 3 Ca (s) + 2 NH 3 (l) → Ca 3 N 2 (s) + 3 H 2 (g)

NH 3 Gas incoloro Tóxico (en altos niveles de exposición) Líquido excelente disolvente. Producción de fertilizantes y fuente primaria en la producción de sustancias químicas. Se obtiene a partir del proceso Haber: N 2 (g) + 3 H 2 (g) → 2 NH 3 (g)

HNO 3 Líquido incoloro, corrosivo y tóxico ( puede causar quemaduras graves). Producción de fertilizantes y explosivos. Tiene usos adicionales en metalurgia y refinado.

NO 2 Gas color café. Olor fuerte y penetrante. Es uno de los contaminantes del aire más prominentes Su dímero N 2 O 4 (incoloro) ∆ + N 2 O 4(g) 2 NO 2 (g)

Usos Producción industrial del amoniaco NH 3 y conversión en ácido nítrico (HNO 3). En estado líquido se utiliza como refrigerante. Hidrazina N 2 H 4 y dimetilhidrazina N 2 H 2(CH 3)2 se utilizan como combustibles de cohetes.

Obtención A partir del aire : Eliminación del oxígeno Aire líquido: Destilación fraccionada Descomposición de NH 4 NO 2 : NH 4 NO 2(s) → 2 H 2 O (g)+ N 2 (g) Oxidación de amoniaco con óxido de cobre (II): 2 NH 3 (g) + 3 Cu. O (s) → 3 Cu (s) + 3 H 2 O + N 2 (g)

Aplicaciones

FÓSFORO • Descubierto en 1669 por Hennig Brandt • Del griego “portador de luz”.

El fósforo P 4 se encuentra como una serie de alótropos. Fósforo blanco Fósforo rojo Fósforo negro (el más estable)

Obtención Reducción de Fluoroapatita (Ca 5(PO 4)3 F) e Hidroxiapatita (Ca 5(PO 4)3 OH).

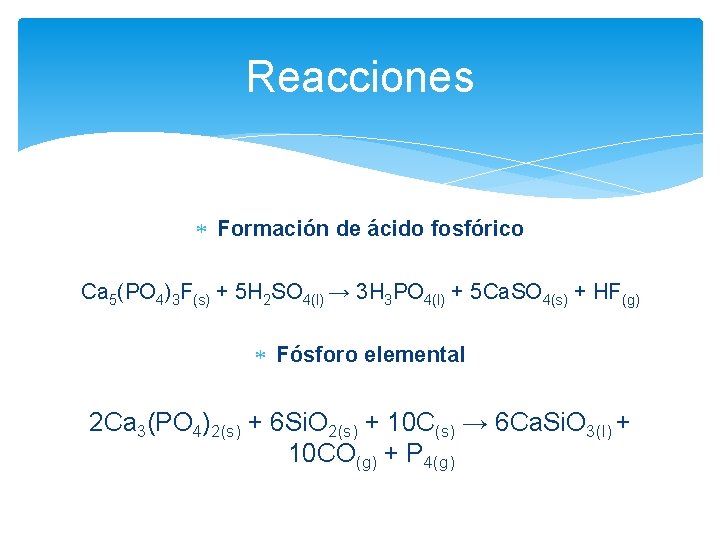
Reacciones Formación de ácido fosfórico Ca 5(PO 4)3 F(s) + 5 H 2 SO 4(l) → 3 H 3 PO 4(l) + 5 Ca. SO 4(s) + HF(g) Fósforo elemental 2 Ca 3(PO 4)2(s) + 6 Si. O 2(s) + 10 C(s) → 6 Ca. Si. O 3(l) + 10 CO(g) + P 4(g)

Funciones biológicas

Usos Pirotecnia, bombas de humo, fabricación de acero y aleaciones. El 85% del ácido fosfórico se emplea en la producción de fertilizantes.

Aplicaciones

ARSÉNICO

Historia � Se conoce desde tiempos remotos, al igual que sus compuestos sulfurados. � Desde entonces se conocían sus propiedades toxicas, irritantes y corrosivas. � Roger Bacon y Alberto Magno se detuvieron en su estudio —se cree que este último fue el primero en aislar el elemento en el año 1250.

Datos generales del elemento � Sólido � Metaloide � Bloque 4, periodo P � Masa atómica: 74. 926 u � Configuración electrónica: [Ar]4 s 2 3 d 10 4 p 3 � Radio medio 115 pm � Electronegatividad 2, 18 (Pauling) � Estado(s) de oxidación ± 3, 5

Estados alotrópicos � Gris metálico • • • Estructura cristalina: romboédrica Densidad: 5, 73 g/cm 3 Punto de fusión: 887 K (614 °C) Punto de ebullición: 1090 K (817 °C) Buen conductor térmico Mal conductor eléctrico

� Amarillo • • Densidad: 1, 97 g/cm 3 Extremadamente volátil Más reactivo que el arsénico metálico Presenta fosforescencia a temperatura ambiente Ø Negro • • Densidad: 4, 7 g/cm 3 Estructura cristalina: hexagonal

Principales minerales � • • Alacranita Fórmula química: As 8 S 9 Densidad: 3. 43 g/cm 3 Arsenolita Fórmula química: As 2 O 3 Densidad: 3, 7 g/cm 3 • Getchellita Fórmula química: Sb. As. S 3 • Densidad: 3. 98 g/cm 3 �

� • • Ø • • Oropimente Fórmula química: As 2 S 3 Densidad: 3, 53 g/cm 3 Rejalgar Fórmula química: As 4 S 4 Densidad: 3, 56 g/cm 3 Tennantita Fórmula química: Cu 12 As 4 S 13 Densidad: 4. 7 g/cm 3

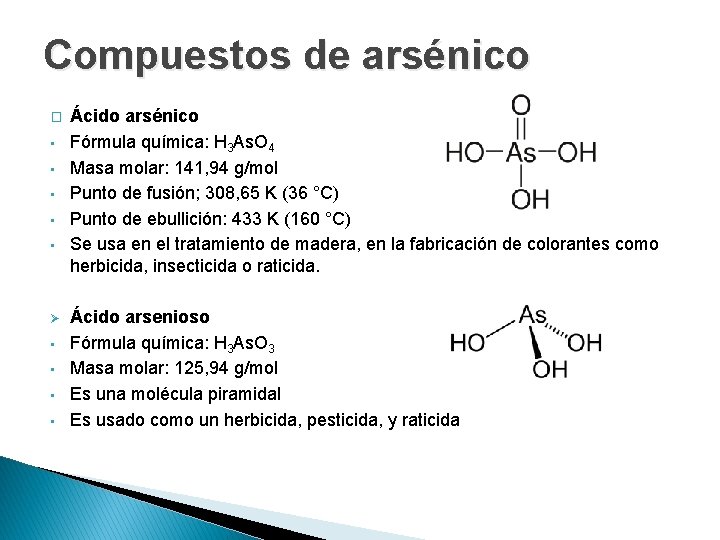
Compuestos de arsénico � • • • Ø • • Ácido arsénico Fórmula química: H 3 As. O 4 Masa molar: 141, 94 g/mol Punto de fusión; 308, 65 K (36 °C) Punto de ebullición: 433 K (160 °C) Se usa en el tratamiento de madera, en la fabricación de colorantes como herbicida, insecticida o raticida. Ácido arsenioso Fórmula química: H 3 As. O 3 Masa molar: 125, 94 g/mol Es una molécula piramidal Es usado como un herbicida, pesticida, y raticida

� • • • Ø • • • Trihidruro de arsénico III Fórmula química: As. H 3 Punto de fusión: 157 K (-116 °C) Punto de ebullición: 210 K (-63 °C) Masa molar: 78. 0 g/mol Gas incoloro, inflamable y altamente tóxico Se usa en síntesis orgánicas y en la formación de materiales semiconductores. Trióxido de arsénico Fórmula química: As 2 O 3 Punto de fusión: 585 K (312 °C) Punto de ebullición: 738 K (465 °C) Masa molar: 197. 8 g/mol Se usa en la fabricación de pesticidas, tratamiento de la leucemia, preservativos para madera y elaboración de semiconductores.

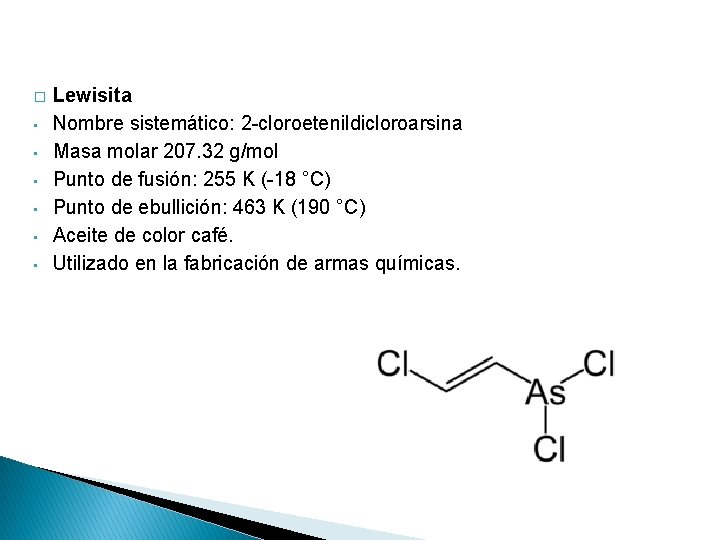
� • • • Lewisita Nombre sistemático: 2 -cloroetenildicloroarsina Masa molar 207. 32 g/mol Punto de fusión: 255 K (-18 °C) Punto de ebullición: 463 K (190 °C) Aceite de color café. Utilizado en la fabricación de armas químicas.

Intoxicación con arsénico � Cuadro clínico agudo • Síntomas gastrointestinales: aliento con olor a ajo, náuseas, vómito, diarrea. • Síntomas cardiovasculares: hipotensión arterial y shock. • Síntomas cutáneo-mucosos: irritación, vesicación y desprendimiento de piel. • Síntomas neurológicos: cefalea, letargo, convulsiones, disfunciones motoras y coma. • Síntomas hematológicos: aplasia medular, desencadenante de anemia, leucopenia, y trombocitopenia.

� Cuadro clínico crónico (arsenicosis) • Es causado principalmente por el consumo continuado de agua contaminada o por el trabajo con dicha sustancia. • La arsenicosis tiene relación directa con la aparición de varios tipos de cáncer. • Síntomas digestivos: náuseas, vómitos, dolores abdominales. • Síntomas cutáneos: aparición de vesículas, ulceras y verrugas. • Lesiones degenerativas en el hígado, lesiones cardiacas, daño renal.

Dato curioso � En las aguas tóxicas y salobres del Lago Mono, en California, una bacteria puede sustituir el fósforo (que hasta la fecha se consideraba indispensable para la vida) con arsénico, al punto de incorporar este elemento a su (ADN). � Este descubrimiento abre la puerta a la búsqueda de nuevas formas de vida en planetas que no contengan fósforo en su atmósfera. � Sin embargo, la bacteria es resistente al arsénico pero no puede sustituir por completo el fósforo.

ANTIMONIO Del griego anti monos “no solo” Símbolo del latín stibium “lápiz”, ya que el negro del antimonio se utilizaba antes para pintarse las cejas.

Características Metaloide 4 formas alotrópicas (blanco, amarillo, negro y explosivo) Acidez media Estructura cristalina Romboédrica Apariencia: sólido cristalino, fundible, quebradizo, blanco plateado que presenta una conductividad eléctrica y térmica baja

Características Isótopos: 31 isótopos de los cuales 2 son estables y se encuentran en la naturaleza. 121 Sb (57. 36%) 123 Sb (42. 62%) Abundancia Corteza terrestre: 0. 2 ppm Sistema Solar: 950 ppb
![Configuración Electrónica Kr 4 d 10 5 s 2 5 p 3 Número atómico Configuración Electrónica [Kr] 4 d 10 5 s 2 5 p 3 Número atómico](https://slidetodoc.com/presentation_image/119246d1af0369eb86a53a38940b67ce/image-39.jpg)
Configuración Electrónica [Kr] 4 d 10 5 s 2 5 p 3 Número atómico 51 Peso atómico 121. 76 Punto de Fusión 630. 7 °C Punto de Ebullición 1750 °C Estado de agregación Sólido Densidad 6. 69 g/cm 3 Dureza de Mohs 3. 5 Niveles de oxidación -3, 3, 5 Electronegatividad 2. 05 Radio Atómico 159 pm %m en la corteza terrestre 6. 5 x 10 -5% Isótopos (%) Sb-121 (57. 21%) Sb-123 (42. 79%)

Obtención Se puede encontrar en minerales como antimonita o estibina (Sb 2 S 3) y valentinita (Sb 2 O 3). Estibina Reducción del óxido con coque 2 Sb 2 O 3 + 3 C → 4 Sb + 3 CO 2 Reducción del sulfuro con hierro Sb 2 S 3 + 3 Fe → 2 Sb + 3 Fe. S Valentinita

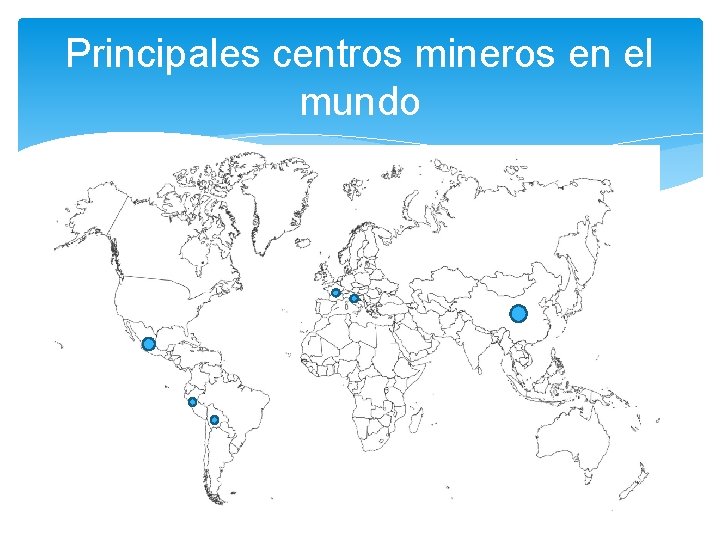
Principales centros mineros en el mundo

Usos Es muy quebradizo por lo que se usa en aleaciones con otros metales como el Sn y Pb. Utilizado en semiconductores (diodos, detectores de infrarrojo). En acumuladores eléctricos. Catalizador en la polimerización del PET (Sb 2 O 3). Sus compuestos son utilizados en retardantes de llama(Sb 2 O 3), pinturas, cerámica, esmaltes, pirotecnia (Sb 2 S 3), entre otros.

Riesgos a la Salud Es tóxico. El envenenamiento con este elemento es similar al causado por el As. Una leve intoxicación puede ocasionar mareo, cefalea y depresión. Una intoxicación grave produce vómitos frecuentes y la muerte.


Historia El bismuto se conocía desde la antigüedad, pero hasta a mediados del siglo XVIII se confundía con el plomo, estaño y cinc. Fue aislado en 1753, en Francia, por C. F. Geoffroy. De la palabra alemana "bisemutum" que significa "materia blanca", en alusión al color del elemento.

Descripción del bismuto • En la clasificación geoquímica de los elementos pertenece a los calcófilos. • Existe en la naturaleza como metal libre y en minerales. • Los compuestos más estables son los del bismuto trivalente. • El bismutato de sodio y el pentafluoruro de bismuto son quizá los compuestos más importantes de Bi(V).

Descripción del bismuto Es opaco a los rayos X y en algunas aleaciones tiene un punto de fusión bajo. Poco conductor del calor y la electricidad. Es un sólido, duro y quebradizo.

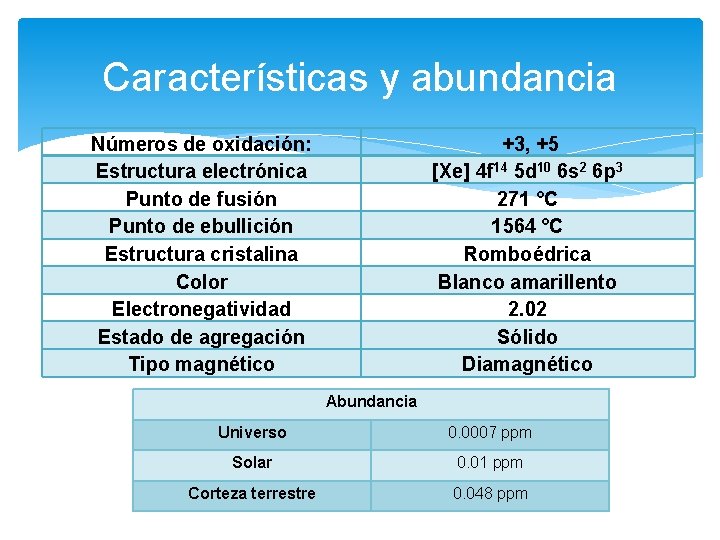
Características y abundancia Números de oxidación: Estructura electrónica Punto de fusión Punto de ebullición Estructura cristalina Color Electronegatividad Estado de agregación Tipo magnético +3, +5 [Xe] 4 f 14 5 d 10 6 s 2 6 p 3 271 °C 1564 °C Romboédrica Blanco amarillento 2. 02 Sólido Diamagnético Abundancia Universo 0. 0007 ppm Solar 0. 01 ppm Corteza terrestre 0. 048 ppm

Minerales Bismutina (Bi 2 S 3) Bismutita Bi 2(CO 3)O 2 Tetradimita (Bi 2 Te 2 S) Eulinita Bi 4(Si. O 4)3 Telurobismuto (Bi 2 Te 3)

Reacciones con agua 2 Bi(s) + 3 H 2 O(g) → Bi 2 O 3(s) + 3 H 2(g) Reacciones con aire 4 Bi(s) + 3 O 2(g) → 2 Bi 2 O 3(s) Reacciones con halógenos 2 Bi(s) + 5 F 2(g) → 2 Bi. F 5(s) 2 Bi(s) + 3 I 2(g) → 2 Bi. I 3(s)

Reacciones Bismuto se disuelve en ácido sulfúrico concentrado o ácido nítrico, soluciones de forma que contenga Bi(III). La reacción de ácido sulfúrico produce dióxido de azufre(IV). Con ácido clorhídrico en presencia de oxígeno, se produce cloruro de bismuto (III). 4 Bi(s) + 3 O 2(g) + 12 HCl(aq) 4 Bi. Cl 3(aq) + 6 H 2 O(l)

Obtención Parte del bismuto comercial se obtiene como subproducto en las metalurgias de otros metales como cobre, plomo y estaño , así como de los lodos anódicos formados en los procesos de refinado electrolítico de éstos. Método de Betts

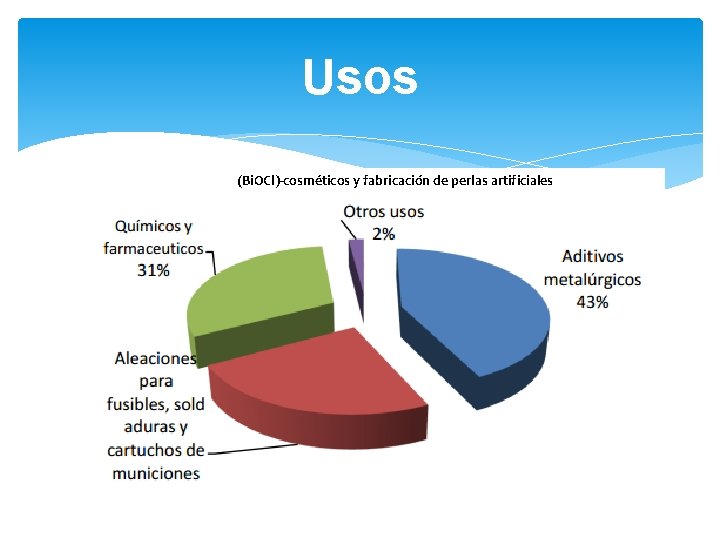
Usos (Bi. OCl)-cosméticos y fabricación de perlas artificiales

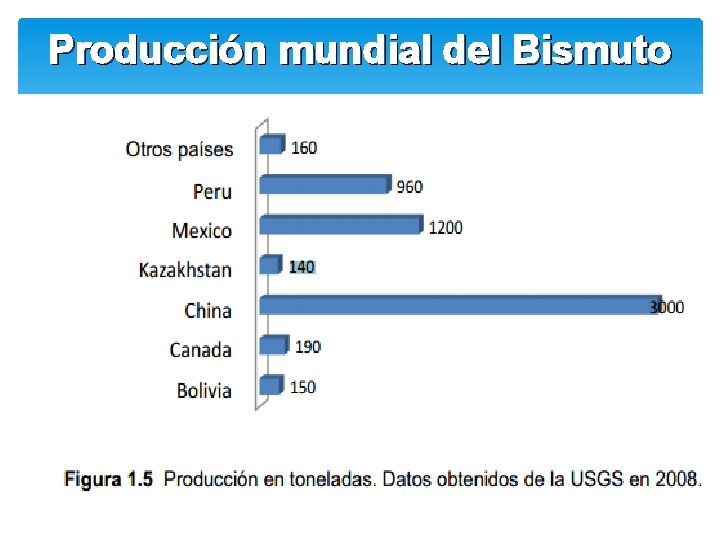
Producción mundial del Bismuto

“Metal verde” Salicilato de Bismuto C 7 H 5 Bi. O 4

Bibliografía http: //eprints. uanl. mx/2660/1/S%C 3%8 DNTESIS_Y_CARACTERIZACI%C 3%93 N_DE__ NANOPART%C 3%8 DCULAS_DE_BISMUTO_OBTENIDAS_MEDIANTE_IRRADIACI%C 3%93 N_DE_MICROO. pdf Mirete Salvador, Catálogo-Glosario de especies minerales, ed. Ministerio de ciencia y tecnología, Madrid, 1991, pp. 166. SHRIVER & ATKINS, Química Inorgánica 4ª Edición, Ed. Mc. Graw Hill, México, 2008, p 347 -375 BROWN, Theodore; Química. La Ciencia Central, Ed. Pearson Educación, México, 2009, p. 890 -899. file: ///C: /Program%20 Files%20(x 86)/freshney. org/Periodic%20 Table/data/EN/xhelp/ page 7. htm
 Margarita gomez acevedo
Margarita gomez acevedo Acevedo in english
Acevedo in english Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Grupo adverbial exemplos
Grupo adverbial exemplos Grupo objeto y grupo sujeto ejemplos
Grupo objeto y grupo sujeto ejemplos Sujeito composto
Sujeito composto Porque la familia es un grupo social
Porque la familia es un grupo social Tabela periodica familia e grupo
Tabela periodica familia e grupo Tabela periodica familia e grupo
Tabela periodica familia e grupo Cuál es la misión de la familia
Cuál es la misión de la familia Que es la familia incompleta
Que es la familia incompleta Muestre respeto y amor en su matrimonio
Muestre respeto y amor en su matrimonio Elementos del grupo 3
Elementos del grupo 3 Grupo funcional del alcohol etilico
Grupo funcional del alcohol etilico Esteres ejemplos
Esteres ejemplos Xenón grupo
Xenón grupo Elementos del grupo 15
Elementos del grupo 15 Elementos bloque p
Elementos bloque p Grupo de nitrógeno
Grupo de nitrógeno Estructura del grupo
Estructura del grupo Actividad economica de exito
Actividad economica de exito Características del conductor de un grupo
Características del conductor de un grupo Propiedades fisicas de los esteres
Propiedades fisicas de los esteres Halogeno
Halogeno Mdl del grupo
Mdl del grupo Vanadio
Vanadio Familia del piruvato
Familia del piruvato Tabla periodica familia del boro
Tabla periodica familia del boro Que ninguna familia se acabe por falta de amor
Que ninguna familia se acabe por falta de amor Familia del 80c537
Familia del 80c537 Familia es un verbo o adjetivo
Familia es un verbo o adjetivo Lista de los deberes cristianos
Lista de los deberes cristianos Fachada del nacimiento sagrada familia
Fachada del nacimiento sagrada familia La sociedad del siglo xxi, nuevos paradigmas de familia
La sociedad del siglo xxi, nuevos paradigmas de familia Oboe instrumento musical
Oboe instrumento musical Grupo de vitaminas
Grupo de vitaminas Desventajas de una lluvia de ideas
Desventajas de una lluvia de ideas Cetonas terminacion
Cetonas terminacion Ibigay ang limang elemento ng tula
Ibigay ang limang elemento ng tula Diferencias entre grupo y equipo
Diferencias entre grupo y equipo Tipos de participantes
Tipos de participantes Clasificacion de las proteinas
Clasificacion de las proteinas Kcat enzimas
Kcat enzimas El color amarillo
El color amarillo Esquema de la tabla periodica
Esquema de la tabla periodica Familia ia
Familia ia Periodo en quimica
Periodo en quimica Strepto grupo b
Strepto grupo b Caproaldehido
Caproaldehido Indice de grupo
Indice de grupo Genero y numero de grupos nominales
Genero y numero de grupos nominales Nitrilo grupo funcional
Nitrilo grupo funcional Nitrilos
Nitrilos Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Grupo amino
Grupo amino Heteroproteinas definicion
Heteroproteinas definicion Exemplos de pronomes
Exemplos de pronomes