Elementos del Grupo 13 Grupo 13 Caractersticas generales
























- Slides: 30

Elementos del Grupo 13

Grupo 13 • Características generales. • Obtención. • Reacciones químicas principales de los elementos. • Importancia industrial y económica. Liga para obtener el archivo de ésta presentación: http: //depa. fquim. unam. mx/vmus/Inorganica/Teo/presentaciones

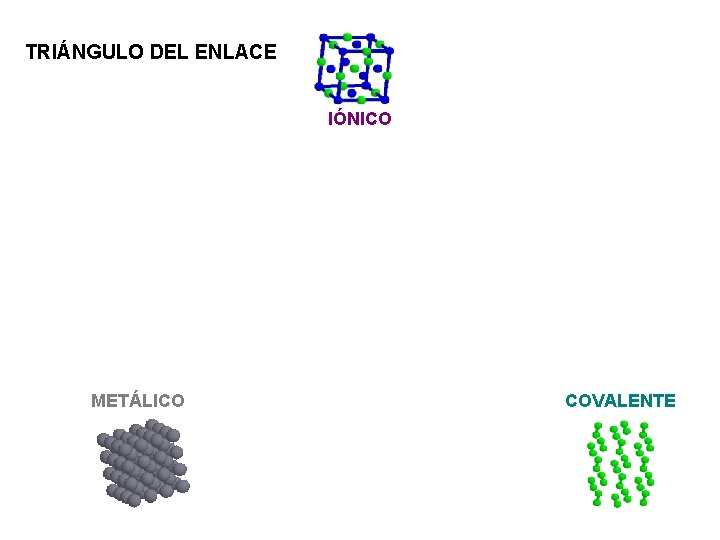
TRIÁNGULO DEL ENLACE IÓNICO METÁLICO COVALENTE

Tablas periódicas (recomendaciones) http: //freshney. org/software. htm http: //depa. fquim. unam. mx/vmus/Tools/Programas/Tabla. Periodica. zip http: //www. educaplus. org/

Generalidades Incremento del carácter metálico del boro al talio, (boro es un no metal). ¿? Puntos de fusión (sin tendencia) ¿B ? Puntos de ebullición decrecen con Z. Configuración electrónica: ns 2 np 1 (deficiencia electrónica, ácidos de Lewis) Estado de oxidación +3. Para todos excepto B también +1. Solo Ga, In y Tl presentan +2. Efecto del par inerte (Talio).

BORO (B) ABUNDANCIA Universo: 0. 001 ppm (peso) Sol: 0. 002 ppm (peso) Corteza terrestre: 950 ppm Agua marina: 4. 41 ppm Humano: 700 ppb (peso) 410 ppb (por átomo). Abunda en zonas volcánicas: Colemanita (Ca 2 B 6 O 11 • 5 H 2 O) Boracita (Mg 7 Cl 2 B 16 O 30) Kernita (Na 2 B 4 O 6(OH)2 • 3 H 2 O) Ulexita (Na. Ca. B 5 O 6(OH)6 • 5 H 2 O) Borax (Na 2 B 4 O 5(OH)4 • n. H 2 O), 4<n<10 Ácido bórico (H 3 BO 3) (H 3 BO 3 + H 2 O = B(OH)4 + H+)

Obtención 2 BBr 3(g) + 3 H 2(g) 2 B(g) + 6 HBr(g) Sobre filamentos de tántalo a 1300 °C Reacciones 4 B(s) + 3 O 2(g) 2 B 2 O 3(s) 2 B(s) + 3 F 2(g) 2 BF 3(g) 2 B(s) + 3 Cl 2(g) 2 BCl 3(g) 2 B(s) + 3 Br 2(g) 2 BBr 3(g)

Economía y usos Esmaltes, chinos Boratos en momificación, egipcios Vidrio, romanos Principales productores, 3 millones de t al año

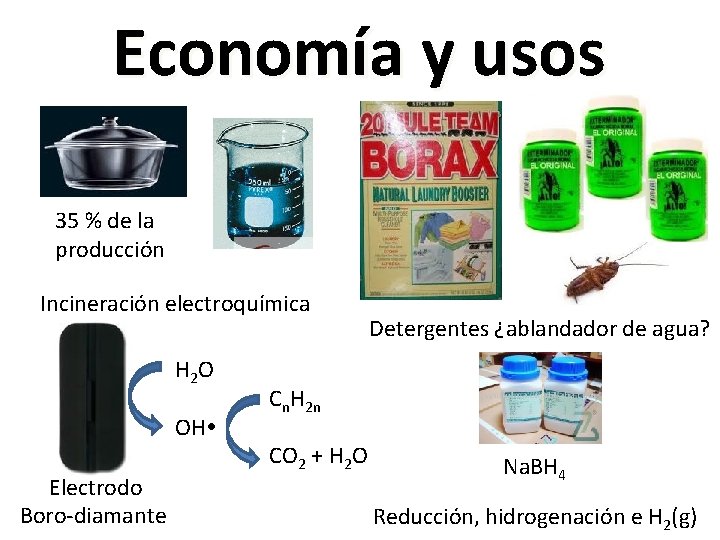
Economía y usos 35 % de la producción Incineración electroquímica H 2 O OH Electrodo Boro-diamante Detergentes ¿ablandador de agua? Cn. H 2 n CO 2 + H 2 O Na. BH 4 Reducción, hidrogenación e H 2(g)

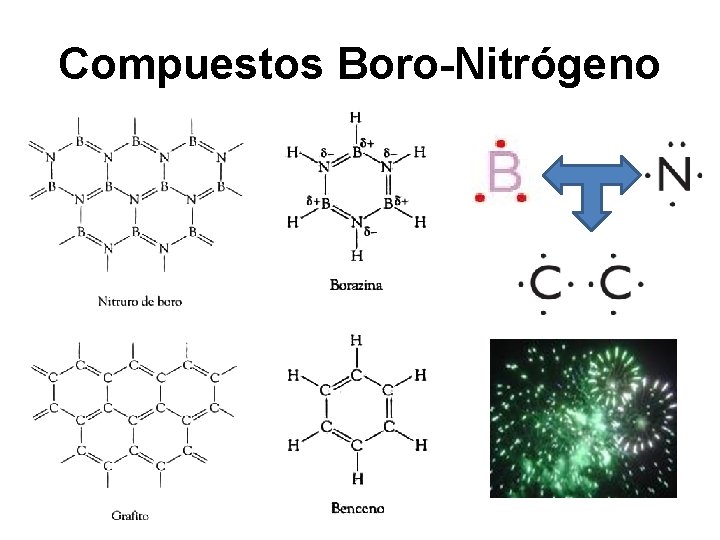
Compuestos Boro-Nitrógeno

Aluminio (Al) ABUNDANCIA Universo: 50 ppm (peso) Sol: 60 ppm (peso) Corteza terrestre: 82000 ppm Agua marina: 0. 0004 ppm Humano: 700 ppb (peso) 210 ppb (por átomo). El aluminio se encuentra usualmente como silicato de aluminio o como silicato mixto de aluminio y otros metales como sodio, potasio, hierro, calcio y magnesio. (No rentables para extracción de Al). La bauxita (Al 2 O 3) y criolita (Na 3 Al. F 6), son la fuente comercial de aluminio y sus compuestos.

Obtención Proceso Hall-Heroult. - El óxido de aluminio (Al 2 O 3) se disuelve en criolita (Na 3 Al. F 6) fundida, aproximadamente a 1000°C. Con electrólisis de la mezcla, el aluminio se reduce en el cátodo, y en el ánodo (de carbón), se forma CO 2 con el oxígeno del Al 2 O 3. Reacciones 2 Al(s) + 3 O 2(g) 2 Al 2 O 3(s) 2 Al(s) + 3 Cl 2(g) 2 Al. Cl 3(s) 2 Al(s) + 3 I 2(g) Al 2 I 6(s) 2 Al(s) + 3 H 2 SO 4(ac) 2 Al 3+(ac) + 3 SO 42 -(ac) + 3 H 2(g) 2 Al(s) + 6 HCl(ac) 2 Al 3+(ac) + 6 Cl-(ac) + 3 H 2(g) 2 Al(s) + 2 Na. OH(ac) + 6 H 2 O 2 Na+(ac) + 2 [Al(OH)4]-(ac) + 3 H 2(g)

Economía y usos Año Prod. Anual Costo/kg 1886 45 kg 11 USD 1989 18 x 106 t 2 USD • Australia es primer productor 65 x 106 t (2005). • En México se consumen al año, 277, 608 t de Al. 180 latas de Al por habitante ($9. 8/kg). • Las latas de refresco solo consumen aproximadamente 8 %, el 75 % es metal reciclado. • La energía del reciclado equivale al 5 % de la energía utilizada obtención de Al. Medicina, Al(OH)3 para curar la acidez Excelente conductor de calor Mac. Book air (la laptop más ligera del mundo, con carcasa de Al)

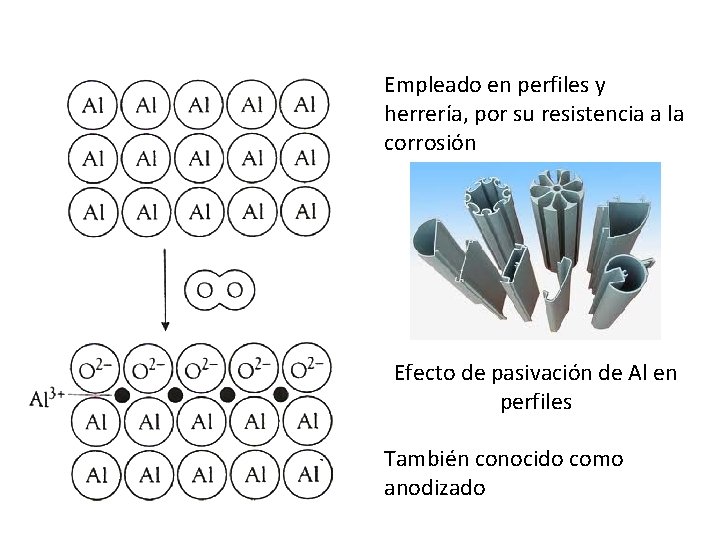
Empleado en perfiles y herrería, por su resistencia a la corrosión Efecto de pasivación de Al en perfiles También conocido como anodizado

Economía y usos Conductor de electricidad Cocción de alimentos Compuestos de aluminio Catalizadores (Friedel Craft, Al. Cl 3) Purificación del agua, Al 2(SO 4)3 Maleable empaque de alimentos y bebidas Cerámicas, Al 2 O 3

Galio (Ga) ABUNDANCIA Universo: 0. 01 ppm (peso) Sol: 0. 04 ppm (peso) Corteza terrestre: 18 ppm Agua marina: 0. 00003 ppm Humano: --- Muy baja abundancia: Galita [Cu. Ga. S 2] y sohngeita [Ga(OH)3]. No existe en forma elemental en la naturaleza. Se encuentra en bauxita, blenda, germanita, pirita, magnetita y caolín, como impureza. Sólo se producen 30 t al año.

Obtención Se recupera como un subproducto de la fabricación de aluminio y se obtiene por electrólisis. Reacciones 2 Ga(s) + 3 O 2(g) 2 Ga 2 O 3(s) Ga(s) + H 2 O(l) no reacciona 2 Ga(s) + 6 HCl(conc) 2 Ga 3+(ac) + 6 Cl-(ac) + 3 H 2(g) 2 Ga(s) + 2 Na. OH(ac) + 6 H 2 O 2 Na+(ac) + 2 [Ga(OH)4]-(ac) + 3 H 2(g)

Economía y usos Descubierto por Paul Lecoq, en Francia 1875. En latín: Gallium Principales países importadores: amplificador de microondas por la emisión estimulada de radiación Aleación Ga-Sn(l) Empleada como enfriador de chips de computadora (65 veces más efectiva) Transistores, rectificadores, celdas fotoeléctricas, diodos láser y máser (Ga. Sb, Ga. P y Ga. As).

Economía y usos Termómetros de alta temperatura Medicina nuclear (Ga-67). Detección de infecciones, tumores y abscesos. Las combinaciones con Ni y Nb son superconductoras A la intemperie forma una capa fina de óxido insoluble e inerte

Indio (In) ABUNDANCIA Universo: 0. 0003 ppm (peso) Sol: 0. 004 ppm (peso) Corteza terrestre: 0. 0049 ppm Agua marina: 0. 0000001 ppm Humano: --Muy baja abundancia: Indita [Fe. In 2 S 4], la requesita [Cu. In. S 2] y como [In 2 S 3]. No existe en forma elemental en la naturaleza. Se encuentra en minerales de hierro, plomo, zinc y cobre, como impureza. Sólo se producen 75 t al año, principalmente por Canadá.

Obtención Se recupera como un subproducto de la fabricación de zinc, cobre, hierro y plomo. Se obtiene generalmente por electrólisis. Reacciones 2 In(s) + 3 O 2(g) 2 In 2 O 3(s) In(s) + H 2 O(l) no reacciona 2 In(s) + 6 HCl(conc) 2 In 3+(ac) + 6 Cl-(ac) + 3 H 2(g) 2 In(s) + 2 Na. OH(ac) + 6 H 2 O no reacciona

Economía y usos • En 2010, la producción mundial total alcanzó 574 t de indio (China produce 300 t, Corea del Sur 80 t y Japón 70 t). • En 2000, el In sólo se empleaba en la industria de la microelectrónica como parte de las soldaduras. Se vendía a precios de alrededor de 70 euros/Kg y la producción mundial total no rebasaba las 100 t. • En 2005 irrumpen los televisores planos en el mercado y los dispositivos de pantalla táctil. • ITO = Indium-Tin-Oxide (In 2 O 3 y Sn. O 2). • En 2011, el precio subió desde 436 hasta 520 euros por kg. Un aumento del 20 % en seis semanas. • Reservas de 49 000 t de In en el mundo. • La alternativa es el Ca. O, cuatro veces mejor conductor que el ITO. Se agrieta con el tiempo. • Otra opción es el grafeno.

Economía y usos • El ITO es fundamental para el montaje de la membrana de electrodos transparentes en el interior de los paneles LCD. • Son sustratos de vidrio con electrodos de ITO. Pantallas planas LCD Dispositivos táctiles GPS

Talio (Tl) ABUNDANCIA Universo: 0. 0005 ppm (peso) Sol: 0. 001 ppm (peso) Corteza terrestre: 0. 6 ppm Agua marina: 0. 000014 ppm Humano: --Muy baja abundancia: La crookesita [Tl. Cu 7 Se 4], la hutchinsonita [Tl. Pb. As 5 S 9] y la lorandita [Tl. As. S 2]. No existe en forma elemental en la naturaleza. La producción anual estimada está alrededor de 30 t.

Obtención Se obtiene como subproducto de la industria del cinc. Se recupera frecuentemente desde los polvos y humos de las chimeneas de los hornos para el procesado de las piritas. Ocasionalmente se extrae a partir del sulfato de talio presente en los lodos producidos en la fabricación del ácido sulfúrico. Reacciones 2 Tl(s) + O 2(g) Tl 2 O(s) 2 Tl(s) + 2 H 2 O(l) 2 Tl. OH(ac) + H 2(g) 2 Tl(s) + 3 F 2(g) 2 Tl. F 3(s) 2 Tl(s) + 3 Cl 2(g) 2 Tl. Cl 3(s) 2 Tl(s) + 2 HCl(ac) 2 Tl. Cl(s) + H 2(g) 2 Tl(s) + H 2 SO 4(ac) Tl 2 SO 4(s) + H 2(g)

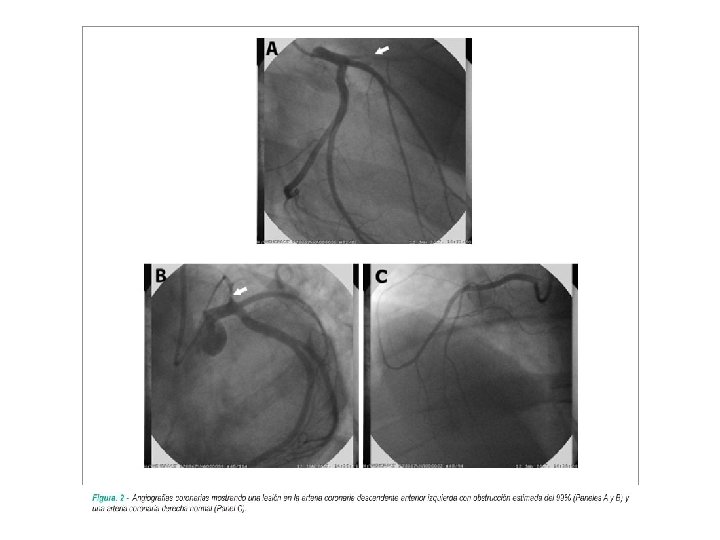
Economía y usos Raticida (Tl 2 SO 4) Emisores y receptores de IR (Bromuro y yoduro de talio) El Tl 2 O 3 se emplea en la producción de vidrios de alto índice de refracción En la medicina en isótopo de Tl 201 es utilizado en el diagnostico de gammagrafías del corazón, el talio es inyectado vía intravenosa


Mecanismo de acción: El ión talio tiene un tamaño similar al ión potasio, reemplazando la acción del potasio. Forma de cristales de cloruro de talio. Inhibición o bloqueo de algunos sistemas enzimáticos. También actúa sobre el metabolismo de las porfirinas, aumentando la eliminación de coproporfirinas urinarias. Éstos síntomas los presentó el ex-espía ruso Alexander Litvinenko, quién falleció el 23 de noviembre de 2006 consecuencia de envenenamiento por talio.

FIN

Échenle un ojo a esta página: http: //www. luisgil 34. com/página-en-reparación/maestros/esferas-magnéticas/ De pasada, también pueden revisar el contenido del sitio que tiene diversas cosas interesantes como por ejemplo de química básica: http: //www. luisgil 34. com/página-en-reparación/cuadernos-de-prácticas-20102011/química/ o también de libros de literatura: http: //www. luisgil 34. com/página-en-reparación/maestros/libros-a-g/ o de presentaciones power point: http: //www. luisgil 34. com/página-en-reparación/maestros/presentaciones/ El sitio contiene muchísimas cosas interesantes y sorprendentes. Parece que es de un profesor de secundaria aquí en México.