ELEMENTOS DEL GRUPO 15 PNICTGENOS ELEMENTOS QUE LO





















- Slides: 22

ELEMENTOS DEL GRUPO 15 PNICTÓGENOS

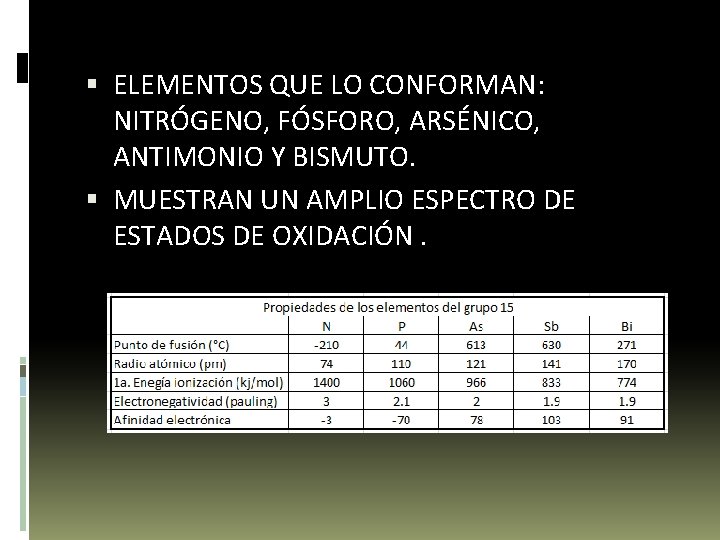
ELEMENTOS QUE LO CONFORMAN: NITRÓGENO, FÓSFORO, ARSÉNICO, ANTIMONIO Y BISMUTO. MUESTRAN UN AMPLIO ESPECTRO DE ESTADOS DE OXIDACIÓN.

OBTENCIÓN DEL NITROGENO Se obtiene de la destilación del aire líquido este se encuentra fácilmente, disponible en moléculas diatómicas.

APLICACIONES DE NITRÓGENO: Principal; obtención de Amoniaco mediante el método de Haber. A partir del amoniaco se obtienen fertilizantes y sales Nítricas. Fabricación de explosivos (nitroglicerina y TNT), y combustibles de cohetes (N 2 H 2)

Sobre el nitrógeno El nitrógeno ocupa el 78% de los agses presentes en el planeta. Pese a su abundancia gaseosa, el nitrógenos es de las sustancias con menor presencia en la corteza terrestre. El NO 2, es un gas venenoso, el cual da la tonalidad café rojizo al cielo de la ciudad de México.

REACCIONES CON NITRÓGENO 6 Li(s)+N 2 Li 3 N(s) 3 Ca(s)+2 NH 3(l) Ca 3 N 2+3 H 2(g) 4 NH 3(g)+7 O 2(g) 6 H 2 O(g)+4 NO 2(g) N 2 O 3(l) NO(g)+NO 2 NH 4 NO 3 N 2 O(s)+2 H 2 O(g) N 2 O(g)+H 2 O(l)+2 e¯ N 2(g)+2 OH¯

OBTENCIÓN DEL FOSFORO En la naturaleza se encuentra formando fosfatos, fluoropatito {3 Ca 3(PO 4)2. Ca. F}; wavellita, Al 3(0 H)3(P 04)6 -5 H 2 O. La ecuación química principal para la obtención de fósforo es la siguiente: 2 Ca 3(PO 4)2 F(s)+6 Si. O 2+10 C(s) 6 Ca. Si. O 3+10 CO(g)+P 4(g)

FOSFORO • En fertilizantes. • Como relleno de detergentes • Nutrientes adicionales en alimentos para animales. • Aditivos y revestimientos en metalurgia. • Plastificantes e insecticidas

Sobre el fósforo Se transporta sumergido en agua o bajo un gas inerte, y se toman especiales medidas en todas sus manipulaciones, debido a su toxicidad El fósforo tiene el 11° lugar de abundancia en la corteza terrestre.

REACCIONES CON FÓSFORO P 4(s)+3 OH¯(ac)+3 H 2 O(l) PH 3(g)+3 H 2 PO 4¯ PCL 3(l)+3 H 2 O(l) H 3 PO 4(l)+3 HCL(ac) 2 H 3 PO 4(l) H 4 P 2 O 7+H 2 O(g) H 3 PO 4(l)+H 4 P 2 O 7(l) H 5 P 3 O 10(l)+H 20(g) 4 PCl 5+4 NH 4 Cl (CL 2 PN)4+16 HCl

OBTENCIÓN DEL ARSÉNICO El arsénico se encuentra principalmente formando sulfuros en minerales que contienen cobre, plomo, hierro, nìquel y con balto entre otros. Reacción para obtener arsénico: Fe. As. S (s) Fe. S(s) + As(g) Se calienta a 700°C en ausencia de oxigeno

APLICACIONES ARSÉNICO: Fabricación de transistores y semiconductores. Elaboración de municiones de armas. En la elaboración de adhesivos para metales Elaboración de venenos contra plagas.

Sobre el arsénico Es el 52º elemento en abundancia en la corteza terrestre con 2 ppm (5· 10 -4 %) Se encuentra en tres estados alotrópicos, gris (α), más estable en condiciones normales; amarillo (γ), más reactivo que el gris y es fosforescente; el negro (β), presenta propiedades de las anteriores.

REACCIONES CON ARSÉNICO ASCl 3+RMg. Cl As. R 3+3 Mg. Cl 2 2 As+3 RBr As. RBr 2+As. R 2 Br+R´Li As 2 R´+Li. Br 4 As(s)+6 CH 3 I(l) 3(CH 3)2 As. I(sol)+As. I 3(sol) 3(CH 3)2 As. I(sol)+2 Na(sol) Na(s)+Na((CH 3)2 As. I)

OBTENCIÓN DEL ANTIMONIO El antimonio se encuentra en la naturaleza en numerosos minerales, aunque es un elemento poco abundante. Normalmente está en forma de sulfuros; la principal mena de antimonio es la antimonita (Sb 2 S 3). Mediante el tostado del sulfuro de antimonio se obtiene óxido de antimonio (III), Sb 2 O 3, que se reduce con coque para la obtención de antimonio. 2 Sb 2 O 3 + 3 C → 4 Sb + 3 CO 2 También se puede obtener por reducción directa del sulfuro, por ejemplo con hierro: Sb 2 S 3(s) + 3 Fe(s) 2 Sb(s) + 3 Fe. S(s)

ANTIMONIO Aleaciones metálicas Fabricación de pinturas, cerámicas, fuegos artificiales y esmaltes. Fabricación de diodos, baterías recargables y acumuladores. Recubrimiento de cables. Catalizador en la formación del PET. Municiones y partes de pistolas.

Sobre el antimonio Las estimaciones sobre la abundancia de antimonio en la corteza terrestre van desde 0, 2 a 0, 5 ppm. En su estado puro, es color blanco azuloso, es muy quebradizo. Se disuelve en ácidos fuertes.

REACCIONES CON ANTIMONIO Sb. Cl 3+H 2 O Sb. OCl+HCl Sb. F 5(l)+HF(l) H 2 F⁺(sol)+Sb. F¯ 6(sol)

OBTENCIÓN DEL BISMUTO Se presenta como bismita, Bi 2 O 3 y bismutita, Bi 2 S 3, y es un producto secundario de la refinación del cobre, estaño, plomo y zinc.

APLICACIONES DEL BISMUTO En metalurgia para obtener aleaciones con bajo punto de fusión. En farmacia para la elaboración de cosméticos y algunos medicamentos (tratamiento de úlceras pépticas y hemorroides)

Sobre el Bismuto El único isótopo estable es el de masa 209. Se estima que la corteza terrestre contiene cerca de 0. 00002% de bismuto. El bismutato de sodio y el pentafluoruro de bismuto son quizá los compuestos más importantes de Bi(V). El primero es un agente oxidante poderoso y el último un agente fluorante útil para compuestos orgánicos.

REACCIONES CON BISMUTO 2 Bi 2+3 O 2 2 Bi. O 3