Glava 6 6 1 Molarna zapremina 6 2







![Parahor Primeri: C 6 H 4 CH 3 CN – toluolnitril [P]teor= 8[P](C)+7 [P](H)+ Parahor Primeri: C 6 H 4 CH 3 CN – toluolnitril [P]teor= 8[P](C)+7 [P](H)+](https://slidetodoc.com/presentation_image_h/dea1bf7ffb84b4f19c31efaeb42bcff1/image-9.jpg)










![Molarna refrakcija [(n 1)/ ] [M(n 1)/ ] specifična refraktivnost (empirijski –za određenu tečnost Molarna refrakcija [(n 1)/ ] [M(n 1)/ ] specifična refraktivnost (empirijski –za određenu tečnost](https://slidetodoc.com/presentation_image_h/dea1bf7ffb84b4f19c31efaeb42bcff1/image-25.jpg)









- Slides: 39

Glava 6 Ø 6. 1. Molarna zapremina Ø 6. 2. Parahor Ø 6. 3. Molarna refrakcija Ø 6. 6. Apsorpcija zračenja Ø 6. 7. Optička aktivnost

Fizičke osobine q. Aditivne osobine su one koje predstavljaju sumu vrednosti odgovarajuće osobine konstituenata sistema. Mr, m, Vm q. Konstitutivne osobine su one koje zavise pre svega od načina vezivanja atoma u molekulu, a u manjoj meri od njihove prirode i broja-Tk, Tt, R, P. q. Koligativne osobine su one koje zavise od broja molekula u sistemu, a ne od njihove prirode- p, T k , Tt ,

Molarna zapremina v. Idealno gasno stanje T = 273, 15 K i P = 101, 325 k. P iznosi: Vm, 0 = (0, 022 414 10 0, 000 19) m 3/mol v. Kod tečnosti molarna zapremina aditivna ali i konstitutivna osobina

v. Izomerna jedinjenja imaju približno istu molarnu zapreminu: CH 3 COOCH 2 CH 3 – metan propionat CH 3 CH 2 COOCH 3 – etil acetat CH 3 CH 2 COOH – propil formijat C 4 H 8 O 2 –isto Vm v. Molarna zapremina članova homologog niza ugljovodonika raste za svaku CH 2 grupu za 22 cm 3/mol Kopp-ovo pravilo Molarne zapremine mnogih tečnosti, kada se određuju na njihovim tačkama ključanja (korespodentna temperatura) pod atmosferskim pritiskom, jednake su sumi zapremina atoma konstituenata

Određivanje ekvivalenta zapremine vodonika: 2 Vm(H)= Vm(Cn. H 2 n+2)-n. Vm(CH 2)= Vm(Cn. H 2 n+2)-n·22=11 cm 3/mol Vm(H)=5, 5 cm 3/mol Zapreminski ekvivalenti elemenata, cm-3/mol H 5, 5 I 37, 5 C 11, 0 -O- 7, 8 (OH) Cl 22, 8 O= 12, 2(C=O) Br 27, 8 S 22, 6 Ekvivalenti zapremine elemanata mogu poslužiti samo za približno izračunavanje molarnih zapremina tečnosti, jer Kopovo pravilo ne daje zadovoljavajuće rezultate čak i kada se uzme u obzir konstitutivni faktor

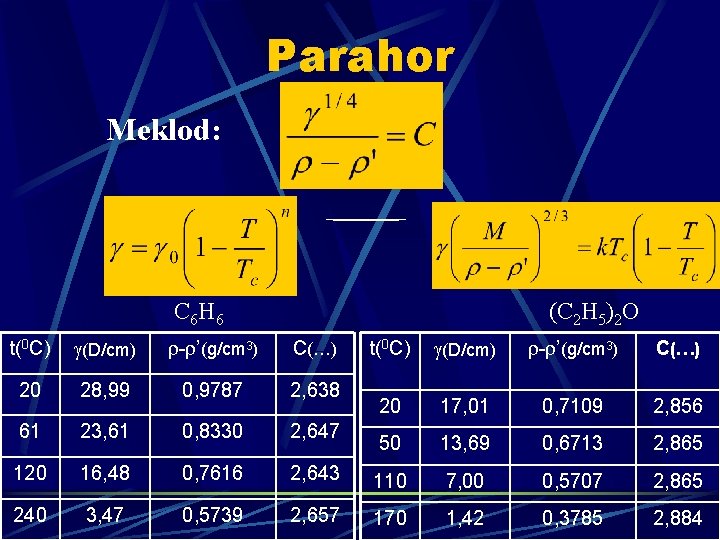
Parahor Meklod: C 6 H 6 (C 2 H 5)2 O t(0 C) (D/cm) - ’(g/cm 3) C(…) 20 28, 99 0, 9787 2, 638 20 17, 01 0, 7109 2, 856 61 23, 61 0, 8330 2, 647 50 13, 69 0, 6713 2, 865 120 16, 48 0, 7616 2, 643 110 7, 00 0, 5707 2, 865 240 3, 47 0, 5739 2, 657 170 1, 42 0, 3785 2, 884

Atomski i strukturni ekvivalenti parahora Ugljenik 4, 8 Vodonik 17, 1 Azot 12, 5 Kiseonik 20, 0 O 2 u estrima 60, 0 Brom 68, 0 Trostruka veza 46, 6 Jod 90, 3 -člani prsten 16, 7 Fluor 25, 0 4 -člani prsten 11, 6 Sumpor 48, 5 6 -člani prsten 6, 1 Fosfor 39, 2 Naftalinski prsten 12, 2

’<< Ekvivalenti parahora C 4, 8(11, 5) H 17, 1(14, 4) S Cl 48, 5 53, 8 = 23, 2 46, 6 O Br 68, 0 6 -prsten 6, 1 Primeri: SF 6 20, 0 [P]exp=143, 3 [P]teor=6 [P] (F)+ [P] (S)=150+48, 5=146, 5
![Parahor Primeri C 6 H 4 CH 3 CN toluolnitril Pteor 8PC7 PH Parahor Primeri: C 6 H 4 CH 3 CN – toluolnitril [P]teor= 8[P](C)+7 [P](H)+](https://slidetodoc.com/presentation_image_h/dea1bf7ffb84b4f19c31efaeb42bcff1/image-9.jpg)
Parahor Primeri: C 6 H 4 CH 3 CN – toluolnitril [P]teor= 8[P](C)+7 [P](H)+ [P](N)+ [P](6 -prsten)+3 [P](=)+ [P]( ) 8· 4, 8+7 · 17, 1+12, 5+6 · 6, 1+3 · 23, 2+46, 6=292, 9 [P]exp(o-TN)=299, 6 [P]exp(m-TN)=295, 6 [P]exp(p-TN)=294, 4 (C 2 H 4 O)3 – paraaldehid [P]teor=363, 6 – linearna struktura [P]teor=300, 1 –ciklična struktura [P]exp=298, 7

Parahor Primeri: Koliki je parahor C 2 H 6 ako je parahor: P(CH 3 Cl)=110, P(CH 4)=73 i P(HCl)=71. a) 33 b) 110 c) 112 d) 114 e) 254 f) ne znam Rešenje Pošto je parahor aditivna veličina to možemo odrediti: PCH 2=PCH 3 Cl-PHCl=110 -71=39. Onda je: PC 2 H 6=PCH 4+PCH 2=73+39=112

REFLEKSIJA Jednakost prelomnih uglova Upadni ugao Prelaomni ugao mmmmm

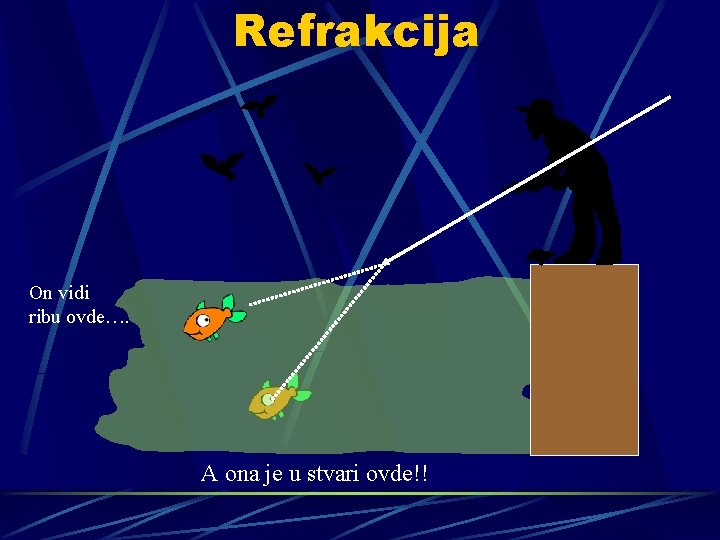
Refrakcija On vidi ribu ovde…. A ona je u stvari ovde!!

Refrakcija Kratke talasne dužine su skrenute više od dugih disperzija Svetlost je skrenuta i rezultujuće boje razdvojene (disperzija). Crveno je manje prelomljeno a ljubičasto više.

Refrakcija Indeks prelamanja

Opšti kurs fizičke hemije-II semestar Indeks prelamanja, n- kvantitativno merilo prelamanja svetlosti prelasku iz jedne sredine u drugu-optička osobina karakteristična za svaku providnu, izotropnu supstanciju Primena indeks prelamanja, n: 1. Identifikacija- u neorganskoj hemiji i analizi masti, ulja, šećera 2. Kvantitativno određivanje-merilo čistoće-produkti destilacije, industiraja hrane, biohemija 3. Određivanje strukture

Definicija indeksa prelamanja Možemo definisati indeks prelamanja kao: Apsolutni indeks prelamanja Većina sredina nisu magnetici i imaju magnetsku permeabilnost m=m 0, kada je: karakteristika sredine v 1 v 2 Relativni indeks prelamanja 1 2

Snell-ijusov zakon 1621, holandski fizičar Willebrord Snell (1591 -1626), je izveo odnos između uglova pod kojim svetlost prelazi iz jedne sredine u drugu: gde je: ni indeks prelamanja sredine koju svetlost napušta, i je upadni ugao između upadnog zraka i normalu na graničnu površinu, nr je indeks prelamanja sredine u koju svetlost ulazi, r je prelomni ugao između prelomnog zraka i normale na graničnu površinu.

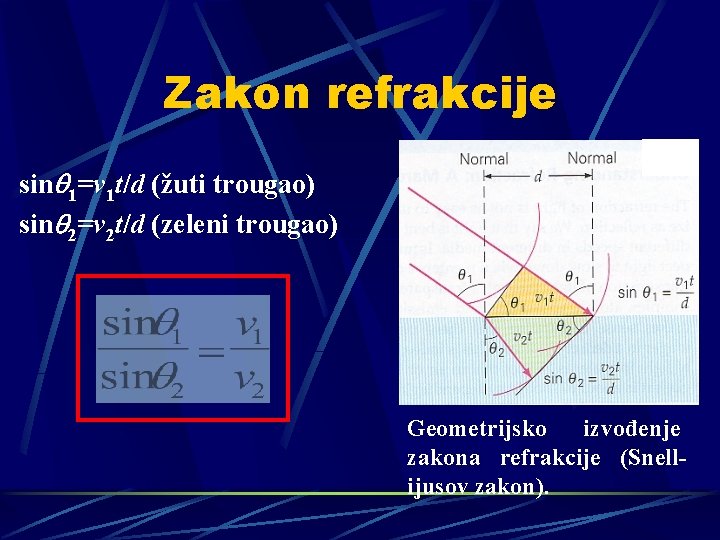
Zakon refrakcije sinq 1=v 1 t/d (žuti trougao) sinq 2=v 2 t/d (zeleni trougao) Geometrijsko izvođenje zakona refrakcije (Snellijusov zakon).

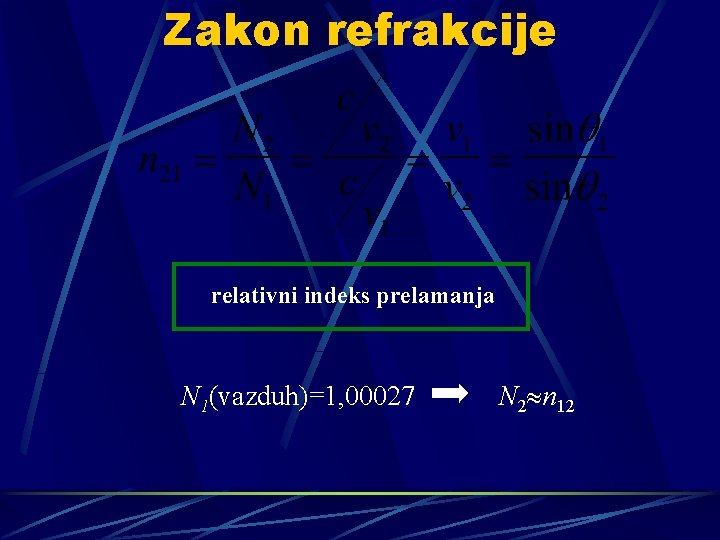
Zakon refrakcije relativni indeks prelamanja N 1(vazduh)=1, 00027 N 2 n 12

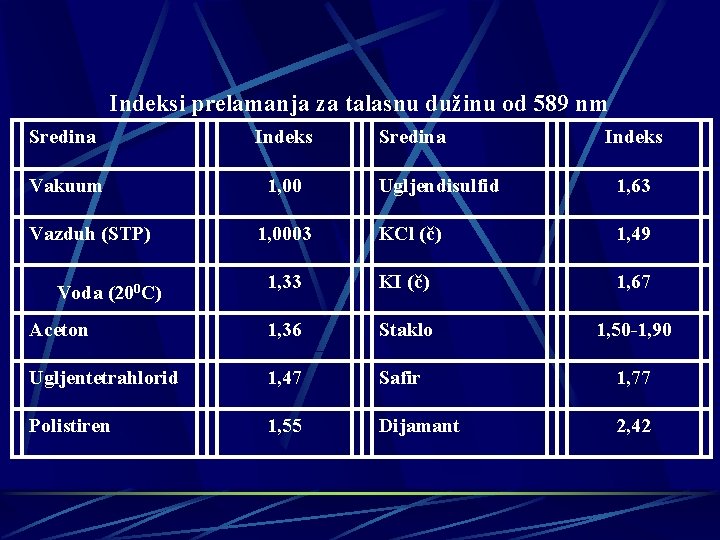
Indeksi prelamanja za talasnu dužinu od 589 nm Sredina Indeks Vakuum 1, 00 Sredina Indeks Ugljendisulfid 1, 63 KCl (č) 1, 49 1, 33 KI (č) 1, 67 Aceton 1, 36 Staklo 1, 50 -1, 90 Ugljentetrahlorid 1, 47 Safir 1, 77 Polistiren 1, 55 Dijamant 2, 42 Vazduh (STP) Voda (200 C) 1, 0003

Merenje indeksa prelamanja Indeks prelamanja se meri: • refraktometrijski i • interferometrijski Refraktometrijsko merenje se zasniva na principu kritičnog ugla. Kritični ugao je onaj prelomni ugao čiji je upadni ugao 900. Za sve upadne uglove veće od 900 dolazi do totalne refleksije zračenja.

Duga l Zrak svetlosti susreće kap vode u atmosferi Dolazi do refleksije i refrakcije Prvo se zrak prelama na prednjoj površini kapljice l Ljubičasta svetlost najviše skreće l Crvena svetlost će skretati najmanje Na zadnjoj površini svetlost se odbija Ona se ponovo prelama pri povratku na prednjoj površini i nastavlja kroz vazduh Zraci napuštaju kap pod različitim uglovima l l Ugao između bele svetlosti i ljubičaste je 40° Ugao između bele svetlosti i srvenog zraka je 42°

Pojava duge Kišne kapi na većoj visini upravljaju crvenu svetlost prema posmatraču Kapljice niže na nebu upravljaju ljubičastu svetlost prema posmatraču Druge boje spektra leže između crvene i ljubičaste

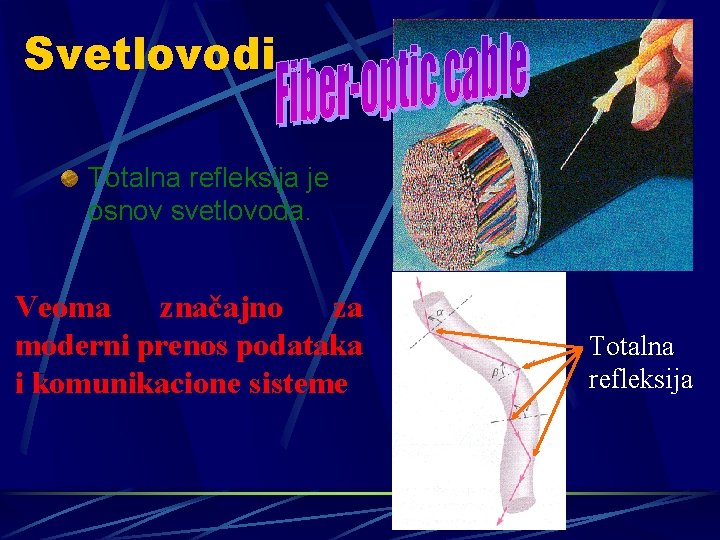
Svetlovodi Totalna refleksija je osnov svetlovoda. Veoma značajno za moderni prenos podataka i komunikacione sisteme Totalna refleksija
![Molarna refrakcija n 1 Mn 1 specifična refraktivnost empirijski za određenu tečnost Molarna refrakcija [(n 1)/ ] [M(n 1)/ ] specifična refraktivnost (empirijski –za određenu tečnost](https://slidetodoc.com/presentation_image_h/dea1bf7ffb84b4f19c31efaeb42bcff1/image-25.jpg)
Molarna refrakcija [(n 1)/ ] [M(n 1)/ ] specifična refraktivnost (empirijski –za određenu tečnost i nezavisno od temperature-za određivanje gustine tečnosti) molarna refraktivnost (aditivna i konstitutivna velilina) specifična refrakcija molarna refrakcija (teorijski izvedena-aditivna i konstitutivna veličina-nezavisna od pritiska, temperature i agregatnog stanja)

Molarna refrakcija Prava molarna zapremina molekuli-provodne sfere ni-broj atoma nj-broj veza nk-broj prstenova

Molarna refrakcija Ekvivalenti refrakcije C H O(CO) O(OH) = R 2, 413 1, 092 1, 189 RD 2, 418 1, 100 2, 211 R 2, 438 1, 115 2, 247 R 2, 466 1, 127 2, 267 1, 522 1, 686 2, 328 1, 525 1, 733 2, 398 1, 531 1, 824 2, 506 1, 541 1, 893 2, 539 Strukturna određivanja Izmereno Izračunato C 6 H 12 C 6 H 6 (C 2 H 5)2 O CHCl 3 27, 71 27, 67 26, 15 26, 31 22, 48 22, 31 21, 40 21, 42

Ekvivalenti molarne refrakcije za natrijumovu D-liniju Vodonik 1, 100 Kiseonik (u CO grupi, O=) 2, 211 Ugljenik 2, 418 Kiseonik (u etrima, O ) 1, 643 Hlor 5, 967 Kiseonik (u OH grupi, O )1, 525 Brom 8, 865 Dvostruka veza 1, 733 Jod 13, 900 Trostruka veza 2, 398 3 -člani prsten 0, 710 4 -člani prsten 0, 480 E = R eksp R izr optička anomalija E>0 optička egzaltacija E<0 optička depresija

Optička anomalija CH 3 -CH=CH-CH 3 2, 4 heksadien E=1, 76 cm 3 mol-1 CH 3 -CH=CH-C 2 H 5 2, 4 heptadien E=1, 96 cm 3 mol-1 -C=C-C=C- polienski lanac- najveća anomalija =C=C= kumulovane-najmanja anomalija benzen E=-0, 16 alilbenzen E=-0, 25 stiren E=1, 27 butadien E=1, 40 acetofen E=0, 78 2 -metil butadien E=1, 04 Keto oblik Keto-enolna tautomerija [R]M=31, 57 cm 3 mol-1 Enolni oblik [R]M=32, 62 cm 3 mol

Kvantitativna određivanja refrakcija smeše

Disperzija Indeks prelamanja zavisi od talasne dužine svetlosti Ova zavisnost n od λ se zove disperzija, n=f(l) Snell-ijusov zakon ukazuje da ugao refrakcije kada svetlost ulazi u datu sredinu zavisi od talasne dužine svetlosti

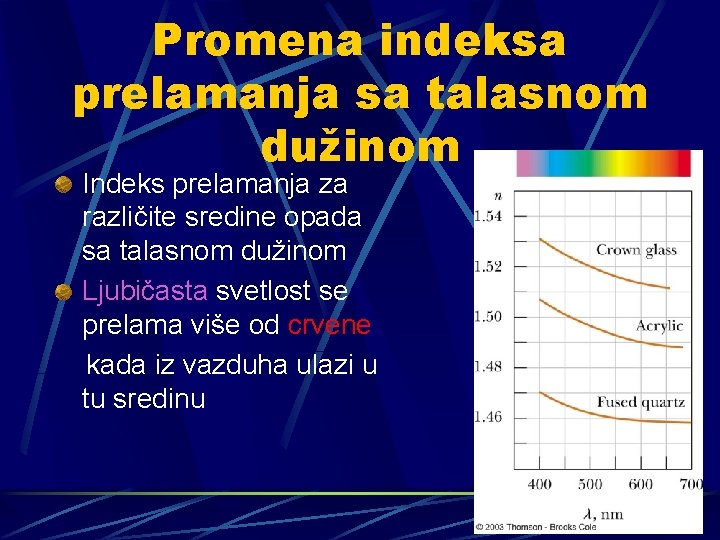
Promena indeksa prelamanja sa talasnom dužinom Indeks prelamanja za različite sredine opada sa talasnom dužinom Ljubičasta svetlost se prelama više od crvene kada iz vazduha ulazi u tu sredinu

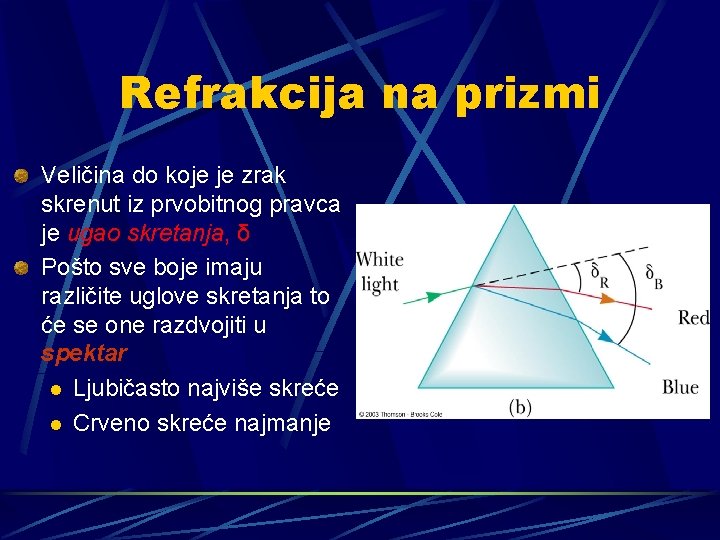
Refrakcija na prizmi Veličina do koje je zrak skrenut iz prvobitnog pravca je ugao skretanja, δ Pošto sve boje imaju različite uglove skretanja to će se one razdvojiti u spektar l Ljubičasto najviše skreće l Crveno skreće najmanje

Opšti kurs fizičke hemije-II semestar Indeks prelamanja za dati medijum zavisi od dve promenjljive: a. Indeks prelamanja (n) zavisi od talasne dužine ( ). Zraci različitih talasnih dužina se prelamaju u različitoj meri u istoj sredini proizvodeći tako različite indekse prelamanja. b. Indeks prelamanja (n) zavisi od temperature. Ako se temperatura menja, menja se i gustina; stoga se menja brzina ( ). § Gustina medijuma opada sa porastom temperature. § Brzina svetlosti u medijumu raste sa temperaturom i opadanjem gustina. § Odnos brzine svetlosti u vakuumu i u datoj sredini opada, tj. indeks prelamnja opada sa porastom temperature.

Disperzija refrakcije

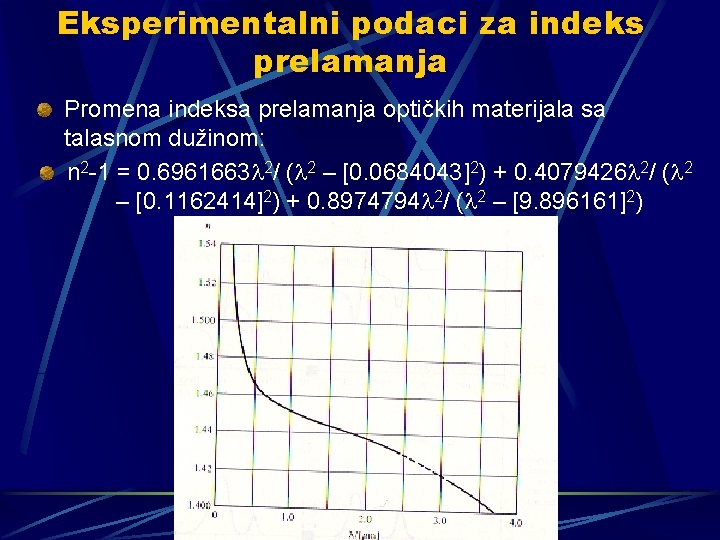
Eksperimentalni podaci za indeks prelamanja Promena indeksa prelamanja optičkih materijala sa talasnom dužinom: n 2 -1 = 0. 6961663 2/ ( 2 – [0. 0684043]2) + 0. 4079426 2/ ( 2 – [0. 1162414]2) + 0. 8974794 2/ ( 2 – [9. 896161]2)

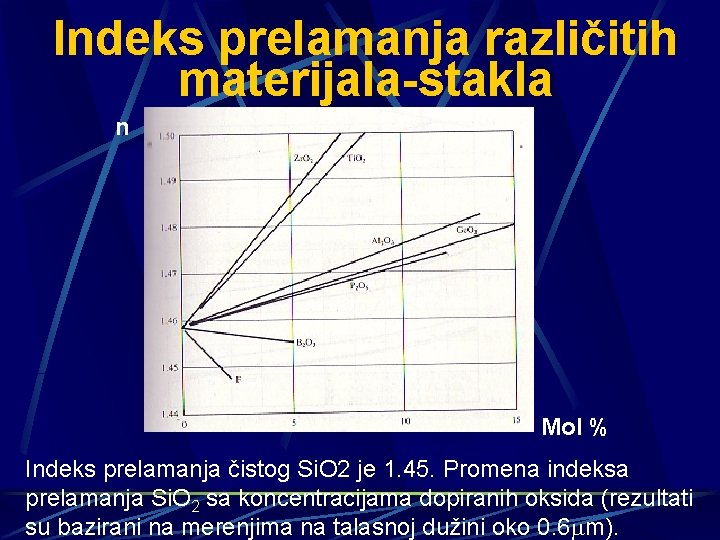
Indeks prelamanja različitih materijala-stakla n Mol % Indeks prelamanja čistog Si. O 2 je 1. 45. Promena indeksa prelamanja Si. O 2 sa koncentracijama dopiranih oksida (rezultati su bazirani na merenjima na talasnoj dužini oko 0. 6 m).

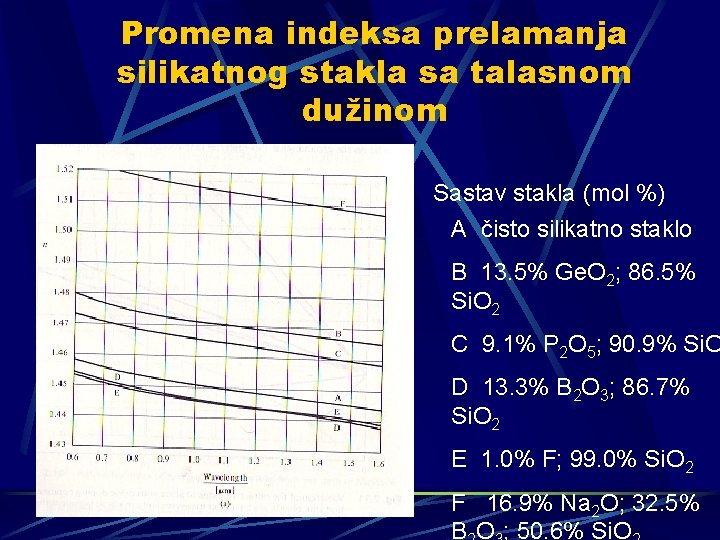
Promena indeksa prelamanja silikatnog stakla sa talasnom dužinom Sastav stakla (mol %) A čisto silikatno staklo B 13. 5% Ge. O 2; 86. 5% Si. O 2 C 9. 1% P 2 O 5; 90. 9% Si. O D 13. 3% B 2 O 3; 86. 7% Si. O 2 E 1. 0% F; 99. 0% Si. O 2 F 16. 9% Na 2 O; 32. 5% B O ; 50. 6% Si. O

Opšti kurs fizičke hemije Promena indeksa prelamanja sa temperaturom § Indeks prelamanja (ND) opada sa porastom temperature, t. j. brzina svetlosti u sredini raste kako gustina opada. § Merene vrednosti (ND) se obično izražavaju na 20 o. C Za temperaturu > 20 o. C ( t je pozitivno), tj. , dodaje se korekcioni faktor Za temperaturu < 20 o. C ( t je negativno), tj. , oduzima se korekcioni faktor § Korekcioni faktor = t * 0. 00045 = (Temp – 20) * 0. 00045 § Primenjuje se sledeća jednačina za korekciju temperature: ND 20 = ND Temp + (Temp – 20) * 0. 00045 Pr: Za izmerenu vrednost od 1, 5523 na 16 o. C, korekcija je: ND 20 = 1. 5523 + (16 – 20) * 0. 00045 = 1. 5523 + (-4) * 0. 00045 1. 5500 1. 5523 1. 5550 1. 5580 1. 5600 § Tipične vrednosti za organske tečnosti su : 1. 3400 - 1. 5600
 Amagatov zakon
Amagatov zakon Molski udeo formula
Molski udeo formula Relativni indeks prelamanja
Relativni indeks prelamanja Alisa u zemlji čuda prepričana lektira
Alisa u zemlji čuda prepričana lektira Sumerska umetnost
Sumerska umetnost Brijeg umanjenica
Brijeg umanjenica Vrste kobasica
Vrste kobasica Kabelska glava
Kabelska glava Adina glava
Adina glava Glava arbetsratt download
Glava arbetsratt download Hesov zakon
Hesov zakon Molar mass of oxygen
Molar mass of oxygen Ostwaldov zakon
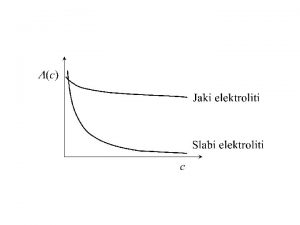
Ostwaldov zakon Molarna provodljivost
Molarna provodljivost Molarna provodljivost
Molarna provodljivost Molarna masa vazduha
Molarna masa vazduha Molekulska masa
Molekulska masa Petostrana piramida
Petostrana piramida Volumen kocke i kvadra 5 razred
Volumen kocke i kvadra 5 razred Prizma geometrijsko tijelo
Prizma geometrijsko tijelo Povrsina kocke
Povrsina kocke Prostorna dijagonala prizme
Prostorna dijagonala prizme Zakon spojenih sudova
Zakon spojenih sudova Obujam kugle formula
Obujam kugle formula Zapremina kvadrata formula
Zapremina kvadrata formula Zapremina zarubljene kupe
Zapremina zarubljene kupe