Idealno gasno stanjeisti gasovi Parametri P V T































- Slides: 32

Idealno gasno stanje-čisti gasovi Parametri P, V, T i n nisu nezavisni. Odnos između njih eksperimentalno je utvrđeni izražava se kroz gasne zakone. Gasni zakoni: 1. Bojl-Maritov: PV=const. pri konstantnim T i n 2. Gej-Lisakov: V T pri konstantnim P i n 3. Šarlov: P T pri konstantnim V i n 4. Avogadrov: V n pri konstantnim P i T Jednačina idealnog gasnog stanja: PV = n. RT R je molarna gasna konstanta

Idealno gasno stanje-smeše gasova Ako gasni zakoni i jednačina idealnog gasnog stanja važi za čiste gasove, važiće i za smešu gasova. Gasni zakoni za smešu gasova: 1. Daltonov: P=P 1 + P 2 + P 3 +. . . Pi pri konstantnoj T Pi=ni. RT/V=xi. P 2. Amagaov: V=V 1+V 2+V 3+. . . Vi pri konstantnim P i T 1. Vi=ni. RT/P=xi. V 2. Srednja molarna masa:

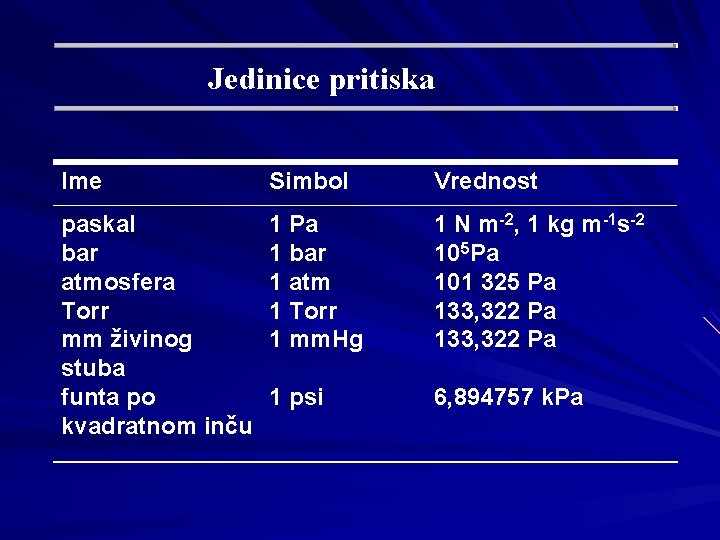
Jedinice pritiska Ime Simbol Vrednost paskal bar atmosfera Torr mm živinog stuba funta po kvadratnom inču 1 Pa 1 bar 1 atm 1 Torr 1 mm. Hg 1 N m-2, 1 kg m-1 s-2 105 Pa 101 325 Pa 133, 322 Pa 1 psi 6, 894757 k. Pa

Vežba 1. 1 1. a. Pretvoriti 723 torr u kilopaskale (k. Pa). Rešenje: (723 torr) x (101, 325 k. Pa/760 torr) = 96, 39 k. Pa 1. b. Atmosferski pritisak na Marsu iznosi 0, 61 k. Pa. Koliko iznosi ovaj pritisak u torima? Rešenje: 610: 133, 322=4, 58 Torr

Vežba 1. 2 Koliko atoma Xe ima u uzorku koji sadrži 2, 8 mol Xe? Rešenje: (2, 8 mol) x (6. 022 x 1023 mol-1) = 1, 69 x 1024

Vežba 1. 3 (a) Koju količinu H 2 O ima 200 g vode? (b) Koliko molekula H 2 O ima u 100 g vode? (a) 200 g x (1 mol/18, 015 g) = 11, 1 mol (b) 100 g x (1 mol/18, 015 g) x (6. 02214 x 1023 mol-1) = 3, 34 x 1024 molekula

Vežba 1. 4. Propan se koristi kao gas u spreju za osvežavanje vazduha. Koja je zapremina propana ako se 2 dm 3 sa pritiska od 1 atm komprimuje do 3, 5 atm na konstantnoj temperaturi. Rezultat izraziti u jedinici SI sistema. Rešenje:

Vežba 1. 5. U industrijskom procesu azot se zagreva do 500 K u sudu konstantne zapremine. Ako je na 300 K pritisak gasa 100 atm, koliki pritisak (u Pa) će gas pokazivati na 500 K? Početno Krajnje Isto Primedba: Eksperiment pokazuje da je stvarni pritisak 183 atm pod ovim uslovima, tako da pretpostavka idealnog gasnog stanja dovodi do greške od oko 10%

Vežba 1. 6.

Vežba 1. 7. Koja je krajnja zapremina gasa u SI koji se greje od 250 o. C do 1000 o. C čiji pritisak raste od 20, 0 k. Pa do 150, 0 k. Pa, ako je početna zapremina 25 m. L? Rešenje: V 2 = (p 1 V 1/T 1)(T 2 /p 2) V 2 = (20, 0 k. Pa x 25 m. L/ 523, 15 K)(1273, 15 K / 150, 0 k. Pa) = 8, 11 m. L=8, 11· 10 -6 m 3

Vežba 1. 8.

Vežba 1. 9. Izračunati pritisak 2, 22 g ugljendioksida zatvorenog u balon zapremine od 1 L na 57 o. C. • Rešenje: p = n. RT/V = (m/M)RT/V • p = (2, 22 g/44, 01 g mol-1) x (8, 3145 k. Pa L K-1 mol-1) x(330, 15 K/1 L)= 138, 47 k. Pa

Vežba 1. 10 Izračunati molsku frakciju N 2, O 2, i Ar u suvom vazduhu na nivou mora ako se 100 g vazduha sastoji od 75, 5 g N 2, 23, 2 g O 2 i 1, 3 g Ar. Rešenje: 75, 5 (g N 2) /28(g/mol)= 2, 70 mol N 2; 1, 3(g. Ar)/40(g/mol)=0, 0325 mol Ar 23, 2 (g O 2 /32 g/mol)= 0, 725 mol O 2; x. N 2 = 0, 781; x. O 2 = 0, 210; x. Ar = 0, 009

Domaći! 19. 10. 2009 1. Izračunati srednju molarnu masu vazduha.

Srednja molarna masa vazduha Izračunati srednju molarnu masu vazduha. x. N 2=0, 78 MN 2=28 g/mol x. O 2=0, 21 MO 2=32 g/mol x. Ar=0, 01 Mar=40 g/mol

Vežba 1. 11 Vazduh približno sadrži 80% azota i 20% kiseonika (molarnih). Ako se 6 g vodonika doda u balon zapremine 22, 414 L na 0 o. C i prvobitno napunjenog vazduhom pritisku od 1 atm, kolika će biti srednja molarna masa smeše vazduha i vodonika.

Rešenje Zapremina od 22, 4 L pri STP sadrži 1 mol.

Vežba 1. 12 Smeša vodonika i helijuma sadrži 25. 0 masenih % vodonika. Koliki je parcijalni pritisak (mm. Hg) vodonika u smeši pri STP? (Relativne atomske mase: H = 1. 008, He = 4. 00).

Rešenje:

Vežba 1. 13 Koliki je parcijalni pritisak He (u atm) u smeši 1, 0 g g H 2 and 5. 0 g He in cilindru zapremine 5, 0 L na 20, 0 o. C? (Relatvne atomske mase: H = 1. 008, He = 4. 00).

Rešenje

Vežba 1. 14 Izračunati parcijalni pritisak gasa (u k. Pa) koji se sastoji od 2, 50 g kiseonika i 6, 43 g ugljendioksida pri ukupnom pritisku od 88 k. Pa. Rešenje: 2, 50 g/32 g/mol = 0, 0781 mol O 2; 6, 43 g/44 g/mol = 0, 146 mol CO 2; Ukupno = 0. 224 mol gasa x. O 2 = 0, 349; x. CO 2 = 0, 652 p. O 2 = x. O 2 p = 30, 71 k. Pa; p. CO 2 = x. CO 2 p = 57, 38 k. Pa

Vežba 1. 15 Dva odvojena balona sadrže gasove A i B. Gustina gasa A je tri puta veća od gustine gasa B, a molarna masa gasa A je jednaka četvrtini molarne mase gasa B. Ako su gasovi na istoj temperaturi i u idealnom gasnom stanju, odnos pritisaka gasova A i B je: a) 1 b) 12 c) 13 d) 4 e) 5 f) ne znam

Rešenje

Vežba 16 Koja od sledećih relacija ne daje pravu liniju kada se prikaže grafički za He? I. P od T pri V, n=const. II. V od T pri P, n=const. III. P od V pri T, n=const. Odgovor a) I b) I i II c) II i III d) III e) II f) I i III

Vežba 17

Vežba 18

Pitanja Koji zakoni važe za idealno gasno stanje? Nula idealno gasne skale temperatura iznosi u celzijusovim stepenima: Pri kojim uslovima se gas približava idealnom gasnom stanju? Vrednost molarne gasne konstante R u SI sistemu jedinica iznosi: Šta je Avogardova konstanta i koliko iznosi? Šta je parcijalni pritisak gasa i u kakvom odnosu je sa ukupnim pritiskom gasne smeše?

Vežba 19 Vodonik će disosovati u atome na dovoljno visokoj temperaturi. Kolika će biti gustina vodonika na 2000 o. C ako 33% disosuje u atome a pritisak je 1 bar? a) 1 g/cm 3 b) 7, 95 g/L c) 7, 95∙ 10 -3 kg/m 3 d) 7, 95 kg/m 2 e) 1 10 -3 kg/m 3 f) ne znam

Rešenje

Vežba 20 Sud je podeljen u dva dela. Deo A sadrži gas A na 400 K i 5 atm. Deo B sadrži gas B na 400 K i 8 atm. Pregrada između delova je uklonjena. Molska frakcija gasa A u smeši je x. A = 0. 581395. Krajnja zapremina je 29 ℓ. Odrediti početnu zapreminu delova A i B.

Rešenje:
 Molska frakcija
Molska frakcija Jednacina stanja idealnog gasa zadaci
Jednacina stanja idealnog gasa zadaci Gasno rezanje
Gasno rezanje Kovolumen
Kovolumen Euro norme izduvnih gasova
Euro norme izduvnih gasova племенити гасови
племенити гасови Parametri vitali bambino
Parametri vitali bambino Parametri cinetici
Parametri cinetici Parametri naizmenicne struje
Parametri naizmenicne struje Piastrinopenia severa
Piastrinopenia severa Diametre biacromial
Diametre biacromial Velocita di taglio
Velocita di taglio Parametri vitali
Parametri vitali Frequenza cardiaca valori
Frequenza cardiaca valori Abc matematika
Abc matematika Parametri antropometrici neonato
Parametri antropometrici neonato Parametri vitali definizione
Parametri vitali definizione Frequenza respiratoria
Frequenza respiratoria Schema parametri vitali
Schema parametri vitali Konakion intramuscolo
Konakion intramuscolo