Realno gasno stanje Poglavlje 1 5 Kompresioni faktor






















- Slides: 43

Realno gasno stanje Poglavlje 1. 5 Kompresioni faktor Molekulske interakcije Virijalni koeficijenti Van der Valsova jednačina Kondenzacija Kritično stanje Izoterme Korespodentna stanja Druge jednačine stanja Realno gasno stanje je svako stanje gasa, ali su odstupanja od idealnog posebno izražena na visokim pritiscima i niskim temperaturama blizu kondenzacije. Između čestica postoje veoma izražene interakcije i zapremina molekula nije više zanemarljiva.

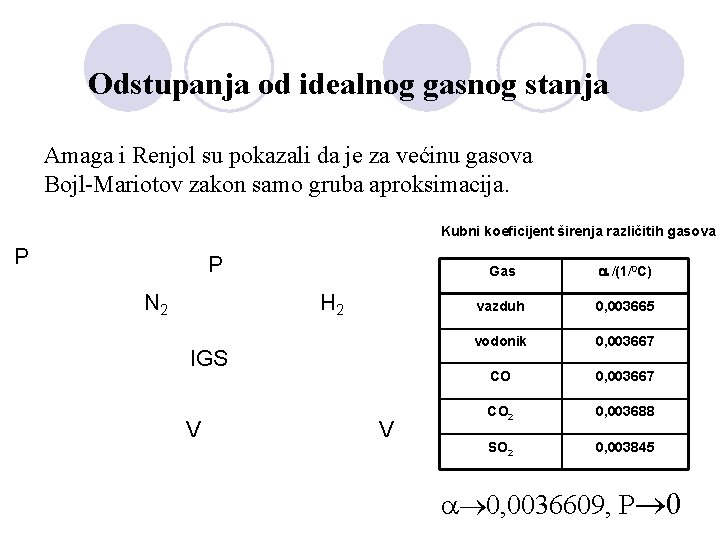
Odstupanja od idealnog gasnog stanja Amaga i Renjol su pokazali da je za većinu gasova Bojl-Mariotov zakon samo gruba aproksimacija. Kubni koeficijent širenja različitih gasova P P N 2 H 2 IGS V V Gas /(1/0 C) vazduh 0, 003665 vodonik 0, 003667 CO 2 0, 003688 SO 2 0, 003845 0, 0036609, P 0

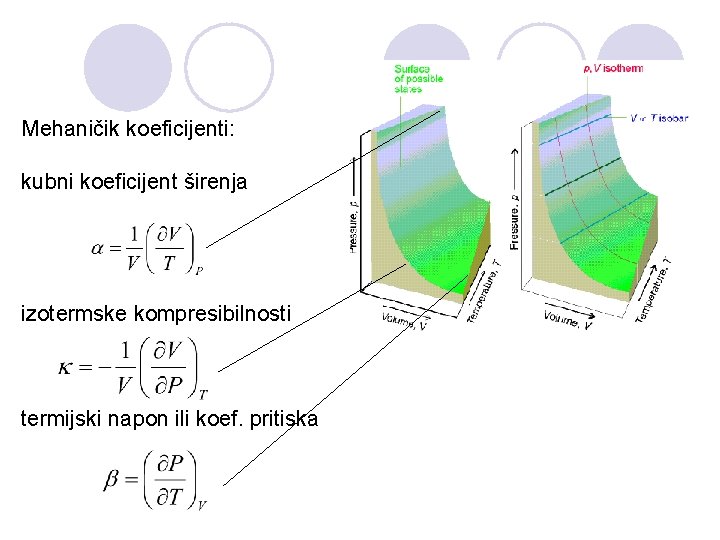
Mehaničik koeficijenti: kubni koeficijent širenja izotermske kompresibilnosti termijski napon ili koef. pritiska

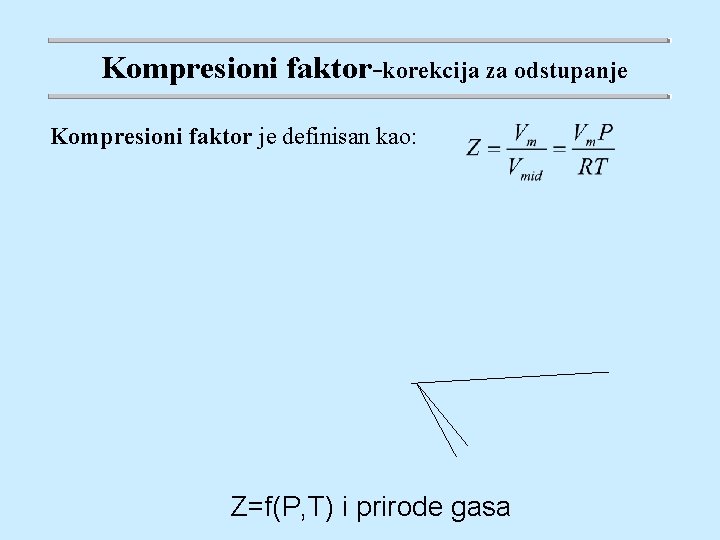
Kompresioni faktor-korekcija za odstupanje Kompresioni faktor je definisan kao: Z=f(P, T) i prirode gasa

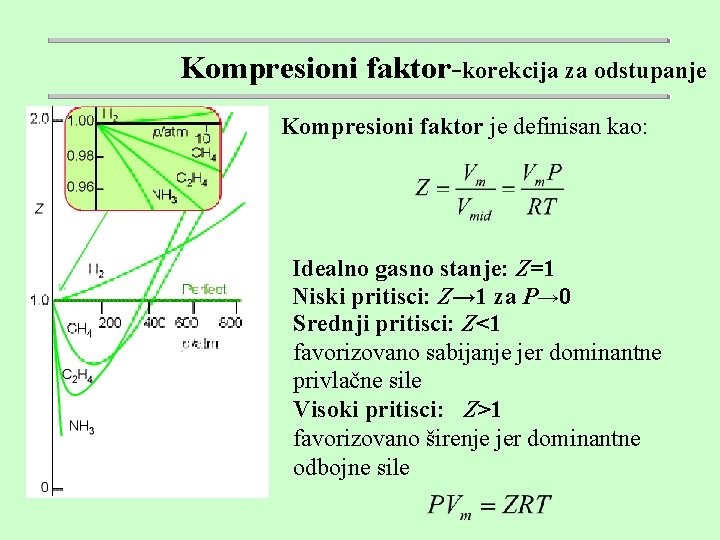
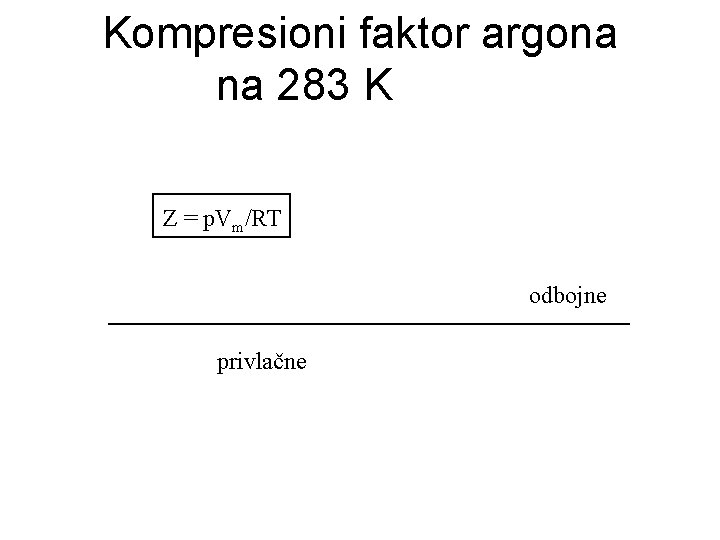
Kompresioni faktor-korekcija za odstupanje Kompresioni faktor je definisan kao: Idealno gasno stanje: Z=1 Niski pritisci: Z→ 1 za P→ 0 Srednji pritisci: Z<1 favorizovano sabijanje jer dominantne privlačne sile Visoki pritisci: Z>1 favorizovano širenje jer dominantne odbojne sile

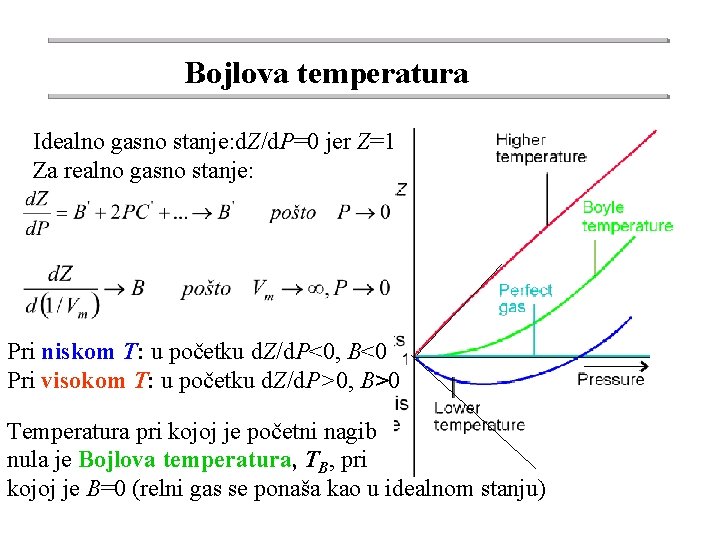
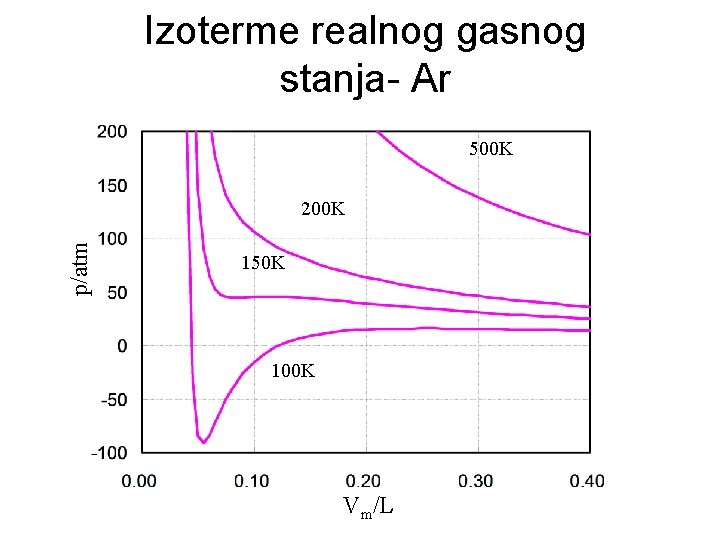
Bojlova temperatura Najviša temperatura iznad koje se minimum na krivoj PV=f(P) više ne javlja je tzv. Bojlova temperatura U RGS gas je u oblasti nižih pritisaka ispod Bojlove temperature kompresibilniji, a u oblasti viših pritisaka je manje kompresibilan nego u IGS. Gasovi koji se lakše prevode u tečnosti imaju više Bojlove tačke dok gasovi, kao vodonik i helijum, koji se teško prevode u tečno stanje imaju niske Bojlove temperature ( 1630 C za H 2 i -2510 C za He).

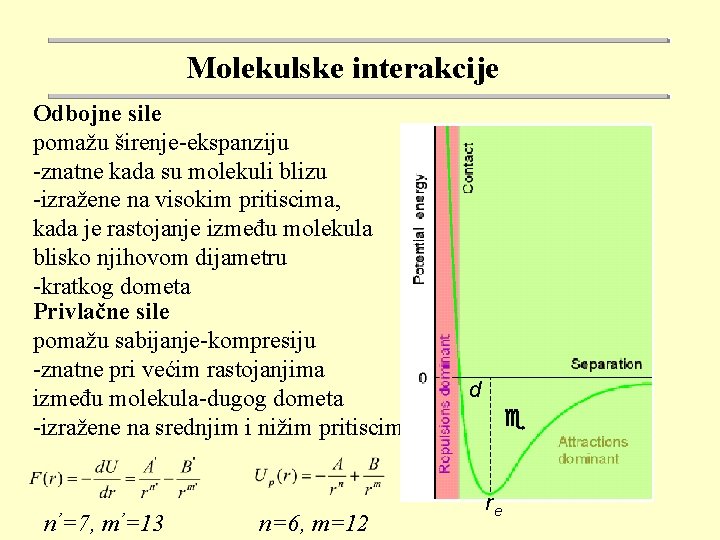
Molekulske interakcije Odbojne sile pomažu širenje-ekspanziju -znatne kada su molekuli blizu -izražene na visokim pritiscima, kada je rastojanje između molekula blisko njihovom dijametru -kratkog dometa Privlačne sile pomažu sabijanje-kompresiju -znatne pri većim rastojanjima između molekula-dugog dometa -izražene na srednjim i nižim pritiscima n’=7, m’=13 n=6, m=12 d e re

Kompresioni faktor argona na 283 K Z = p. Vm/RT odbojne privlačne

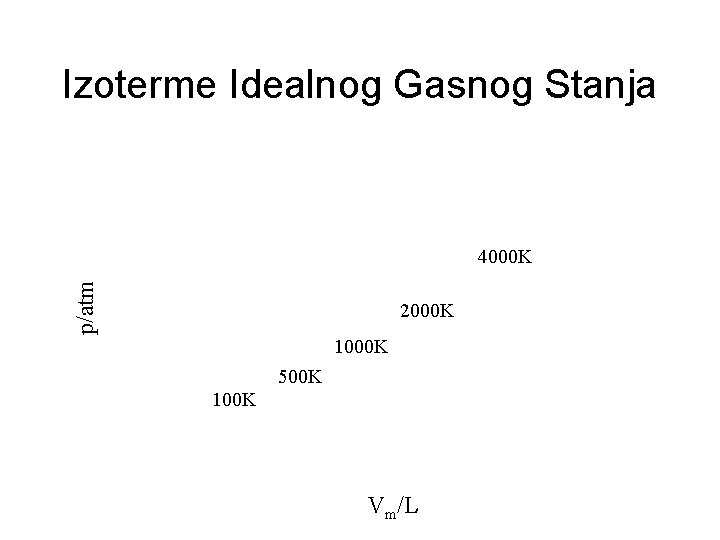
Virijalna jednačina stanja Za realni gas velikih molarnih zapremina i na visokim temperaturama izoterme su vrlo slične izotermama u idealnom gasnom stanju. Pri drukčijim uslovima jednačina idealnog gasnog stanja je samo prvi član serije tj. moraju se uvesti popravke: Ovo je virijalna jednačina stanja, u kojoj virijalni koeficijenti rastu sa porastom temperature. P=0 blisko jednačini idelanog gasnog stanja PVm=RT P raste: B značajno, linearna veza između Z i P P visoko: C i viši članovi doprinose, odstupanje od linearnosti Virial potiče od lat. vis, viris, znači sila, virijalni koeficijenti zavise od sile interakcije između molekula

Bojlova temperatura Idealno gasno stanje: d. Z/d. P=0 jer Z=1 Za realno gasno stanje: Pri niskom T: u početku d. Z/d. P<0, B<0 Pri visokom T: u početku d. Z/d. P>0, B>0 Temperatura pri kojoj je početni nagib nula je Bojlova temperatura, TB, pri kojoj je B=0 (relni gas se ponaša kao u idealnom stanju)

Drugi virijalni koeficijent, B Na Bojlovoj temperaturi B=0

Van der Waals-ova jednačina Johannes Dederic van der Waals (1837 -1923), holandski fizičar, dobio Nobelovu nagradu 1910 za fiziku za rad na jednačini stanja za gasove i tečnosti. Ovo je semiempirijska teorija zasnovana na eksperimentalnim posmatranjima kombinovano sa rigoroznim termodinamičkim tretmanom. Van der Waals-va jednačina se može pisati kao: gde su a i b van der Valsove konstante specifične za svaki gas. Konstanta a je u vezi sa privlačnim silama između molekula a V-nb je zapremina u kojoj se mogu kretati molekuli.

Izvođenje Vandervalsove jednačine Zapremina molekula-kovolumen Kovolumen je četiri puta veći od zapremine samih molekula u jednom molu: Zapremina Vmid je manja od Vm za sopstvenu zapreminu molekula. Da bi se dobila zapremina jednog mola gasa u IGS treba od zapremine u RGS oduzeti zapreminu koju zauzimaju molekuli. Ta zapremina je kovolumen. odbijanje

Izvođenje Vandervalsove jednačine Međumolekulske interakcije-unutrašnji pritisak Pid u IDGS je veći od pritiska P u RGS zbog privlačnih sila između molekula za vrednost tzv. unutrašnjeg pritiska Pu: privlačenje Pritisak je srazmeran gustini gasa jer srednja sila udara molekula po jedinici površine zida zavisi od gustine. Ova sila je u RGS zbog privlačenja koje trpe molekuli koji udaraju u zid suda od molekula iz gasa manja i to opet srazmerno gustini gasa i zavisno od osobina gasa. Zato je Pu srazmerno kvadratu gustine odnosno obrnuto srazmerno kvadratu zapremine gasa a zavisi i od prirode gasa kroz konstantu proporcionalnosti:

Van der Waals-ova jednačina Granični uslovi: Niski pritisci Visoki pritisci H 2, He CO 2, CH 4

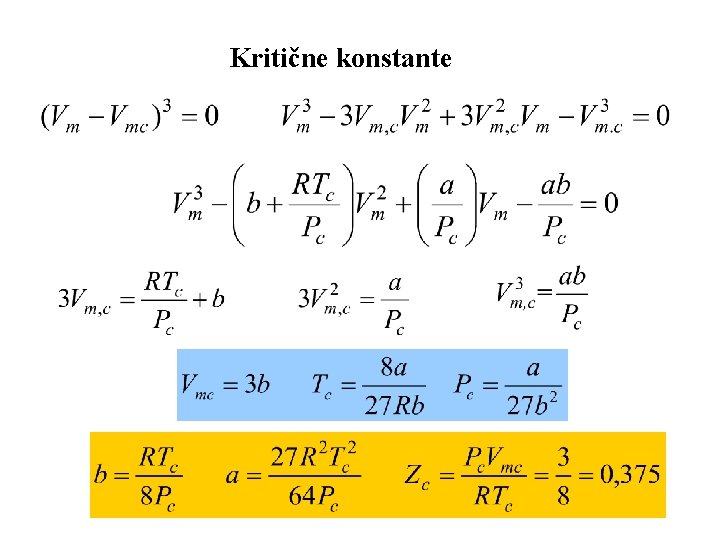
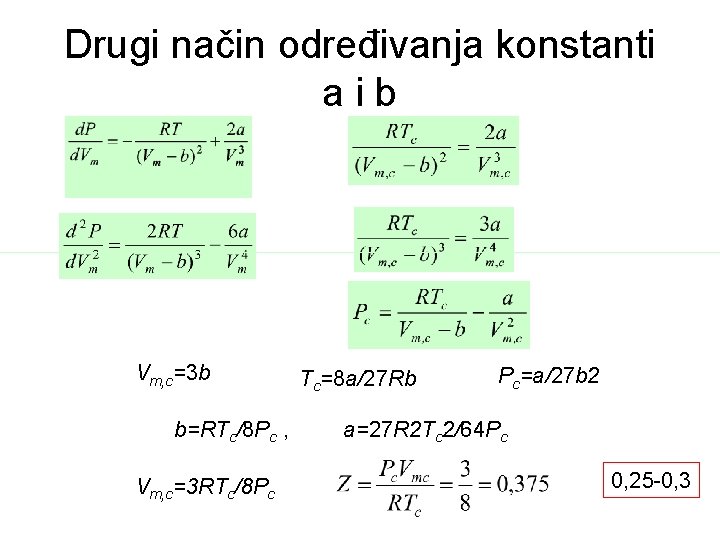
Konstanta a zavisi od temperature a konstanta b od pritiska Ove konstante se nalaze iz kritičnih konstanti ili iz eksperimentalnih podataka za P, T i V

Izoterme Idealnog Gasnog Stanja p/atm 4000 K 2000 K 1000 K 500 K 100 K Vm/L

Izoterme realnog gasnog stanja- Ar 500 K p/atm 200 K 150 K 100 K Vm/L

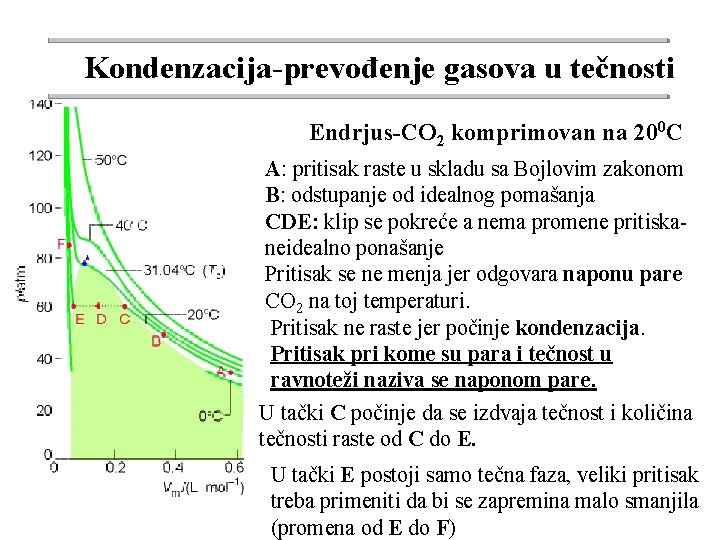
Kondenzacija-prevođenje gasova u tečnosti Endrjus-CO 2 komprimovan na 200 C A: pritisak raste u skladu sa Bojlovim zakonom B: odstupanje od idealnog pomašanja CDE: klip se pokreće a nema promene pritiskaneidealno ponašanje Pritisak se ne menja jer odgovara naponu pare CO 2 na toj temperaturi. Pritisak ne raste jer počinje kondenzacija. Pritisak pri kome su para i tečnost u ravnoteži naziva se naponom pare. U tački C počinje da se izdvaja tečnost i količina tečnosti raste od C do E. U tački E postoji samo tečna faza, veliki pritisak treba primeniti da bi se zapremina malo smanjila (promena od E do F)

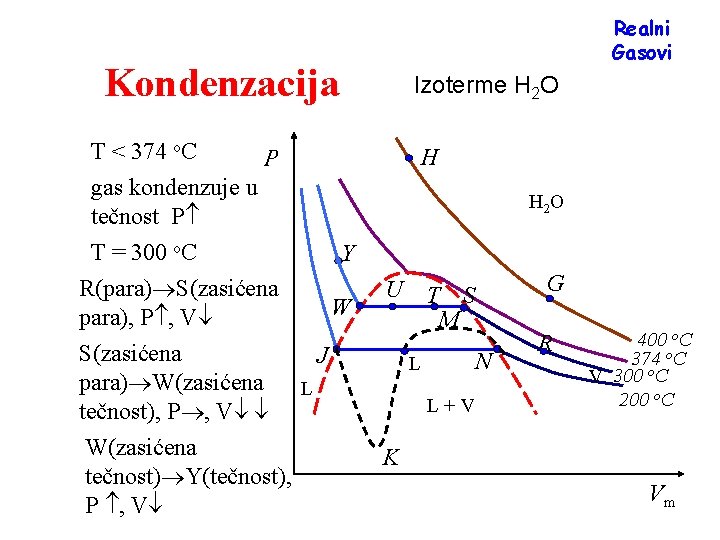
Realni Gasovi Kondenzacija T < 374 o. C Izoterme H 2 O H P gas kondenzuje u tečnost P H 2 O T = 300 o. C Y R(para) S(zasićena para), P , V S(zasićena para) W(zasićena tečnost), P , V W(zasićena tečnost) Y(tečnost), P , V W U J N L L G T S M L+V R 400 o. C 374 o. C V 300 o. C 200 o. C K Vm

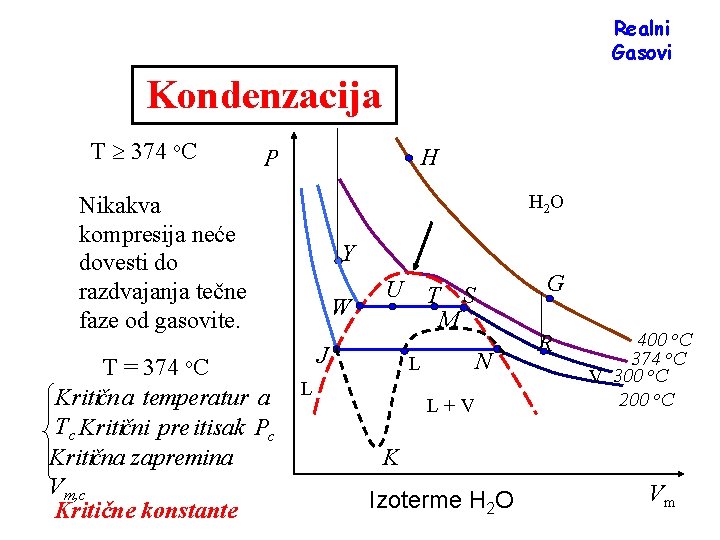
Realni Gasovi Kondenzacija T 374 o. C H P H 2 O Nikakva kompresija neće dovesti do razdvajanja tečne faze od gasovite. T = 374 o. C Kritičn a temperatur a Tc Kritični pre itisak Pc Kritična zapremina Vm, c Kritične konstante Y W U J N L L G T S M L+V R 400 o. C 374 o. C V 300 o. C 200 o. C K Izoterme H 2 O Vm

Fluid Postoji kontinuitet između gasovitog i tečnog stanja. Zbog ove kontinualnosti se koristi naziv fluid ili za tečnost ili za gas. Obično se tečnost posmatra kao veoma gust gas. Samo kada su obe faze prisutne jasna je razlika između gasova i tečnosti. Fluid je definisan kao tečnost ako je temperatura ispod Tc a čija je molarna zapremina manja od Vm, c. Ako ova dva uslova nisu ispunjana, fluid se naziva gas. Gasovita faza ispod Tc se naziva parom.

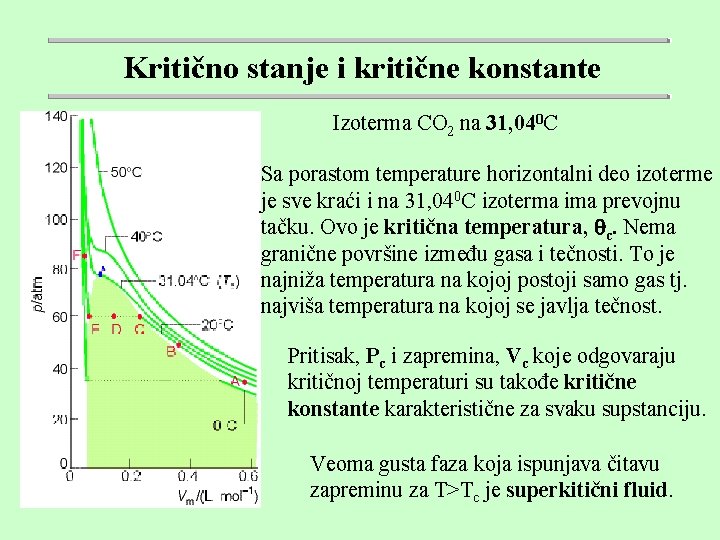
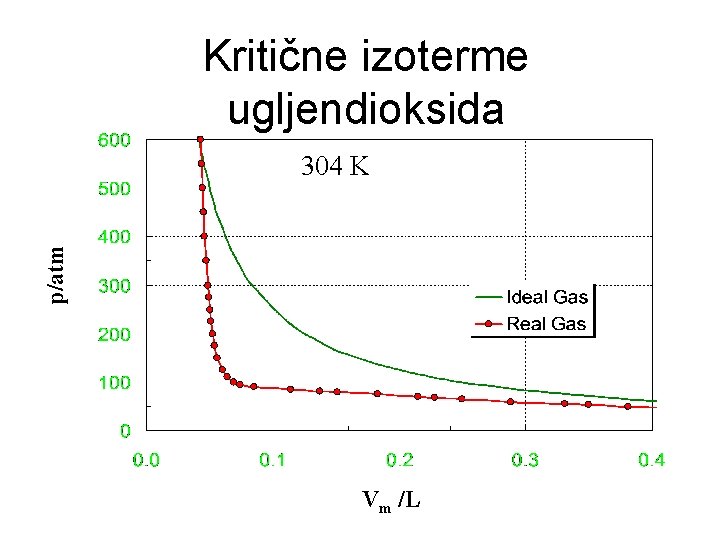
Kritično stanje i kritične konstante Izoterma CO 2 na 31, 040 C Sa porastom temperature horizontalni deo izoterme je sve kraći i na 31, 040 C izoterma ima prevojnu tačku. Ovo je kritična temperatura, c. Nema granične površine između gasa i tečnosti. To je najniža temperatura na kojoj postoji samo gas tj. najviša temperatura na kojoj se javlja tečnost. Pritisak, Pc i zapremina, Vc koje odgovaraju kritičnoj temperaturi su takođe kritične konstante karakteristične za svaku supstanciju. Veoma gusta faza koja ispunjava čitavu zapreminu za T>Tc je superkitični fluid.

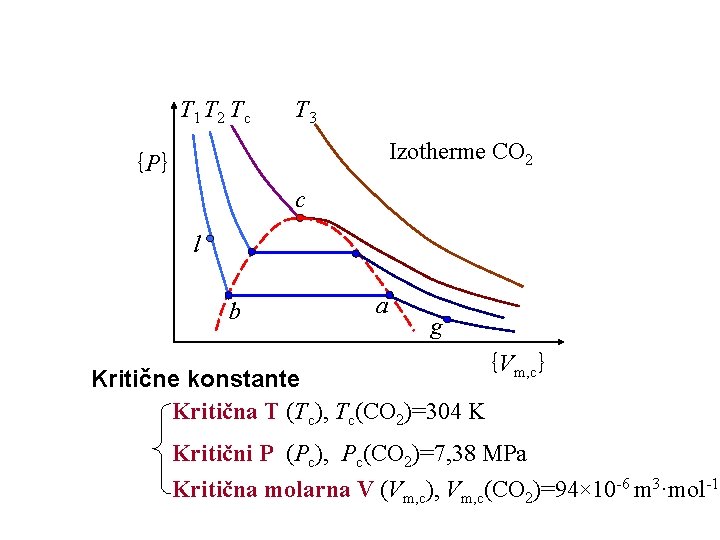
T 1 T 2 Tc T 3 Izotherme CO 2 {P} c l b a g Kritične konstante Kritična T (Tc), Tc(CO 2)=304 K {Vm, c} Kritični P (Pc), Pc(CO 2)=7, 38 MPa Kritična molarna V (Vm, c), Vm, c(CO 2)=94× 10 -6 m 3·mol-1

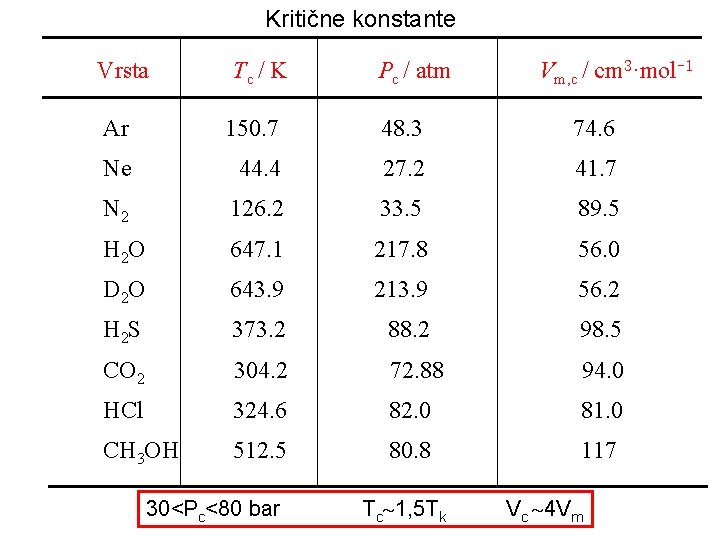
Kritične konstante Vrsta Tc / K Pc / atm Vm, c / cm 3·mol-1 Ar 150. 7 48. 3 74. 6 Ne 44. 4 27. 2 41. 7 N 2 126. 2 33. 5 89. 5 H 2 O 647. 1 217. 8 56. 0 D 2 O 643. 9 213. 9 56. 2 H 2 S 373. 2 88. 2 98. 5 CO 2 304. 2 72. 88 94. 0 HCl 324. 6 82. 0 81. 0 CH 3 OH 512. 5 80. 8 117 30<Pc<80 bar Tc 1, 5 Tk Vc 4 Vm

Superkritični fluid je onaj čije T i P zadovoljavaju: T > Tc i P > Pc Superkritični fiquid obično ima: Ø gustinu sličnu tečnosti Ø viskoznost mnogo manja od one tipične za tečnost Ø difuzioni koeficijent je mnogo veći nego u tečnostima.

Kritične izoterme ugljendioksida p/atm 304 K Vm /L

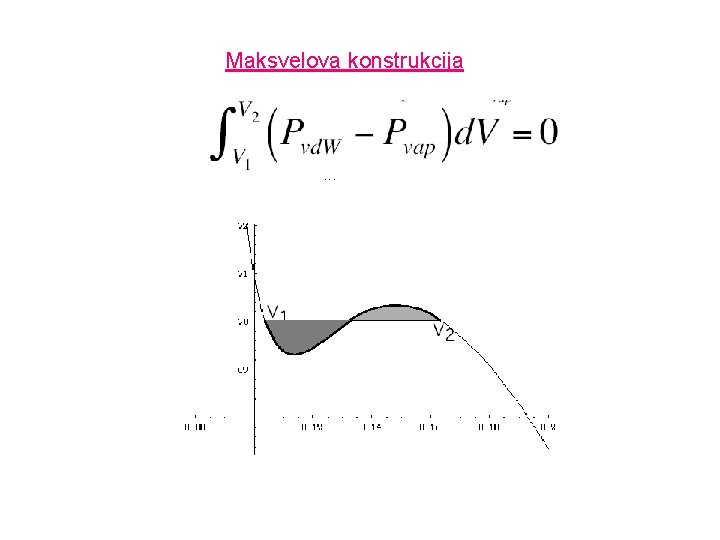
Izoterme po Van der Waals-u Nerealno je očekivati da će tako jednostavna jednačina idealno opisivati ponašanje svih gasova. -Van der Waals-ova jednačina: analitički izražena omogućava samo opšta opažanja u ponašanju realnih gasova. Najuočljivija razlika između izmerenih i izračunatih izotermi za CO 2 je tzv. vandervalsova petlja, pad ispod i porast iznad eksperimentalne krive za T<Tc. Realna kriva se dobija Maksvelovom konstrukcijom a konstante poređenjem eksperimentalne i izračunate izoterme. -Virijalna jednačina: daje mnogo veća slaganja između eksperimentalnih i izračunatih vrednosti u širokom intervalu temperatura.

Maksvelova konstrukcija

Kritične konstante

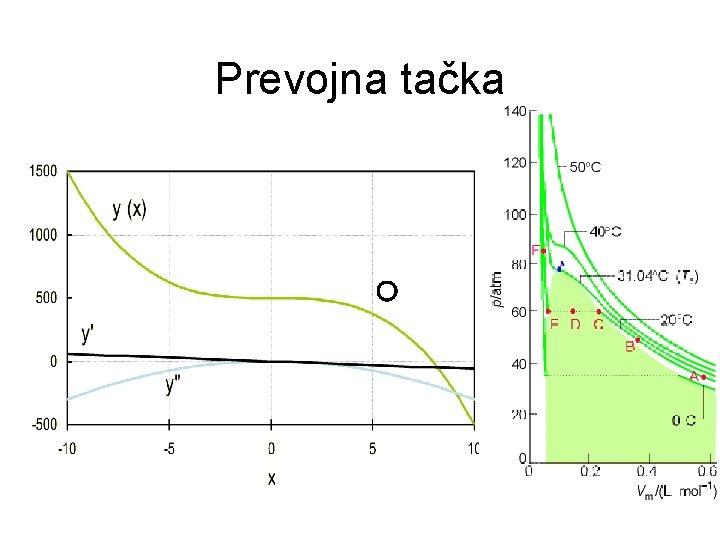
Prevojna tačka

Prevojna tačka

Drugi način određivanja konstanti aib Vm, c=3 b b=RTc/8 Pc , Vm, c=3 RTc/8 Pc Tc=8 a/27 Rb Pc=a/27 b 2 a=27 R 2 Tc 2/64 Pc 0, 25 -0, 3


Određivanje kritičnih konstanti Ortobarne gustine t i p

Princip korespodentnih stanja U mnogim oblastima nauka često je potrebno izražavati fundamentalne osobine različitih objekata na relativnoj skali radi poređenja. Za gasove u tu svrhu koristimo redukovane veličine tako što parametre različitih stanja normiramo u odnosu na standardno stanje: Opažanje da realni gasovi na istim redukovanim P i V imaju istu redukovanu temperaturu Tr je princip korespodentnih stanja

Redukovane veličine i princip korespodentnih stanja


Druge jednačine stanja Veliki broj jednačina sličnih Van der Waalsovoj su postavljene i primenjene za različite gasove. Može se uočiti da se različite vrednosti za konstante a i b mogu dobiti primenom različitih jednačina: Berteloova: Klauzijusova Diteričijeva N = N 0 exp ( U /RT) P = P 0 exp ( U /RT) Redlih-Kvongova Može se uočiti da se različite vrednosti za konstante a i b mogu dobiti primenom različitih jednačina

Druge jednačine stanja Samo jednačine koje imaju dve konstante mogu biti izrežene u redukovanom obliku.

Virialna jednačina • Prednost – zadovoljava podatke za gas sa željenom tačnošću. – koristi gasne zakone kao osnovu. • Nedostaci – beskonačan broj članova. – virialni koeficijenti zavise od temperature.

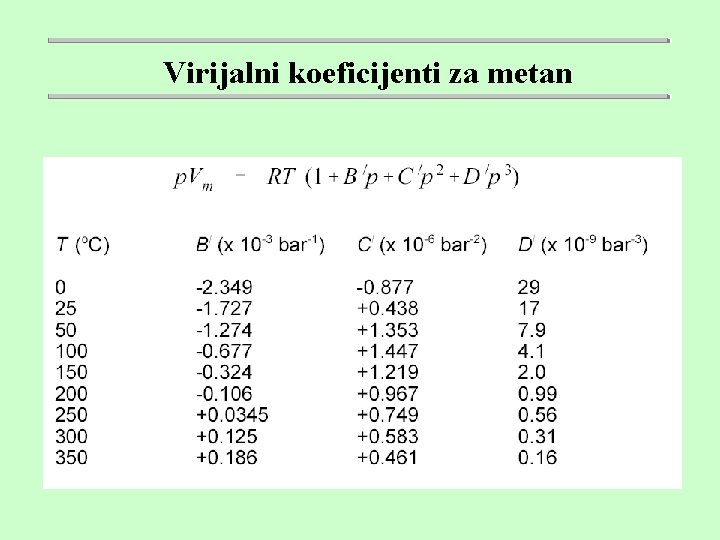
Virijalni koeficijenti za metan

Sumiranje rezulata primene Van der Valsove jednačine (1) Na visokim temperaturama i velikim zapreminama vd. W prelazi u jednačinu idealnog gasnog stanja jer: § Na visokim temperaturama privlačne sile odnosno član a/V 2 m su zanemarljivi § Ako je Vm veliko, tada je Vm-b~Vm (2) Tečnosti i gasovi postoje kada su privlačne i odbojne sile uravnotežene, konstanta a odgovara privlačnim a b odbojnim silama. (3) Kritične konstante su povezane sa vd. W konstantama: za T<Tc izoterme osciluju, prolazeći kroz minimum i maksimum koji konvergiraju sa približavanjem Tc i prvi i drugi izvod su jednaki nuli Kritični kompresioni faktor
 Jednačina gasnog stanja
Jednačina gasnog stanja Idealno gasno stanje
Idealno gasno stanje Nerealni brojevi
Nerealni brojevi Gasno rezanje
Gasno rezanje Vidski parnjak primjeri
Vidski parnjak primjeri Zdravlje definicija szo
Zdravlje definicija szo Glagolsko stanje
Glagolsko stanje Ego stanje dete
Ego stanje dete Dvovidni
Dvovidni Tecno agregatno stanje
Tecno agregatno stanje Kviz imenice glagoli pridjevi
Kviz imenice glagoli pridjevi Cvrsto agregatno stanje
Cvrsto agregatno stanje Dovrsni in nedovrsni
Dovrsni in nedovrsni Jednacine sa zagradama
Jednacine sa zagradama Dobijanje masti i ulja
Dobijanje masti i ulja Stanje predmeta
Stanje predmeta Kiša glagoli
Kiša glagoli Neutralizacija karboksilnih kiselina
Neutralizacija karboksilnih kiselina Kruzenje kiseonika u prirodi
Kruzenje kiseonika u prirodi Glagoli primjeri
Glagoli primjeri Glagoli
Glagoli Faktor kedatangan kuasa barat pada abad ke 16
Faktor kedatangan kuasa barat pada abad ke 16 Faktor aktivitas dan faktor stress
Faktor aktivitas dan faktor stress Faktor yang mempengaruhi rheologi
Faktor yang mempengaruhi rheologi Faktor-faktor yang mempengaruhi besar energi listrik adalah
Faktor-faktor yang mempengaruhi besar energi listrik adalah Makalah pengolahan hasil pertanian
Makalah pengolahan hasil pertanian Faktor pembentukan persekutuan tanah melayu 1948
Faktor pembentukan persekutuan tanah melayu 1948 Faktor yang mempengaruhi menyimak
Faktor yang mempengaruhi menyimak Faktor faktor yang mempengaruhi kesetimbangan kimia
Faktor faktor yang mempengaruhi kesetimbangan kimia Proses pemicu dalam kewirausahaan disebut juga
Proses pemicu dalam kewirausahaan disebut juga Faktor faktor kedatangan jepun ke negara kita tingkatan 4
Faktor faktor kedatangan jepun ke negara kita tingkatan 4 Faktor faktor yang mempengaruhi perubahan
Faktor faktor yang mempengaruhi perubahan Persepsi adalah
Persepsi adalah Faktor internal yang mempengaruhi perkembangan hama
Faktor internal yang mempengaruhi perkembangan hama Menurut david mccleland, kewirausahaan ditentukan oleh?
Menurut david mccleland, kewirausahaan ditentukan oleh? Penyebab pengingkaran kewajiban warga negara
Penyebab pengingkaran kewajiban warga negara Faktor faktor yang mempengaruhi persepsi
Faktor faktor yang mempengaruhi persepsi Contoh emulsi oil in water
Contoh emulsi oil in water Faktor yang mempengaruhi nilai opsi
Faktor yang mempengaruhi nilai opsi Faktor faktor perang dunia kedua
Faktor faktor perang dunia kedua Makna dan daya ikat konstitusi
Makna dan daya ikat konstitusi Faktor aktifitas
Faktor aktifitas Manfaat informasi akuntansi diferensial
Manfaat informasi akuntansi diferensial Faktor yang mempengaruhi semangat wirausaha
Faktor yang mempengaruhi semangat wirausaha