Generalidades Dermatologa Dra Roxana Del guila Jefa del










- Slides: 28

Generalidades Dermatología Dra. Roxana Del Águila Jefa del Departamento de Dermatología Instituto de Oncología “Ángel H. Roffo”. UBA

Drogas nuevas Toxicidades nuevas Una encrucijada estratégica entre Oncología y Dermatología 2

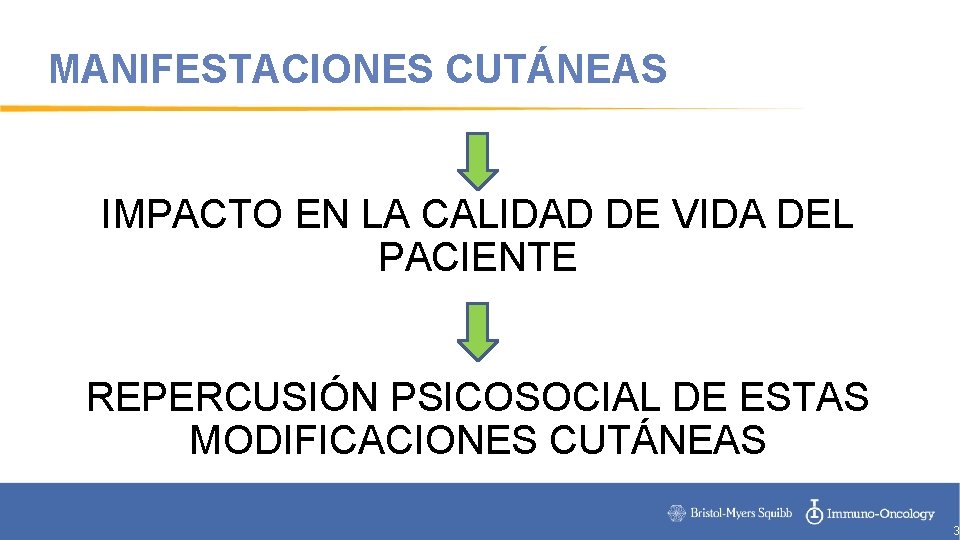
MANIFESTACIONES CUTÁNEAS IMPACTO EN LA CALIDAD DE VIDA DEL PACIENTE REPERCUSIÓN PSICOSOCIAL DE ESTAS MODIFICACIONES CUTÁNEAS 3

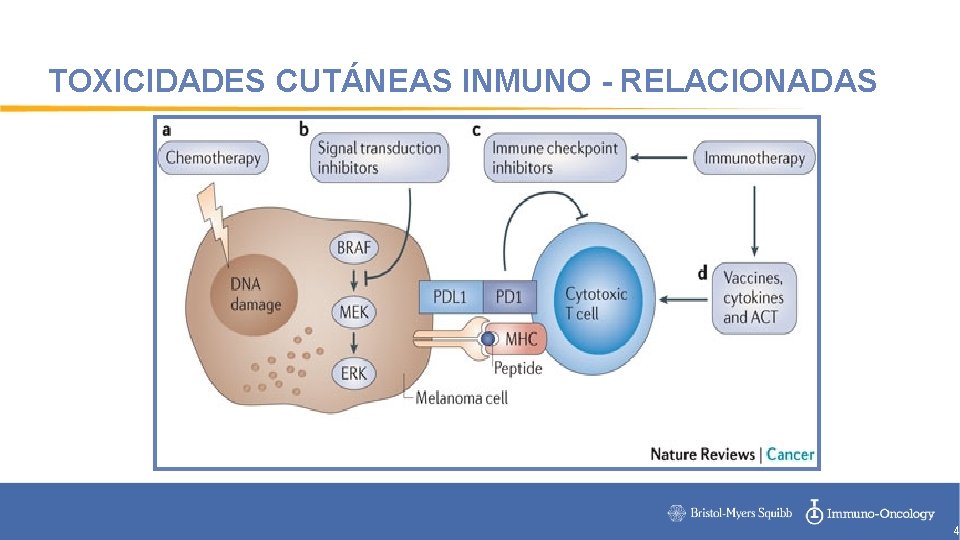
TOXICIDADES CUTÁNEAS INMUNO - RELACIONADAS 4

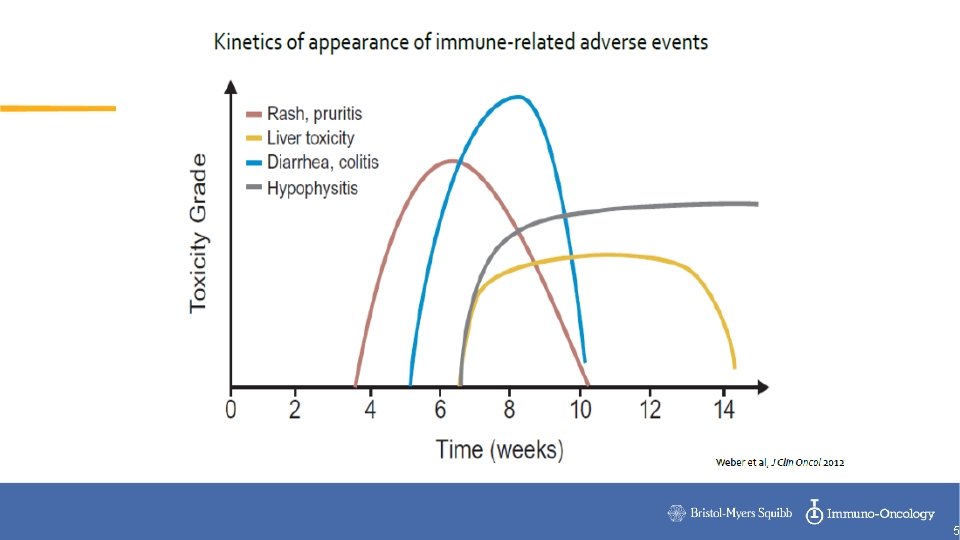
5

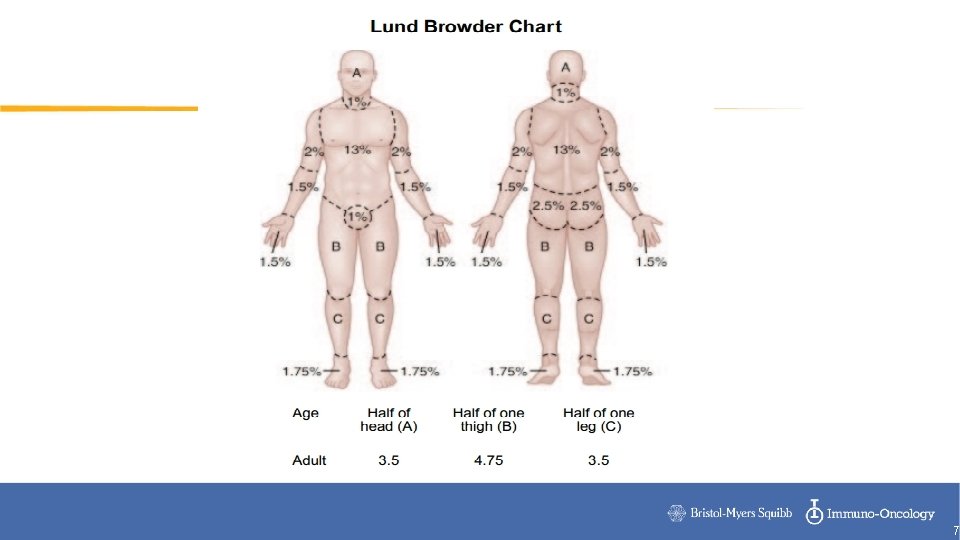
EA inmuno-relacionados- Clasificación Grado Rash Alopecia Hipopigmentación 1 Erupción macular o papular <10%BSA con o sin síntomas. Pérdida de cabello ≤ 50%, no obvia a distancia, solo a inspección cercana. Camuflaje, no peluca. Hipopigmentación o depigmentación <10%BSA, sin impacto psicosocial. 2 Erupción macular o papular 1030&BSA con o sin síntomas, limitante Pérdida de cabello >50%, requiere peluca, impacto psicosocial. Hipopigmentación o depigmentación >10%BSA, o con impacto psicosocial. 3 Maculas/ pápulas >30%BSA con o sin síntomas, limita el autocuidado. 4 Dermatitis ampollar, exfoliativa o ulcerativa generalizada 5 Muerte 6

7

Signos y Síntomas de IMARs en Piel • Rash –Máculopapuloso –Pápulopustuloso –Folicular –Urticariforme • Prurito • Otros –Dermatitis Liquenoide –Síndrome de Sweet –Penfigoide ampollar –Stevens- Johnson / Necrólisis Epidérmica Tóxica (Lyell) –Exacerbación o aparición de otras Dermatosis: Colagenopatías, Psoriasis • Vitiligo 8

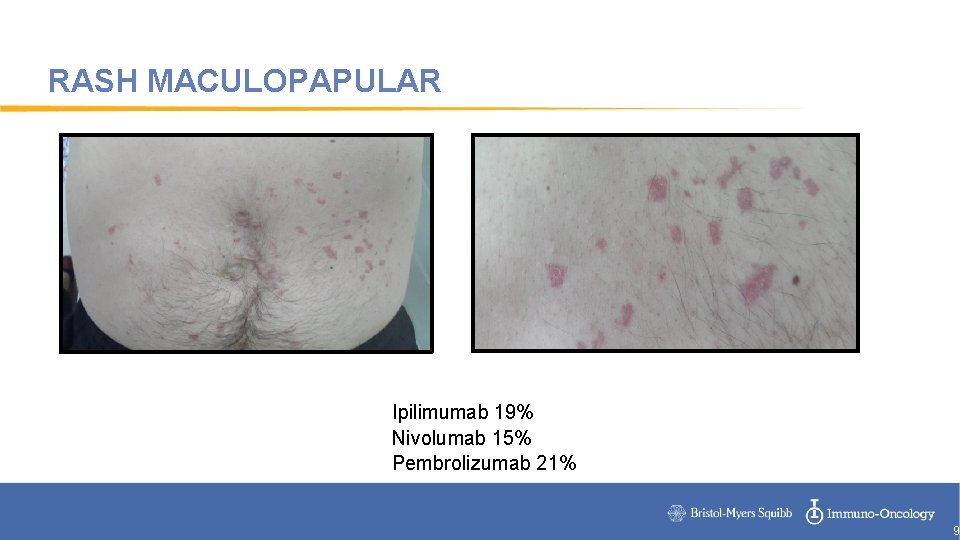
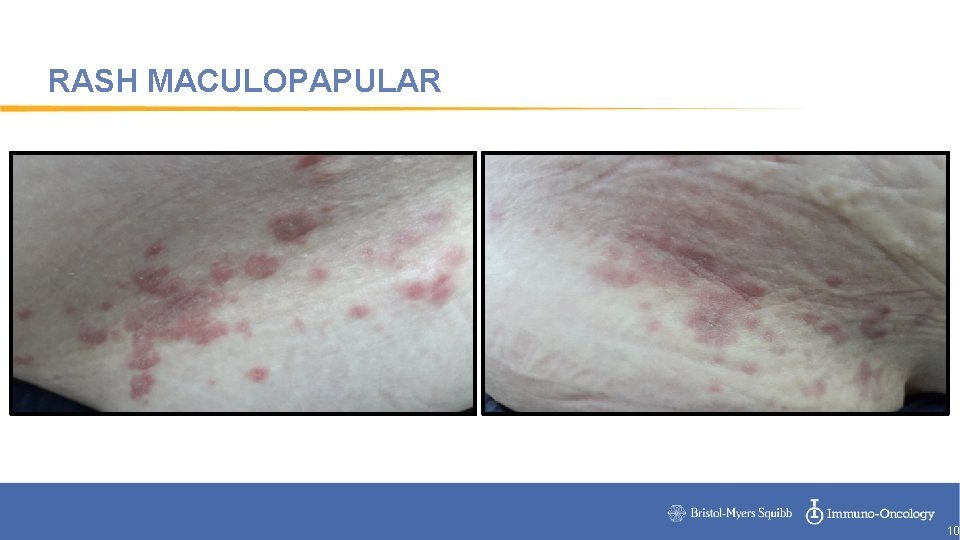
RASH MACULOPAPULAR Ipilimumab 19% Nivolumab 15% Pembrolizumab 21% 9

RASH MACULOPAPULAR 10

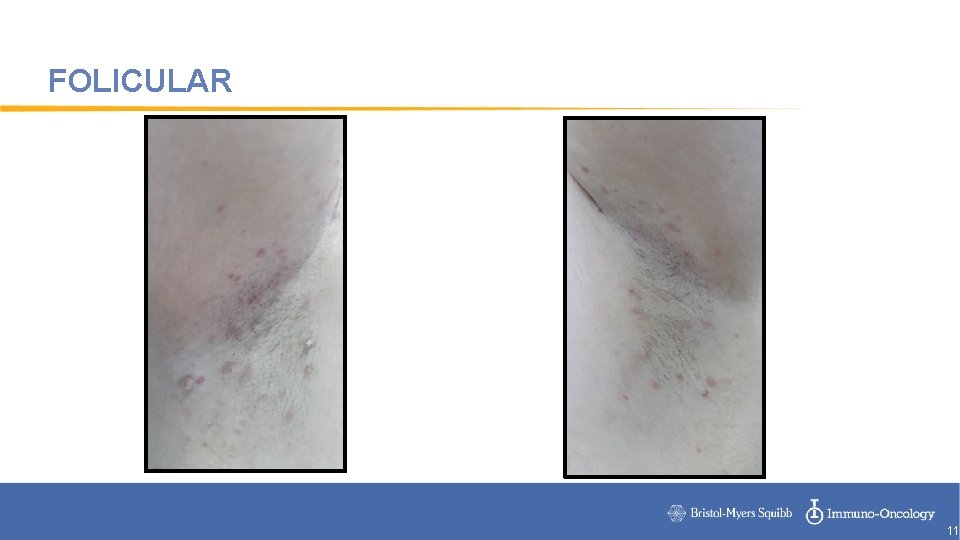
FOLICULAR 11

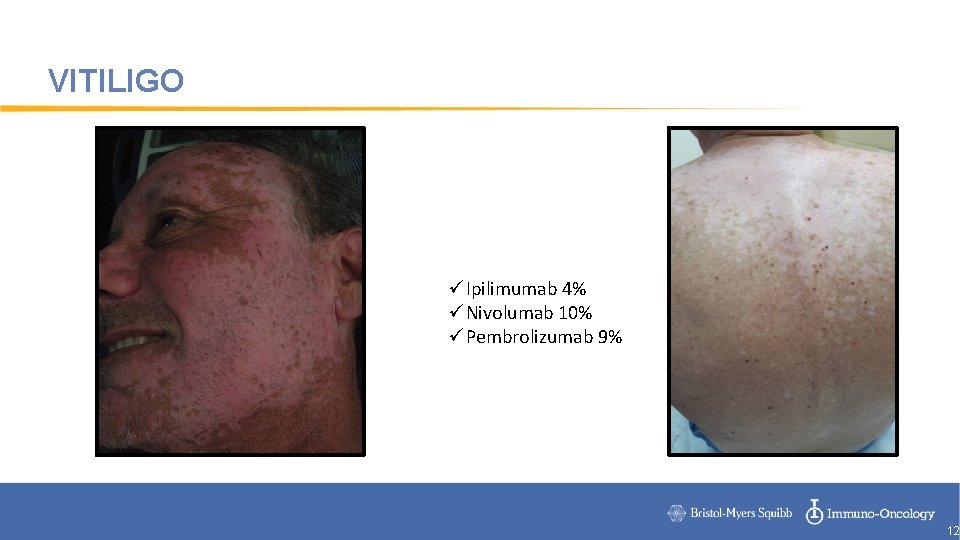
VITILIGO üIpilimumab 4% üNivolumab 10% üPembrolizumab 9% 12

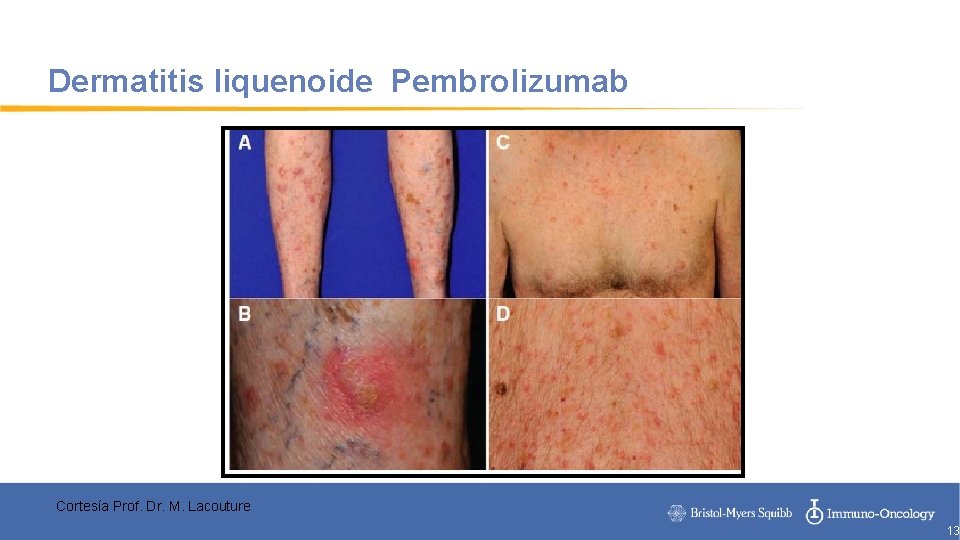
Dermatitis liquenoide Pembrolizumab Cortesía Prof. Dr. M. Lacouture 13

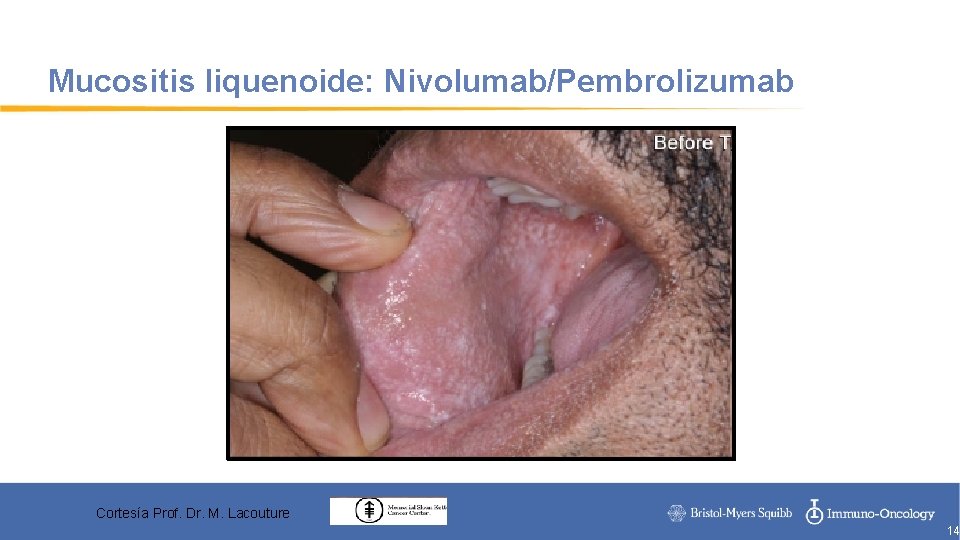
Mucositis liquenoide: Nivolumab/Pembrolizumab Cortesía Prof. Dr. M. Lacouture 14

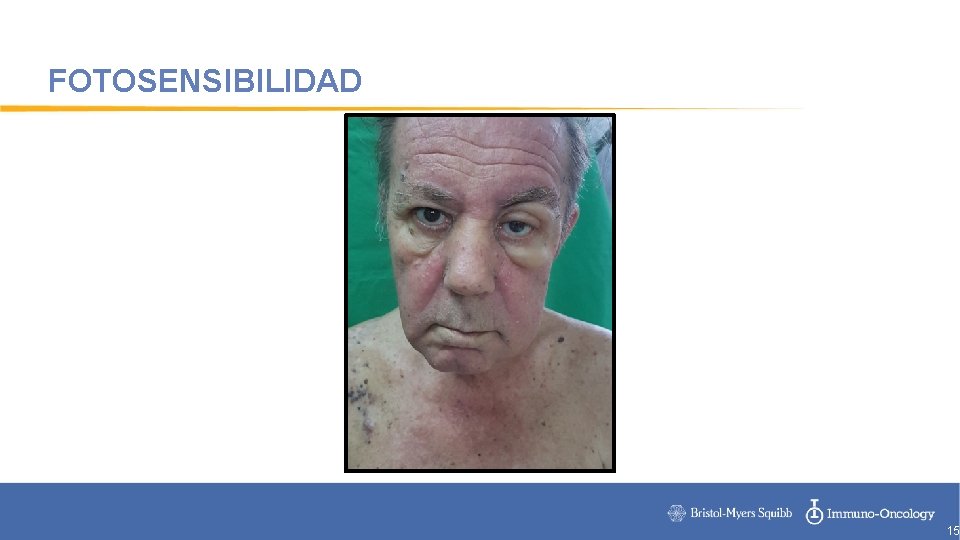
FOTOSENSIBILIDAD 15

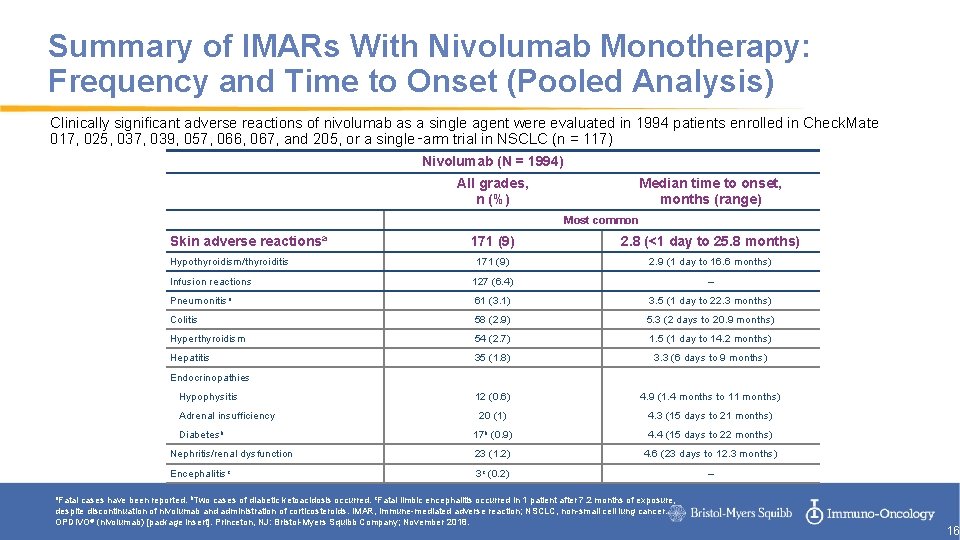
Summary of IMARs With Nivolumab Monotherapy: Frequency and Time to Onset (Pooled Analysis) Clinically significant adverse reactions of nivolumab as a single agent were evaluated in 1994 patients enrolled in Check. Mate 017, 025, 037, 039, 057, 066, 067, and 205, or a single‑arm trial in NSCLC (n = 117) Nivolumab (N = 1994) All grades, n (%) Median time to onset, months (range) Most common Skin adverse reactionsa 171 (9) 2. 8 (<1 day to 25. 8 months) 171 (9) 2. 9 (1 day to 16. 6 months) Infusion reactions 127 (6. 4) – Pneumonitisa 61 (3. 1) 3. 5 (1 day to 22. 3 months) Colitis 58 (2. 9) 5. 3 (2 days to 20. 9 months) Hyperthyroidism 54 (2. 7) 1. 5 (1 day to 14. 2 months) Hepatitis 35 (1. 8) 3. 3 (6 days to 9 months) 12 (0. 6) 4. 9 (1. 4 months to 11 months) 20 (1) 4. 3 (15 days to 21 months) 17 b (0. 9) 4. 4 (15 days to 22 months) Nephritis/renal dysfunction 23 (1. 2) 4. 6 (23 days to 12. 3 months) Encephalitisc 3 c (0. 2) – Hypothyroidism/thyroiditis Endocrinopathies Hypophysitis Adrenal insufficiency Diabetesb a. Fatal cases have been reported. b. Two cases of diabetic ketoacidosis occurred. c. Fatal limbic encephalitis occurred in 1 patient after 7. 2 months of exposure, despite discontinuation of nivolumab and administration of corticosteroids. IMAR, immune-mediated adverse reaction; NSCLC, non-small cell lung cancer. OPDIVO® (nivolumab) [package insert]. Princeton, NJ: Bristol-Myers Squibb Company; November 2018. 16

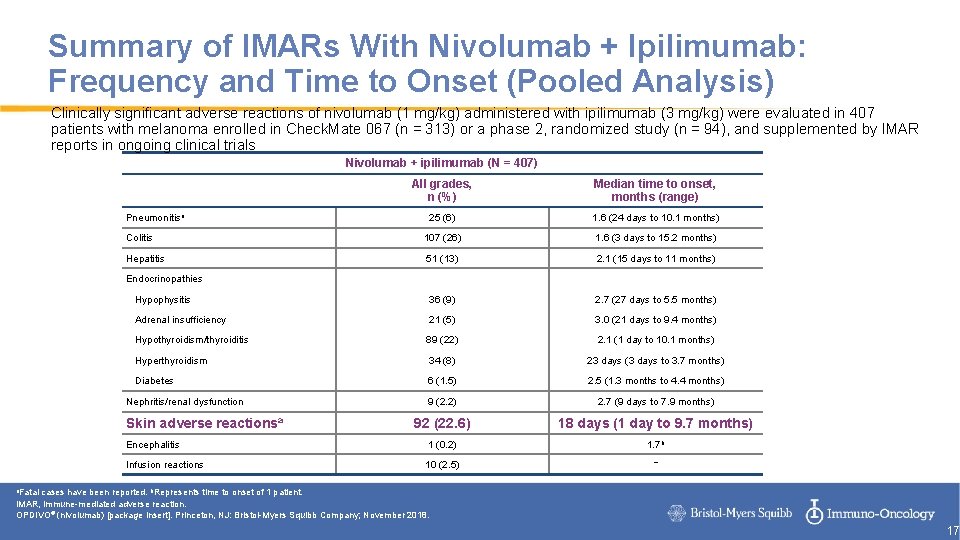
Summary of IMARs With Nivolumab + Ipilimumab: Frequency and Time to Onset (Pooled Analysis) Clinically significant adverse reactions of nivolumab (1 mg/kg) administered with ipilimumab (3 mg/kg) were evaluated in 407 patients with melanoma enrolled in Check. Mate 067 (n = 313) or a phase 2, randomized study (n = 94), and supplemented by IMAR reports in ongoing clinical trials Nivolumab + ipilimumab (N = 407) All grades, n (%) Median time to onset, months (range) 25 (6) 1. 6 (24 days to 10. 1 months) Colitis 107 (26) 1. 6 (3 days to 15. 2 months) Hepatitis 51 (13) 2. 1 (15 days to 11 months) Hypophysitis 36 (9) 2. 7 (27 days to 5. 5 months) Adrenal insufficiency 21 (5) 3. 0 (21 days to 9. 4 months) Hypothyroidism/thyroiditis 89 (22) 2. 1 (1 day to 10. 1 months) Hyperthyroidism 34 (8) 23 days (3 days to 3. 7 months) Diabetes 6 (1. 5) 2. 5 (1. 3 months to 4. 4 months) 9 (2. 2) 2. 7 (9 days to 7. 9 months) 92 (22. 6) 18 days (1 day to 9. 7 months) Encephalitis 1 (0. 2) 1. 7 b Infusion reactions 10 (2. 5) – Pneumonitisa Endocrinopathies Nephritis/renal dysfunction Skin adverse reactionsa a. Fatal cases have been reported. b. Represents time to onset of 1 patient. IMAR, immune-mediated adverse reaction. OPDIVO® (nivolumab) [package insert]. Princeton, NJ: Bristol-Myers Squibb Company; November 2018. 17

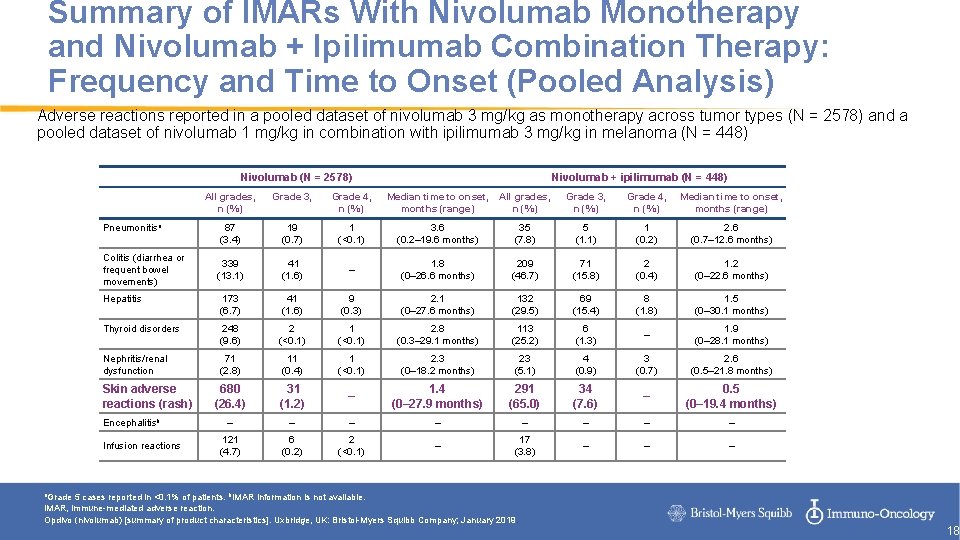
Summary of IMARs With Nivolumab Monotherapy and Nivolumab + Ipilimumab Combination Therapy: Frequency and Time to Onset (Pooled Analysis) Adverse reactions reported in a pooled dataset of nivolumab 3 mg/kg as monotherapy across tumor types (N = 2578) and a pooled dataset of nivolumab 1 mg/kg in combination with ipilimumab 3 mg/kg in melanoma (N = 448) Nivolumab (N = 2578) Nivolumab + ipilimumab (N = 448) All grades, n (%) Grade 3, n (%) Grade 4, n (%) Median time to onset, months (range) 87 (3. 4) 19 (0. 7) 1 (<0. 1) 3. 6 (0. 2– 19. 6 months) 35 (7. 8) 5 (1. 1) 1 (0. 2) 2. 6 (0. 7– 12. 6 months) 339 (13. 1) 41 (1. 6) – 1. 8 (0– 26. 6 months) 209 (46. 7) 71 (15. 8) 2 (0. 4) 1. 2 (0– 22. 6 months) Hepatitis 173 (6. 7) 41 (1. 6) 9 (0. 3) 2. 1 (0– 27. 6 months) 132 (29. 5) 69 (15. 4) 8 (1. 8) 1. 5 (0– 30. 1 months) Thyroid disorders 248 (9. 6) 2 (<0. 1) 1 (<0. 1) 2. 8 (0. 3– 29. 1 months) 113 (25. 2) 6 (1. 3) – 1. 9 (0– 28. 1 months) Nephritis/renal dysfunction 71 (2. 8) 11 (0. 4) 1 (<0. 1) 2. 3 (0– 18. 2 months) 23 (5. 1) 4 (0. 9) 3 (0. 7) 2. 6 (0. 5– 21. 8 months) 680 (26. 4) 31 (1. 2) – 1. 4 (0– 27. 9 months) 291 (65. 0) 34 (7. 6) – 0. 5 (0– 19. 4 months) – – – – 121 (4. 7) 6 (0. 2) 2 (<0. 1) – 17 (3. 8) – – – Pneumonitisa Colitis (diarrhea or frequent bowel movements) Skin adverse reactions (rash) Encephalitisb Infusion reactions a. Grade 5 cases reported in <0. 1% of patients. b. IMAR information is not available. IMAR, immune-mediated adverse reaction. Opdivo (nivolumab) [summary of product characteristics]. Uxbridge, UK: Bristol-Myers Squibb Company; January 2019. 18

Rare/uncommon IMARs (ie, ≥ 1/10, 000 to <1/100) Across Tumor Types IMARs in patients treated with nivolumab or nivolumab + ipilimumab 10 mg/kg (n = 448) Gastrointestinal • Intestinal perforationa • Gastritis • Duodenitis Endocrine • Diabetic ketoacidosisb • Diabetes mellitusb Neurologic • Guillain-Barré syndrome • Polyneuropathy • Neuritis • Peroneal nerve palsy • Autoimmune neuropathy • Encephalitisb Myotoxicities • Arrhythmia (including ventricular arrhythmia)a, c • Atrial fibrillation • Myocarditisa, d Immune • Sarcoidosis General and administration site conditions • Chest pain Skin • Psoriasis • Toxic epidermal necrolysisa, d • Stevens-Johnson syndromed Infections and infestations • Bronchitis Renal • Tubulointerstitial nephritis Respiratory • Pleural effusion Solid organ transplant rejection and has been reported post-marketing for patients treated with PD-1 inhibitors 2 a. Fatal cases have been reported in completed or ongoing clinical studies. b. Life-threating cases have been reported in completed or ongoing clinical studies. c. The frequency of adverse events in the cardiac disorders system organ class regardless of causality was higher in the nivolumab group than in the chemotherapy group in post-CTLA 4/BRAF inhibitor metastatic melanoma population. d. Reported also in studies outside the pooled dataset. The frequency is based on the program-wide exposure. IMAR, immunemediated adverse reaction. Opdivo (nivolumab) [summary of product characteristics]. Uxbridge, UK: Bristol-Myers Squibb Company; January 2019. 19

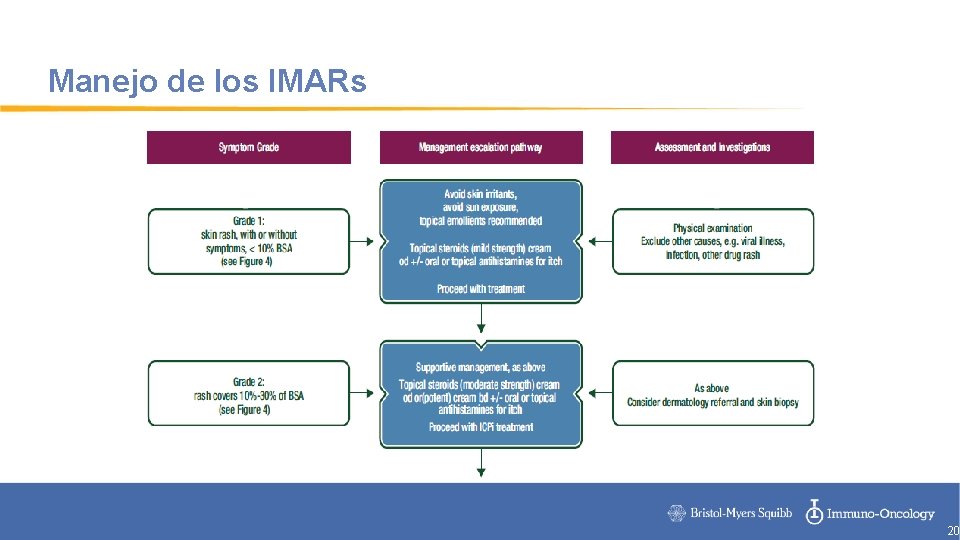
Manejo de los IMARs 20

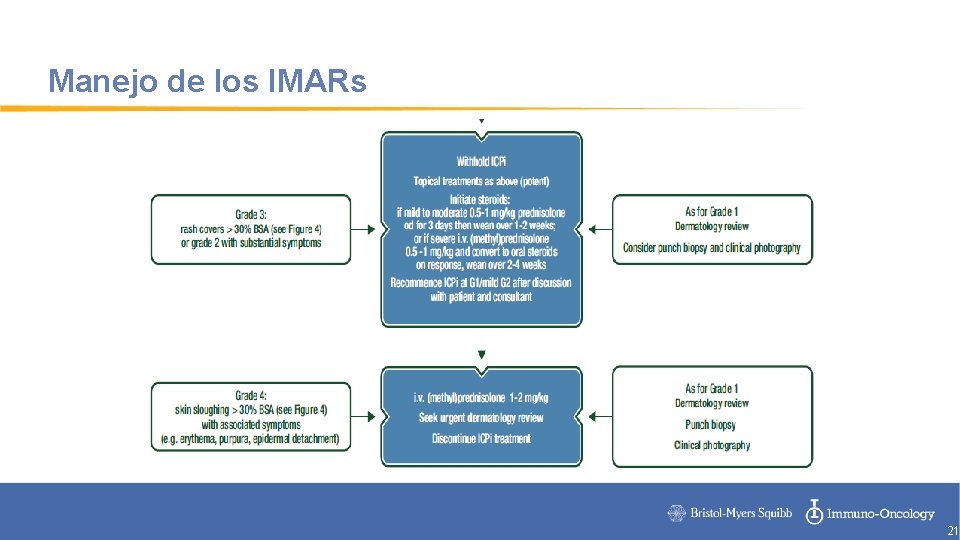
Manejo de los IMARs 21

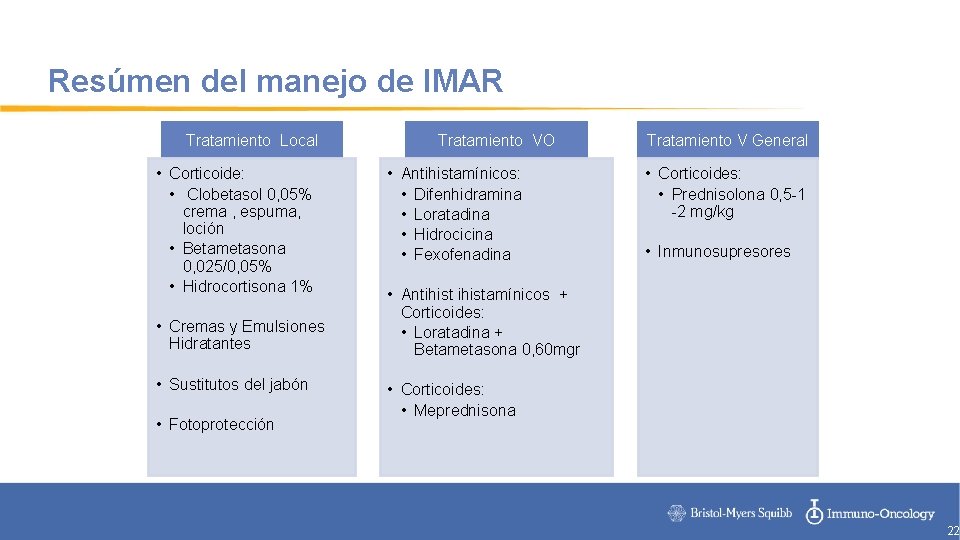
Resúmen del manejo de IMAR Tratamiento Local • Corticoide: • Clobetasol 0, 05% crema , espuma, loción • Betametasona 0, 025/0, 05% • Hidrocortisona 1% • Cremas y Emulsiones Hidratantes • Sustitutos del jabón • Fotoprotección Tratamiento VO • Antihistamínicos: • Difenhidramina • Loratadina • Hidrocicina • Fexofenadina Tratamiento V General • Corticoides: • Prednisolona 0, 5 -1 -2 mg/kg • Inmunosupresores • Antihistamínicos + Corticoides: • Loratadina + Betametasona 0, 60 mgr • Corticoides: • Meprednisona 22

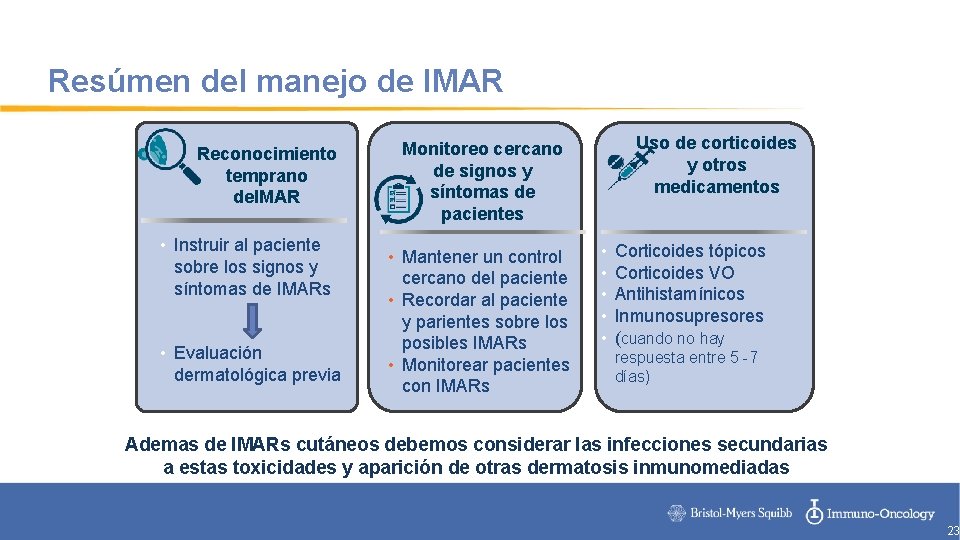
Resúmen del manejo de IMAR Reconocimiento temprano de. IMAR • Instruir al paciente sobre los signos y síntomas de IMARs • Evaluación dermatológica previa Uso de corticoides y otros medicamentos Monitoreo cercano de signos y síntomas de pacientes • Mantener un control cercano del paciente • Recordar al paciente y parientes sobre los posibles IMARs • Monitorear pacientes con IMARs • • • Corticoides tópicos Corticoides VO Antihistamínicos Inmunosupresores (cuando no hay respuesta entre 5 -7 días) Ademas de IMARs cutáneos debemos considerar las infecciones secundarias a estas toxicidades y aparición de otras dermatosis inmunomediadas 23

Conclusión NOFR 1900267 -08 Date of preparation: April 2019 24

EVALUACIÓN DERMATOLÓGICA EN PACIENTES ONCOLÓGICOS Comunicación fluída con dermatólogos Contacto para derivación/ evaluación Demora en conseguir turnos: • Cambios en los nevos: 38 días Oncólogo Comunicación con el oncólogo Dermatólogo Evaluación dermatológica • Botox : 8 días 25

Conclusión LA IMPORTANCIA DEL MANEJO DE LA TOXICIDAD CUTÁNEA, ESTÁ SOBRE TODO EN LA PREVENCIÓN CON UNA EVALUACIÓN DERMATOLÓGICA PREVIA PARA MINIMIZAR EN LO POSIBLE LAS REACCIONES CUTÁNEAS Y EN DARLE PAUTAS DE ALARMA CLARAS Y LA ADECUADA CONTENCIÓN AL PACIENTE Y TRATAMIENTO PERSONALIZADO 26

Muchas Gracias!

 Roxana del aguila
Roxana del aguila Dermatologia sassuolo
Dermatologia sassuolo El guila
El guila Guila con los ojos abiertos
Guila con los ojos abiertos Roxana bravo
Roxana bravo Dr. roxana viera
Dr. roxana viera Preseted
Preseted Carmen costache
Carmen costache Roxana knobel
Roxana knobel Dr roxana darabont
Dr roxana darabont Profesora roxana
Profesora roxana Samanta computer
Samanta computer Sfetea roxana
Sfetea roxana Roxana chapter 6
Roxana chapter 6 The shawshank redemption themes
The shawshank redemption themes Roxana mayer johnson
Roxana mayer johnson Roxana gavriloaia
Roxana gavriloaia Dr roxana viera
Dr roxana viera Cetam
Cetam Derecho mercantil generalidades
Derecho mercantil generalidades Generalidades de un producto
Generalidades de un producto Generalidades del reino fungi
Generalidades del reino fungi Pericardio
Pericardio Generalidades de la estadistica
Generalidades de la estadistica Generalidades del continente africano
Generalidades del continente africano Prueba de lundh
Prueba de lundh Generalidades del metabolismo
Generalidades del metabolismo Generalidades del deporte
Generalidades del deporte Generalidades de las fuentes del derecho escrito
Generalidades de las fuentes del derecho escrito