FUNES QUMICAS GRAA PORTO Funes qumicas Conjunto de




















































- Slides: 60

FUNÇÕES QUÍMICAS GRAÇA PORTO

Funções químicas Conjunto de substâncias que apresentam propriedades químicas semelhantes. As substâncias inorgânicas podem ser classificadas em quatro funções: §Ácidos §Bases §Sais §Óxidos Assim, numa reação química, todos os ácidos, por exemplo, terão comportamento semelhante.

Ácidos de Arrhenius: são substâncias compostas que, em solução aquosa, liberam como cátion o Hidroxônio (H 3 O+ ou H+). Ionização de um Ácido HCl + H 2 O H 3 O+ + Cl. H 2 SO 4 + 2 H 2 O 2 H 3 O+ + SO 42 H 3 PO 4 + 3 H 2 O 3 H 3 O+ + PO 43 -

Hidrogênios ionizáveis Os hidrogênios que fornecem H 3 O+ são chamados de hidrogênios ionizáveis. São aqueles que se ligam ao elemento mais eletronegativo na molécula do ácido. Geralmente a quantidade de hidrogênios do ácido é a mesma que pode ionizar, mas existem exceções: H 3 PO 3 + 2 H 2 O 2 H 3 O+ + HPO 32 - apenas 2 H+ H 3 PO 2 + H 2 O H 3 O+ + H 2 PO 21 - apenas 1 H+

Classificação dos Ácidos Quanto a presença ou ausência de Carboxila (-COOH) Orgânicos (CH 3 -COOH, HOOC-COOH) Inorgânicos (H 2 CO 3, H 2 CO 2, HCN) Quanto a presença ou ausência de Oxigênio Hidrácidos (HCl, H 2 S, HBr) Oxiácidos (H 2 SO 4, H 3 PO 4, HCl. O 4)

Classificação dos Ácidos Quanto ao número de elementos Químicos: Binário (HCl, HBr, HF) Ternário (H 2 SO 4, H 3 PO 4, HCN) Quanto ao número de Hidrogênios Ionizáveis: Monoácidos (HCl, HI, H 3 PO 2) Diácidos (H 2 SO 4, H 2 S, H 3 PO 3) Triácidos (H 3 PO 4, H 3 BO 3, H 3 BO 2) Tetrácidos (H 4 P 2 O 7)

Quanto ao Grau de Ionização (a) Ácidos fracos: 0< a < 5% Ácidos moderados: 5% £ a £ 50% Ácidos fortes : 50% < a < 100% Nº de Mol Ionizados a = Nº Inicial de Mols Ácido fraco: HCl. O Ácido moderado: H 3 PO 4 Ácido forte : H 2 SO 4 HCl. O 4

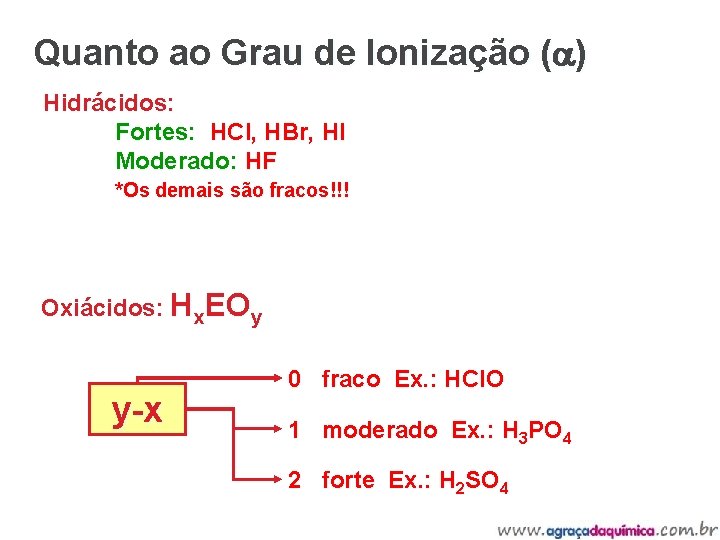
Quanto ao Grau de Ionização (a) Hidrácidos: Fortes: HCl, HBr, HI Moderado: HF *Os demais são fracos!!! Oxiácidos: Hx. EOy y-x 0 fraco Ex. : HCl. O 1 moderado Ex. : H 3 PO 4 2 forte Ex. : H 2 SO 4

Nomenclatura Oficial: Hidrácidos Seguem a seguinte regra: Ácidos + ídrico Radical do Elemento Oxiácidos Seguem a seguinte regra: ico (+ oxigênio) Ácido _________ + Radical do Elemento oso (- oxigênio)

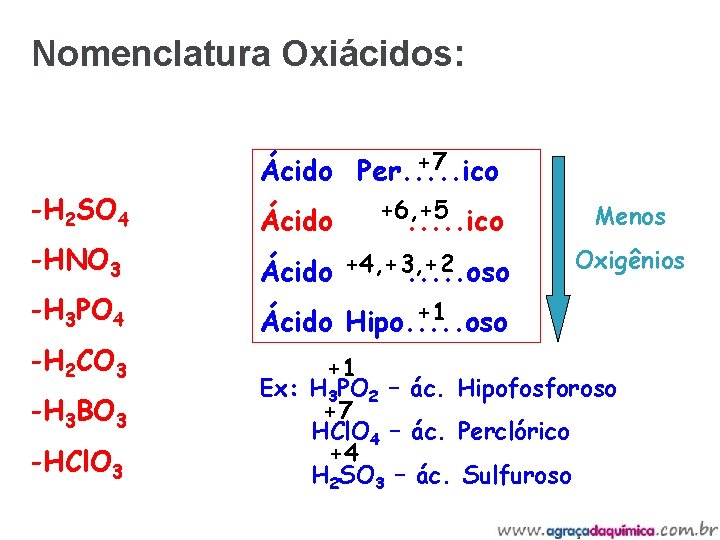
Nomenclatura Oxiácidos: -H 2 SO 4 -HNO 3 -H 3 PO 4 -H 2 CO 3 -H 3 BO 3 -HCl. O 3 +7 Ácido Per. . . ico Ácido +6, +5. . . ico Ácido +4, +3, +2. . . oso Menos Oxigênios +1 Ácido Hipo. . . oso +1 Ex: H 3 PO 2 – ác. Hipofosforoso +7 HCl. O 4 – ác. Perclórico +4 H 2 SO 3 – ác. Sulfuroso

Exemplo: +2 - 2 H 2 S Ácido sulfídrico +2 +4 - 6 H 2 SO 3 Ácido sulfuroso +2 +6 - 8 H 2 SO 4 Ácido sulfúrico *Para ácidos do enxofre usamos o radical em latim “sulfur”.

Características gerais dos ácidos üApresentam sabor azedo; üDesidratam a matéria orgânica; üDeixam incolor a solução fenolftaleína, e vermelho o papel de tornassol; üNeutralizam bases formando sal e água;

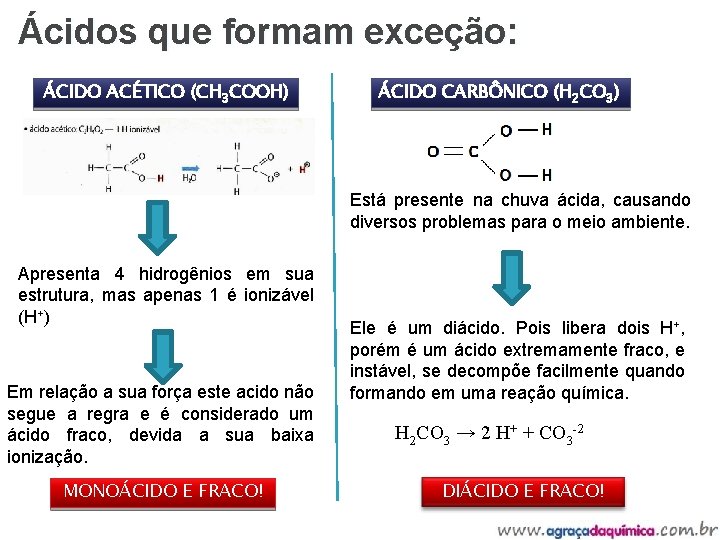
Ácidos que formam exceção: ÁCIDO ACÉTICO (CH 3 COOH) ÁCIDO CARBÔNICO (H 2 CO 3) Está presente na chuva ácida, causando diversos problemas para o meio ambiente. Apresenta 4 hidrogênios em sua estrutura, mas apenas 1 é ionizável (H+) Em relação a sua força este acido não segue a regra e é considerado um ácido fraco, devida a sua baixa ionização. MONOÁCIDO E FRACO! Ele é um diácido. Pois libera dois H+, porém é um ácido extremamente fraco, e instável, se decompõe facilmente quando formando em uma reação química. H 2 CO 3 → 2 H+ + CO 3 -2 DIÁCIDO E FRACO!

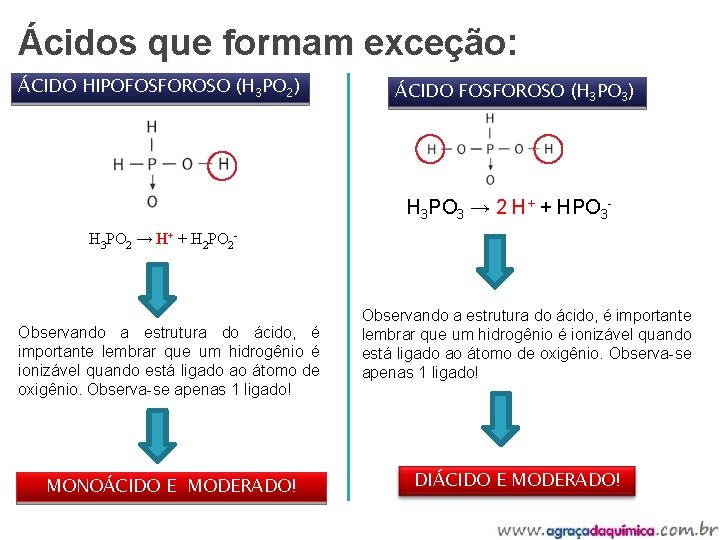
Ácidos que formam exceção: ÁCIDO HIPOFOSFOROSO (H 3 PO 2) ÁCIDO FOSFOROSO (H 3 PO 3) H 3 PO 3 → 2 H+ + HPO 3 H 3 PO 2 → H+ + H 2 PO 2 - Observando a estrutura do ácido, é importante lembrar que um hidrogênio é ionizável quando está ligado ao átomo de oxigênio. Observa-se apenas 1 ligado! MONOÁCIDO E MODERADO! Observando a estrutura do ácido, é importante lembrar que um hidrogênio é ionizável quando está ligado ao átomo de oxigênio. Observa-se apenas 1 ligado! DIÁCIDO E MODERADO!

Ácidos importantes: 1) H 2 SO 4 – Ác. Sulfúrico (ácido ou água de bateria) É um líquido incolor e oleoso de densidade 1, 85 g/cm 3, é um ácido forte que reage com metais originando sulfatos além de ser muito higroscópico. Pode ser obtido a partir das seguintes reações: S + O 2 SO 2 + ½O 2 SO 3 + H 2 O H 2 SO 4 *É usado para medir o desenvolvimento industrial de um país.

Ácidos importantes: 2) HCl – Ác. Clorídrico (ácido muriático) Solução de hidreto de cloro em água. Apresenta forte odor, além de ser sufocante. É utilizado na limpeza de peças metálicas e de superfícies de mármore. É encontrado no suco gástrico humano.

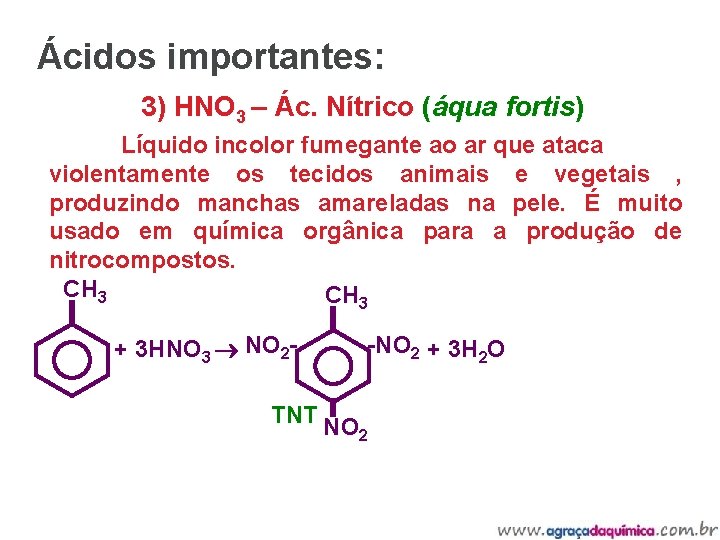
Ácidos importantes: 3) HNO 3 – Ác. Nítrico (áqua fortis) Líquido incolor fumegante ao ar que ataca violentamente os tecidos animais e vegetais , produzindo manchas amareladas na pele. É muito usado em química orgânica para a produção de nitrocompostos. CH 3 + 3 HNO 3 NO 2 - -NO 2 + 3 H 2 O TNT NO 2

Ácidos importantes: 4) H 3 PO 4 – Ác. Fosfórico (Acidulante INS-338) Obtido pela oxidação do fósforo vermelho com ácido nítrico concentrado. É um ácido moderado usado na industria de vidros, preparo de águas minerais e nos refrigerantes de “cola”. Seus fosfatos são usados como adubo. *Seus fosfatos fazem parte da formulação do fertilizante “NPK”.

Bases De acordo com Arrhenius, base ou hidróxido é toda substância que, dissolvida em água, dissocia-se fornecendo como ânion exclusivamente OH- (hidroxila). Na. OH Na+ + OH- Ca(OH)2 Ca 2+ + 2 OH- Al(OH)3 Al 3+ + 3 OH- §Possuem OH- §Metais; §Lig. Iônicas; §Sólidas.

Bases (exceção) * NH 3 + H 2 O <NH 4 OH> §Ametais; §Lig. covalentes; §Solução aquosa; §Volátil.

Nomenclatura Hidróxido de _________ Nome do Elemento Na. OH hidróxido de sódio Fe(OH)2 hidróxido de ferro II Fe(OH)3 hidróxido de ferro III

Classificação Quanto ao Número de Hidroxilas - Monobases: - Dibases: - Tribases: - Tetrabases: Na. OH; NH 4 OH Ca(OH)2; Mg(OH)2 Al(OH)3; Fe(OH)3 Pb(OH)4; Sn(OH)4 Quanto ao Grau de Dissociação Iônica - Fortes: Os hidróxidos de metais alcalinos (1 A) e metais alcalinos terrosos (2 A). - Fracas: Nesse grupo incluem-se o hidróxido de amônio (NH 4 OH) e as demais bases.

Classificação Quanto à Solubilidade em Água - Totalmente solúveis: os hidróxidos metais alcalinos e o hidróxido de amônio (NH 4 OH). - Parcialmente solúveis: hidróxidos metais alcalino-terrosos. - Insolúveis: todos os demais hidróxidos. KOH Monobase Forte Solúvel Al(OH)3 Tribase Fraca Insolúvel

Características gerais das bases üApresentam sabor adstringente; üDeixam vermelha a solução de fenolftaleína, e azul o papel de tornassol; üNeutralizam ácidos formando sal e água;

Bases importantes: 1) Na. OH – Hidróxido de sódio (Soda caústica) É um sólido branco floculado muito solúvel em água além de extremamente caústico. É usado na desidratação de gorduras, no branqueamento de fibras (celulose) e na fabricação de sabões e detergentes e como desentupidor de ralos e esgotos. *Sabões e detergentes são chamados de agentes tensoativos e possuem caráter básico.

Bases importantes: 2) Ca(OH)2 – Hidróxido de cálcio (cal apagada, hidratada ou extinta) É uma suspensão aquosa de aparência leitosa, obtida a partir do Ca. O (cal virgem). É usada em construções, na neutralização de solos ácidos e na fabricação de doces. Ca. O + H 2 O Ca(OH)2 Cal Virgem Cal Apagada

Bases importantes: 3) Mg(OH)2 – Hidróxido de magnésio (Leite de magnésia) É uma suspensão leitosa, obtida a partir do Mg. O. É usada como antiácido estomacal e também como laxante. Mg(OH)2 + 2 HCl Mg. Cl 2 + 2 H 2 O

Bases importantes: 4) Al(OH)3 – Hidróxido de alumínio É uma suspensão gelatinosa que pode adsorver moléculas orgânicas que por ventura estejam em solução aquosa (no tratamento da água). É usada como antiácido estomacal, para tingimentos e na preparação de lacas (resina ou verniz) para pintura artística. *Como antiácido estomacal recebe os nomes de Mylantha plus e Gelmax.

DESCARTE DE ÁCIDOS E BASES Ácidos e Bases Neutralizar com Na. OH ou H 2 SO 4 , respectivamente, utilizar papel indicador ou gotas de fenolftaleína, para garantir que o p. H da solução resultante situe-se entre 6 e 8. Após a neutralização, descartar lentamente na pia sob água corrente. Para soluções extremamente ácidas, como mistura sulfonítrica, por exemplo, utilizar cal na neutralização. Resíduos de ácidos devem ser descartados em frascos de vidro. Resíduos de base polietileno(plástico). Prof. Busato devem ser descartados em frascos de Química

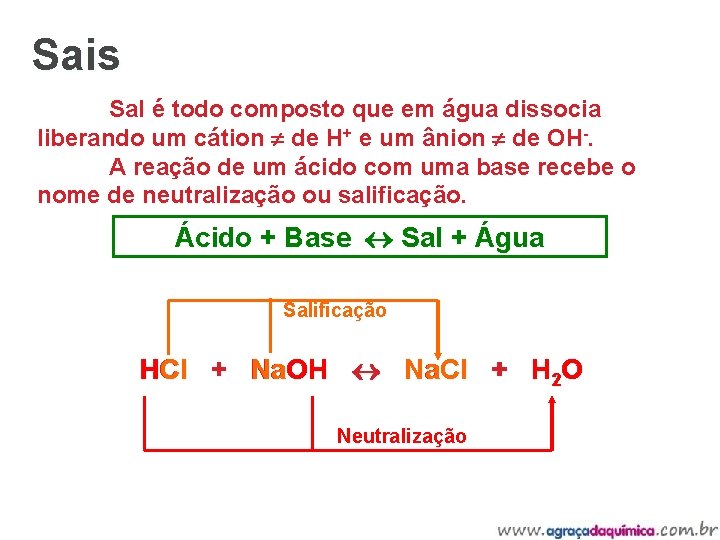
Sais Sal é todo composto que em água dissocia liberando um cátion de H+ e um ânion de OH-. A reação de um ácido com uma base recebe o nome de neutralização ou salificação. Ácido + Base Sal + Água Salificação HCl + Na. OH Na. Cl + H 2 O Neutralização

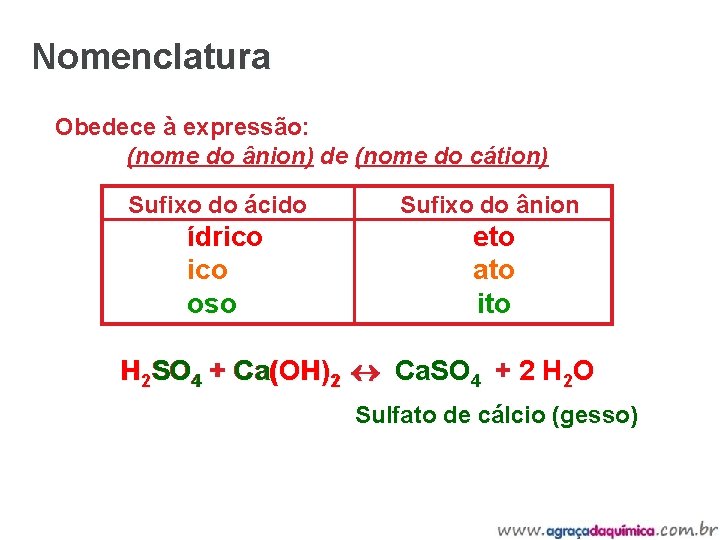
Nomenclatura Obedece à expressão: (nome do ânion) de (nome do cátion) Sufixo do ácido Sufixo do ânion ídrico eto ico ato oso ito H 2 SO 4 + Ca(OH)22 Ca. SO 4 + 2 H 2 O Sulfato de cálcio (gesso)

Sais neutros ou normais São obtidos por neutralização total (H+ioniz = OH-): H 2 CO 3 + + Ca(OH) + Ca Ca(OH)22 Ca. CO 3 + 2 H 2 O 2 Na. OH + H 2 SO 4 Na. SO 4 + 2 H 2 O

Sais Hidrogenados e Sais hidroxilados São obtidos por neutralização parcial (H+ionizáveis ≠ OH-): H 2 CO 3 + + Na. OH + Na Na. OH Na. HCO 3 + H 2 O Sal hidrogenado ou hidrogenossal HCl + Mg(OH)22 Mg(OH)Cl + H 2 O Cl + Mg Sal hidroxilado ou hidróxissal

Classificação Quanto à Presença de Oxigênio - Oxissais : Ca. SO 4 , Ca. CO 3 , KNO 3 - Halóides: Na. Cl , Ca. Cl 2 , KCl Quanto ao Número de Elementos - Binários: Na. Cl , KBr , Ca. Cl 2 - Ternários: Ca. SO 4 , Al 2(SO 4)3 - Quaternários: Na. CNO , Na 4 Fe(CN)6

Classificação Quanto à Presença de Água - Hidratados: Cu. SO 4. 5 H 2 O; Ca. SO 4. 2 H 2 O - Anidro: KCl; Na. Cl; Ca. SO 4 Quanto à Natureza - Neutros ou normais: Na. Br; Ca. CO 3 - Hidrogenossais: Na. HCO 3; Ca. HPO 4 - Hidroxissais: Ca(OH)Br - Duplos ou mistos: Na. KSO 4; Ca. Cl. Br

Sais importantes: 1) Na. HCO 3 – Bicarbonato de sódio (ENO, Sonrisal) É um pó branco que perde CO 2 com facilidade (efervescência). É usado como antiácido estomacal , fermento químico e nos extintores de incêndio. H 2 CO 3 Na. HCO 3 + H 2 O Na. OH + H 2 O+ CO 2 *Pode ser usado para neutralizar os ácidos graxos na manteiga rançosa.

Sais importantes: 2) Ca. CO 3 – Carbonato de cálcio (mármore, calcáreo) É um sólido branco que por aquecimento perde CO 2 e produz Ca. O (calcinação). É usado na fabricação de cimentos(Portland), como corretivo do solo e como fundente em metalurgia. Ca. CO 3 Ca. O + CO 2 *Na Espanha é encontrado na região de Aragón, daí seu nome mineral (aragonita). Na forma de estalagmites pode ser chamado de calcita (mármore Carrara).

Sais importantes: 3) Na. NO 3 – Nitrato de sódio (Salitre do Chile) É um sólido cristalizado no sistema cúbico, além de ser um ótimo oxidante para reações químicas. É usado na fabricação de fertilizantes e explosivos. *Nos Andes era utilizado na conservação da carne por ser higroscópico.

Sais importantes: 4) NH 4 Cl – Cloreto de amônio (Sal amoníaco) É um sólido granulado obtido do líquido amoniacal das fábricas de gás. É usado na fabricação de pilhas secas, na soldagem, na galvanização do ferro e na fabricação de tecidos. *Por ser higroscópico é utilizado na fabricação de bolachas.

Preparação de um sal a partir de outro sal: Ametais: F O N Cl Br I S C P H Metais: K Mg Al Zn Fe Ni H Sn Cu Ag Au SAL METAL OU AMETAL 1 ÁCIDO 2 BASE 3 SAL 4 São reações de deslocamento que devem portanto obdecer às filas de reatividade São reações de dupla troca onde deverão aparecer um precipitado, ou um produto gasoso (volátil) (H 2 CO 3, HCN, H 2 SO 3 ou NH 4 OH), ou um produto pouco ionizado (bases e ácidos fracos e/ou água) EXEMPLOS: 1 Reação de um sal com um metal Fe + Cu. SO 4 → Fe. SO 4 + Cu Zn + 2 Ag. NO 3 → Zn(NO 3)2 + 2 Ag Aqui um metal “mais reativo” desloca um “menos reativo”.

Preparação de um sal a partir de outro sal: EXEMPLOS: 2 Reação de um sal com um não-metal 2 Na. Br + Cl 2 → 2 Na. Cl + Br 2 Na 2 S + Br 2 → 2 Na. Br + S 3 Reação de um sal com um ácido Cu. SO 4 + H 2 S → H 2 SO 4 + Cu. S (precipitado) 2 Na. Cl + H 2 SO 4 → Na 2 SO 4 + 2 HCl (volátil) Na. NO 2 + HCl → Na. Cl + HNO 2 (pouco ionizado) Aqui um não-metal “mais reativo” desloca um “menos reativo”.

Preparação de um sal a partir de outro sal: EXEMPLOS: 4 Reação de um sal com uma base Fe. Cl 3 + 3 Na. OH → Fe(OH)3 + 3 Na. Cl Na 2 CO 3 + Ca(OH)2 → 2 Na. OH + Ca. CO 3 Ca. O + CO 2 5 Reação de um sal com outro sal Ag. NO 3 + Na. Cl → Na. NO 3 + Ag. Cl Ba. Cl 2 + K 2 SO 4 → Ba. SO 4 + 2 KCl

Óxidos Óxido é todo composto binário oxigenado, no qual o oxigênio é o elemento mais eletronegativo. Fórmula geral dos óxidos: x+ E 2 2 O X Exemplos: CO 2, H 2 O, Mn 2 O 7, Fe 2 O 3

Nomenclatura Regra geral: (Prefixo) + óxido de (prefixo) + elemento CO -monóxido de monocarbono N 2 O 5 -pentóxido de dinitrogênio P 2 O 3 -trióxido de difosforo H 2 O -monóxido de dihidrogênio Nox fixo(1 A 2 A)- óxido de elemento Para metais: Nox - óxido de elemento+valência Na 2 O -óxido de sódio Al 2 O 3 -óxido de alumínio Fe. O -óxido de ferro II (óxido ferroso) Fe 2 O 3 -óxido de ferro III (óxido férrico)

Classificação • Óxidos Ácidos • Óxidos Básicos • Óxidos Anfóteros • Óxidos Neutros • Óxidos Duplos • Peróxidos

Classificação 18 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Óxidos Básicos Óxidos Anfóteros Ácidos (anidridos) Nox ≥+4 ÓXIDO DUPLO OU MISTO= Me 3 O 4 OB + H 2 O BASE OB + ÁCIDO SAL + ÁGUA ÓXIDOS INDIFERENTES OU NEUTROS= CO, N 2 O. OA + H 2 O ÁCIDO OA + BASE SAL + ÁGUA PERÓXIDOS=. . O 2 H, 1 A e 2 A SUPERÓXIDOS=. . O 4

Óxidos Básicos (metálicos) São formados por metais alcalinos e alcalinos terrosos e reagem com água formando bases e com ácidos formando sal e água. Óxido básico + H 2 O base 2 Na. O + H 2 O 2 Na. OH Ca. O + H 2 O Ca(OH)2 Ca. O (cal virgem, cal viva ) Óxido básico + ácido sal + H 2 O Mg. O + 2 HCl Mg. Cl 2 + H 2 O

Óxidos Ácidos (anidridos) São formados por ametais e reagem com água formando ácidos e com bases formando sal e água. Óxido ácido + H 2 O ácido CO 2 + H 2 O H 2 CO 3 (gás carbônico) – EFEITO ESTUFA N 2 O 5 + H 2 O 2 HNO 3 SO 3 + H 2 O H 2 SO 4 “chuva ácida” Óxido ácido + base sal + H 2 O CO 2 + Ca(OH)2 Ca. CO 3 + H 2 O

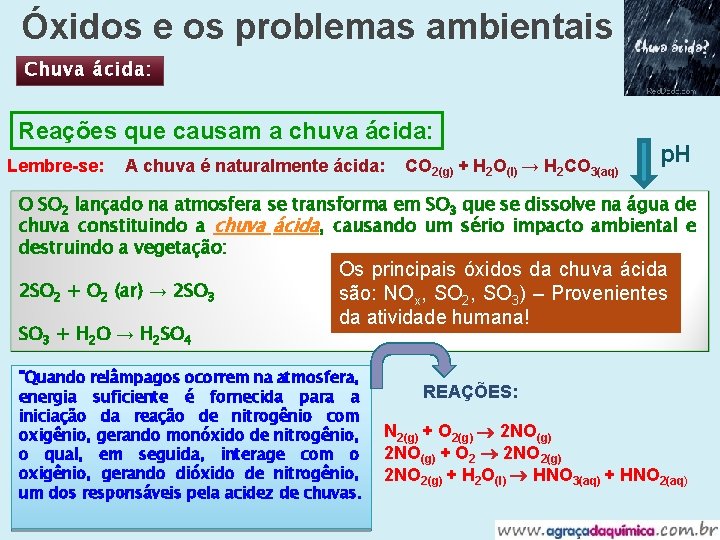
Óxidos e os problemas ambientais Chuva ácida: Reações que causam a chuva ácida: Lembre-se: A chuva é naturalmente ácida: CO 2(g) + H 2 O(l) → H 2 CO 3(aq) p. H O SO 2 lançado na atmosfera se transforma em SO 3 que se dissolve na água de chuva constituindo a chuva ácida, causando um sério impacto ambiental e destruindo a vegetação: 2 SO 2 + O 2 (ar) → 2 SO 3 + H 2 O → H 2 SO 4 Os principais óxidos da chuva ácida são: NOx, SO 2, SO 3) – Provenientes da atividade humana! "Quando relâmpagos ocorrem na atmosfera, energia suficiente é fornecida para a iniciação da reação de nitrogênio com oxigênio, gerando monóxido de nitrogênio, o qual, em seguida, interage com o oxigênio, gerando dióxido de nitrogênio, um dos responsáveis pela acidez de chuvas. REAÇÕES: N 2(g) + O 2(g) 2 NO(g) + O 2 2 NO 2(g) + H 2 O(l) HNO 3(aq) + HNO 2(aq)

Chuva ácida: consequências Para a Saúde A chuva ácida liberta metais tóxicos que estavam no solo. Esses metais podem contaminar os rios e serem inadvertidamente utilizados pelo homem causando sérios problemas de saúde. Nas Casas, Prédios e demais edifícios A chuva ácida também ajuda a corroer alguns dos materiais utilizados nas construções, danificando algumas estruturas, como as barragens, as turbinas de geração de energia, etc. Para o meio ambiente ►Lagos Os lagos podem ser os mais prejudicados com o efeito das chuvas ácidas, pois podem ficar totalmente acidificados perdendo toda a sua vida. ► Desflorestação A chuva ácida provoca clareiras, matando algumas árvores de cada vez. Podemos imaginar uma floresta, que vai sendo progressivamente dizimada, podendo eventualmente ser até destruída. ► Agricultura A chuva ácida afeta as plantações quase da mesma forma que as florestas, no entanto a destruição é mais rápida, uma vez que as plantas são todas do mesmo tamanho e assim, igualmente atingidas pelas chuvas ácidas.

Problemas ambientais Efeito estufa: Gases de estufa Principais causas Dióxido de Carbono(CO 2) Combustão de combustíveis fósseis: petróleo, gás natural, carvão, desflorestação (libertam CO 2 quando queimadas ou cortadas). O CO 2 é responsável por cerca de 64% do efeito estufa. Diariamente são enviados cerca de 6 milhões de toneladas de CO 2 para a atmosfera. Tem um tempo de duração de 50 a 200 anos. Clorofluorcarbono (CFC) Metano (CH 4) São usados em sprays, motores de aviões, plásticos e solventes utilizados na indústria eletrônica. Responsável pela destruição da camada de ozônio. Também é responsável por cerca de 10% do efeito estufa. O tempo de duração é de 50 a 1700 anos. Produzido por campos de arroz, pelo gado e pelas lixeiras. É responsável por cerca de 19 % do efeito estufa. Tem um tempo de duração de 15 anos. Ácido nítrico (HNO 3) Produzido pela combustão da madeira e de combustíveis fósseis, pela decomposição de fertilizantes químicos e por micróbios. É responsável por cerca de 6% do efeito estufa. Ozono (O 3) É originado através da poluição dos solos provocada pelas fábricas, refinarias de petróleo e veículos automóveis

Problemas ambientais Efeito estufa: 1 2 3 4 QUAIS AS PRINCIPAIS FONTES DOS GASES COM EFEITO DE ESTUFA? Os gases responsáveis pelo aquecimento global da Terra, encontram-se na combustão de combustíveis fósseis, como o petróleo e seus derivados, e nas cidades cerca de 40 % deve-se à queima de gasolina e de óleo a diesel, fato que se traduz pelo número de veículos automóveis que aí circulam. Os veículos automóveis são responsáveis pela libertação de monóxido de carbono (CO) e dióxido de carbono (CO 2), óxidos de nitrogênio (NOx), dióxido de enxofre (SO 2), derivados de chumbo e hidrocarbonetos. As indústrias também são responsáveis por este fenômeno uma vez que emitem enxofre, chumbo e outros materiais pesados, bem como resíduos sólidos que ficam suspensos no ar, por sua vez a concentração de oxigênio vai sendo cada vez menor o que vai provocar doenças graves no sistema nervoso, cancro, problemas respiratórios. Quanto à agricultura, as substâncias são originadas a partir do cultivo de arroz, agricultura, queima de resíduos agrícolas e de florestas, entre outras fontes. 5 6 A incineração de resíduos e a deposição de resíduos sólidos nas terras constituem outras fontes de gases com efeito de estufa A ação do ser humano na natureza tem feito aumentar a quantidade de dióxido de carbono na atmosfera, através de uma queima intensa e descontrolada de combustíveis fósseis e do desflorestamento. A derrubada de árvores provoca o aumento da quantidade de dióxido de carbono na atmosfera pela queima e também por decomposição natural. Além disso, as árvores aspiram dióxido de carbono e produzem oxigênio. Uma menor quantidade de árvores significa também menos dióxido de carbono sendo absorvido.

Óxidos Anfóteros (anfipróticos) São óxidos de caráter intermediário entre ácido e básico. Reagem com ácidos e bases formando sal e água. Óxido anfótero + ácido/base sal + água Zn. O + 2 HCl Zn. Cl 2 + H 2 O Zn. O + 2 Na. OH Na 2 Zn. O 2 + H 2 O Al 2 O 3 + 6 HCl → 2 Al. Cl 3 + 3 H 2 O Al 2 O 3 + 2 KOH → 2 KAl. O 2 + H 2 O Al 2 O 3 - Zn. O (hipoglós) Al 2 O 3(alumina)

Óxidos Neutros (indiferentes) São todos covalentes e não reagem com base, ácido ou água; mas podem reagir com oxigênio. CO + H 2 O Não ocorre reação NO + HCl Não ocorre reação Óxido Neutro + O 2 Oxidação CO + ½O 2 CO 2 CO - N 2 O – H 2 O

Óxidos Duplos (mistos) São óxidos que, quando aquecidos, originam dois outros óxidos. M 3 O 4 Fe, Pb, Mn Fe. O + Fe 2 O 3 Fe 3 O 4 (magnetita , imã) Fe 3 O 4; Pb 3 O 4; Mn 3 O 4

Peróxidos São formados por metais alcalinos, alcalinos terrosos e hidrogênio e possuem oxigênio com Nox = -1. M 2 O 2 - MO 2 M. Alcalinos M. Alc. Terrosos Ex. : Na 2 O 2, Li 2 O 2, Ca. O 2, Mg. O 2 H 2 O 2 - Ag. Oxidante e Bactericida

Óxidos importantes: 1) Zn. O – óxido de Zinco (Hipoglós) É um sólido branco de caráter anfótero (anfiprótico). É usado na fabricação de cremes dermatológicos, na industria de tintas e na galvanização do ferro. *A proteção de superfícies metálicas com tintas ou metais de sacrifício é chamada de proteção anódica.

Óxidos importantes: 2) Al 2 O 3 – óxido de Alumínio (Bauxita, Alumina) É um sólido muito duro (dureza 9) de onde é extraído por eletrólise o alumínio metálico. Na forma cristalizada é encontrado nas safiras e nos rubis. *É um óxido anfótero abrasivo que também pode ser chamado de Coríndon.

Óxidos importantes: 3) H 2 O 2 – Peróxido de hidrogênio (água oxigenada) É uma solução aquosa que se decompõe facilmente em presença de luz (fotólise). É utilizada como agente oxidante e bactericida. H 2 O 2 H 2 O + ½O 2 *Os recipientes que guardam a água oxigenada são opacos para impedir a entrada de luz.

Óxidos importantes: 4) Fe 3 O 4 – Tetróxido de triferro (magnetita, imã) É um sólido escuro que apresenta características ferromagnéticas. É utilizado na fabricação de caixas de som e aparelhos eletrônicos em geral. Fe. O + Fe 2 O 3 Fe 3 O 4 *A tarja dos cartões magnéticos é constituída por este óxido.
 I graa
I graa Foi graa
Foi graa Qumicas
Qumicas Main funes
Main funes Main funes
Main funes Tipo de linguagem
Tipo de linguagem Main funes
Main funes Bagua funes
Bagua funes Geometria da via
Geometria da via Porto vivo, sru
Porto vivo, sru Signe de cruveilhier baumgarten
Signe de cruveilhier baumgarten Porto latin
Porto latin Portuguese fortified wine
Portuguese fortified wine Financial system
Financial system Faculty of engineering university of porto
Faculty of engineering university of porto Ednano
Ednano Celk porto belo
Celk porto belo Geciane silveira porto
Geciane silveira porto Porto polio
Porto polio Juan pablo porto
Juan pablo porto Sengstaken blakemore tüpü
Sengstaken blakemore tüpü Meu barco navega no mar
Meu barco navega no mar Rua dr roberto frias
Rua dr roberto frias Capitaneria di porto san benedetto del tronto
Capitaneria di porto san benedetto del tronto Portugal
Portugal Surface anatomy of liver
Surface anatomy of liver Agere conjugation
Agere conjugation Linha fina exemplo
Linha fina exemplo Porto assegnato
Porto assegnato Life cycle of fasciola hepatica
Life cycle of fasciola hepatica Esas porto
Esas porto Hepatic portal vein
Hepatic portal vein Notalegal porto alegre
Notalegal porto alegre Concetta lo porto
Concetta lo porto Tarebi porto
Tarebi porto Porto
Porto Geciane silveira porto
Geciane silveira porto Blagajna
Blagajna Inferior gastric artery
Inferior gastric artery Geciane porto
Geciane porto Hiperonimo de suco
Hiperonimo de suco North wall effect
North wall effect Funções sintáticas 7 ano porto editora
Funções sintáticas 7 ano porto editora Due rimorchiatori conducono
Due rimorchiatori conducono Sistema porta hepatico
Sistema porta hepatico Porto
Porto Eclusa porto primavera
Eclusa porto primavera Conjunto de software
Conjunto de software Conjunto de alabanzas y piropos a la virgen
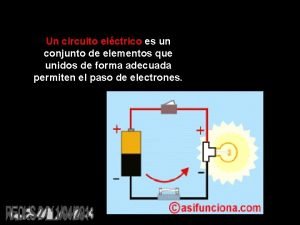
Conjunto de alabanzas y piropos a la virgen Un circuito eléctrico es un conjunto de elementos
Un circuito eléctrico es un conjunto de elementos Diagrama de conjunto numerico
Diagrama de conjunto numerico Conjunto de identidades
Conjunto de identidades Defecto schottky
Defecto schottky Conjunto coherente de enunciados escritos
Conjunto coherente de enunciados escritos Comunho
Comunho Cuál es el menor número natural
Cuál es el menor número natural Conjunto de circunstancias
Conjunto de circunstancias Ejemplo de conjunto unitario
Ejemplo de conjunto unitario O que é o conjunto universo
O que é o conjunto universo Conjunto de datos bibliográficos precisos.
Conjunto de datos bibliográficos precisos. Tiempos del lavado de manos quirurgico
Tiempos del lavado de manos quirurgico