Estrutura dos tomos e tendncias peridicas Aula 4
































- Slides: 39

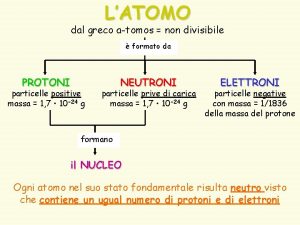
Estrutura dos átomos e tendências periódicas Aula 4

• ORBITAL – O QUE É UM ORBITAL? • NIVEIS DE ENERGIA– O QUE É UM NIVEL DE ENERGIA? • FORMA DO ORBITAL? - COMO PODEMOS SABER?






• ORBITAL – O QUE É UM ORBITAL? • NIVEIS DE ENERGIA– O QUE É UM NIVEL DE ENERGIA? • FORMA DO ORBITAL? - COMO PODEMOS SABER? • QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? • NÚMEROS QU NTICOS





• • • ORBITAL – O QUE É UM ORBITAL? NÍVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA? FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NÚMEROS QU NTICOS • FORMA DE PREENCHER OS ORBITAIS







• • ORBITAL – O QUE É UM ORBITAL. NIVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA. FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NUMEROS QU NTICOS FORMA DE PREENCHER OS ORBITAIS CARGA NUCLEAR EFECTIVA (Z*)

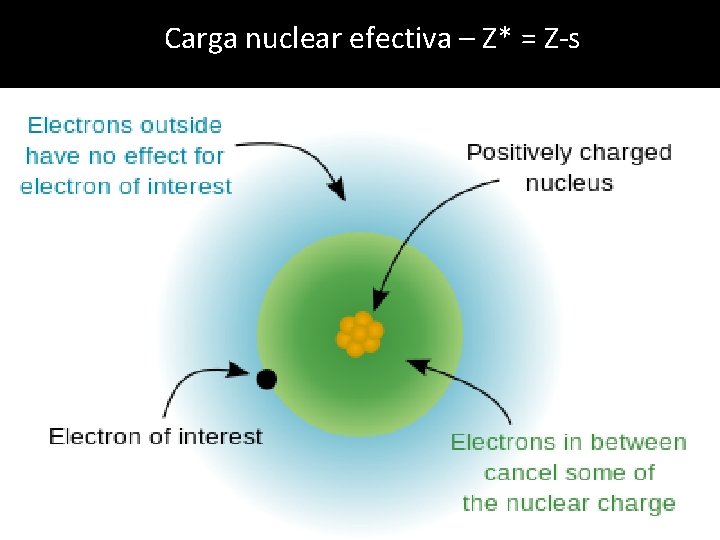
Carga nuclear efectiva – Z* = Z-s

Regras de Slater Electrão de interesse em orbital s ou p 0, 35 para os electrons no mesmo nível de energia ( mesmo n). 0, 85 para os electrons no nível de energia imediatamente abaixo (n-1). 1 para os electrons nos nível de energia seguintes (n-2). Electrão de interesse em orbital d ou f 0, 35 para os electrons no mesmo nível de energia ( mesmo n). 1 para os electrons nos nível de energia seguintes.

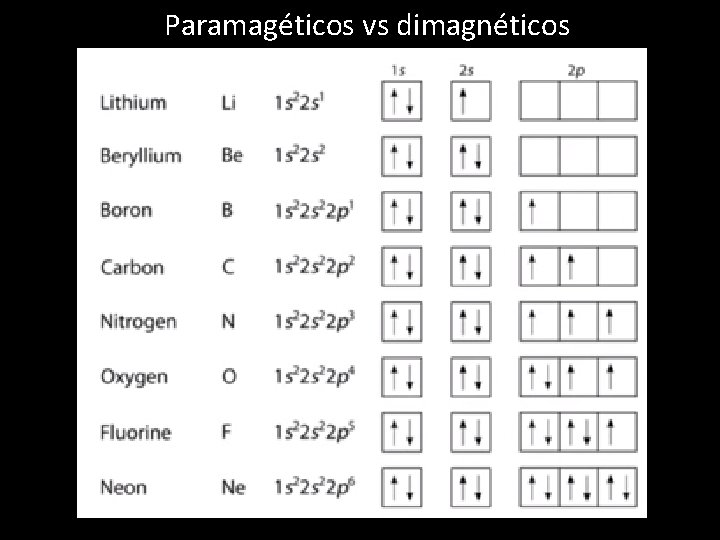
Paramagéticos vs dimagnéticos


• • ORBITAL – O QUE É UM ORBITAL? NIVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA? FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NÚMEROS QU NTICOS FORMA DE PREENCHER OS ORBITAIS CARGA NUCLEAR EFECTIVA (Z*) • RAIO ATÔMICO

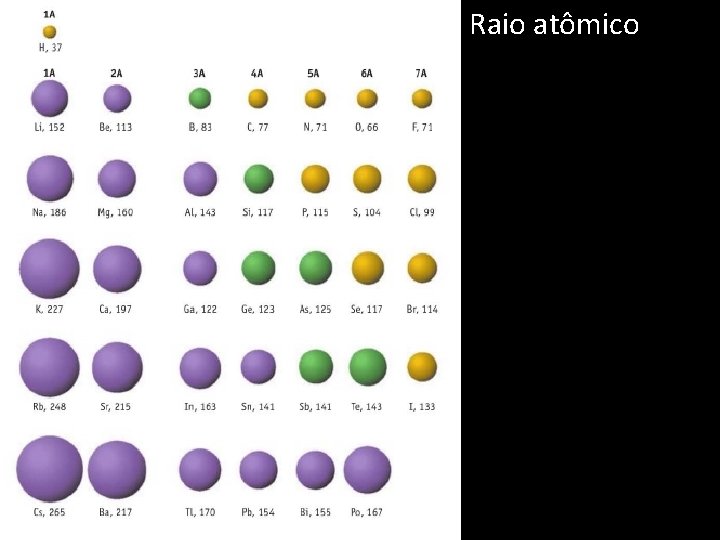
Raio atômico

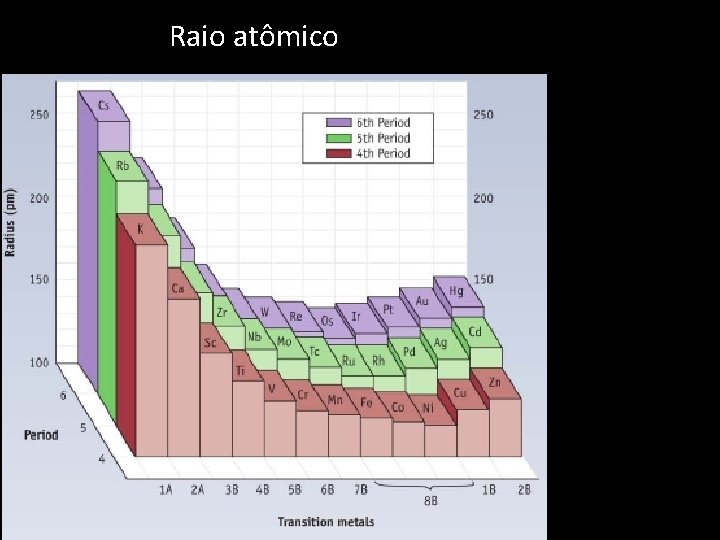
Raio atômico

• • ORBITAL – O QUE É UM ORBITAL? NIVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA? FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NÚMEROS QU NTICOS FORMA DE PREENCHER OS ORBITAIS CARGA NUCLEAR EFECTIVA (Z*) RAIO ATÔMICO • ENERGIA DE IONIZAÇÃO


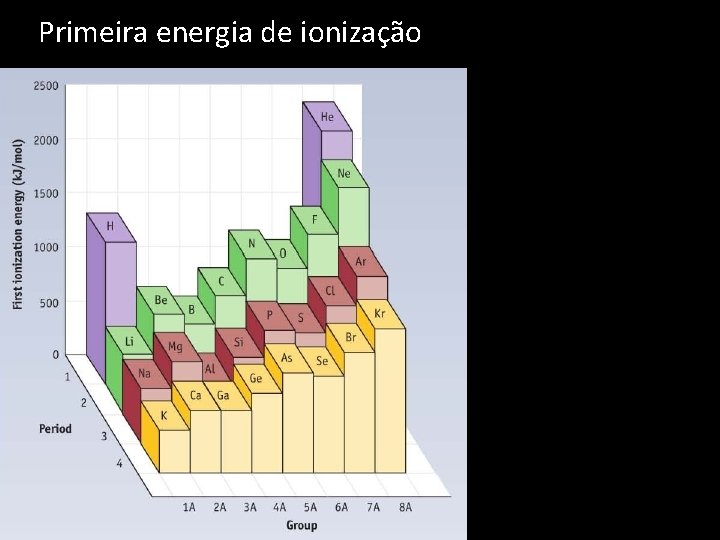
Primeira energia de ionização

• • • ORBITAL – O QUE É UM ORBITAL? NIVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA? FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NÚMEROS QU NTICOS FORMA DE PREENCHER OS ORBITAIS CARGA NUCLEAR EFECTIVA (Z*) RAIO ATÔMICO ENERGIA DE IONIZAÇÃO • AFINIDADE ELECTRÔNICA

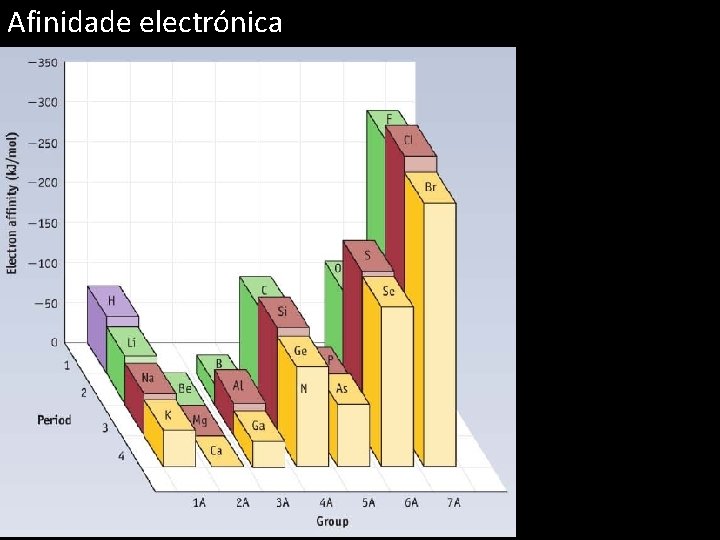
Afinidade electrónica

• • • ORBITAL – O QUE É UM ORBITAL? NIVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA? FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NÚMEROS QU NTICOS FORMA DE PREENCHER OS ORBITAIS CARGA NUCLEAR EFECTIVA (Z*) RAIO ATÔMICO ENERGIA DE IONIZAÇÃO AFINIDADE ELECTRÔNICA • RAIOS IÔNICOA

Raios iônicos

• • • ORBITAL – O QUE É UM ORBITAL? NIVEIS DE ENERGIA – O QUE É UM NIVEL DE ENERGIA? FORMA DO ORBITAL? - COMO PODEMOS SABER? QUANTOS ORBITAIS PODEM EXISTIR POR NIVEL DE ENERGIA? NÚMEROS QU NTICOS FORMA DE PREENCHER OS ORBITAIS CARGA NUCLEAR EFECTIVA (Z*) RAIO ATÔMICO ENERGIA DE IONIZAÇÃO AFINIDADE ELECTRÔNICA • RESUMO.

28. Um átomo neutro possui dois electrons com n=1, oito electrons com n=2, oito electrons com n=3 e dois electrons com n=4. Supondo que se encontra no seu estado fundamental dê as seguintes informações: Número atómico Número total de electrons s Número total de electrons p Número total de electrons d O elemento é um metal, um não metal ou um metalóide? 29. Organize os seguintes átomos em ordem crescente de energia ionização: Si, K, P e Ca. 30. Quais os seguintes ions são menos prováveis de serem encontrados em compostos químicos; Cs+, In 4+; Fe 4+ , Te-2.

31. Responda às seguintes questões: Entre os elementos S, Se e Cl qual possui o maior raio atómico? Qual possui o maior raio, Br ou Br- e explique detalhadamente porquê? Qual dos seguintes elementos deveria ter a maior diferença entre a primeira e segunda energia de ionização: Si, Na, P ou Mg? Qual dos seguintes elementos possui o maior raio atómico; N, P ou As? Qual deles seguintes elementos ui o maior raio iônico: O 2 -, N 3 - ou F-. 32. Compare os elementos Na, B, Al e C em relação às seguintes propriedades: Qual tem o maior raio atômico. Qual tem a entalpia de adição electrónica mais negativa? Coloque os elementos na ordem crescente de energia de ionização.


 Tomos trivia answers
Tomos trivia answers Tomos greco
Tomos greco Tendncias
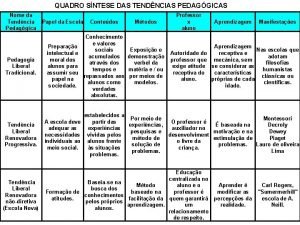
Tendncias Tendncias
Tendncias Tendncias
Tendncias Tendncias
Tendncias Peridicas
Peridicas Peridicas
Peridicas Peridicas
Peridicas Isoelectrónico
Isoelectrónico Caracteristicas de metales
Caracteristicas de metales Raio atômico
Raio atômico Caracter metalico en la tabla periodica
Caracter metalico en la tabla periodica Raio atômico
Raio atômico Raio atomico tabela periodica
Raio atomico tabela periodica Peridicas
Peridicas Peridicas
Peridicas Volumen atomico
Volumen atomico Peridicas
Peridicas Antero de quental linguagem, estilo e estrutura
Antero de quental linguagem, estilo e estrutura Nefridióporo
Nefridióporo Unicamp o impressionante exercito de argila
Unicamp o impressionante exercito de argila Estrutura dos carboidratos
Estrutura dos carboidratos Estrutura e funcionamento de ecossistemas
Estrutura e funcionamento de ecossistemas Hallar la distancia
Hallar la distancia Bases de solidos geometricos
Bases de solidos geometricos Mateo 7: 13
Mateo 7: 13 Dos reyes dos laberintos
Dos reyes dos laberintos Los envió de dos en dos
Los envió de dos en dos Defesa dos direitos dos usuários pnh
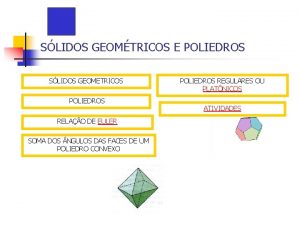
Defesa dos direitos dos usuários pnh O que é poliedro
O que é poliedro El que habla dos idiomas vale por dos
El que habla dos idiomas vale por dos Carta formal
Carta formal Estrutura da reportagem
Estrutura da reportagem Estrutura de um sistema operacional
Estrutura de um sistema operacional As vigas
As vigas Estrutura linear
Estrutura linear Estrutura do virus
Estrutura do virus Estrutura de von neumann
Estrutura de von neumann Sistema financeiro nacional organograma
Sistema financeiro nacional organograma