Aula 04 Cincias dos Materiais Estrutura Cristalinas dos

















- Slides: 19

Aula 04 – Ciências dos Materiais Estrutura Cristalinas dos Metais

• Sólidos A formação do estado sólido pode ser considerada em termos dois tipos de ligações interatômicas: primária e secundária Três tipos de ligações primárias: Ligações iônica – os sólidos se formam via forças Coulombianas atrativas que ocorrem entre os íons que são espécies eletricamente carregadas formadas por átomos que perderam (cátions) ou ganharam (ânions) elétrons; Ligações covalente – os sólidos são formados por um compartilhamento dos elétrons de valência entre todos os átomos adjacentes; Ligações metálicas – os sólidos são formados por cátions metálicos que compartilham seus elétrons de valências entre todos os cátions adjacentes, formando um “mar de elétrons” que atua como uma forma de “cola” para manter os núcleos catiônicos juntos (superando a força repulsiva de carga iguais) Dois tipos de ligações secundárias: Ligações de van der Waals – forças resultantes da atração elétrica não de cargas opostas como nas ligações iônicas, mas de dipolos elétricos que podem ser: induzidos ou permanente (formado por moléculas polares) Ligações de Hidrogênio – são também forças resultantes de atrações de dipolos elétricos, só que com uma separação de carga muito mais forte do que ocorre nos dipolos elétricos normais (formado por moléculas fortemente polares). Isto ocorre quando o hidrogênio se liga covalente a um dos elementos: Oxigênio (O), Flúor (F) ou Nitrogênio (N).

Relação com as Propriedades • Sólidos iônicos em geral são : - duros - isolantes térmicos e elétricos - apresentam altos pontos de fusão e ebulição - baixos coeficientes de expansão térmica

Relação com as Propriedades • Sólidos covalentes podem ser : - duros ou frágeis dependendo de suas estruturas de empacotamento e da natureza dos átomos envolvido. - isolantes térmicos e elétricos - apresentam altos pontos de fusão e ebulição - baixos coeficientes de expansão térmica

Relação com as Propriedades • Sólidos metálicos: - bons condutores elétricos e térmicos devido aos elétrons livres; - ruptura dúctil na temperatura, ou seja, a fratura só ocorre após os materiais terem sofridos significativos níveis de deformação permanente; - a ligação pode ser fraca ou forte e conseqüentemente seus pontos de fusão e ebulição; - altos coeficientes de expansão térmica

Relação com as Propriedades • Sólidos Moleculares: formados por ligações secundárias - apresentam baixíssimos pontos de fusões e ebulições. - por outro lado, muitos polímeros modernos, apesar de serem sólidos moleculares podem apresentar pontos de fusões e ebulições mais elevados pela presença de ligações de hidrogênio e pela presença de moléculas polares (dipolos permanente) - podem apresentarem elevadas taxas de deformações elástica e permanente.

Exercício • Tendo em conta os modelos atômicos e os tipos de enlaces químicos formados entre os átomos justifique as seguintes propriedades: sólidos metálicos : ruptura dúctil sólidos iônicos: duros e frágeis sólidos covalentes: elevado ponto de ebulição Sólido molecular: baixíssimo ponto de fusão

Estrutura dos Sólidos • Por que estudar? além dos tipos de ligações químicas muitas das propriedades de alguns materiais estão diretamente relacionadas com suas estruturas cristalinas ou não-cristalinas! • Conceitos fundamentais Material cristalino: é aquele em que seus átomos estão posicionados em um arranjo repetitivo ou periódico ao longo de grandes distâncias atômicas; Estrutura cristalina: forma pela qual os átomos, íons ou moléculas do material estão espacialmente arranjados. Rede cristalina: um arranjo tridimensional de pontos que coincidem com as posições dos átomos, íons ou moléculas centrais do material. Células unitárias: é a menor estrutura repetitiva da rede ou estrutura cristalina e define a estrutura cristalina em termos de sua geometria

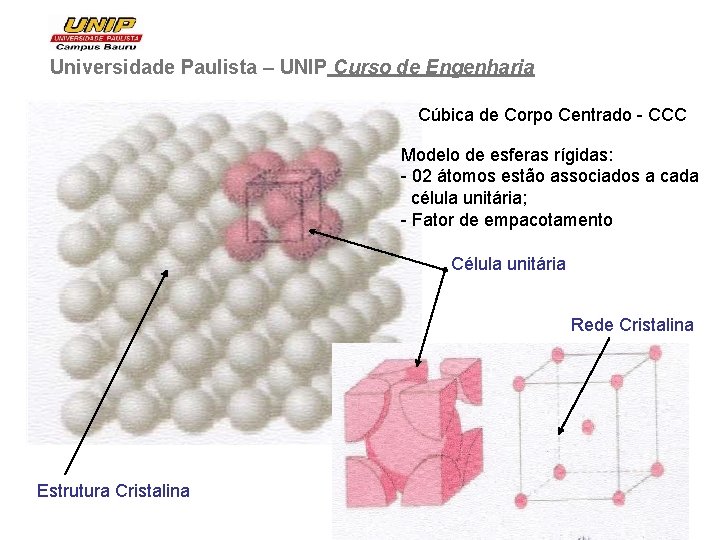
Universidade Paulista – UNIP Curso de Engenharia Cúbica de Corpo Centrado - CCC Modelo de esferas rígidas: - 02 átomos estão associados a cada célula unitária; - Fator de empacotamento Célula unitária Rede Cristalina Estrutura Cristalina

Sete Sistemas Cristalinas Eixos • • Cúbico Hexagonal Tetragonal Trigonal Ortorrômbico Monoclínico Triclínico a=b=c a=b#c a=b=c a#b#c ngulos entre eixos α=β=γ=90 o α=β=90 o γ=120 o α=β=γ=90 o α=β=γ#90 o α=β=γ=90 o α=γ=90 o#β α#β#γ#90 o

Estrutura cristalina dos metais • 03 estruturas cristalinas relativamente simples são encontradas para a maioria dos metais mais comum: - cúbica simples - cúbica de faces centradas - cfc - cúbica de corpo centrado - ccc

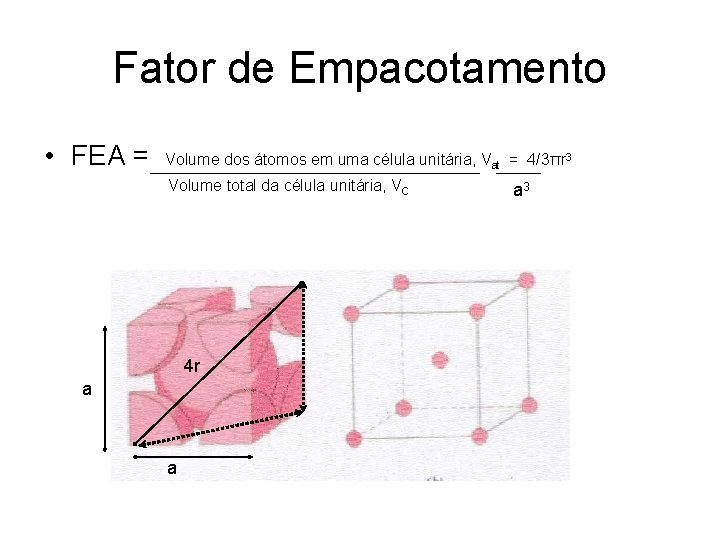
Universidade Paulista – UNIP Curso de Engenharia No Coordenação – NC: número de vizinhos mais próximos de um dado átomo em uma dada estrutura espacial Estruturas cristalinas EMPACOTAMENTOS Estruturas amorfas Fator de Empacotamento Atômica – FEA = Volumedos átomos célula unitária / V olume total da célula unitária


Fator de Empacotamento para um metal de raio r N de átomos o por célula • Cúbico simples: FEA = 4/3πr 3 como a=2 r FEA=0, 52 1 FEA = 4/3πr 3 como a=4 r/√ 3 a 3 • Cúbico de Face Centrada: FEA=0, 68 2 FEA = 4/3πr 3 FEA=0, 74 4 a 3 • Cúbico de Corpo Centrado: a 3 como a=2 r/√ 2

Fator de Empacotamento • FEA = Volume dos átomos em uma célula unitária, Vat = 4/3πr 3 Volume total da célula unitária, V C 4 r a a a 3



Cálculo da densidade teórica de um sólido metálico ρ = n. PA V CN A Onde: n= número de átomos por célula unitária PA= peso atômico VC= volume da célula unitária NA = número de Avogrado (6, 02 x 1023)

Exercícios • Calcule o raio de um átomo de tântalo sabendo que o Ta possui uma estrutura cristalina CCC, uma massa específica (densidade) de 16, 6 g/cm 3 e um peso atômico de 180, 9 g/mol. • O Nióbio possui um raio atômico de 0, 143 nm e uma massa específica de 8, 57 g/cm 3. Determine se ele possui uma estrutura cristalina CFC ou CCC. Peso atômico =92, 9 g/mol. • O raio atômico do Pb vale 0, 175 nm, calcule o volume de sua célula unitária em m 3 sabendo que o Pb apresenta estrutura cristalina CFC.
 Caracter ionico
Caracter ionico Diamante
Diamante Enlace polar
Enlace polar Estructuras cristalinas ejemplos
Estructuras cristalinas ejemplos Tecnologia dos materiais
Tecnologia dos materiais Resistencia dos materiais
Resistencia dos materiais Fator de empacotamento ccc
Fator de empacotamento ccc Limite de proporcionalidade
Limite de proporcionalidade Resistência dos materiais
Resistência dos materiais Resistencia dos materiais
Resistencia dos materiais Resistência dos materiais
Resistência dos materiais Resistencia dos materiais
Resistencia dos materiais Materiais solúveis e insolúveis na água
Materiais solúveis e insolúveis na água Resistência dos materiais
Resistência dos materiais Moluscos estrutura corporal
Moluscos estrutura corporal Fosfoesfingolipídeos
Fosfoesfingolipídeos Estrutura e funcionamento dos ecossistemas
Estrutura e funcionamento dos ecossistemas O impressionante exército de argila de xian
O impressionante exército de argila de xian Estrutura soneto
Estrutura soneto Materiais eletricos
Materiais eletricos





































