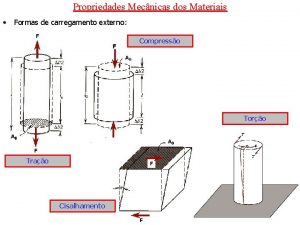
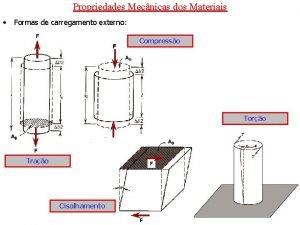
Fundamentos de cincia e engenharia de materiais A







































































![DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Se a subtração der DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Se a subtração der](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-118.jpg)
![DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Quando passa pela origem DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Quando passa pela origem](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-119.jpg)
![DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] Os números devem ser divididos DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] Os números devem ser divididos](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-120.jpg)




![As duas direções pertencem a mesma família? [101] As direções dizem-se cristalograficamente equivalentes se, As duas direções pertencem a mesma família? [101] As direções dizem-se cristalograficamente equivalentes se,](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-127.jpg)



![Exemplo Calcule a densidade linear para a direção [100] em uma estrutura cristalina CCC. Exemplo Calcule a densidade linear para a direção [100] em uma estrutura cristalina CCC.](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-133.jpg)





















- Slides: 177

Fundamentos de ciência e engenharia de materiais. A pesquisa para obter novas propriedades de materiais ou novos materiais nunca para! 1

Ligações Atômicas 2

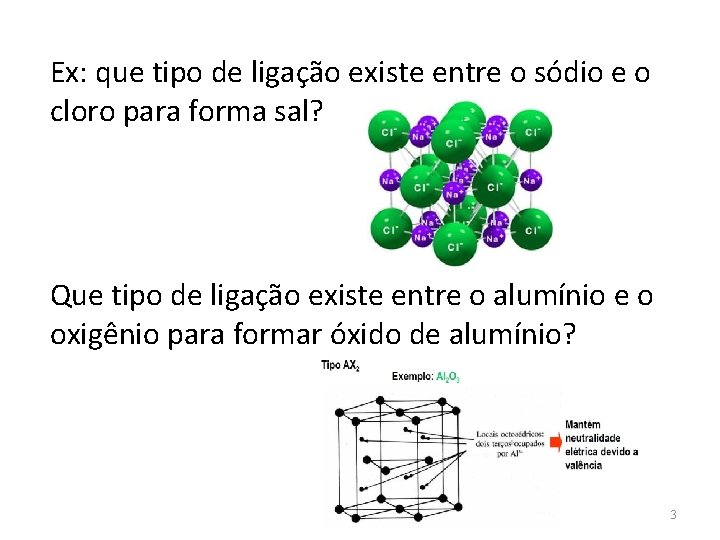
Ex: que tipo de ligação existe entre o sódio e o cloro para forma sal? Que tipo de ligação existe entre o alumínio e o oxigênio para formar óxido de alumínio? 3

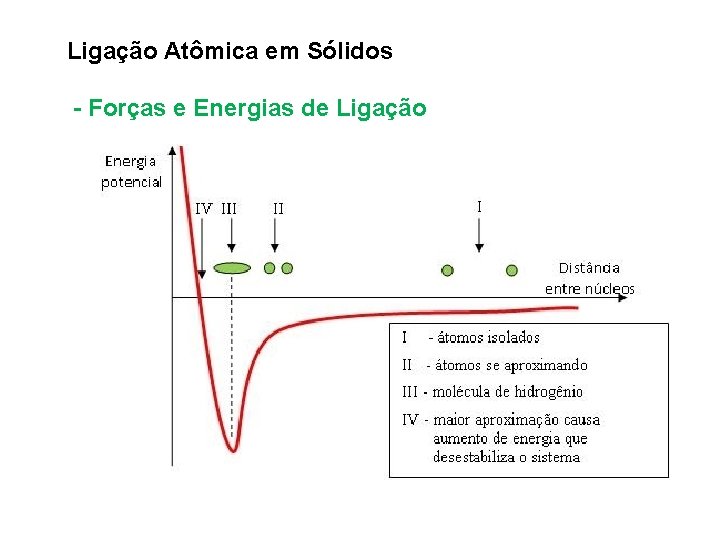
Ligação Atômica em Sólidos - Forças e Energias de Ligação Os princípios de ligação atômica são melhores ilustrados considerando a interação entre dois átomos isolados à medida que eles são colocados em proximidade um do outro a partir de uma distância infinita de separação entre eles. Estas forças são de dois tipos: atração e repulsão. A magnitude de cada uma é função da separação ou distância interatômica.

Ligação Atômica em Sólidos - Forças e Energias de Ligação A origem da força de atração (FA)depende do tipo particular de ligação que existe entre dois átomos. Sua magnitude varia com a distância. A força de repulsão (FR) se origina da superposição da camada mais externa. F L= F R + F A A força resultante (FL) é a soma das duas forças.

Ligação Atômica em Sólidos - Forças e Energias de Ligação No estado de equilíbrio a força líquida é nula. Os centros de dois átomos permanecerão separados por uma distância de equilíbrio (ro). Uma vez na posição, os dois átomos reagirão com ação oposta a qualquer tentativa de separá-los ou de aproximá-los. Energia de ligação: corresponde a energia no ponto mínimo da curva.

Ligação Atômica em Sólidos - Forças e Energias de Ligação

Ligação Atômica em Sólidos - Forças e Energias de Ligação A energia de ligação representa a energia necessária para separar estes dois átomos até uma distância infinita.

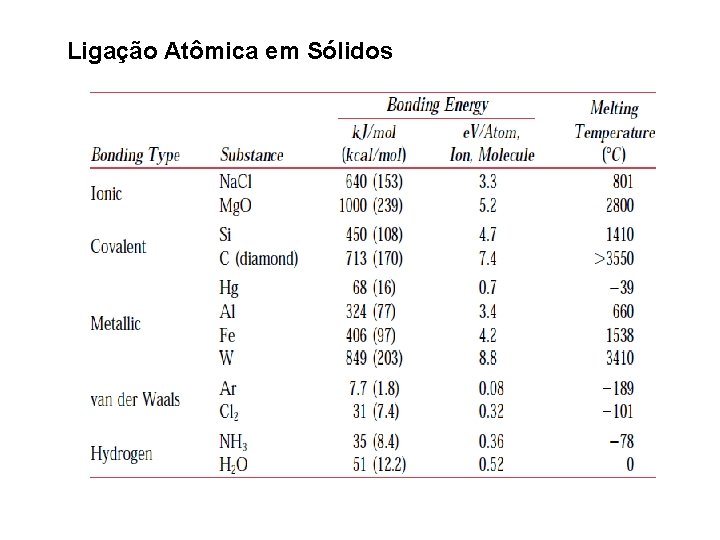
Ligação Atômica em Sólidos Três tipos de ligação química são encontradas em sólidos: iônica, covalente e metálica. A ligação envolve os elétrons de valência. Em geral, cada uma destes tipos de ligação surge a partir da tendência dos átomos de assumir estruturas eletrônicas estáveis, tais como aquelas dos gases nobres.

Ligação Atômica em Sólidos - LIGAÇÃO IÔNICA É sempre encontrada em compostos que são constituídos de ambos elementos metálicos e nãometálicos. No processo de união, todos os átomos adquirem configuração de gás nobre ou estáveis e adicionalmente carga elétrica, tornando-se íons. O cloreto de sódio é um material iônico clássico.



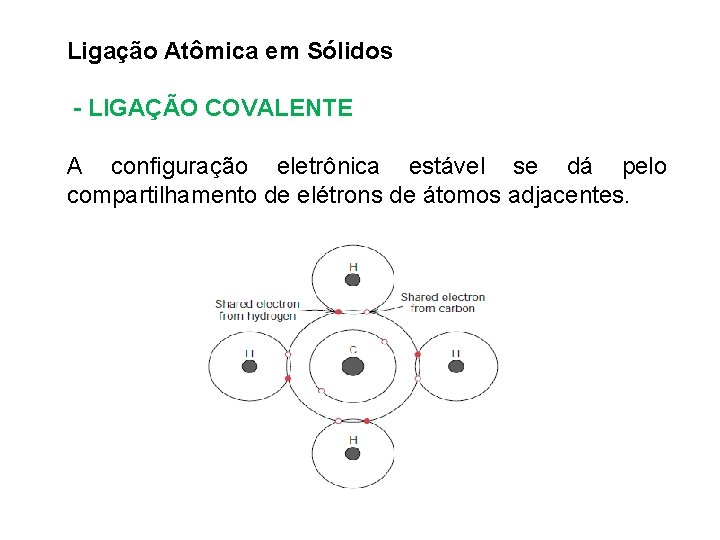
Ligação Atômica em Sólidos - LIGAÇÃO COVALENTE A configuração eletrônica estável se dá pelo compartilhamento de elétrons de átomos adjacentes.

Que tipo de ligação existe numa molécula de gás cloro? Que tipo de ligação existe numa molécula de gás nitrogênio? Que tipo de ligação existe numa molécula de gás oxigênio? 14

Ligação Atômica em Sólidos - LIGAÇÃO COVALENTE O número de ligações covalentes permitida para um determinado átomo é especificada pela quantidade de elétrons de valência. Para N’ elétrons de valência, o átomo pode se ligar de maneira covalentemente com no máximo (8 – N’) outros átomos. Por exemplo, para o átomo de cloro, N’=7 e 8 -7=1, o que significa que um átomo de cloro pode se ligar apenas com apenas um átomo, (Cl 2).

Ligação Atômica em Sólidos

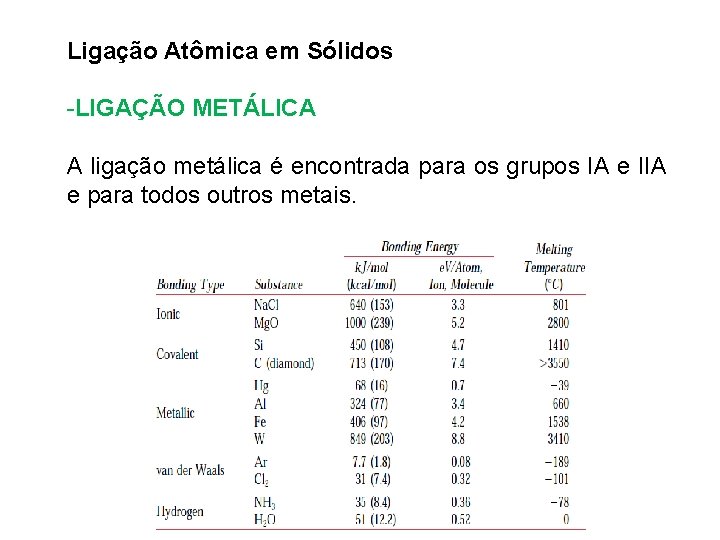
Ligação Atômica em Sólidos -LIGAÇÃO METÁLICA É encontrada em metais e suas ligas. Materiais metálicos tem um, dois ou três elétrons de valência sendo estes livres para se mover pela estrutura do material.

Ligação Atômica em Sólidos -LIGAÇÃO METÁLICA A ligação metálica é encontrada para os grupos IA e IIA e para todos outros metais.

ASSUNTO Materiais cristalinos -Estrutura cristalina: conceitos fundamentais, célula unitária, - Sistemas cristalinos, - Polimorfismo e alotropia - Direções e planos cristalográficos, anisotropia, - Determinação das estruturas cristalinas por difração de raios-x. 19

O que é um material cristalino, de um exemplo. 20

O que é um material amorfo, de um exemplo 21

Material amorfo Alumínio em pó


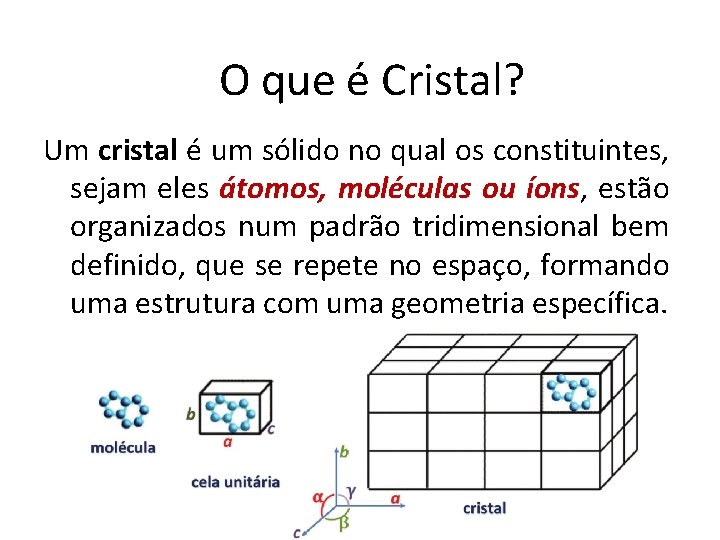
Estrutura dos Sólidos Cristalinos Conceitos Fundamentais Materiais sólidos podem ser classificados de acordo com a regularidade com que seus átomos ou íons se combinam entre si. Um material cristalino é um material no qual os átomos, íons ou moléculas estão situados em um arranjo repetitivo ou periódico por grande distâncias atômicas, ou seja, os átomos se posicionarão entre si num modo tridimensional, onde cada átomo está ligado a seus átomos vizinhos mais próximos.

Estrutura dos Sólidos Cristalinos Conceitos Fundamentais Todos os metais, muitos materiais cerâmicos e certos polímeros formam estruturas cristalinas sob condições normais de solidificação. As propriedades dos sólidos cristalinos depende da estrutura do cristal do material, referente a maneira, na qual átomos, íons e moléculas são espacialmente dispostos. Existe uma grande cristalinas diferentes. quantidade de estruturas

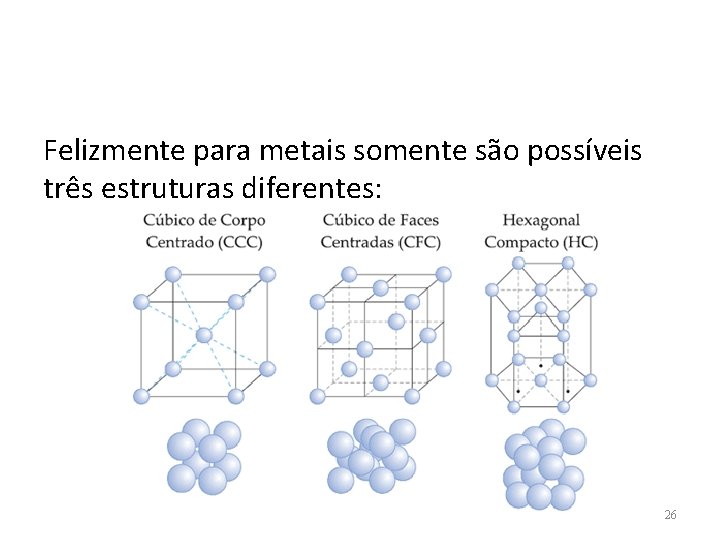
Felizmente para metais somente são possíveis três estruturas diferentes: 26

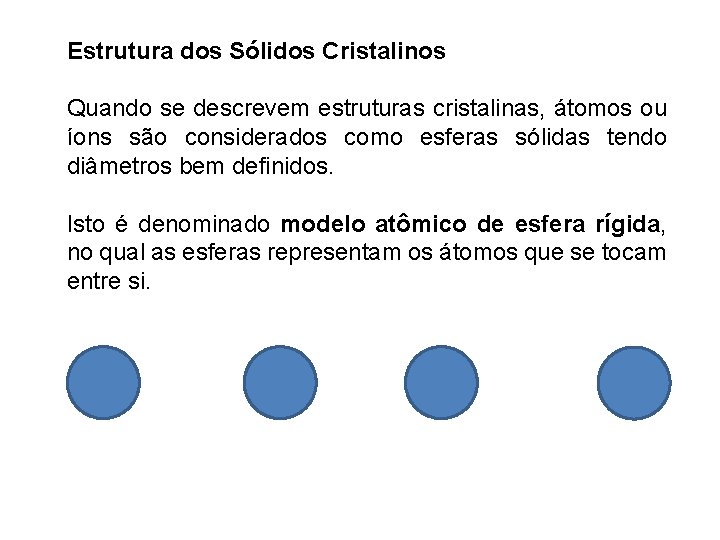
Estrutura dos Sólidos Cristalinos Quando se descrevem estruturas cristalinas, átomos ou íons são considerados como esferas sólidas tendo diâmetros bem definidos. Isto é denominado modelo atômico de esfera rígida, no qual as esferas representam os átomos que se tocam entre si.

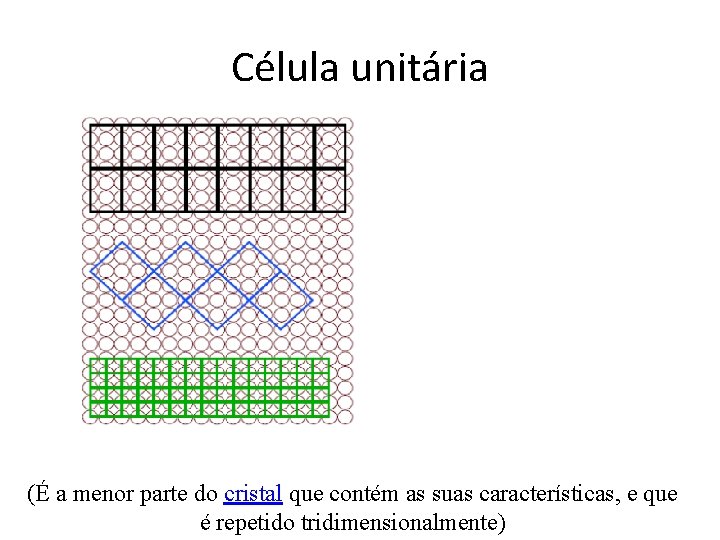
Estrutura dos Sólidos Cristalinos Na descrição de estruturas cristalinas, é conveniente subdividir em pequenas porções menores denominas de células unitárias. Células unitárias para maior parte das estruturas cristalinas são paralelepípedos ou prismas que possuem três conjuntos de faces paralelas. Uma célula unitária é escolhida para representar a simetria da estrutura cristalina.

Estrutura dos Sólidos Cristalinos A célula unitária pode ser definida como a unidade estrutural básica ou bloco de construção da estrutura cristalina. Ela define a estrutura do cristal em função de sua geometria e da posição de seus átomos no seu interior.

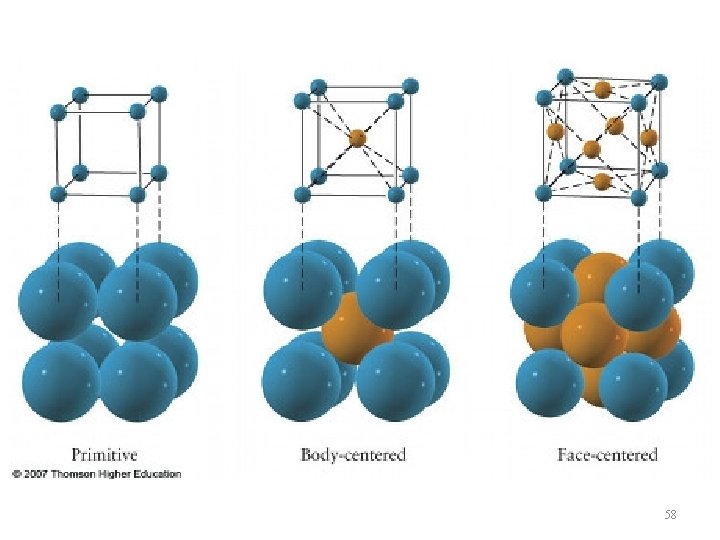
ESTRUTURAS CRISTALINAS METÁLICAS Nesse grupo a ligação é metálica e não-direcional. Estrutura cristalina Cúbica de Face Centrada (FCC) v Tipo de estrutura cristalina encontrada para muitos metais. v Os átomos são localizados em cada um dos cantos e nos centros de todas as faces do cubo. v Os elementos metálicos ouro, prata, cobre e alumínio apresentam essa estrutura cristalina.

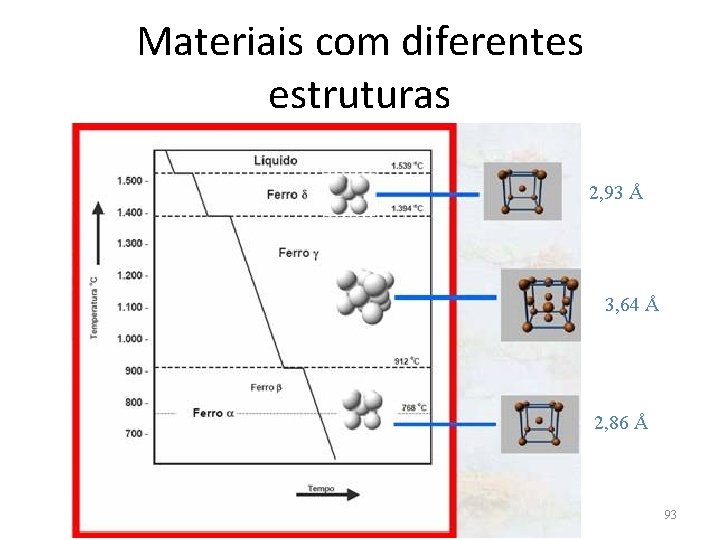
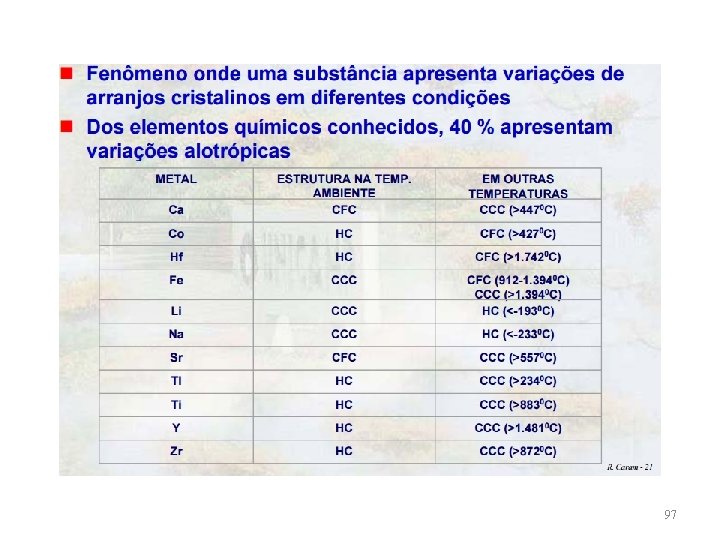
Estrutura Cristalina (EC) do Fe Apresenta diferentes formas estruturais (EC) dependendo da temperatura: • Ferro α: É o que se encontra na temperatura ambiente, até os 788 °C. O sistema cristalino é uma rede cúbica centrada no corpo e é ferromagnético. • Ferro β: 788 - 910 °C. Tem o mesmo sistema cristalino que o α, porém a temperatura de Curie é de 770 °C, e passa a ser paramagnético. • Ferro γ: 910 - 1400 °C; apresenta uma rede cúbica centrada nas faces. • Ferro δ: 1400 - 1539 °C; volta a apresentar uma rede cúbica centrada no corpo. 31

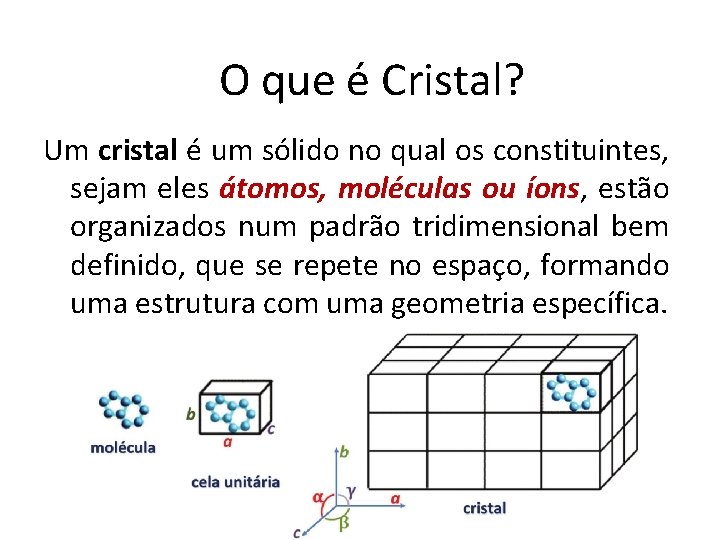
O que é Cristal? Um cristal é um sólido no qual os constituintes, sejam eles átomos, moléculas ou íons, estão organizados num padrão tridimensional bem definido, que se repete no espaço, formando uma estrutura com uma geometria específica.

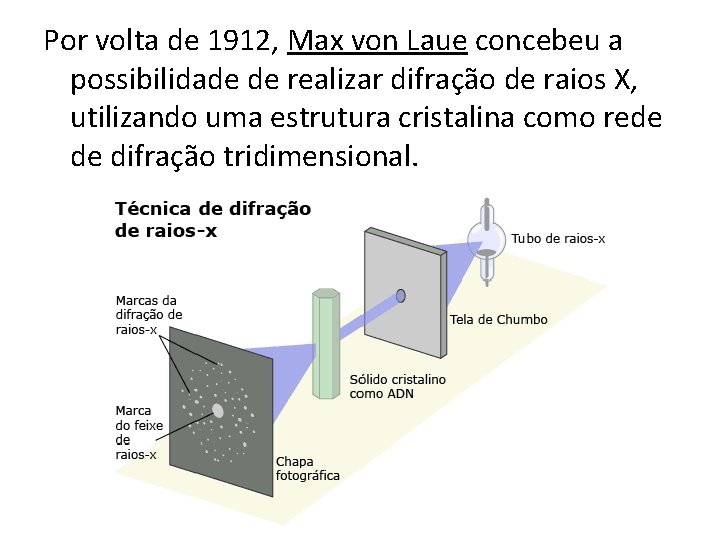
Por volta de 1912, Max von Laue concebeu a possibilidade de realizar difração de raios X, utilizando uma estrutura cristalina como rede de difração tridimensional.

34

35

Nobel em Química 2011: Descoberta dos Quasicristais, uma Nova Classe de Sólidos 36

37

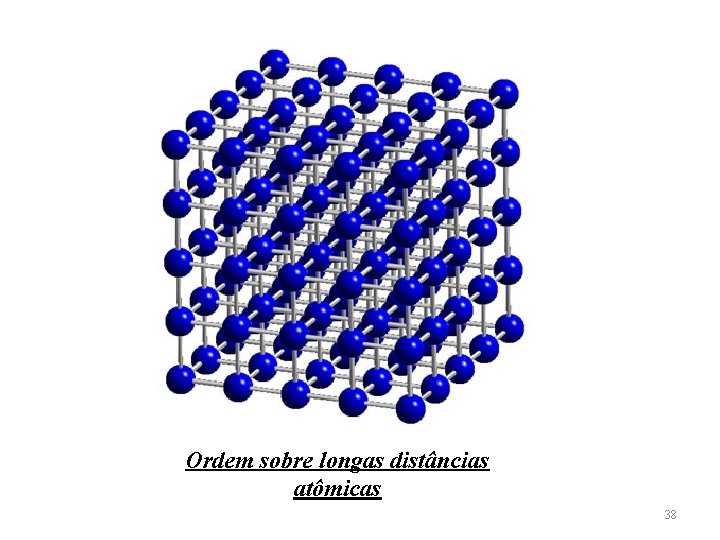
Ordem sobre longas distâncias atômicas 38


Padrão de Difração 40

Material cristalino? 41

42

43

44

Um cristal é um sólido no qual os constituintes, sejam eles átomos, moléculas ou íons, estão organizados num padrão tridimensional bem definido, que se repete no espaço, formando uma estrutura com uma geometria específica. 45

46

47

48

49

50

ARRANJAMENTO ATÔMICO • Os materiais sólidos podem ser classificados em cristalinos ou não-cristalinos de acordo com a regularidade na qual os átomos ou íons se dispõem em relação à seus vizinhos. • Material cristalino é aquele no qual os átomos encontramcristalino se ordenados sobre longas distâncias atômicas formando uma estrutura tridimensional que se chama de rede cristalina • Todos os metais, muitas cerâmicas e alguns polímeros formam estruturas cristalinas sob condições normais de solidificação 51

ARRANJAMENTO ATÔMICO • Nos materiais não-cristalinos ou amorfos não existe ordem de longo alcance na disposição dos átomos • As propriedades dos materiais sólidos cristalinos depende da estrutura cristalina, ou seja, da maneira na qual os átomos, moléculas ou íons estão espacialmente dispostos. • Há um número grande de diferentes estruturas cristalinas, desde estruturas simples exibidas pelos metais até estruturas mais complexas exibidas pelos cerâmicos e polímeros 52

Célula unitária (É a menor parte do cristal que contém as suas características, e que é repetido tridimensionalmente)

ESTRUTURA CRISTALINA DOS METAIS • Como a ligação metálica é não-direcional não há restrições quanto ao número e posições dos vizinhos (átomos) mais próximos. • Então, a estrutura cristalina dos metais têm geralmente um número grande de primeiros vizinhos e alto empacotamento atômico. • Três são as estruturas cristalinas mais comuns em metais: Cúbica de corpo centrado, cúbica de face centrada e hexagonal compacta 54

55

SISTEMA CÚBICO Os átomos podem ser agrupados dentro do sistema cúbico em 3 diferentes tipos de repetição – Cúbico simples – Cúbico de corpo centrado – Cúbico de face centrada 56

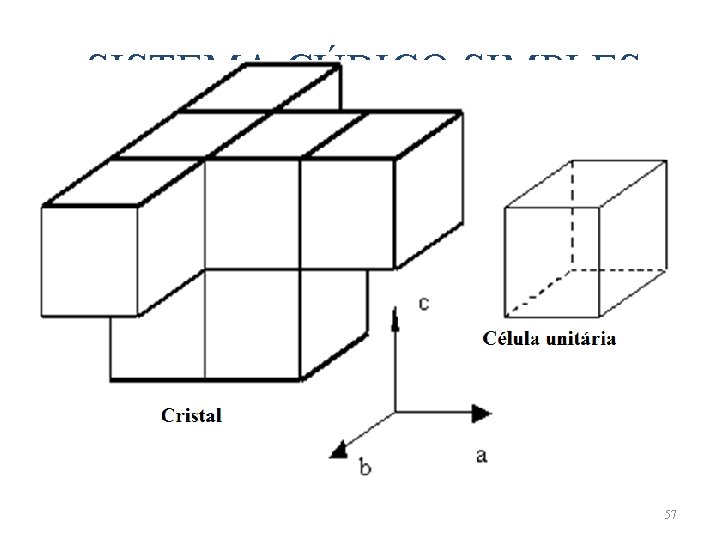
SISTEMA CÚBICO SIMPLES 57

58

59

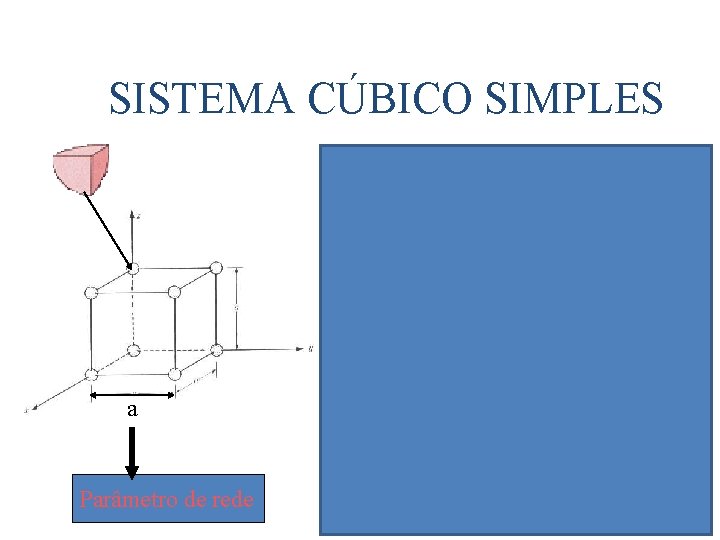
SISTEMA CÚBICO SIMPLES a Parâmetro de rede w Apenas 1/8 de cada átomo cai dentro da célula unitária, ou seja, a célula unitária contém apenas 1 átomo. w Essa é a razão que os metais não cristalizam na estrutura cúbica simples (devido ao baixo empacotamento atômico) 60

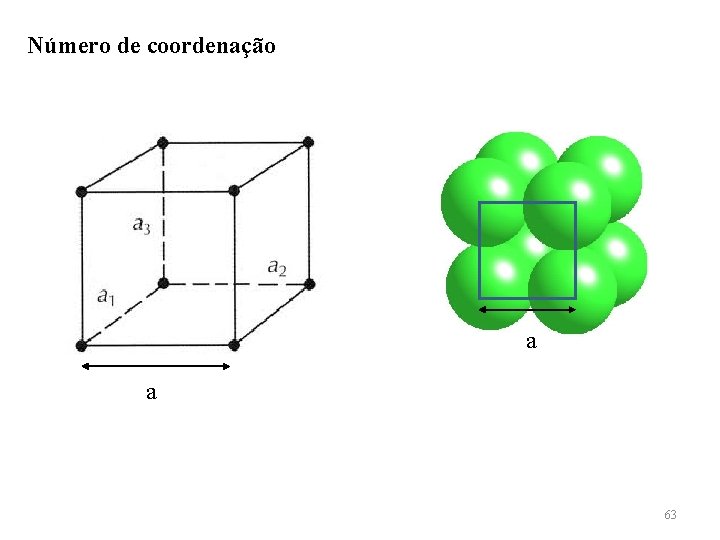
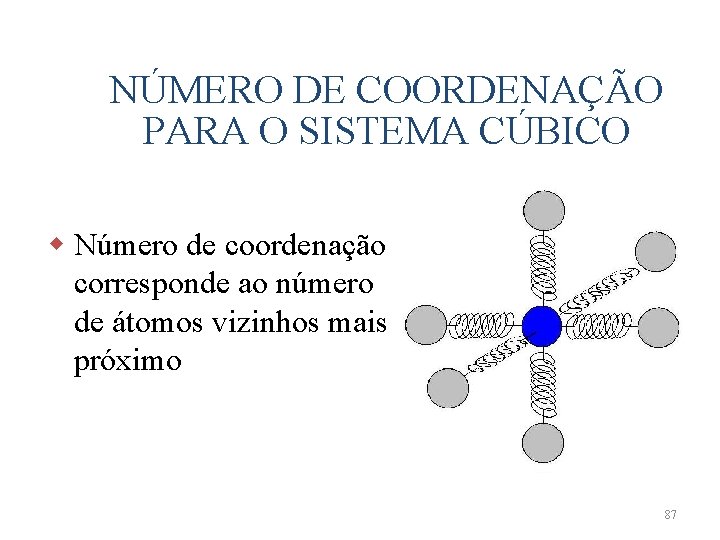
NÚMERO DE COORDENAÇÃO PARA CS w Número de coordenação corresponde coordenação ao número de átomos vizinhos mais próximos w Para a estrutura cúbica simples o número de coordenação é 6. 61

62

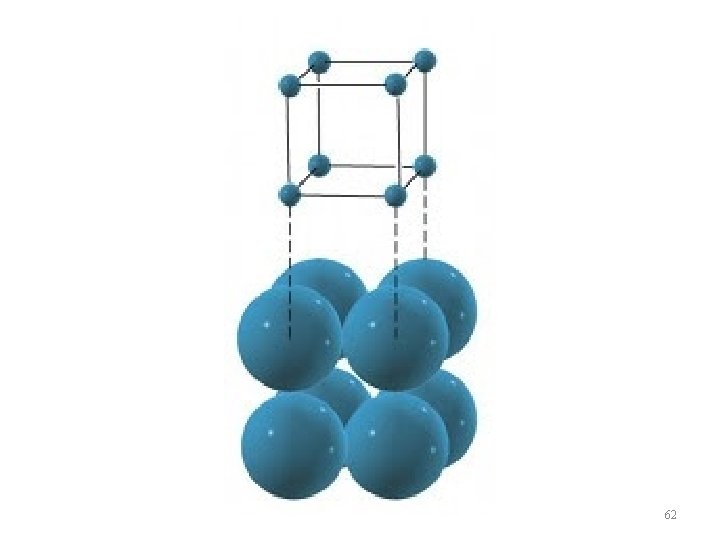
Número de coordenação a a 63

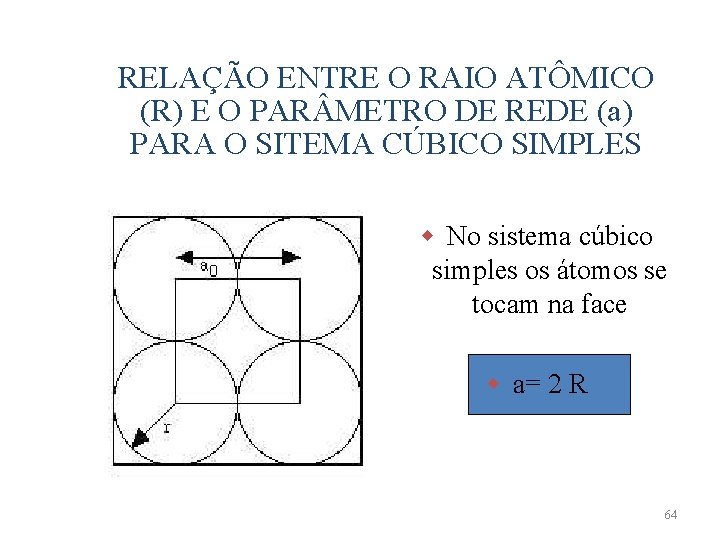
RELAÇÃO ENTRE O RAIO ATÔMICO (R) E O PAR METRO DE REDE (a) PARA O SITEMA CÚBICO SIMPLES w No sistema cúbico simples os átomos se tocam na face w a= 2 R 64

FATOR DE EMPACOTAMENTO ATÔMICO PARA CÚBICO SIMPLES Fator de empacotamento= Número de átomos x Volume dos átomos Volume da célula unitária Vol. dos átomos=número de átomos x Vol. Esfera (4 R 3/3) Vol. Da célula=Vol. Cubo = a w Fator de empacotamento = 3 4 R 3/3 (2 R) 3 O FATOR DE EMPACOTAMENTO PARA A EST. CÚBICA SIMPLES É O, 52 65

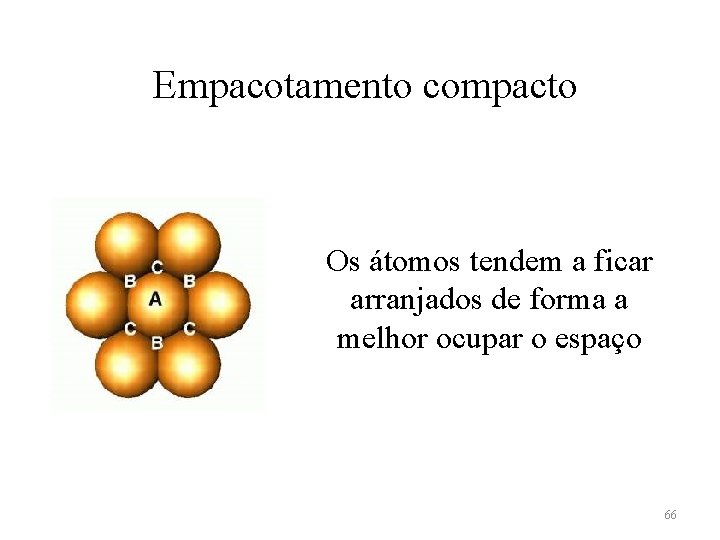
Empacotamento compacto Os átomos tendem a ficar arranjados de forma a melhor ocupar o espaço 66

67

68

69

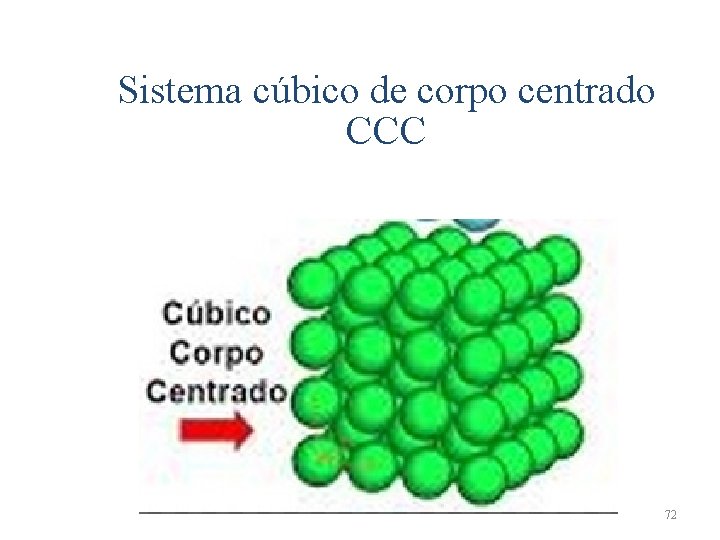
Sistema cúbico de corpo centrado CCC 70

71

Sistema cúbico de corpo centrado CCC 72

EST. CÚBICA DE CORPO CENTRADO w O PAR METRO DE REDE E O RAIO ATÔMICO ESTÃO RELACIONADOS NESTE SISTEMA POR: accc= 4 R /(3)1/2 Filme w Na est. ccc cada átomo dos vertices do cubo é dividido com 8 células unitárias w Já o átomo do centro pertence somente a sua célula unitária. w Cada átomo de uma estrutura ccc é cercado por 8 átomos adjacentes w Há 2 átomos por célula unitária na estrutura ccc w O Fe, Cr, W cristalizam em ccc 73

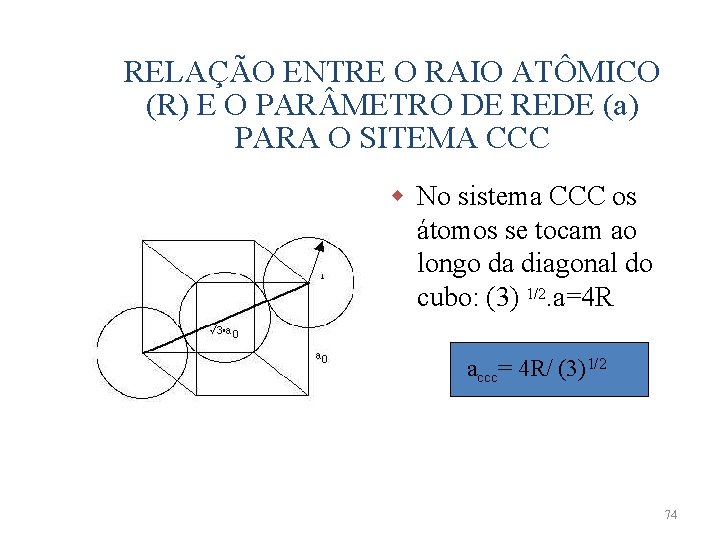
RELAÇÃO ENTRE O RAIO ATÔMICO (R) E O PAR METRO DE REDE (a) PARA O SITEMA CCC w No sistema CCC os átomos se tocam ao longo da diagonal do cubo: (3) 1/2. a=4 R accc= 4 R/ (3)1/2 74

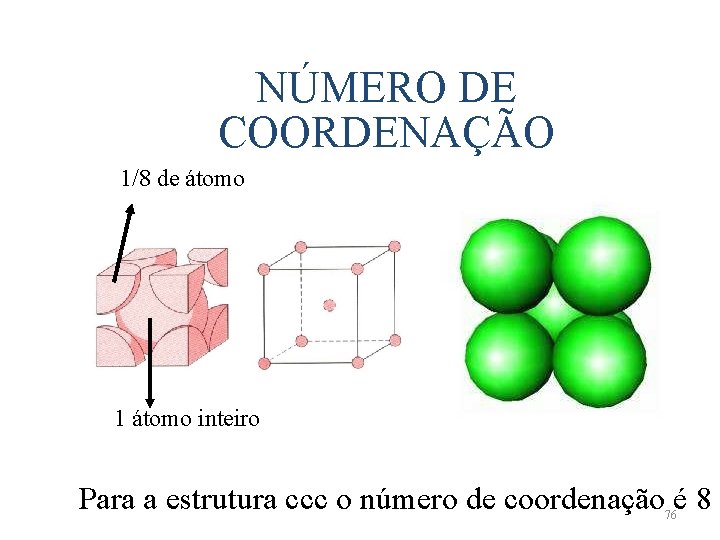
NÚMERO DE COORDENAÇÃO PARA CCC w Número de coordenação corresponde coordenação ao número de átomos vizinhos mais próximos w Para a estrutura ccc o número de coordenação é 8. 75

NÚMERO DE COORDENAÇÃO 1/8 de átomo 1 átomo inteiro Para a estrutura ccc o número de coordenação é 8 76

FATOR DE EMPACOTAMENTO ATÔMICO PARA CCC w Fator de empacotamento= Número de átomos x Volume dos átomos Volume da célula unitária O FATOR DE EMPACOTAMENTO PARA A EST. CC É O, 68 (demonstre) 77

EST. CÚBICA DE FACE CENTRADA w O PAR METRO DE REDE E O RAIO ATÔMICO ESTÃO RELACIONADOS PARA ESTE SISTEMA POR: acfc = 4 R/(2)1/2 =2 R. (2)1/2 Filme 25 w Na est. cfc cada átomo dos vertices do cubo é dividido com 8 células unitátias w Já os átomos das faces pertencem somente a duas células unitárias w Há 4 átomos por célula unitária na estrutura cfc w É o sistema mais comum encontrado nos metais (Al, Fe, Cu, Pb, Ag, 78 Ni, . . . )

79

NÚMERO DE COORDENAÇÃO PARA CFC w Número de coordenação corresponde ao número de átomos vizinhos mais próximo w Para a estrutura cfc o número de coordenação é 12. 12 80

NÚMERO DE COORDENAÇÃO PARA CFC Para a estrutura cfc o número de coordenação é 12. 12 81

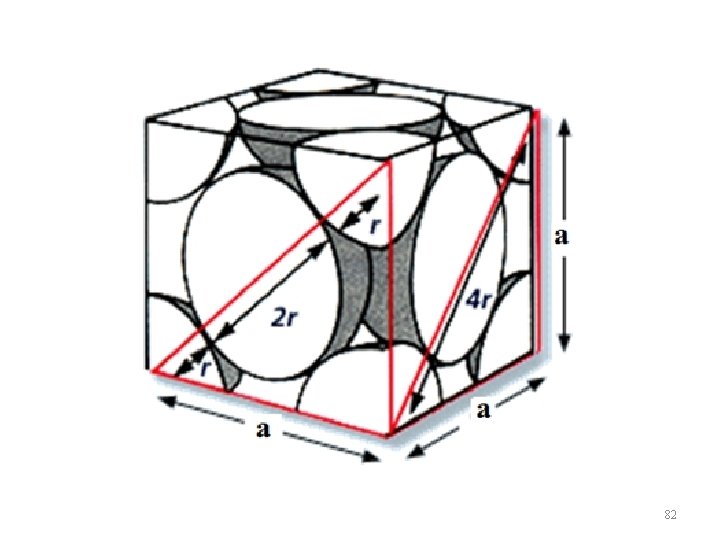
82

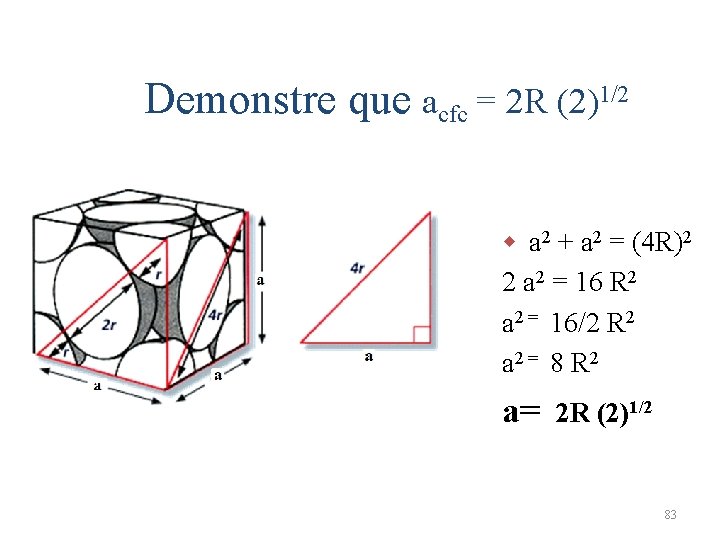
Demonstre que acfc = 2 R (2)1/2 w a 2 + a 2 = (4 R)2 2 a 2 = 16 R 2 a 2 = 16/2 R 2 a 2 = 8 R 2 a= 2 R (2)1/2 83

FATOR DE EMPACOTAMENTO ATÔMICO PARA CFC w Fator de empacotamento= Número de átomos X Volume dos átomos Volume da célula unitária O FATOR DE EMPACOTAMENTO PARA A EST. CFC É O, 74 84

DEMONSTRE QUE O FATOR DE EMPACOTAMENTO PARA A EST. CFC É O, 74 w Fator de empacotamento= Número de átomos X Volume dos átomos Volume da célula unitária Vol. dos átomos=Vol. Esfera= 4 R 3/3 Vol. Da célula=Vol. Cubo = a 3 Fator de empacotamento = 4 X 4 R 3/3 (2 R (2)1/2)3 Fator de empacotamento = 16/3 R 3 16 R 3(2)1/2 Fator de empacotamento = 0, 74 85

TABELA RESUMO PARA O SISTEMA CÚBICO Átomos Número de por célula coordenação CS 1 6 CCC 2 8 CFC 4 12 Parâmetro de rede Fator de empacotamento 2 R 0, 52 0, 68 4 R/(3)1/2 0, 74 4 R/(2)1/2 86

NÚMERO DE COORDENAÇÃO PARA O SISTEMA CÚBICO w Número de coordenação corresponde ao número de átomos vizinhos mais próximo 87

SISTEMA HEXAGONAL SIMPLES w Os metais não cristalizam no sistema hexagonal simples porque o fator de empacotamento é muito baixo w Entretanto, cristais com mais de um tipo de átomo cristalizam neste sistema 88

89

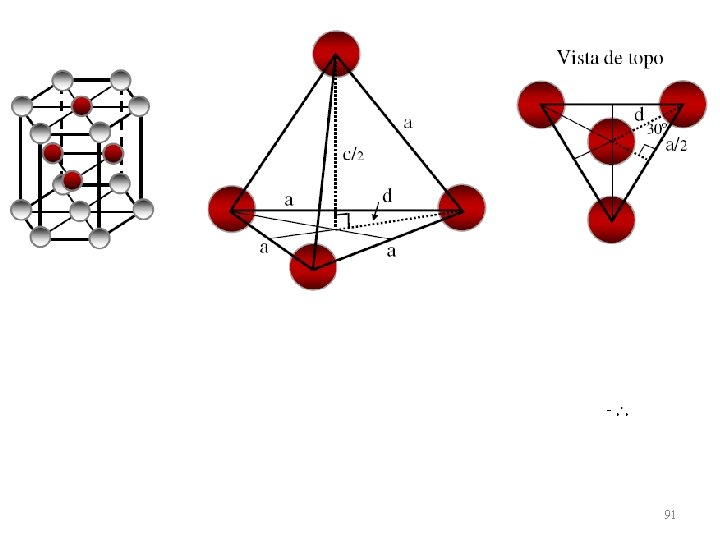
EST. HEXAGONAL COMPACTA w O sistema Hexagonal Compacta é mais comum nos metais (ex: Mg, Zn) w Na HC cada átomo de uma dada camada está diretamente abaixo ou acima dos interstícios formados entre as camadas adjacentes 90

91

92

Materiais com diferentes estruturas 2, 93 Å 3, 64 Å 2, 86 Å 93

EXERCÍCIO w O ferro passa de ccc para cfc a 910 ºC. Nesta temperatura os raios atômicos são respectivamente , 1, 258Å e 1, 292Å. Qual a percentagem de variação de volume percentual provocada pela mudança de estrutura? w Vccc= 2 a 3 accc= 4 R/ (3)1/2 Vccc= 49, 1 Å3 Vcfc= a a 3 cfc = 2 R (2) 1/2 Vcfc= 48, 7 Å3 V%= 48, 7 - 49, 1 /49, 1 = - 0, 8% de variação Dica: Para o cálculo tomar como base 2 células unitárias da estrutura CCC. 94

O que é Cristal? Um cristal é um sólido no qual os constituintes, sejam eles átomos, moléculas ou íons, estão organizados num padrão tridimensional bem definido, que se repete no espaço, formando uma estrutura com uma geometria específica.

Célula unitária (É a menor parte do cristal que contém as suas características, e que é repetido tridimensionalmente)

97

CÁLCULO DA DENSIDADE w O conhecimento da estrutura cristalina permite o cálculo da densidade ( ): = n. A Vc. NA n= número de átomos da célula unitária A= peso atômico Vc= Volume da célula unitária NA= Número de Avogadro (6, 02 x 1023 átomos/mol) 98

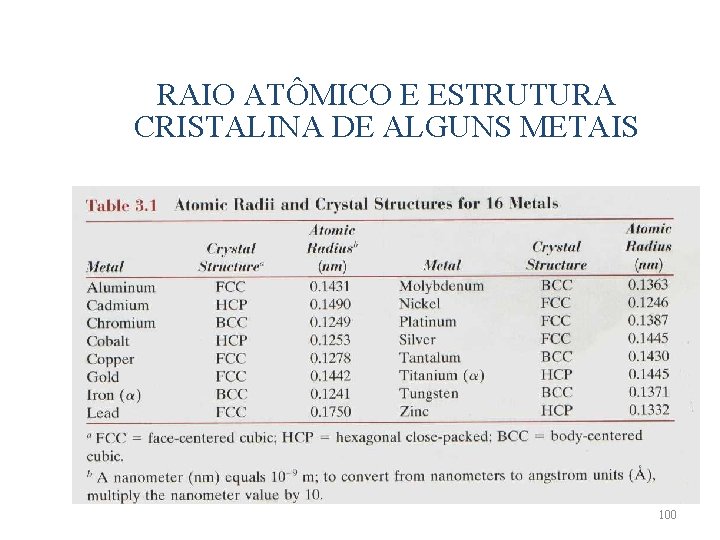
EXEMPLO: w Cobre têm raio atômico de 0, 128 nm (1, 28 Å), uma estrutura cfc, um peso atômico de 63, 5 g/mol. Calcule a densidade do cobre. w Resposta: 8, 89 g/cm 3 w Valor da densidade medida= 8, 94 g/cm 3 O Alumínio têm raio atômico de 0, 1431 nm (1, 431 Å), uma estrutura cfc, pesquise o seu peso atômico e Calcule a densidade teórica do alumínio. Compare seu resultado com o reportado na literatura. 99

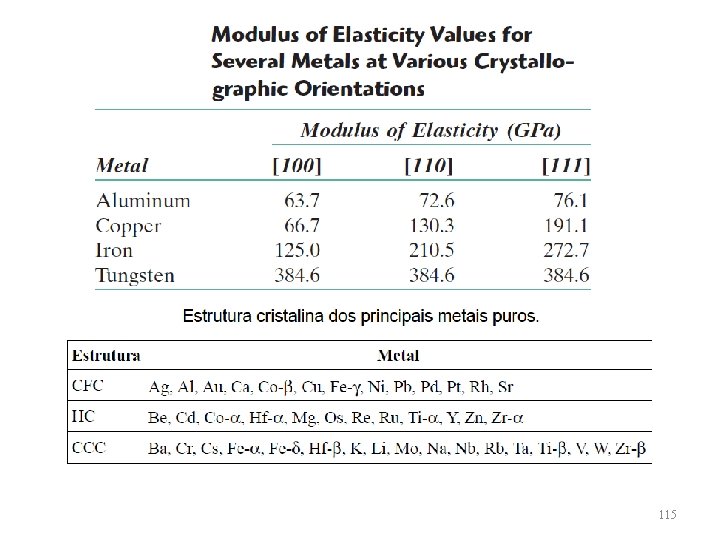
RAIO ATÔMICO E ESTRUTURA CRISTALINA DE ALGUNS METAIS 100

101

102

103

104

105

Um metal é considerado continuo para dimensões superiores a 1 mmx 1 mm 106

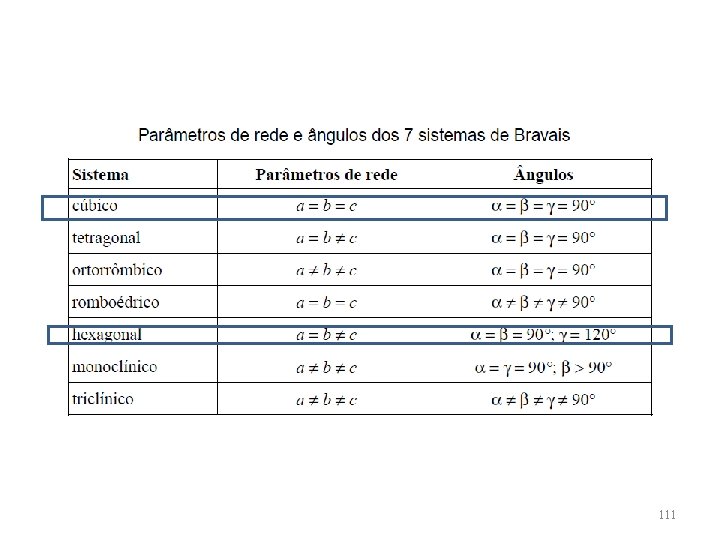
SISTEMAS CRISTALINOS w Estes sistemas incluem todas as possíveis geometrias de divisão do espaço por superfícies planas contínuas 107

108

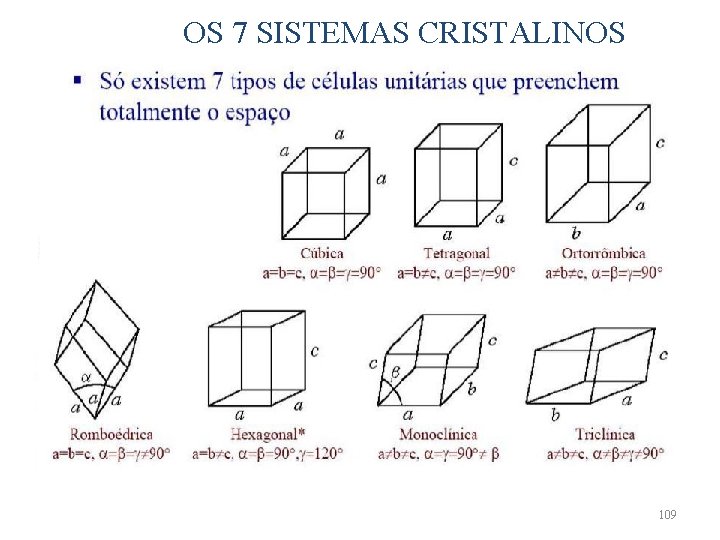
OS 7 SISTEMAS CRISTALINOS 109

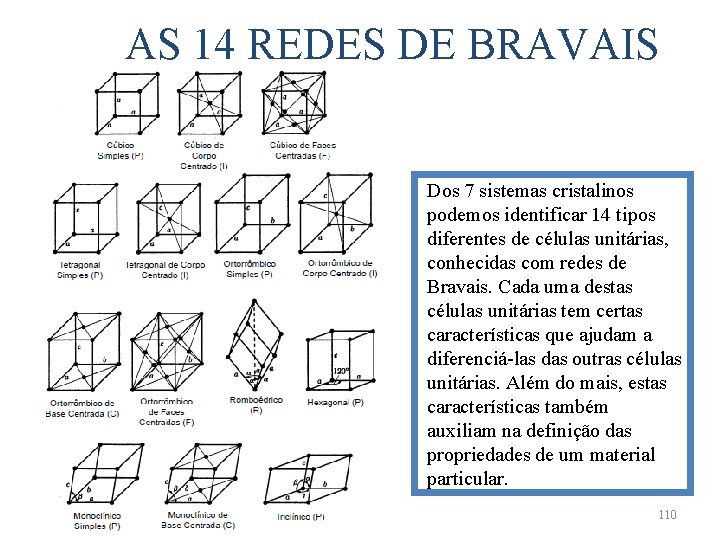
AS 14 REDES DE BRAVAIS Dos 7 sistemas cristalinos podemos identificar 14 tipos diferentes de células unitárias, conhecidas com redes de Bravais. Cada uma destas células unitárias tem certas características que ajudam a diferenciá-las das outras células unitárias. Além do mais, estas características também auxiliam na definição das propriedades de um material particular. 110

111

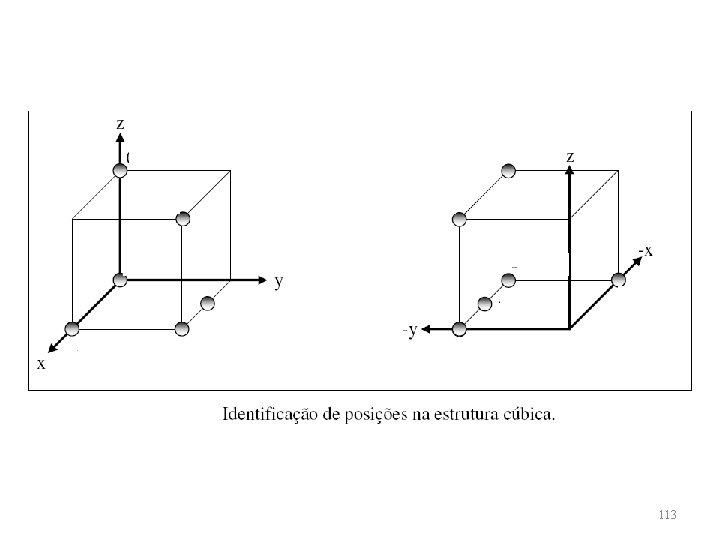
POSIÇÕES NOS CRISTAIS 112

113

DIREÇÕES NOS CRISTAIS 114

115

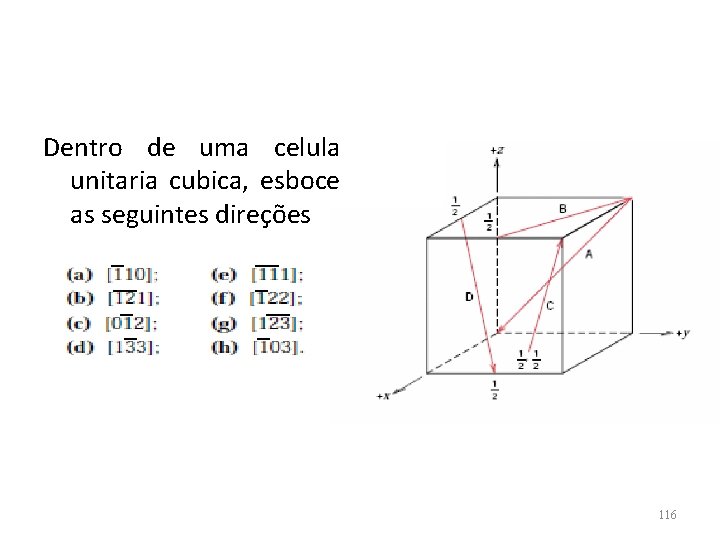
Dentro de uma celula unitaria cubica, esboce as seguintes direções 116

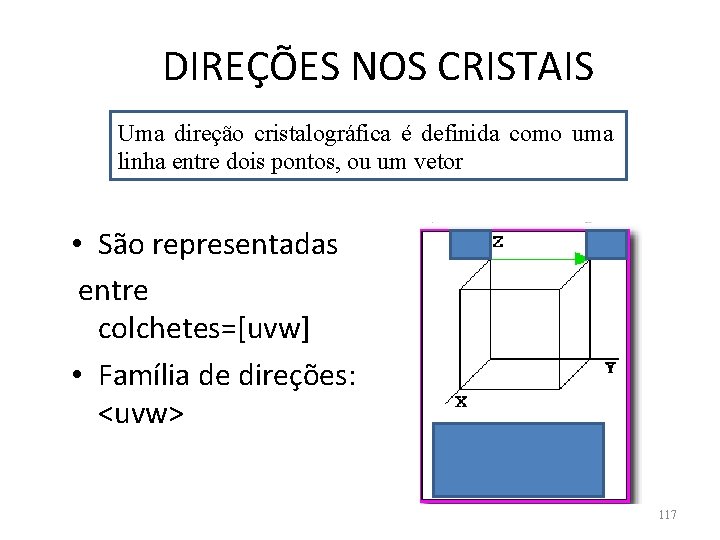
DIREÇÕES NOS CRISTAIS Uma direção cristalográfica é definida como uma linha entre dois pontos, ou um vetor • São representadas entre colchetes=[uvw] • Família de direções: <uvw> 117
![DIREÇÕES NOS CRISTAIS São representadas entre colchetes hkl Se a subtração der DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Se a subtração der](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-118.jpg)
DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Se a subtração der negativa, coloca-se uma barra sobre o número 118
![DIREÇÕES NOS CRISTAIS São representadas entre colchetes hkl Quando passa pela origem DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Quando passa pela origem](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-119.jpg)
DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] • Quando passa pela origem 119
![DIREÇÕES NOS CRISTAIS São representadas entre colchetes hkl Os números devem ser divididos DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] Os números devem ser divididos](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-120.jpg)
DIREÇÕES NOS CRISTAIS • São representadas entre colchetes= [hkl] Os números devem ser divididos ou multiplicados por um fator comum para dar números inteiros 120

121

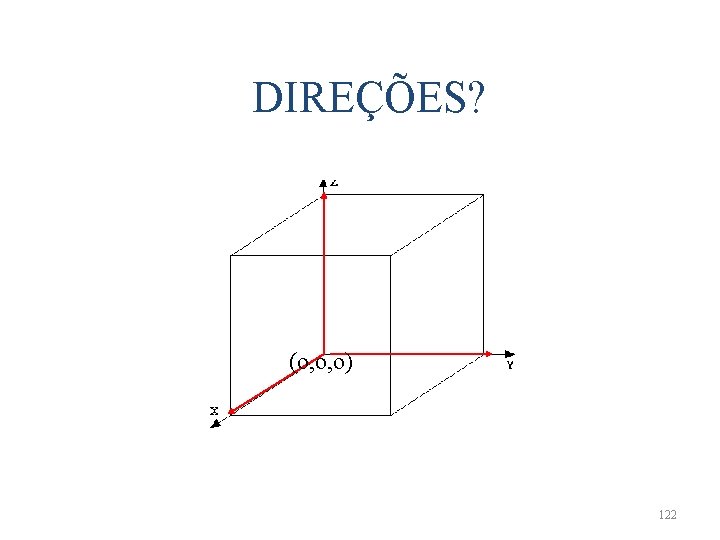
DIREÇÕES? (o, o, o) 122

Dentro de uma celula unitaria cubica, esboce as seguintes direções 123

DIREÇÕES PARA O SISTEMA CÚBICO • A simetria desta estrutura permite que as direções equivalentes sejam agrupadas para formar uma família de direções: • <100> para as faces • <110> para as diagonais das faces • <111> para a diagonal do cubo <110> <111> <100> 124

125

126
![As duas direções pertencem a mesma família 101 As direções dizemse cristalograficamente equivalentes se As duas direções pertencem a mesma família? [101] As direções dizem-se cristalograficamente equivalentes se,](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-127.jpg)
As duas direções pertencem a mesma família? [101] As direções dizem-se cristalograficamente equivalentes se, ao longo dessas direções, o espaçamento entre os átomos for o mesmo. Por exemplo, as seguintes direções, correspondentes às diagonais do cubo, são cristalograficamente equivalentes 127

Algumas direções da família de direções <100> 128

DENSIDADE ATÔMICA LINEAR E PLANAR As densidades linear e planar são considerações importantes por estarem relacionadas com o processo de deslizamento — isto é, o mecanismo segundo o qual os metais se deformam plasticamente. O deslizamento ocorre nos planos cristalográficos mais densamente empacotados e, naqueles planos, ao longo das direções que possuem o maior empacotamento atômico. 129

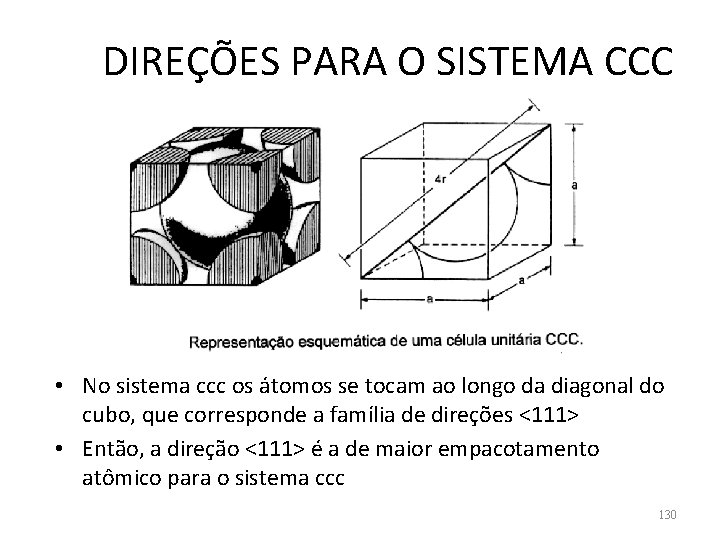
DIREÇÕES PARA O SISTEMA CCC • No sistema ccc os átomos se tocam ao longo da diagonal do cubo, que corresponde a família de direções <111> • Então, a direção <111> é a de maior empacotamento atômico para o sistema ccc 130

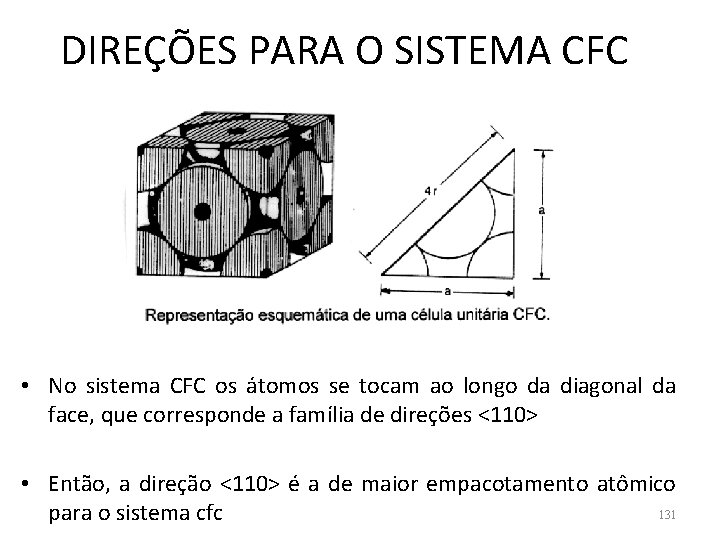
DIREÇÕES PARA O SISTEMA CFC • No sistema CFC os átomos se tocam ao longo da diagonal da face, que corresponde a família de direções <110> • Então, a direção <110> é a de maior empacotamento atômico 131 para o sistema cfc

DENSIDADE ATÔMICA LINEAR Densidade linear= átomos/cm (igual ao fator de empacotamento em uma dimensão) 132
![Exemplo Calcule a densidade linear para a direção 100 em uma estrutura cristalina CCC Exemplo Calcule a densidade linear para a direção [100] em uma estrutura cristalina CCC.](https://slidetodoc.com/presentation_image/24aef7f72b8f7e45e9e1eb062c2ce108/image-133.jpg)
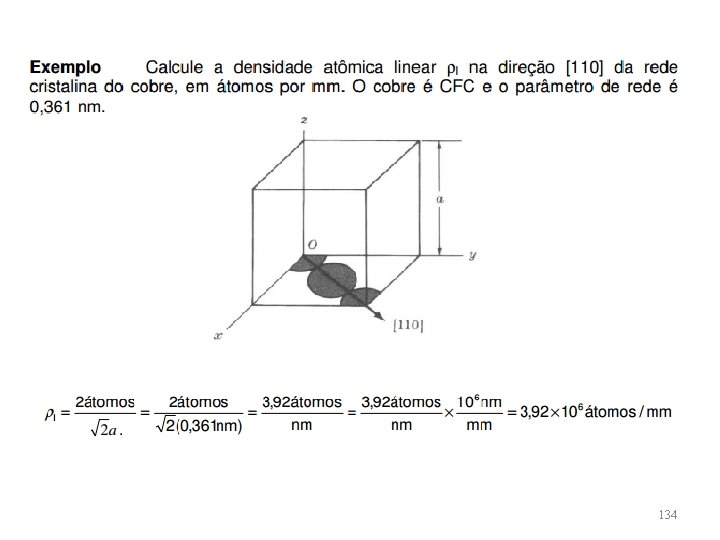
Exemplo Calcule a densidade linear para a direção [100] em uma estrutura cristalina CCC. 133

134

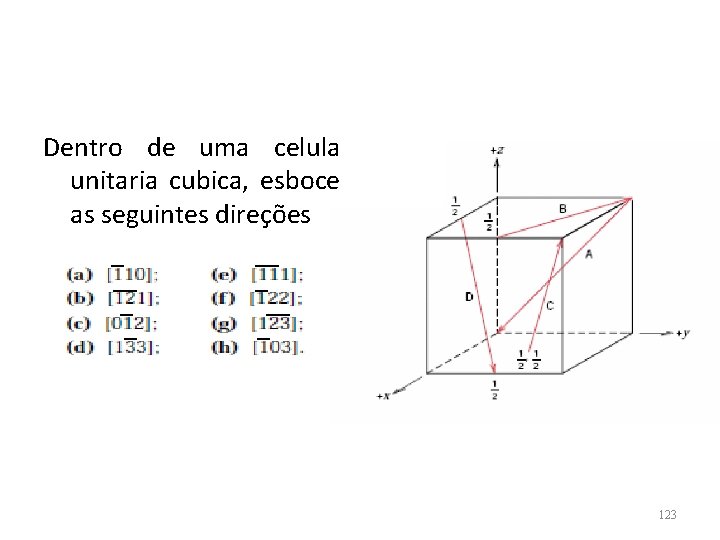
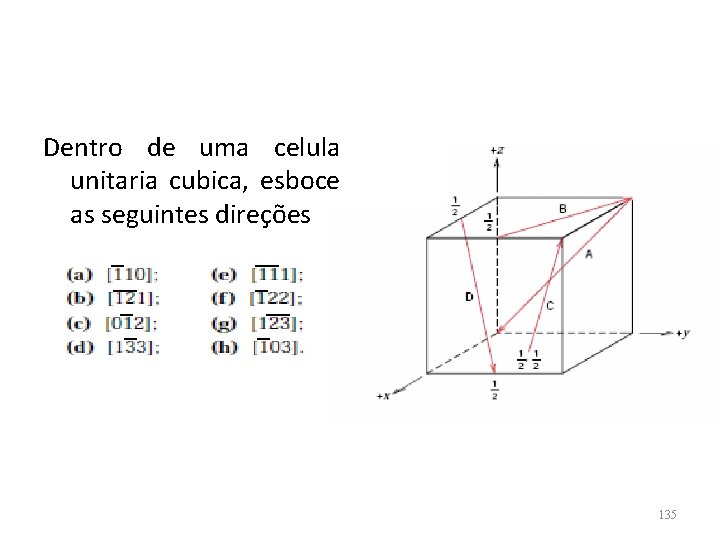
Dentro de uma celula unitaria cubica, esboce as seguintes direções 135

PLANOS CRISTALINOS Por quê são importantes? · Para a determinação da estrutura cristalina Os métodos de difração medem diretamente a distância entre planos paralelos de pontos do reticulado cristalino. Esta informação é usada para determinar os parâmetros do reticulado de um cristal. Os métodos de difração também medem os ângulos entre os planos do reticulado. Estes são usados para determinar os ângulos interaxiais de um cristal. · Para a deformação plástica A deformação plástica (permanente) dos metais ocorre pelo deslizamento dos átomos, escorregando uns sobre os outros no cristal. Este deslizamento tende a acontecer preferencialmente ao longo de planos direções específicos do cristal. · Para as propriedades de transporte Em certos materiais, a estrutura atômica em determinados planos causa o transporte de elétrons e/ou acelera a condução nestes planos, e, relativamente, reduz a velocidade em planos distantes destes. Exemplo 1: Grafita A condução de calor é mais rápida nos planos unidos covalentemente sp 2 do que nas direções perpendiculares a esses planos. Exemplo 2: supercondutores a base de YBa 2 Cu 3 O 7 Alguns planos contêm somente Cu e O. Estes planos conduzem pares de elétrons (chamados pares de cobre) que são os responsáveis pela supercondutividade. Estes supercondutores são eletricamente isolantes em direções perpendiculares as dos planos Cu-O. 136

PLANOS CRISTALINOS • São representados de maneira similar às direções • São representados pelos índices de Miller = (hkl) • Planos paralelos são equivalentes tendos os mesmos índices 137

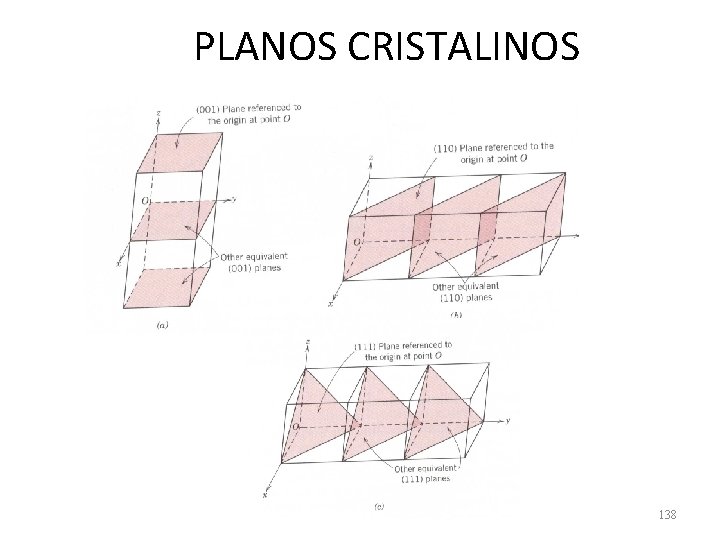
PLANOS CRISTALINOS 138

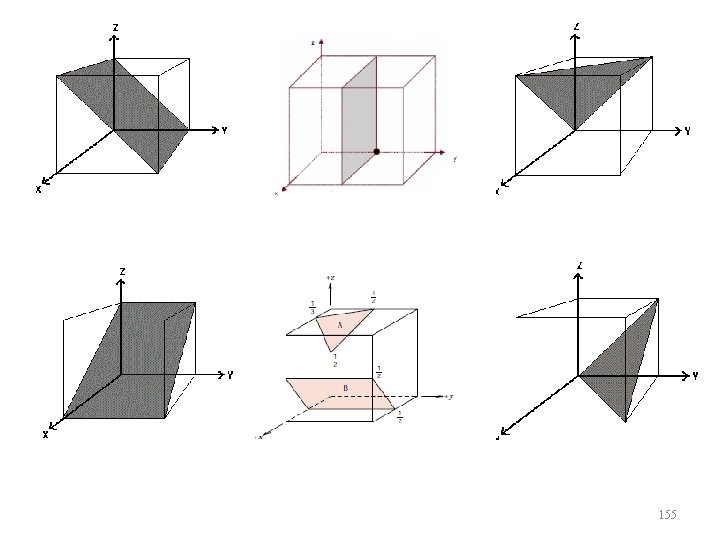
PLANOS CRISTALINOS Planos (010) • São paralelos aos eixos x e z (paralelo à face) • Cortam um eixo (neste exemplo: y em 1 e os eixos x e z em ) • 1/ , 1/1, 1/ = (010) 139

PLANOS CRISTALINOS Planos (110) • São paralelos a um eixo (z) • Cortam dois eixos (x e y) • 1/ 1, 1/ = (110) 140

PLANOS CRISTALINOS Planos (111) • Cortam os 3 eixos cristalográficos • 1/ 1, 1/ 1 = (111) 141

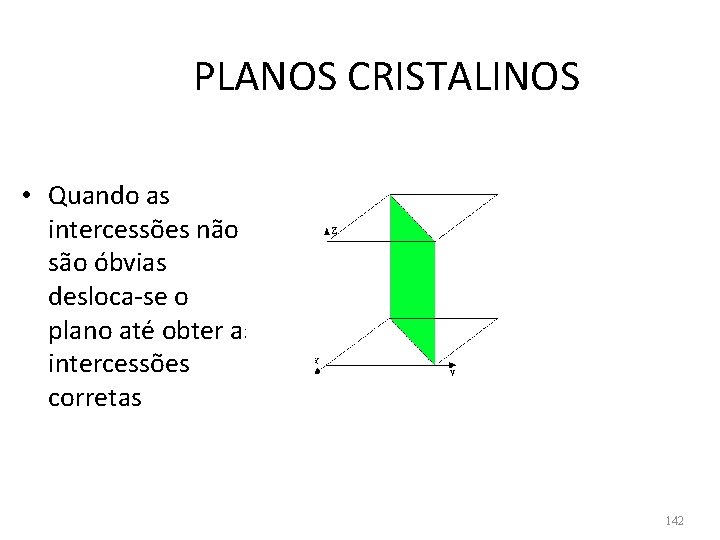
PLANOS CRISTALINOS • Quando as intercessões não são óbvias desloca-se o plano até obter as intercessões corretas 142

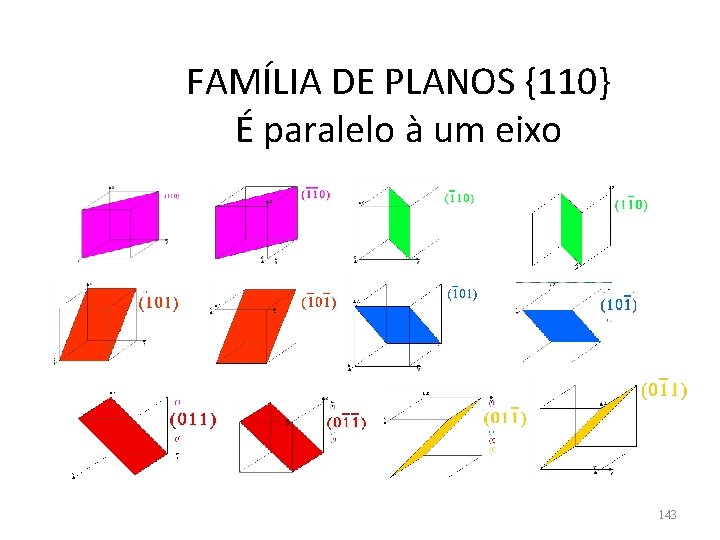
FAMÍLIA DE PLANOS {110} É paralelo à um eixo 143

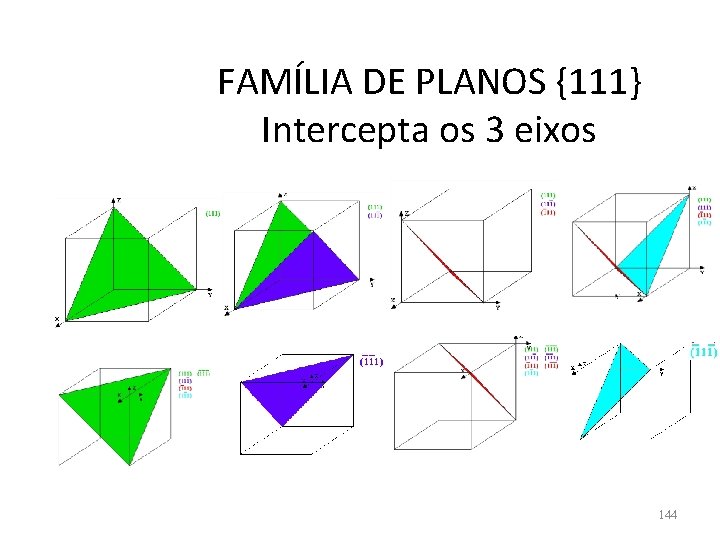
FAMÍLIA DE PLANOS {111} Intercepta os 3 eixos 144

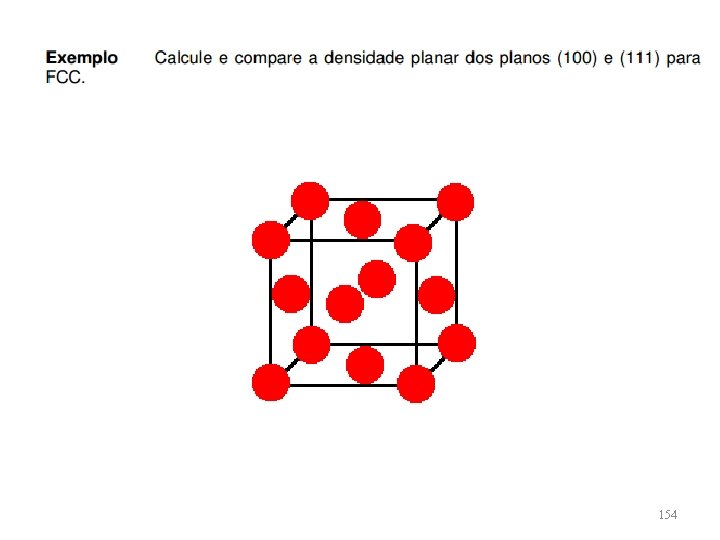
PLANOS NO SISTEMA CÚBICO • A simetria do sistema cúbico faz com que a família de planos tenham o mesmo arranjamento e densidade • Deformação em metais envolve deslizamento de planos atômicos. O deslizamento ocorre mais facilmente nos planos e direções de maior densidade atômica 145

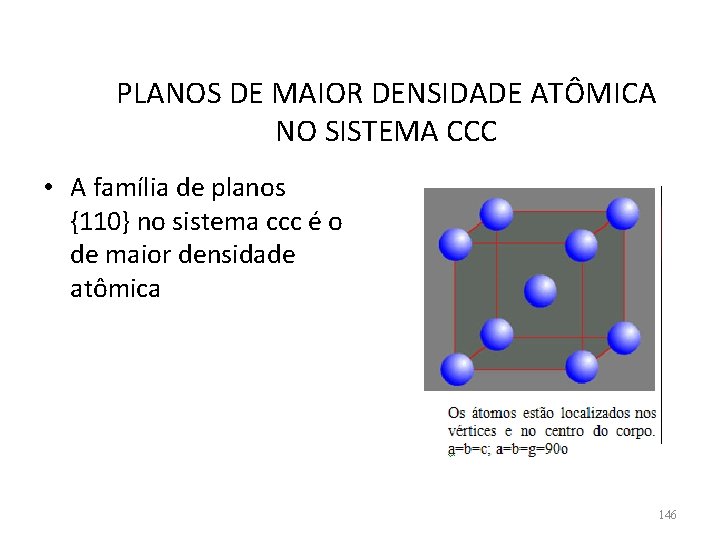
PLANOS DE MAIOR DENSIDADE ATÔMICA NO SISTEMA CCC • A família de planos {110} no sistema ccc é o de maior densidade atômica 146

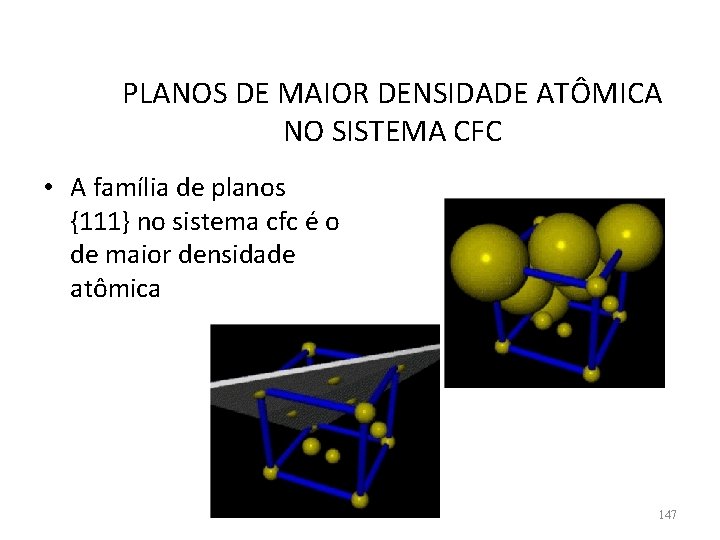
PLANOS DE MAIOR DENSIDADE ATÔMICA NO SISTEMA CFC • A família de planos {111} no sistema cfc é o de maior densidade atômica 147

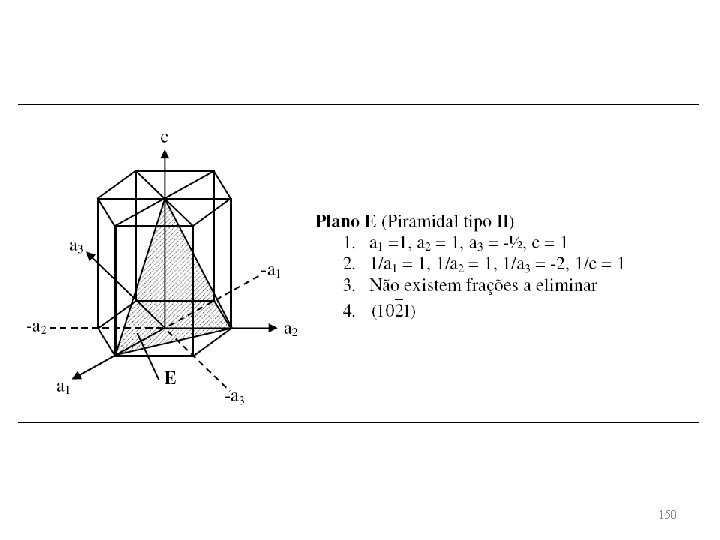
Planos em cristais hexagonais 148

149

150

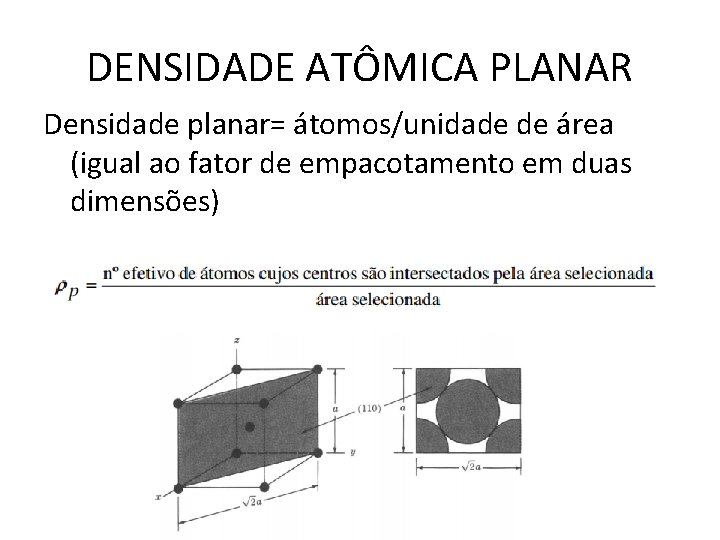
DENSIDADE ATÔMICA PLANAR Densidade planar= átomos/unidade de área (igual ao fator de empacotamento em duas dimensões)

152

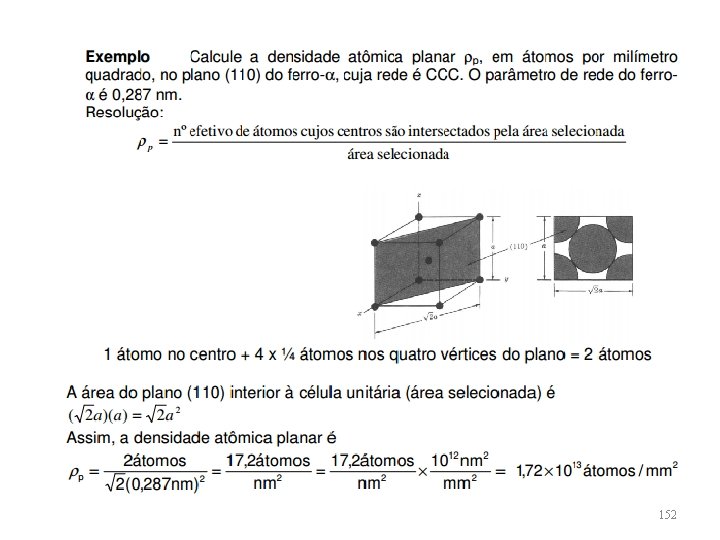
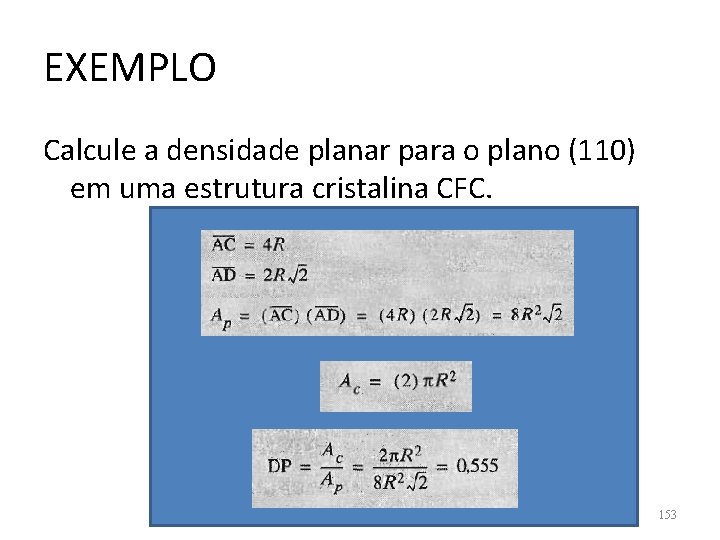
EXEMPLO Calcule a densidade planar para o plano (110) em uma estrutura cristalina CFC. 153

154

155

DENSIDADE ATÔMICA LINEAR E PLANAR As densidades linear e planar são considerações importantes por estarem relacionadas com o processo de deslizamento — isto é, o mecanismo segundo o qual os metais se deformam plasticamente. O deslizamento ocorre nos planos cristalográficos mais densamente empacotados e, naqueles planos, ao longo das direções que possuem o maior empacotamento atômico. 156

• As densidades linear e planar são considerações importantes por estarem relacionadas com o processo de deslizamento — isto é, o mecanismo segundo o qual os metais se deformam plasticamente (Seção 7. 4). O deslizamento ocorre nos planos cristalográficos mais densamente empacotados e, naqueles planos, ao longo das direções que possuem o maior empacotamento atômico. 157

158

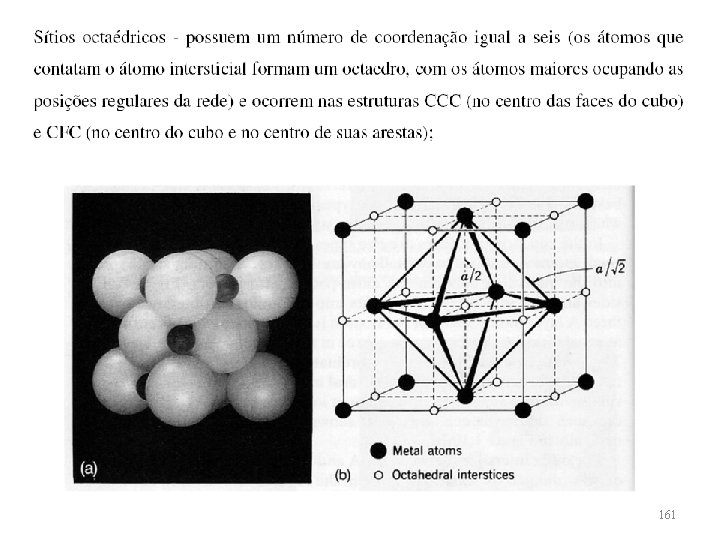
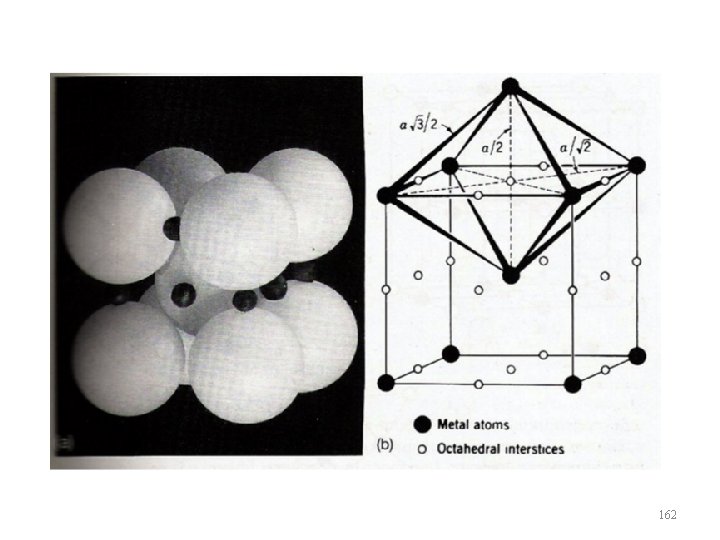
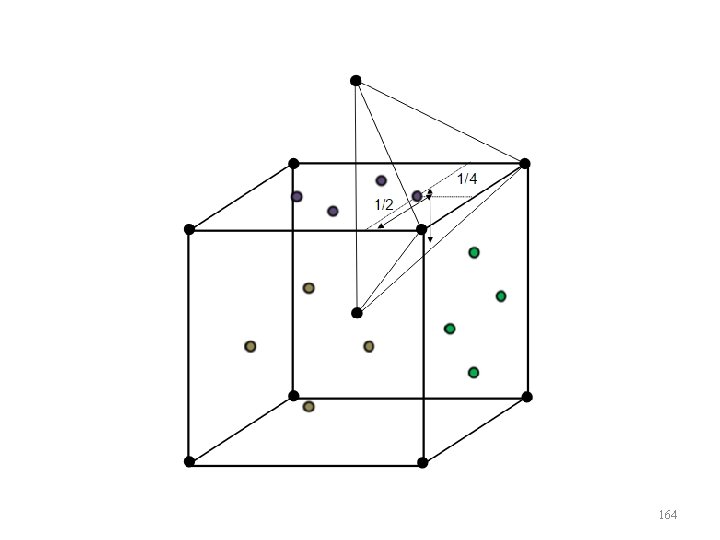
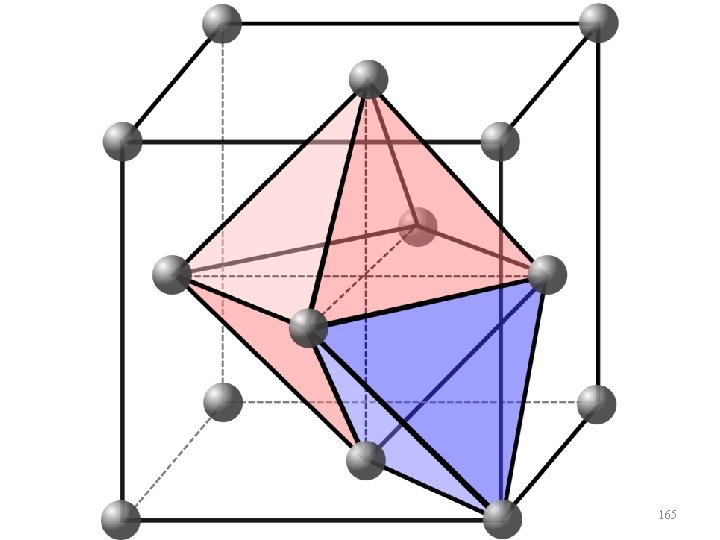
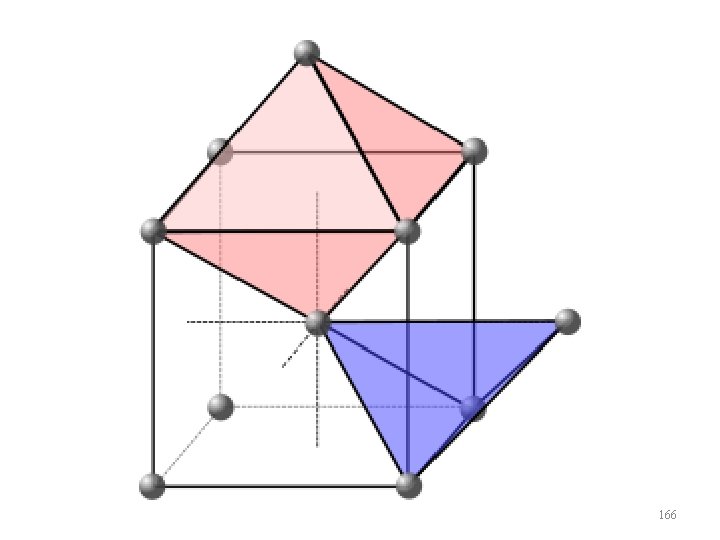
Sítios Intersticiais • Nas estruturas cristalinas existem pequenos espaços vazios entre os átomos da rede, nos quais átomos menores podem se alojar. Essas regiões da estrutura são denominadas de sítios intersticiais. 159

160

161

162

163

164

165

166

1. ) Diferencie materiais cristalinos de materiais não-cristalinos em termos de arranjo atômico. 2. ) Quais são as estruturas cristalinas mais comuns encontradas nos materiais metálicos? 3. ) O que você entende como “fator de empacotamento atômico” e de que depende? 4. ) A - O ferro tem estrutura cúbica de corpo centrado (CCC) e raio atômico de 1, 241 Å a temperatura ambiente. Calcule o parâmetro de rede e o fator de empacotamento atômico para o ferro nestas condições. R: a = 2, 86 x 10 -8 cm ou 0, 2864 nm e F. E. = 0, 68 • B - A 910 °C o ferro passa de estrutura cúbica de corpo centrado (CCC) para estrutura cúbica de face centrada (CFC) e raio atômico de 1, 292 Å. Calcule o parâmetro de rede e o fator de empacotamento atômico para o ferro nestas condições. • R: a = 3, 51 x 10 -8 cm ou 0, 351 nm e F. E. = 0, 74 5. ) Sabendo que o Pb cristaliza no sistema CFC calcule o parâmetro de rede para o Pb e o seu raio atômico. Dados: A = 207 g/mol, ρ = 11, 34 g/cm 3 6. ) O que é polimorfismo ou alotropia? Quais as conseqüências deste fenômeno nas propriedades dos materiais? Cite 2 exemplos de materiais que exibem polimorfismo. 7. ) A - Como são representadas uma única direção e uma família de direções cristalográficas? • B - Como são representados um único plano e uma família de planos cristalográficos? 8. ) O que você entende por anisotropia? 167

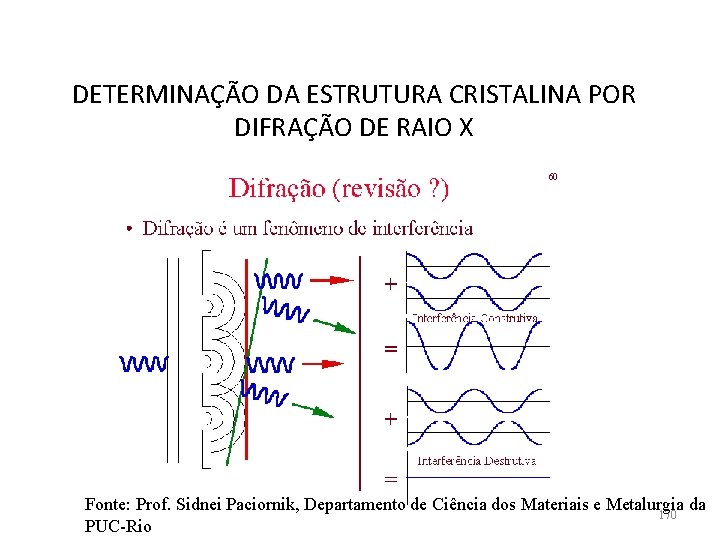
DETERMINAÇÃO DA ESTRUTURA CRISTALINA POR DIFRAÇÃO DE RAIO X Raíos-x tem comprimento de onda similar a distância interplanar 0, 1 nm 168

DETERMINAÇÃO DA ESTRUTURA CRISTALINA POR DIFRAÇÃO DE RAIO X O FENÔMENO DA DIFRAÇÃO: Quando um feixe de raios x é dirigido à um material cristalino, esses raios são difratados pelos planos dos átomos ou íons dentro do cristal 169

DETERMINAÇÃO DA ESTRUTURA CRISTALINA POR DIFRAÇÃO DE RAIO X Fonte: Prof. Sidnei Paciornik, Departamento de Ciência dos Materiais e Metalurgia da 170 PUC-Rio

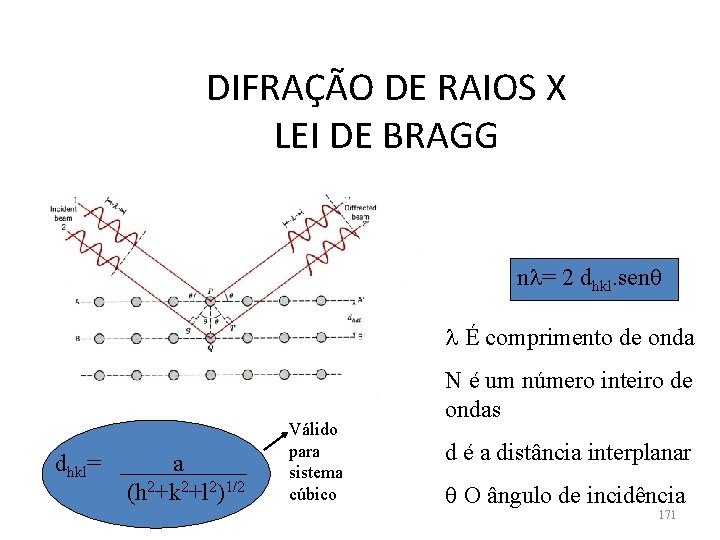
DIFRAÇÃO DE RAIOS X LEI DE BRAGG n = 2 dhkl. sen É comprimento de onda dhkl= a (h 2+k 2+l 2)1/2 Válido para sistema cúbico N é um número inteiro de ondas d é a distância interplanar O ângulo de incidência 171

Espaçamento Interplanar 172

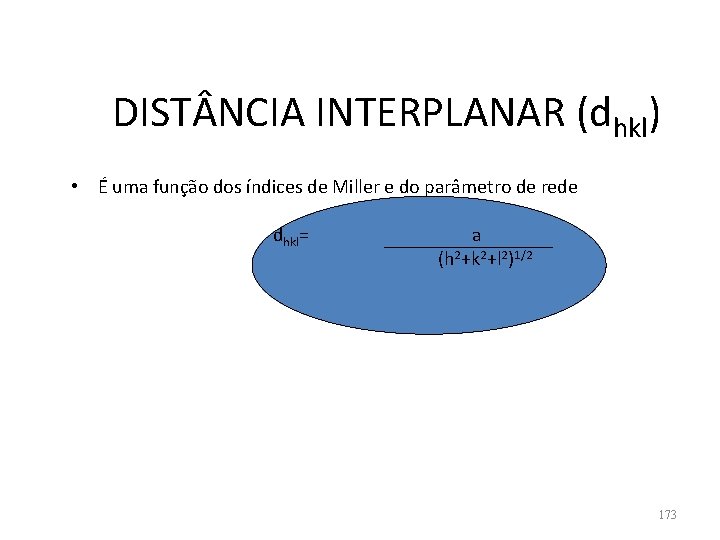
DIST NCIA INTERPLANAR (dhkl) • É uma função dos índices de Miller e do parâmetro de rede dhkl= a (h 2+k 2+l 2)1/2 173

174

TÉCNICAS DE DIFRAÇÃO • Técnica do pó: É bastante comum, o material a ser analisado encontra-se na forma de pó (partículas finas orientadas ao acaso) que são expostas à radiação x monocromática. O grande número de partículas com orientação diferente assegura que a lei de Bragg seja satisfeita para alguns planos cristalográficos 175

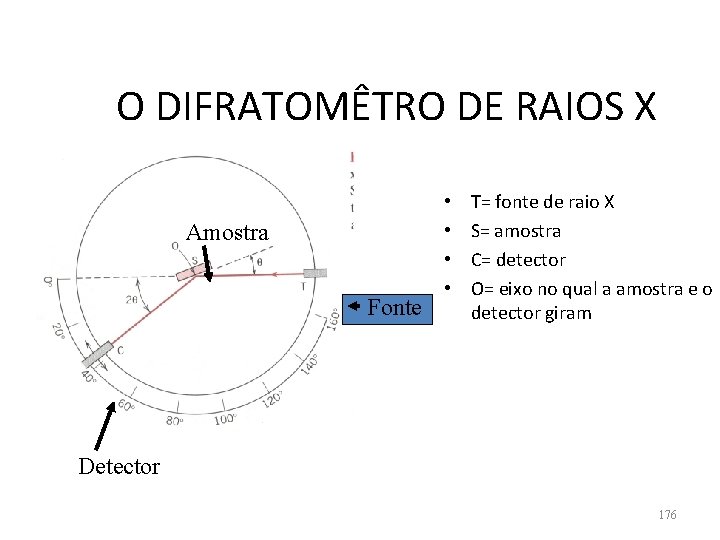
O DIFRATOMÊTRO DE RAIOS X Amostra Fonte • • T= fonte de raio X S= amostra C= detector O= eixo no qual a amostra e o detector giram Detector 176

DIFRATOGRAMA Fonte: Prof. Sidnei Paciornik, Departamento de Ciência dos Materiais e Metalurgia da PUC-Rio 177
 Acincia
Acincia Fundamentos de engenharia de software
Fundamentos de engenharia de software Varela materiais de construção
Varela materiais de construção Materiais betuminosos
Materiais betuminosos Sapatilha roxa
Sapatilha roxa Materiais eletricos
Materiais eletricos Riscadores
Riscadores Objetivos da administração de materiais
Objetivos da administração de materiais Limite de proporcionalidade
Limite de proporcionalidade Materiais
Materiais Fratura ductil
Fratura ductil Os objetos são feitos de diferentes materiais
Os objetos são feitos de diferentes materiais Materiais não estruturados
Materiais não estruturados Materiais naturais manufaturados
Materiais naturais manufaturados Fontes formais e materiais do direito do trabalho
Fontes formais e materiais do direito do trabalho Carga p
Carga p Resistência dos materiais
Resistência dos materiais Resistencia dos materiais
Resistencia dos materiais Classificação dos materiais na natureza
Classificação dos materiais na natureza Tcc objetivo geral
Tcc objetivo geral Materiais combinados
Materiais combinados Diferentes materiais
Diferentes materiais Planejamento das necessidades de materiais
Planejamento das necessidades de materiais Audge
Audge Quais são os materiais expelidos pelos vulcões
Quais são os materiais expelidos pelos vulcões Materiais e métodos tcc
Materiais e métodos tcc Resistencia dos materiais
Resistencia dos materiais Limite de escoamento
Limite de escoamento Resistência dos materiais
Resistência dos materiais Materiais
Materiais Profmaria3
Profmaria3 Materiais diamagnéticos
Materiais diamagnéticos Materiais sintéticos
Materiais sintéticos Materiais
Materiais Materiais
Materiais Efape material de apoio
Efape material de apoio Expelidos
Expelidos Fluxograma de compras de materiais
Fluxograma de compras de materiais Tecnologia dos materiais
Tecnologia dos materiais Fator de empacotamento cfc
Fator de empacotamento cfc Resistência dos materiais
Resistência dos materiais Materiais de moldagem odontologia
Materiais de moldagem odontologia Materiais sintéticos
Materiais sintéticos Mecatronica unip
Mecatronica unip Engenharia de produção universo
Engenharia de produção universo Engenharia industrial madeireira ufpr
Engenharia industrial madeireira ufpr Engenharia de software
Engenharia de software Mecatrnica
Mecatrnica Engenharia software
Engenharia software Engenharia
Engenharia Fluxo
Fluxo Friburgo
Friburgo Engenharia elétrica unip
Engenharia elétrica unip Engenharia química unip
Engenharia química unip Univag engenharia info
Univag engenharia info Engenharia urbana ufrj
Engenharia urbana ufrj Engenharia
Engenharia Escola engenharia
Escola engenharia Renumerar vigas cypecad
Renumerar vigas cypecad Modelo prescritivo
Modelo prescritivo Engenharia de software
Engenharia de software Trfego
Trfego Unip mecatronica
Unip mecatronica Engenharia química unip
Engenharia química unip Linguagem cientifica
Linguagem cientifica Msf engenharia
Msf engenharia Engenharia reversa de software exe
Engenharia reversa de software exe Escola de eel
Escola de eel Engenharia de software
Engenharia de software Engenharia software
Engenharia software Surgimento da engenharia moderna
Surgimento da engenharia moderna Unip mecatronica
Unip mecatronica Modelo engenharia
Modelo engenharia Engenharia mecatronica unip
Engenharia mecatronica unip Mba engenharia de software
Mba engenharia de software Engenharia
Engenharia Engenharia de transporte
Engenharia de transporte Engenharia de tráfego
Engenharia de tráfego Ftc engenharia civil
Ftc engenharia civil Fundamentos del software libre
Fundamentos del software libre Fundamentos del diseño estructura
Fundamentos del diseño estructura Fundamentos sistemas operativos
Fundamentos sistemas operativos Fundamentos de la poo
Fundamentos de la poo Competencias del área de comunicación
Competencias del área de comunicación La teoría conductista tiene sus fundamentos en
La teoría conductista tiene sus fundamentos en Fundamentos basicos del baloncesto
Fundamentos basicos del baloncesto Fundamentos conceituais do teatro
Fundamentos conceituais do teatro Fundamentos de la inteligencia de negocios
Fundamentos de la inteligencia de negocios Que son los fundamentos antropológicos
Que son los fundamentos antropológicos Fundamentos de la interculturalidad
Fundamentos de la interculturalidad Cuatro fundamentos
Cuatro fundamentos Fundamentos dividendos
Fundamentos dividendos 4 vs 4 voley
4 vs 4 voley Fundamentos ecologicos
Fundamentos ecologicos Fundamentos de la administracion de recursos humanos
Fundamentos de la administracion de recursos humanos São fundamentos do basquetebol
São fundamentos do basquetebol Fundamentos de la electricidad
Fundamentos de la electricidad Fundamentos del curriculum
Fundamentos del curriculum Clases de iglecrecimiento
Clases de iglecrecimiento 7 pasos para plantar una iglesia
7 pasos para plantar una iglesia Fundamentos de la planeacion estrategica
Fundamentos de la planeacion estrategica Fundamentos de auditoria
Fundamentos de auditoria Fundamento de la doctrina social de la iglesia
Fundamento de la doctrina social de la iglesia Fundamentos del comunitarismo
Fundamentos del comunitarismo Cuadro comparativo de los frentes geopoliticos de venezuela
Cuadro comparativo de los frentes geopoliticos de venezuela Baloncesto
Baloncesto Introducción del voleibol
Introducción del voleibol Definición de paradigma
Definición de paradigma Fundamentos del comportamiento individual
Fundamentos del comportamiento individual Fundamentos de la teoria de los colores harald küppers
Fundamentos de la teoria de los colores harald küppers Fuentes del curriculo
Fuentes del curriculo Voleibol fundamentos e regras
Voleibol fundamentos e regras Fundamentos do grego bíblico william mounce
Fundamentos do grego bíblico william mounce Fundamentos de la inteligencia emocional
Fundamentos de la inteligencia emocional Fundamentos de pruebas de software
Fundamentos de pruebas de software De otro modo pseint
De otro modo pseint Site:slidetodoc.com
Site:slidetodoc.com Fundamentos de economia
Fundamentos de economia Fundamentos da psicopedagogia
Fundamentos da psicopedagogia Fundamentos de filosofia gilberto cotrim
Fundamentos de filosofia gilberto cotrim Fundamentos de las pruebas de software
Fundamentos de las pruebas de software Regras básicas do handebol
Regras básicas do handebol Fundamentos del futbol
Fundamentos del futbol Características de la ética cristiana
Características de la ética cristiana Fundamentos de redes de computadores
Fundamentos de redes de computadores Fundamentos da linguagem visual
Fundamentos da linguagem visual Fundamentos tecnicos del handball
Fundamentos tecnicos del handball Frentes geopolíticos de venezuela
Frentes geopolíticos de venezuela Fundamentos de composicion
Fundamentos de composicion Fundamentos de los sistemas operativos
Fundamentos de los sistemas operativos Fundamentos de javascript
Fundamentos de javascript Fundamentos de la contabilidad gubernamental
Fundamentos de la contabilidad gubernamental Introduccion de los fundamentos tecnicos del baloncesto
Introduccion de los fundamentos tecnicos del baloncesto Fundamentos basicos en salud
Fundamentos basicos en salud Fundamentos de arquitectura de computadoras
Fundamentos de arquitectura de computadoras Fundamentos del ping pong
Fundamentos del ping pong Fundamentos de la ebi
Fundamentos de la ebi Fundamentos de auditoria
Fundamentos de auditoria