Estructura de las aleaciones Temas a desarrollar para

























- Slides: 44

Estructura de las aleaciones

Temas a desarrollar para interpretar la estructura de las aleaciones • Efecto de 2 do elemento en la estructura de un metal • Estructura de una solución solida • Soluciones solidas primarias de sustitución • • Estructura de fases intermedias • Fases intersticiales

definiciones • Aleación (subst homogénea con prop metálicas, formada por mas de 2 elementos) • Quienes pueden ser aleantes? • Aleaciones binarias y mas complejas

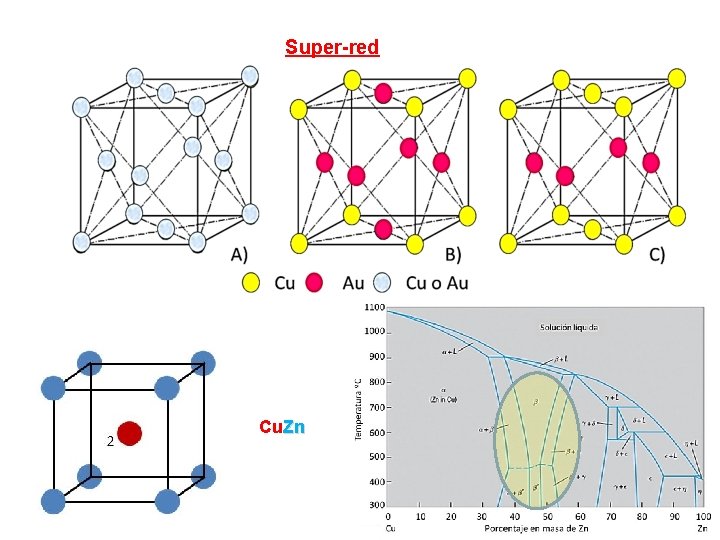
Efecto de 2 do elemento en la estructura de un metal • Indiferentes entre si (forman una solución solida desordenada: ej, Cu. Ni) • Se atraen entre si (1 -Super red: ej. Latón (Cu. Zn) , 2 - intermetálico: ej Mg 2 Si , 3 - compuesto químico: ej, Cu 2 O • Se repelen, (mezcla de fases)

Estructura de una solución solida

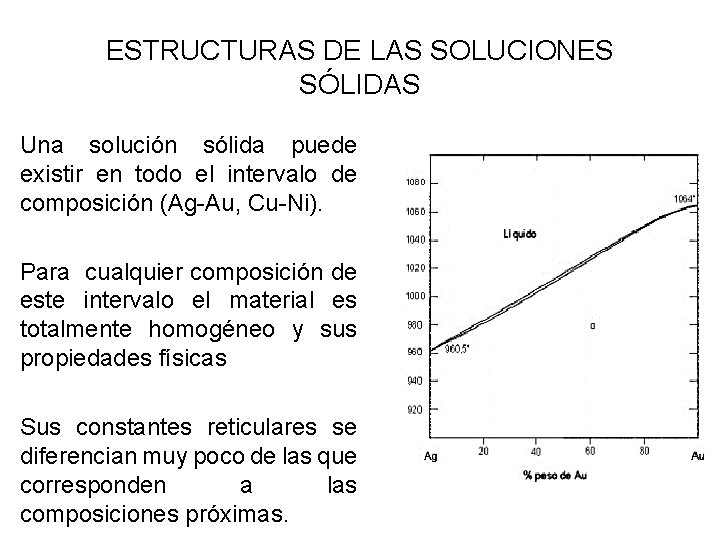
ESTRUCTURAS DE LAS SOLUCIONES SÓLIDAS • Una solución sólida puede existir en todo el intervalo de composición (Ag-Au, Cu-Ni). • Para cualquier composición de este intervalo el material es totalmente homogéneo y sus propiedades físicas • Sus constantes reticulares se diferencian muy poco de las que corresponden a las composiciones próximas.

ESTRUCTURAS DE LAS SOLUCIONES SÓLIDAS • Algunas soluciones sólidas pueden persistir en todo el intervalo de composiciones • Se extiende de un metal puro al otro metal puro y se dice entonces, que los componentes son totalmente miscibles.

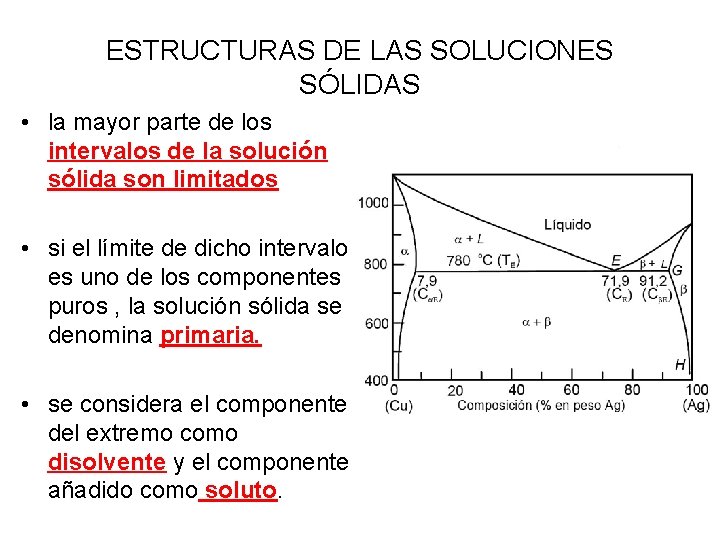
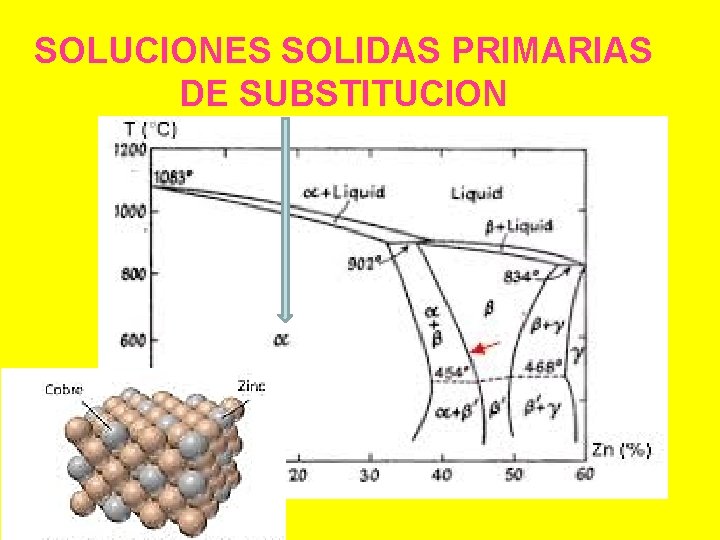
ESTRUCTURAS DE LAS SOLUCIONES SÓLIDAS • la mayor parte de los intervalos de la solución sólida son limitados • si el límite de dicho intervalo es uno de los componentes puros , la solución sólida se denomina primaria. • se considera el componente del extremo como disolvente y el componente añadido como soluto.

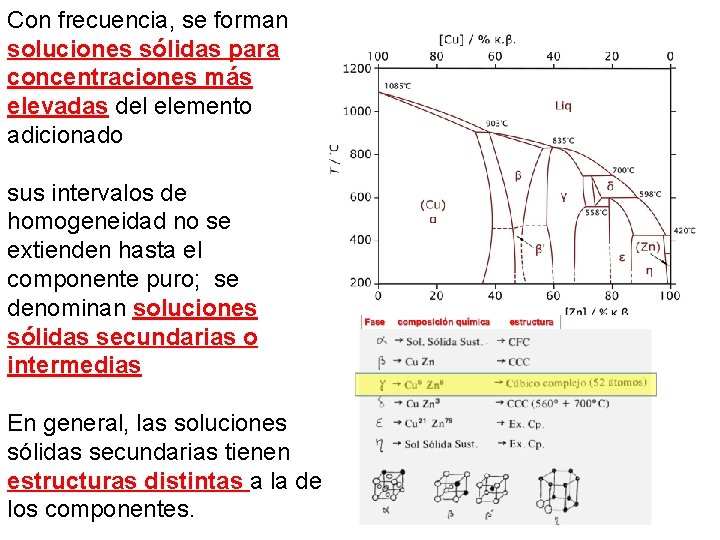
Con frecuencia, se forman soluciones sólidas para concentraciones más elevadas del elemento adicionado sus intervalos de homogeneidad no se extienden hasta el componente puro; se denominan soluciones sólidas secundarias o intermedias En general, las soluciones sólidas secundarias tienen estructuras distintas a la de los componentes.

Resumen de Estructura de una solución solida • Puede ocupar todo el intervalo de CQ • Pueden ser: primarias y también secundarias • Estructura cristalina de las primarias ≠ • Estructura cristalina de las secundarias • Hay abundancia pq tienen enlace metálico (favorece formación Soluciones Solidas desordenadas) • Distribución de átomos depende de la Temperatura (laton: ẞ→ẞ”)

Super-red Cu. Zn

SOLUCIONES SOLIDAS PRIMARIAS DE SUBSTITUCION

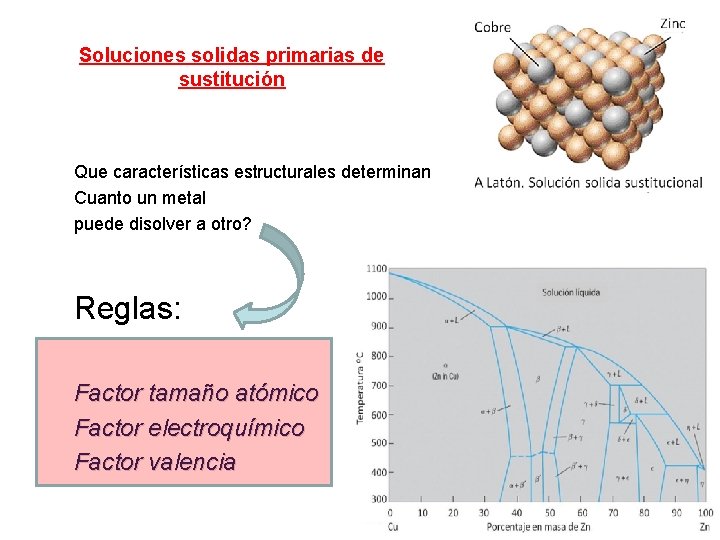
Soluciones solidas primarias de sustitución Que características estructurales determinan Cuanto un metal puede disolver a otro? Reglas: Factor tamaño atómico Factor electroquímico Factor valencia

A continuación se expone las características de la estructura atómica que determinan la extensión con que un metal puede disolver a otro y formar una solución solida primaria de substitución. Reglas generales Factor tamaño: una diferencia creciente Factor tamaño: entre los diámetros del soluto y solvente disminuye el intervalo de solución solida primaria. Si la diferencia es >15% la solubilidad es pequeña y el factor tamaño es desfavorable

Factor electroquímico: Factor electroquímico cuanto mas electropositivo sea un componente y mas electronegativo el otro, mayor será la tendencia a formar compuestos intermetálicos en lugar de soluciones solidas de amplio intervalo. Esta circunstancia será causa de una solubilidad primaria pequeña.

• Efecto valencia relativa: Efecto valencia relativa • a igualdad de los otros factores es mas probable que un metal de valencia baja disuelva a otro de valencia mas alta, que lo contrario. • Ej, Cu disolverá al Zn

Como se dedujo la regla «factor tamaño» ? Comparando las solubilidades de distintos elementos en el Cu, Ag y Au. soluto Berilio Zinc Solubilidad en % de Factor tamaño en % átomos En cobre 16, 6 38, 4 En plata 3, 5 40, 2 En cobre -12, 9 +4, 2 En plata -22, 9 -8 Sin embargo, para lograr una amplia solubilidad no basta con que este factor sea favorable: este factor sea favorable Los átomos también deben ser electroquímicamente semejantes ( sino formaran compuestos)

Observaciones • La aplicación de la regla «factor tamaño» exige conocer las medidas del diámetro atómico • Si los átomos cambian de estado electrónico al alearse, debe escogerse el diámetro del ion.

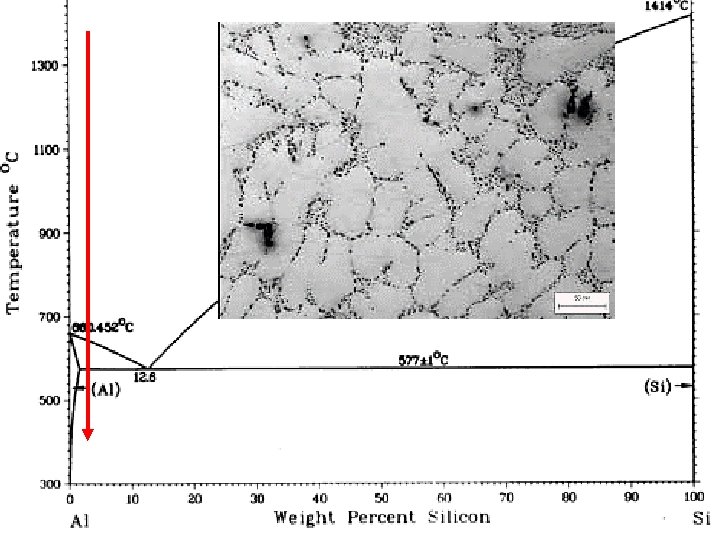
Ejemplo de la regla de Hume-Rothery Si consideramos una solución de SILICIO en ALUMINIO podemos averiguar a priori el grado aproximado de solubilidad que presentará dicha solución. Sabemos que: Al Si Radio atómico = 0, 143 nm « Radio atómico = 0, 117 nm Estructura cristalina = FCC « Estructura cristalina = estructura del diamante (FCC) Valencia = +3 « Valencia = -4 Los dos átomos tienen una electronegatividad similar. 1. La diferencia entre los radios atómicos debe ser inferior al 15 por 100. 2. La electronegatividad (capacidad del átomo para atraer un electrón) debe ser similar. 3. Los dos metales deben poseer la misma estructura cristalina. 4. La valencia con la que actúan debe ser la misma. Conclusión: la solución de Si en Al viola las reglas 1, 3 y 4, es por esto que no nos sorprenderá saber que el Si sólo es soluble en Al en una proporción inferior al 2% (porcentaje atómico).


Analizando las cuatro reglas de Hume-Rothery que determinan la posible solubilidad de dos o más elementos químicos (diferencia de tamaño relativo, de electronegatividad, de valencia o de estructura cristalina), podríamos decir que= la más importante y decisiva es la concerniente al grado de parecido entre sus radios atómicos. Por ello, las predicciones se hacen principalmente a partir de las diferencias de radios atómicos, siempre que no exista una diferencia enorme en alguna de las otras tres reglas, entonces: Conclusión: cuanto menor sea la diferencia de radio atómico, mayor grado relativo de solubilidad sólida.

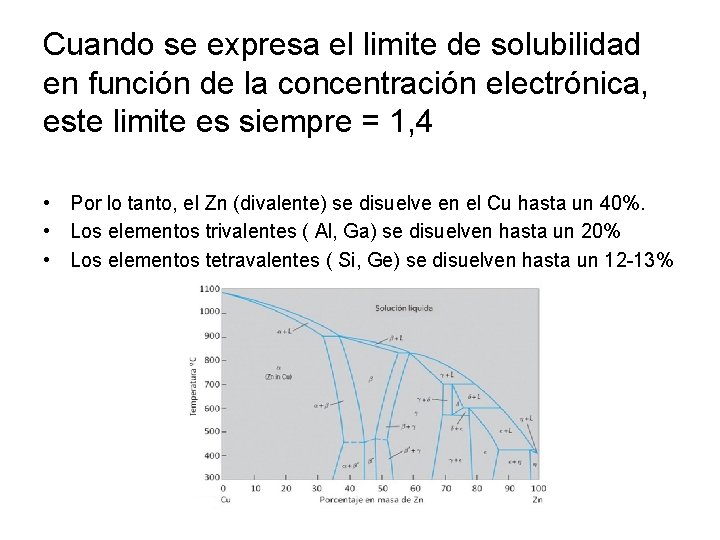
Influencia de la concentración electrónica en la solubilidad Si adoptamos al Cu+ y Ag+ como disolventes y aleamos con elementos de valencia >1 (con factor tamaño y electroquímico favorables), aparece una relación entre «el limite de solubilidad primaria» y «valencia del soluto»

Cuando se expresa el limite de solubilidad en función de la concentración electrónica, este limite es siempre = 1, 4 • Por lo tanto, el Zn (divalente) se disuelve en el Cu hasta un 40%. • Los elementos trivalentes ( Al, Ga) se disuelven hasta un 20% • Los elementos tetravalentes ( Si, Ge) se disuelven hasta un 12 -13%

Estructura de las fases intermedias

Las fases intermedias de las aleaciones pueden agruparse en: 1. Compuestos electroquímicos 2. Compuestos por factor tamaño 3. Compuestos electrónicos

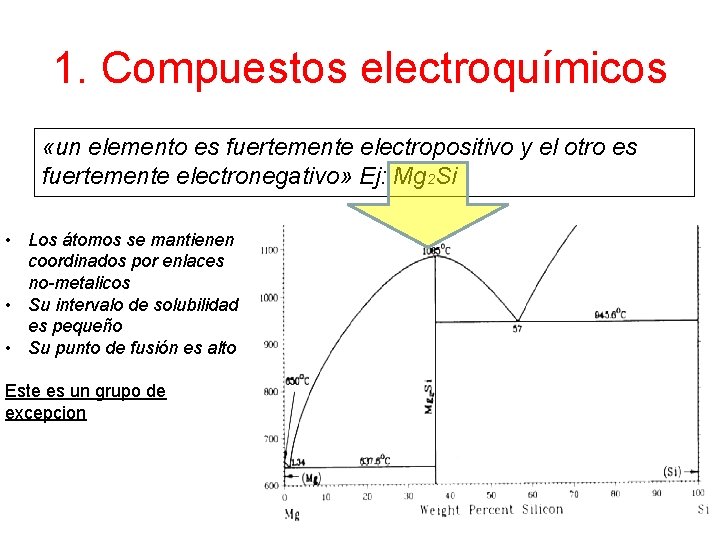
1. Compuestos electroquímicos «un elemento es fuertemente electropositivo y el otro es fuertemente electronegativo» Ej: Mg 2 Si • Los átomos se mantienen coordinados por enlaces no-metalicos • Su intervalo de solubilidad es pequeño • Su punto de fusión es alto Este es un grupo de excepcion

fases intermedias • Excepto el grupo de aleaciones formadas por elementos fuertemente electropositivos y electronegativos, el resto se considera como si fuesen SOLUCIONES SOLIDAS PRIMARIAS • Ordenadas-desordenadas, con enlaces metálicos • Si están desordenadas, habrá intervalos de solubilidad apreciable o si están ordenadas, pueden denominarse intermetalicos

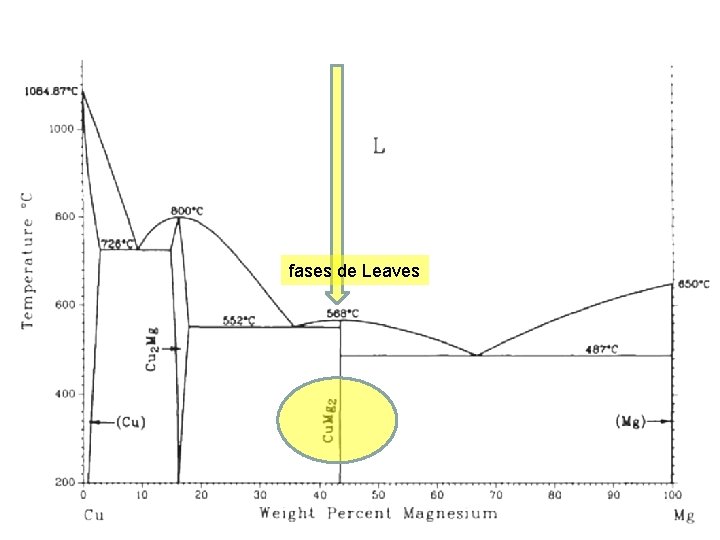
Si por alguna razón de descarta el factor electroquímico, entonces factor tamaño y la concentración de electrones de valencia comanda la formación de fases 2. Compuestos de factor tamaño: son de 2 tipos -uno de los átomos es mas pequeño que el otro -la diferencia en diámetros atómicos es de un 20 a 30% (Ej: fases de Leaves, cuya composición es AB 2 Porque existen estas fases? Porque al ser la diferencia de diametros del 22, 5%, las estructura pueden ensamblarse con numeros de coordinacion de 16

fases de Leaves

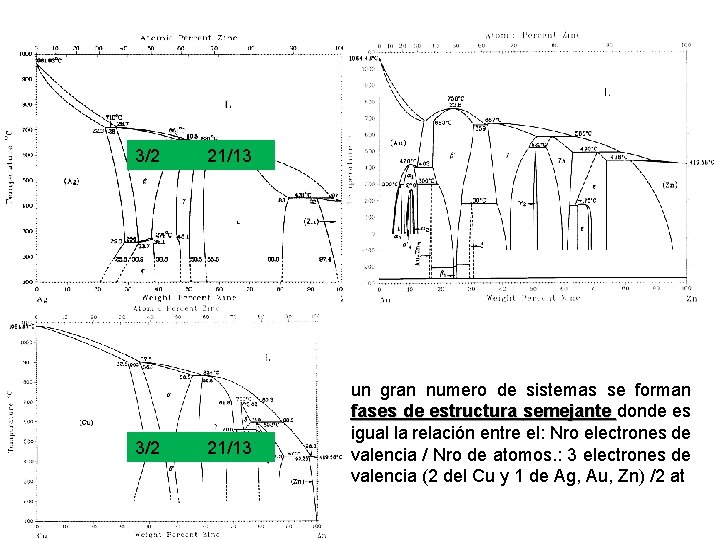
compuestos electrónicos Porque existen? ? ? • En un gran numero de sistemas se forman fases de estructura semejante donde es igual la relación entre el: Nro electrones de valencia / Nro de átomos. • Estas fases se llaman compuestos electrónicos • Las relaciones donde aparecen fases semejantes son: 3/2 - 21/13 - 7/4 Ejemplo: estructura BCC (latón β) ; concentración electrónica: 3/2 (Cu, Ag, Au)Zn, Cu. Be, Ag. Mg, Cu 3 Sn (Co, Ni o Fe)Al.

3/2 21/13 un gran numero de sistemas se forman fases de estructura semejante donde es semejante igual la relación entre el: Nro electrones de valencia / Nro de atomos. : 3 electrones de valencia (2 del Cu y 1 de Ag, Au, Zn) /2 at

Ejemplos de compuestos intermetálicos • Carburos: son de interés como Carburos: constituyentes secundarios en los aceros alaedos ( por ej, aceros para herramientas, inoxidables, para resistir al desgaste, etc) • Compuestos electrónicos: tienen Compuestos electrónicos: importancia en aleaciones base cobre (por ej, latones, bronces, cuproaluminios, etc)

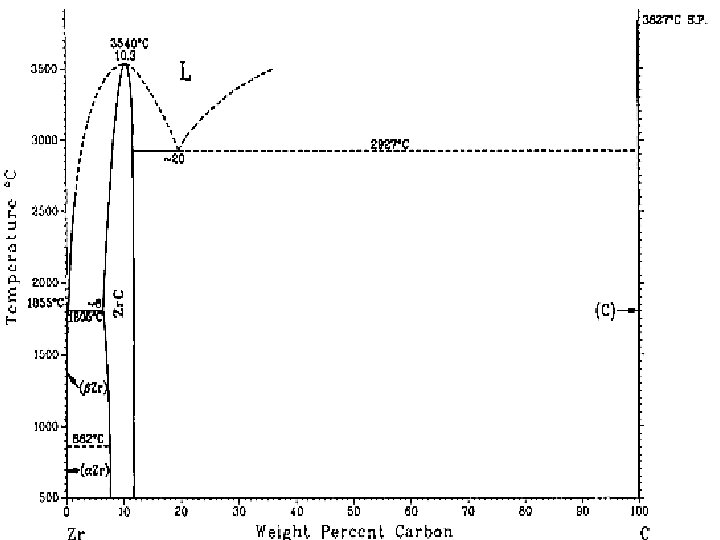
Carburos Se clasifican de acuerdo a su red cristalina, en simples (Ti. C, Zr. C, VC, Nb. C…) y complejos. 1. Tienen red similar al Cl. Na 2. No admiten Fe en solución solida substitucional ni reaccionan con del Fe 3. Son carburos estables, con alto punto de fusión


FASES INTERSTICIALES

Fases intersticiales • Los metales de transición (Ti, Fe, V, Cr, Mo, Cu, Ni, Zn, Ag, etc) pueden alojar en sus intersticios al H, N, C, B alojar en sus intersticios • y formar Hidruros, Hidruros Nitruros, Nitruros Carburos, Carburos Boruros • Esta jnserccion crea una red densa o una estructura red densa ligeramente deformada • Son verdaderas aleaciones, con propiedades metálicas

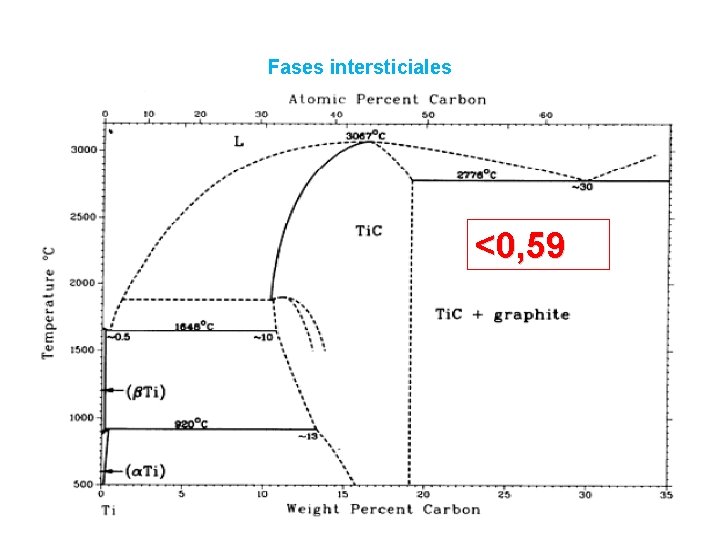
Fases intersticiales Que pasa si…. • el radio del átomo intersticial <0, 59…………se <0, 59 forman fases intermedias de estructura cristalina simple (FCC, HX) • Las composiciones son : M 4 X, M 2 X, MX 2 • los átomos del metal ocupan los nudos y los átomos del no-metal, los intersticios

Fases intersticiales <0, 59

Ti. C • La estructura de compuesto está formada por átomos de carbono incrustados en un la retícula del titanio metálico. • Es un material cerámico • Posee una estructura cristalina cúbica similar a la del cloruro de sodio • Se caracteriza por una particularmente alta dureza de hasta 4000 HV. 5 y se funde solo a una temperatura de 3140 ° C. Es, sin embargo, muy frágil.

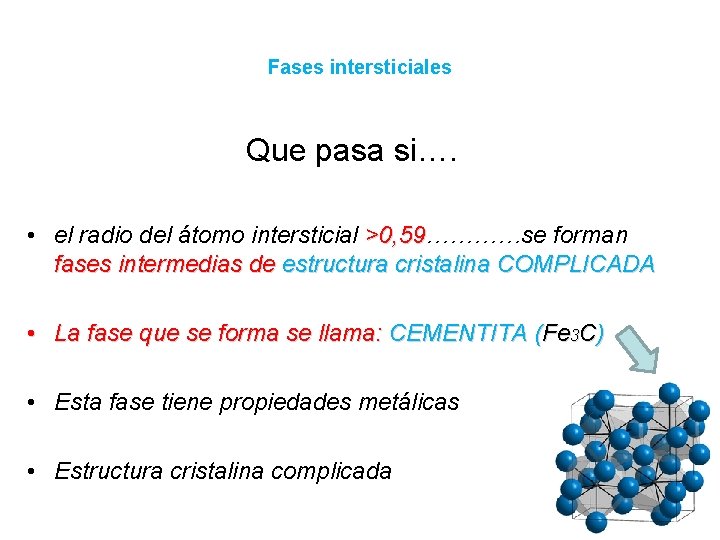
Fases intersticiales Que pasa si…. • el radio del átomo intersticial >0, 59…………se forman >0, 59 fases intermedias de estructura cristalina COMPLICADA • La fase que se forma se llama: CEMENTITA (Fe 3 C) • Esta fase tiene propiedades metálicas • Estructura cristalina complicada

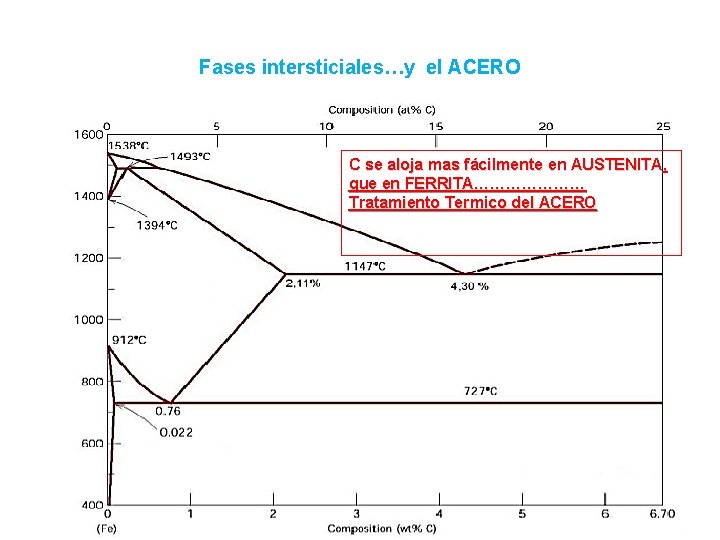
Fases intersticiales…y el ACERO C se aloja mas fácilmente en AUSTENITA, que en FERRITA………………… Tratamiento Termico del ACERO

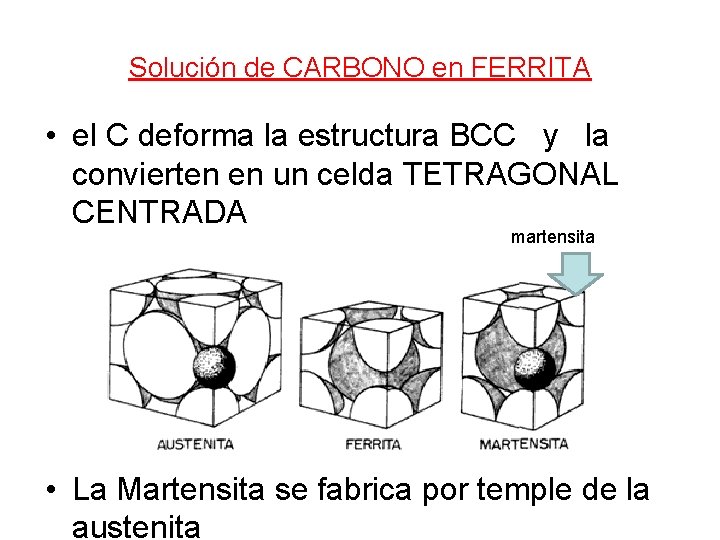
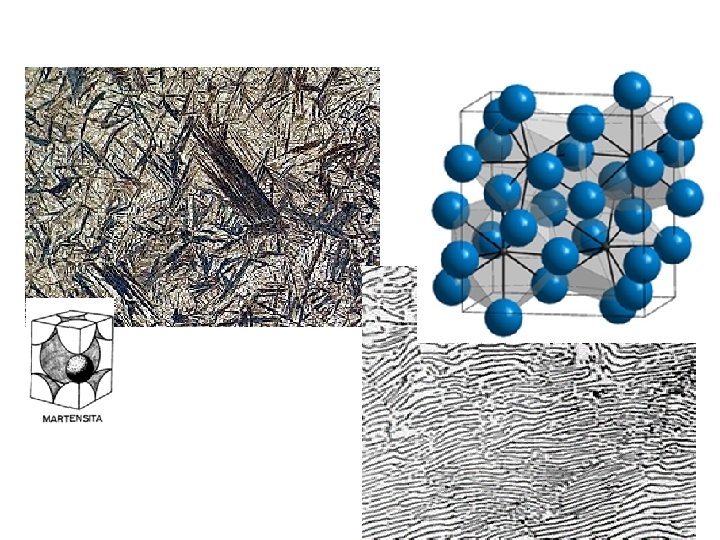
Solución de CARBONO en FERRITA • el C deforma la estructura BCC y la convierten en un celda TETRAGONAL CENTRADA martensita • La Martensita se fabrica por temple de la austenita

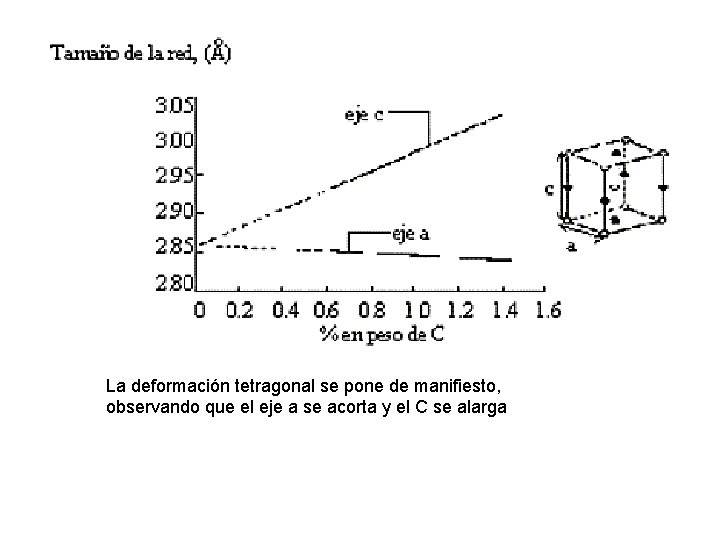
La deformación tetragonal se pone de manifiesto, observando que el eje a se acorta y el C se alarga
